Химическая физика, 2019, T. 38, № 4, стр. 16-22
Измерение константы скорости реакции атомов хлора с CF3Br методом резонансной флуоресценции в диапазоне температур 273–353 K
И. К. Ларин 1, А. И. Спасский 1, Е. М. Трофимова 1, *
1 Институт энергетических проблем химической физики
Российской академии наук им. В.Л. Тальрозе
Москва, Россия
* E-mail: eltrofimova@yandex.ru
Поступила в редакцию 13.08.2018
После доработки 19.11.2018
Принята к публикации 21.11.2018
Аннотация
Методом резонансной флуоресценции измерена константа скорости реакции атомов хлора с CF3Br в диапазоне температур 273–353 K. Показано, что измеренные нами значения константы скорости данной реакции возрастают при проведении экспериментов при более низкой температуре. Измерения при температуре 295 K проведены при разных условиях диффузии атома хлора к стенке реактора. Высказано предположение, что взаимодействие атома хлора с CF3Br происходит на поверхности реактора. Обсуждена возможность взаимодействия этих веществ во время тушения пожаров на различных промышленных объектах.
ВВЕДЕНИЕ
Предельные углеводороды, содержащие в своем составе атомы брома, способны эффективно ингибировать процессы горения за счет того, что они связывают атом водорода, который является разветвляющим агентом в этих цепных процессах. Это позволило применять эти вещества для тушения пожаров [1].
Особенно широко в этих целях использовался бромметан CF3Br (галон 1301), который не только эффективно ингибировал процесс горения, но и представлял меньшую опасность для здоровья людей, чем другие галоны [2]. Несмотря на уникальные свойства данного галона, его производство было запрещено Монреальским протоколом, принятым в 1987 году. Более поздними дополнениями к этому протоколу было запрещено и применение ранее накопленных запасов [3]. Этот запрет был вызван тем, что время жизни галона 1301 в атмосфере составляет десятки лет [4], так как это вещество имеет малое сечение поглощения солнечного излучения, достигающего тропосферы, а также не разрушается в химических реакциях с теми соединениями, которые в ней присутствуют. Интенсивное разрушение CF3Br начинается на высотах, превышающих 10 км, т.е. там, где плотность озона максимальна. В результате фотолиза образуются атомы брома, в десятки и сотни раз более опасные для озонового слоя, чем атомы хлора [5–7]. Отметим, что бромные циклы разрушения озона вплоть до высоты 40 км имеют бóльшую длину цепи, чем хлорные циклы, причем в нижней стратосфере разница в длинах цепей составляет десятки и сотни раз [8].
В течение десятилетий велись поиски заменителей этого опасного для озонового слоя вещества, но так и не нашлось другого реагента, столь же эффективно и быстро подавляющего пламя. Поэтому исследования по эффективности CF3Br при тушении пожаров продолжаются [9], и от применения галона 1301 на военных кораблях и самолетах до сих пор не отказались [10].
Во время крупных и опасных для больших групп людей пожаров нередко возникают заметные концентрации атомов хлора. Это происходит, например, при пожарах в угольных шахтах или при пиролизе органических соединений, добавляемых в полистирол в качестве огнетушащих добавок [11]. Можно предположить, что если при таких пожарах использовать в качестве тушащего вещества CF3Br, то возможна реакция его с атомами хлора. В результате этой реакции опасный для озонового слоя галон, образующий при распаде атомов брома, мог бы быть заменен на менее опасное соединение – CF3Cl, образующее при распаде атомы хлора. Напомним, что образование атомов хлора происходит на тех высотах, когда максимум концентрации озона уже пройден. Это соображение послужило для нас стимулом измерить константу скорости реакции атомов хлора с CF3Br, тем более что нам не удалось найти в научной литературе сведения о таких измерениях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
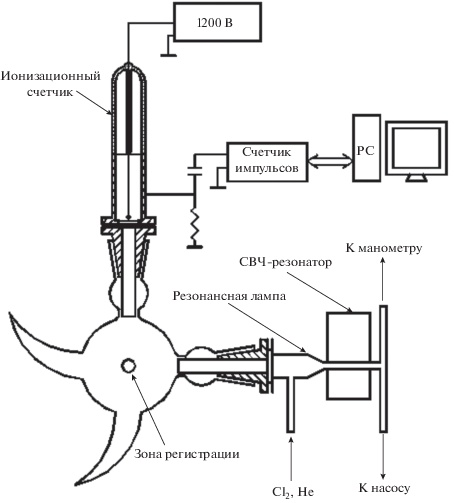
Экспериментальная установка включала в себя источник атомов хлора, систему регистрации последних, реактор и систему подачи реагентов.
Источник и регистрация атомов хлора
Атомы хлора генерировали при помощи резонатора Бройда, пропуская через него молекулярный хлор, разбавленный гелием, по кварцевой трубке, обработанной ортофосфорной кислотой. Источником СВЧ служил прибор ЛУЧ-ЗМ, выходная мощность которого была равна 2.5 Вт. В зоне, находящейся между разрядом и реактором, трубка была дважды изогнута под прямым углом, чтобы предотвратить проникновение ультрафиолета в реактор и счетчик фотонов.
Для регистрации атомов хлора был использован метод атомной резонансной флуоресценции (РФ). Источником резонансного излучения была лампа, работающая на смеси молекулярного хлора с гелием (1 ⋅ 1013 и 1 ⋅ 1017 молекул ⋅ см–3, соответственно) и возбуждаемая разрядом частотой 254 МГц. Фотоны, переизлученные находящимися в реакторе атомами хлора, регистрировались счетчиком, изготовленным в ИНЭП ХФ РАН. Счетчик был заполнен смесью аргона и окиси азота (10 Торр NO и 230 Торр Ar). Длинноволновая граница счетчика определялась потенциалом ионизации NO, равным 8.7 эВ [12], и составляла ~133.8 нм. Лампа и счетчик были снабжены стеклами из MgF2, которые не пропускали излучение с длиной волны меньше 117 нм. Окись азота, заполняющая счетчик, и стекла из MgF2 выполняли роль монохроматора, и это давало возможность работать на линии атома хлора при 118.9 нм, т.е. в области, практически свободной от поглощения молекулярного кислорода, если последний присутствовал в реакторе.
Для более эффективной регистрации атомов хлора была применена система коллимации. В качестве входного и выходного коллиматоров служили латунные трубки внутренним диаметром 6 и длиной 70 мм. Коллиматоры служили для подавления рассеянного света и выделения рабочей зоны диаметром 3 и длиной 6 мм. Применение метода РФ ограничено сверху по концентрации регистрируемых атомов из-за резонансного поглощения вне рабочей зоны. Максимальную концентрацию атомов, которую можно зарегистрировать, можно оценить из соотношения: σL[Cl]max ≅ 1, где σ – сечение поглощения на длине волны 118 нм, равное 2.47 ⋅ 10–13 см2 [13]; [Cl]max – максимальная концентрация регистрируемых атомов хлора; L – линейный размер зоны, где присутствуют атомы.
Таким образом, при уменьшении размеров зоны, в которой присутствуют атомы хлора, возрастает их максимальная концентрация, регистрируемая методом РФ. Наличие металлических коллиматоров, на поверхности которых эффективно гибнут атомы хлора, позволяло ограничить диаметр зоны, в которой они присутствовали, величиной в 1.5–2 см. Зона регистрации атомов хлора методом РФ представлена на рис. 1.
Титрование атомов хлора этаном
Для калибровки абсолютной чувствительности к атомам хлора использовалось титрование с применением C2H6, в качестве титрующего агента, поскольку константа скорости его реакции с атомом хлора достаточно велика и при температуре 300 К составляет величину 5.79 ⋅ 10–11 см3 ⋅ молекула–1 ⋅ с–1 [14]. Титрование проводилось путем введения небольших измеренных потоков C2H6 через капилляр в поток кислорода. Величину потока C2H6 измеряли по падению давления в резервуаре, содержащем C2H6 при давлении ~700 Торр и размещенном на входе в капилляр. Остальные величины потоков были рассчитаны в предположении, что величина потока пропорциональна квадрату падения давления на входе в капилляр.
Этан добавлялся в поток атомов хлора до тех пор, пока сигнал резонансной флуоресценции не падал до нуля. Отметим, что когда сигнал падал до нуля, концентрация C2H6 несколько превышала концентрацию атомов хлора. В момент, когда концентрации были одинаковы, имелся остаточный сигнал, медленно убывающий по закону обратных квадратов. В случае, когда концентрации атомов хлора превышали 1014 атом ⋅ см–3, этим эффектом можно было пренебречь. Но при концентрациях атомов хлора 1012–1013 атом ⋅ см–3 для того, чтобы получить правильные данные, мы прибегали к численному моделированию. Оно учитывало различные скорости потока и изменение концентраций в двух разных частях реактора. Профили концентраций атомарного хлора и C2H6 вдоль реактора были рассчитаны для фиксированных начальных концентраций атомов хлора [Cl]0 и различных начальных концентраций C2H6. С использованием этих профилей, мы рассчитали зависимость концентрации атомов хлора в зоне регистрации от начальной концентрации C2H6.
Сигнал резонансной флуоресценции, S, связан с концентрацией атомов хлора выражением
Коэффициент A учитывает чувствительность системы к атомам Cl, экспоненциальный член отражает эффект самопоглощения излучения атомами хлора в зоне регистрации. Линия атома хлора при 119 нм является дублетом – 118.875 и 118.877 нм. Рекомендованное значение σ для неразрешенного дублета равно 2.47 ∙ 10–13 см2 [13].
Измерения показали, что концентрация атомов Cl пропорциональна величине потока молекулярного Cl2 через реактор. Коэффициент пропорциональности зависел от условий в разряде, поэтому было необходимо калибровать систему в каждом эксперименте. Отношение сигнал/шум, равное двум, было получено при концентрации [Cl] = 1.2 ∙ 1010 атомов ⋅ см–3.
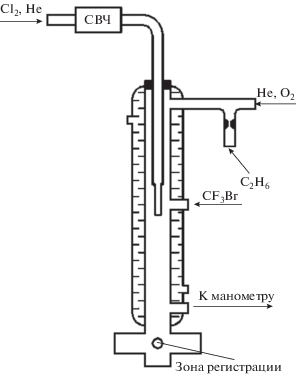
Устройство реактора и подача реагентов
Опыты проводили в проточном реакторе, изображенном на рис. 2. Реактор представлял собой кварцевый цилиндр внутренним диаметром 1.7 см. Изнутри поверхность реактора была покрыта фторопластом Ф-32Л для того, чтобы уменьшить скорость гетерогенной гибели атомов и радикалов. Галон 1301 марки “х. ч.” поступал в реактор в смеси с гелием или аргоном из металлического баллона через вентиль тонкой регулировки. Массовые потоки реагентов и газов-разбавителей определяли, измеряя величину падения давления в калиброванном объеме за определенное время. За изменением давления следили по образцовому манометру. Во всех опытах использовали гелий и аргон марки “ВЧ”. Линия подачи молекулярного хлора была изготовлена из стекла и тефлоновых запорных вентилей без применения вакуумной смазки. Молекулярный хлор синтезировали путем окисления HCl перманганатом калия (KMnO4), очищали низкотемпературной перегонкой и хранили в стеклянных баллонах. При проведении экспериментов он поступал через капилляр в поток He, проходящий через проточную резонансную лампу и через источник атомов хлора. Этан, используемый для калибровки абсолютной чувствительности системы к атомам хлора, хранили в стеклянном баллоне и добавляли в реактор через боковой ввод.
Результаты эксперимента
Атомы хлора в смеси с гелием поступали в реактор через подвижную трубку, соединенную с реактором герметичным устройством, изготовленным из тефлона. Таким образом, они вводились в реактор вдоль его оси на различных расстояниях от зоны регистрации.
Вначале измерялся сигнал РФ, J0, в условиях, когда в реактор поступал только газ-разбавитель. Затем из градуированного объема через боковой вход в реактор вводился CF3Br, который вступал в реакцию с атомами хлора:
Так как атомы хлора не только реагируют с CF3Br, но и взаимодействуют со стенкой реактора, полное выражение для скорости расходования атомов хлора в ходе изучаемой реакции выглядит следующим образом:
(1)
${{d\left[ {{\text{Cl}}} \right]} \mathord{\left/ {\vphantom {{d\left[ {{\text{Cl}}} \right]} {dt}}} \right. \kern-0em} {dt}} = - {{k}_{{\text{I}}}}\left[ {{\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{Br}}} \right]\left[ {{\text{Cl}}} \right] - {{k}_{{{\text{г е т }}}}}\left[ {{\text{Cl}}} \right],$(2)
$\ln \left[ {{\text{Cl}}} \right] = - {{k}_{1}}\left[ {{\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{Br}}} \right]t - {{k}_{{{\text{г е т }}}}}t + {\text{const}},$В условиях, когда в реактор не поступает CF3Br, выражение (1) приобретает вид
(3)
${{d{{{\left[ {{\text{Cl}}} \right]}}_{0}}} \mathord{\left/ {\vphantom {{d{{{\left[ {{\text{Cl}}} \right]}}_{0}}} {dt}}} \right. \kern-0em} {dt}} = - {{k}_{{{\text{г е т }}}}}{{\left[ {{\text{Cl}}} \right]}_{0}}.$После деления на [Cl]0 и интегрирования получим
где [Cl]0 – концентрация атомов хлора при концентрации атмосферного реагента (CF3Br), равной нулю.В результате выражение (2) после несложных преобразований приобретает вид
(5)
$\ln \left( {{{{{{\left[ {{\text{Cl}}} \right]}}_{0}}} \mathord{\left/ {\vphantom {{{{{\left[ {{\text{Cl}}} \right]}}_{0}}} {\left[ {{\text{Cl}}} \right]}}} \right. \kern-0em} {\left[ {{\text{Cl}}} \right]}}} \right) = {{k}_{{\text{I}}}}\left[ {{\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{Br}}} \right]t.$Так как интенсивность сигнала РФ атомов хлора, J, пропорциональна их концентрации, т.е. J ∼ [Cl], то (5) переходит в выражение
(6)
$\ln \left( {{{{{J}_{0}}} \mathord{\left/ {\vphantom {{{{J}_{0}}} J}} \right. \kern-0em} J}} \right) = {{k}_{{\text{I}}}}\left[ {{\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{Br}}} \right]t.$Выражение (6) позволяет определить константу скорости реакции (I) двумя способами. Можно измерить зависимость интенсивности сигнала РФ атомов хлора от концентрации CF3Br при определенном времени контакта реагентов. Также можно при неизменной концентрации бромметана изменять время контакта реагентов. Нами были использованы оба этих способа.
На рис. 3 представлен график зависимости ln(J0/J) от [CF3Br], полученный при температуре 295 K. Давление в реакторе составляло 1.5 Торр, время контакта реагентов – 0.0186 с. Концентрация атомов хлора была равна ~3.7 ∙ 1012 молекула ∙ см–3.
Рис. 3.
График зависимости ln(J0/J) от концентрации CF3Br, полученный при температуре 295 K, концентрации атомов хлора ~3.7 ∙ 1012 молекула ∙ см–3 и времени контакта реагентов 0.0186 с. Давление в реакторе составляло 1.5 Торр, разбавителем служил Не.
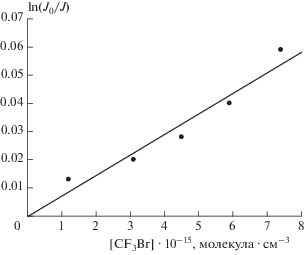
Константа скорости реакции (I), вычисленная по тангенсу угла наклона прямой на рис. 3, оказалась равной
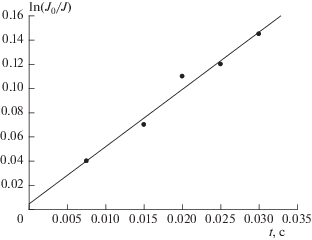
График зависимости ln(J0/J) от времени t контакта реагентов представлен на рис. 4. Данные получены при температуре 295 K, давлении в реакторе 1.8 Торр, концентрации атомов хлора 4.8 ∙ 1012 молекула ∙ см–3 и концентрации CF3Br 4.7 ∙ 1015 молекула ∙ см–3. В качестве разбавителя также использовался гелий.
Рис. 4.
График зависимости ln(J0/J) от времени контакта реагентов, полученный при температуре 295 K, давлении в реакторе, 1.8 Торр, концентрации атомов хлора 4.8 ∙ 1012 молекула ∙ см–3, концентрации CF3Br 4.7 ∙ 1015 молекула ∙ см–3. Разбавителем служил Не.
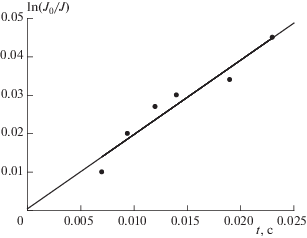
Константа скорости реакции (I), вычисленная по тангенсу угла наклона прямой на рис. 4, оказалась равной
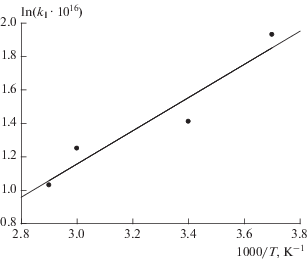
Аналогичные опыты были проведены при температурах 273, 333 и 353 K. Разбавителем служил гелий, давление в реакторе варьировалось в диапазоне 1.5–1.8 Торр.
Зависимость lnkI от 1/T в диапазоне температур 273–353 K приведена на рис. 5. Константа скорости реакции (I), рассчитанная по этим данным, имеет следующее значение:
При температуре 295 K были проведены опыты, в которых разбавителем служил аргон. Давление в реакторе составляло 3.6 Торр, значение концентрации атомов хлора было равно 3.3 ∙ ∙ 1012 молекула ∙ см–3, а концентрация CF3Br составляла 1.8 ∙ 1016 молекула ∙ см–3.
График зависимости ln(J0/J) от времени контакта реагентов, полученный в этих экспериментальных условиях, представлен на рис. 6. Константа скорости реакции, рассчитанная по тангенсу угла наклона прямой на этом графике, оказалась равной
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Характер зависимости скорости реакции (I) от концентрации атмосферного реагента (рис. 3) мог бы указывать на то, что эта реакция является бимолекулярным процессом, протекающим в газовой фазе. Однако в наших исследованиях мы неоднократно сталкивались с тем, что такая зависимость возможна и для гетерогенного процесса [15, 16]. Доказательством того, что исследованный нами процесс является гетерогенным, служит то обстоятельство, что при сокращении характерного времени реакции и увеличении времени диффузии активного центра к стенке реактора наблюдаемое значение константы скорости реакции уменьшалось по сравнению с аналогичным значением, измеренным в условиях быстрой диффузии.
Анализируя экспериментальные данные настоящей работы, можно сравнить значения константы скорости реакции (I), полученные при температуре 295 K и разных условиях диффузии к стенке. Данные, представленные на рис. 4, получены в условиях, когда разбавителем служил газообразный гелий, коэффициент диффузии атома хлора в котором по данным работы [17] равен 0.75. Давление в реакторе составляло величину 1.8 Торр. Рисунок 6 отображает данные, полученные в эксперименте, в котором в качестве разбавителя использовался аргон, а давление в реакторе составляло 3.5 Торр. Коэффициент диффузии атома хлора в аргоне по данным работы [18] равен 0.2. Таким образом, время диффузии в эксперименте, представленном на рис. 6, значительно увеличилось по сравнению с условиями эксперимента при более низком давлении в реакторе и при использовании в качестве разбавителя гелия. Мы считаем, что именно это обстоятельство объясняет уменьшение измеряемой константы скорости реакции (I) в опыте при повышенном давлении в реакторе и использовании аргона в качестве разбавителя и указывает на гетерогенный характер процесса. Увеличение измеряемой нами константы скорости реакции (I) при понижении температуры в реакторе также, по нашему мнению, является свидетельством того, что реакция частично или целиком протекает на стенке реактора.
Авторы работы [19], исследовавшие реакцию атома фтора с CF3Br, также наблюдали рост значения константы скорости этой реакции от 2.5 ∙ 108 см3 ∙ моль–1 ∙ с–1 при 373 K до 8 ∙ 109 см3 ∙ ∙ моль–1 ∙ с–1 при 188 K. Они объясняли такую зависимость от температуры тем, что механизм этой реакции включает образование радикала CF3BrF, который в дальнейшем реагирует с атомами фтора. Однако мы считаем, что для объяснения полученных нами экспериментальных данных не требуется привлечение сложного механизма, они достаточно убедительно говорят в пользу гетерогенного характера реакции (I).
В научной литературе в последние десятилетия широко обсуждается роль гетерогенных процессов в химии атмосферы и высказывается предположение о том, что невозможно создать корректную модель атмосферных процессов, не включая в нее гетерогенные реакции [20, 21]. Измеренное нами значение константы скорости реакции атома хлора с CF3Br при температуре 295 K в четыре раза превышает значение константы скорости реакции этого вещества с радикалом OH, приведенное в работе [22]. Отметим, что концентрация атомов хлора в атмосфере по данным работ [23, 24] достигает величины 10% от концентрации радикалов OH. Наше исследование показало, что константа скорости данной реакции возрастает при уменьшении температуры. Известно, что температура воздуха в атмосфере понижается при подъеме от поверхности Земли к тропопаузе. Так, над экватором минимальная температура воздуха в тропопаузе составляет около 211 K. Экстраполяция значения константы скорости реакции (I) к этой температуре дает величину
Даже при этой температуре измеренная нами константа скорости реакции (I) слишком мала для того, чтобы этот процесс мог существенно повлиять на время жизни CF3Br в атмосфере. Однако в атмосфере присутствует достаточно много разнообразных твердых частиц. Например, в работе [25] было показано, что реакции на частицах льда идут значительно быстрее, чем в газовой фазе. В работе [26] высказано предположение, что частицы пыли и сажи, выбрасываемые вулканической деятельностью, также служат поверхностями, на которых протекают гетерогенные химические реакции, идущие с бóльшими скоростями, чем те же реакции, протекающие в газовой фазе. В работе [27] была исследована гетерогенная реакция радикала OH с хлористым водородом и было показано, что значения константы скорости этой реакции различались на порядки при ее протекании на разных поверхностях. Поэтому не исключено, что в атмосфере существуют такие твердые частицы, на которых гетерогенная реакция (I) идет с высокой скоростью, и это могло бы внести коррективы в расчет времени жизни CF3Br в тропосфере.
Список литературы
Tapscott R.E., Sheinson R.S., Babushok V., Nyden M.R., Gann R.G. // 2001. NIST Technical Note 1443. 2001.
Noto T., Babushok V., Hamins A., Tsang W. // Combust. and Flame. 1998. V. 112. P. 147.
Montreal Protocol on Substances that Deplete the Ozone Layer, United Nations Environment Programme (UNEP): 2006 Assessment Report of the Halons Technical Options Committee.
National Aeronautics and Space Administration. Principal Center for Clean Air Act Regulations Halocarbons: Ozone Depletion and Global Warming Overview 2002. P. 3.
Chang J.S., Duewer W.H. // Ann. Rev. Phys. Chem. 1979. V. 30. P. 443.
Daniel J.S., Solomon S., Portman R.W., Garcia R.R. // J. Geophys. Res. 1999. V. 104. P. 23871.
Solomon S., Mills M., Heidt L.E., Pollock W.H., Tuck A.F. // J. Geophys. Res. 1992. V. 97. P. 825.
Ларин И.К. Химическая физика озонового слоя. М.: ГЕОС, 2013. С. 94.
Linteris G.T., Fumiaki Takahashi, Katta V.R. // Combust. and Flame. 2007. V. 149. P. 91.
National Institute of Standards and Technology Special Publication 1069. Special Publication USA, 2007.
Жуков Д.Д., Красновских М.П. // Хим. науки. 2014. Т. 101. № 412.
Кикоин И.К. Таблицы физических величин. М.: Атомиздат, 1976. С. 200.
Wilmouth D.M., Hanisco T.F., Simpfle R.M., Anderson J.G. // J. Phys. Chem. A. 2009. V. 113. P. 14099.
Bryukov M.G., Slagle I.R., Knyazev V.D. // J. Phys. Chem. A. 2003. V. 107. P. 6565.
Ларин И.К., Спасский А.И., Трофимова Е.М., Туркин Л.Е. // Кинетика и катализ. 2003. Т. 44. С. 218.
Ларин И.К., Спасский А.И., Туркин Л.Е., Трофимова Е.М. // Кинетика и катализ. 2010. Т. 51. С. 1.
Hwang C.J., Jiang R.C., Su T.M. // J. Chem. Phys. 1986. V. 84. P. 5095.
Hwang C.J., Su T.M. // Ibid. 1987. V. 91. P. 2351.
Bozzelli Joseph W., Kolb C.E., Kaufman M. // Ibid. 1973.V. 59. P. 3669.
Hofmann D.J., Oltmans S.J., Komhyr W.D. et al. // Geophys. Res. Lett. 1994. V. 21. P. 65.
Gard E.E., Kleeman M.J., Gross D.S., Hughes L.S. // Science. 1998. V. 279. P. 1184.
Burkholder J.B., Wilson R.R., Gierczak T. et al. // J. Geophys. Res. 1991. V. 96. P. 5025.
Singh H.B., Thakur A.N., Chen Y.E. // Geophys. Rev. Lett. 1996. V. 23. P. 1529.
Vogt R., Crutzen P.J., Sander R. // Nature. 1996. V. 383. P. 327.
Molina M.J., Tso Tai-Ly, Molina L.T., Wang F.C.-Y. // Science. 1988. V. 238. P. 1253.
Роун Ш. Озоновый кризис. М.: Мир, 1993. С. 264.
Behnke W., Zetsch C. // J. Aerosol Sci. 1989. V. 20. P. 1167.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика