Химическая физика, 2019, T. 38, № 4, стр. 74-83
Кинетические особенности термодеструкции поливинилового спирта в композициях с полиоксидом бора. Ч. 1. Кинетика термодеструкции
С. М. Ломакин 1, А. Ю. Шаулов 2, Е. В. Коверзанова 2, *, С. В. Усачев 2, Н. Г. Шилкина 2, Ал. Ал. Берлин 2
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: koverlena@list.ru
Поступила в редакцию 01.08.2018
После доработки 26.09.2018
Принята к публикации 22.10.2018
Аннотация
В работе изучено влияние полиоксида бора на термическую деструкцию поливинилового спирта. На основании результатов термогравиметрического анализа предложена кинетическая модель термодеструкции композиции борной кислоты и поливинилового спирта, учитывающая каталитический характер процесса дегидратации и ускоренную карбонизацию. Установлены характерные особенности механизма протекающих процессов.
ВВЕДЕНИЕ
Гибридные смеси неорганических и органических полимеров, обладающих близкими температурами размягчения, представляют интерес с точки зрения возможности получения материалов, в которых могли бы сочетаться свойства обоих классов полимеров. Наиболее перспективными неорганическими составляющими гибридных смесей являются неорганические полиоксиды, обладающие комплексом полезных свойств и вместе с тем являющиеся химически активными, что открывает дополнительные возможности в регулировании свойств материалов.
Ранее было показано, что при термической деструкции композиций полиоксидов бора с такими полиуглеводородными полимерами, как полиэтилен и поливиниловый спирт (ПВС), наблюдалось значительное влияние полиоксида бора на скорость термической деструкции органических полимеров, а также на изменение характера сопровождающих ее реакций [1, 2]. Было установлено, что в процессе термоокислительной деструкции полиэтилена добавки полиоксида бора приводят к общему замедлению процесса за счет того, что неорганический полиоксид бора выступает в роли высокотемпературного термостабилизатора окисления полиэтилена [1]. С другой стороны, в аналогичной композиции с ПВС полиоксид бора ускоряет процесс его термодеструкции посредством каталитической дегидратации, в результате чего возрастает скорость последующих реакций ароматизации и карбонизации [2].
В настоящей работе рассмотрены кинетические особенности и возможные механизмы термической деструкции ПВС и его композиций с борной кислотой, позволяющие детально оценить процесс высокотемпературных превращений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования и материалы
Объектами исследования служили порошкообразные смеси борной кислоты (БК) и поливинилового спирта в массовом соотношении 1 : 1. В экспериментах использованы борная кислота марки “х. ч.” фирмы “Реахим” и поливиниловый спирт фирмы “Du Pont” с Мn = 300 000 и содержанием ацетатных групп не более 2%.
Методы исследования
Термическую деструкцию ПВС и его композиций с БК исследовали методом термогравиметрического анализа (ТГА) на термоаналитических весах Mettler TG 3000 в инертной среде аргона и на воздухе. Навески образцов составляли 5–10 мг.
Кинетический анализ термической деструкции ПВС и композиций с ними был выполнен с использованием программного обеспечения Thermokinetics NETZSCH-Gerätebau GmbH (Германия). В основе алгоритма программы кинетического анализа лежит вычисление значения регрессии посредством метода Рунге–Кутта (Runge–Kutta) 5-й степени с использованием встроенной формулы Prince-Dormand для автоматической оптимизации количества значащих цифр [3].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
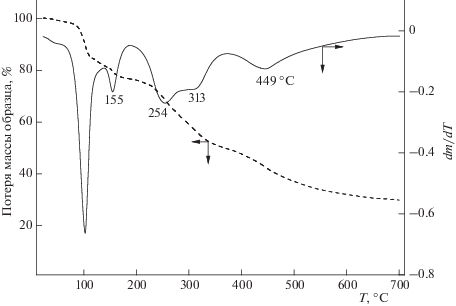
Главная цель работы состояла в исследовании влияния борной кислоты на термическую деструкцию ПВС в композиции ПВС : БК в соотношении 1 : 1. На рис. 1 представлены типичные ТГ- и ДТГ-кривые термодеструкции этой композиции в аргоне при скорости нагрева 10 град/мин, из вида которых следует, что термическая деструкция представляет собой сложный процесс, состоящий по крайней мере из пяти стадий.
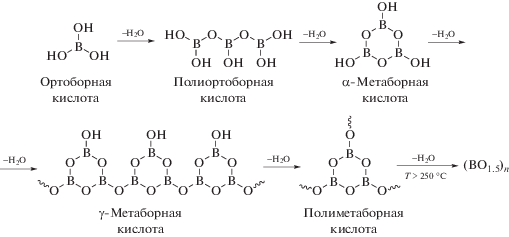
Две первые, низкотемпературные, стадии (120–155 °С) относятся к последовательным процессам первичной дегидратации ортоборной кислоты и ее превращения в метаборную, являющуюся циклическим оксиборатным “прекурсором” полимерного борного ангидрида (Схема 1 ).
Схема 1 . Термические превращения борной кислоты
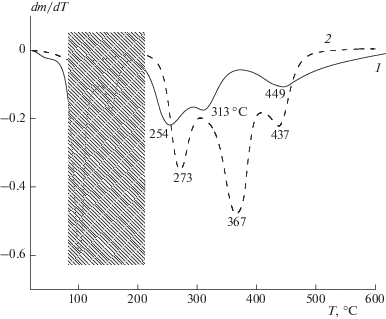
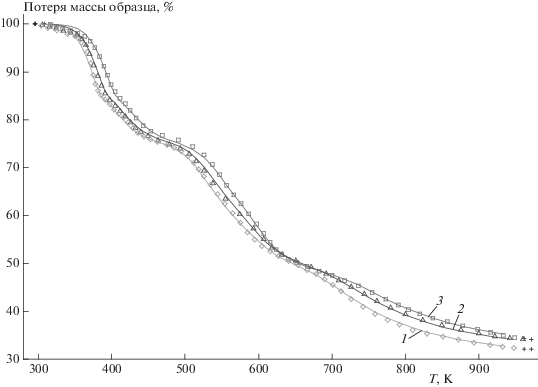
Последующие три стадии термодеструкции композиции ПВС : БК в соотношении 1 : 1 относятся уже к разложению поливинилового спирта, что детально обсуждалось в работе [1] (рис. 1). Известно, что классическая схема термической деструкции поливинилового спирта в инертной среде также включает три стадии (рис. 2), и, как видно, разложение ПВС в композиции осуществляется строго в соответствии с процессом его термодеструкции. Однако температуры, характеризующие максимальные скорости разложения отдельных стадий (Tmax при условии d2m/dT 2= 0), отличаются от аналогичных значений для ПВС. Из графиков видно, что на третьей и четвертой стадиях разложения композиции происходит ускорение как дегидратации, так и последующего распада по сравнению с исходным ПВC. В то же время последняя стадия разложения композиции ПВС с БК смещается в область более высоких температур (449 °С, рис. 3).
Рис. 2.
Зависимость потери массы (ТГ) при термической деструкции ПВС и композиции ПВС c БК в аргоне от температуры: 1 – ПВС/БК (1 : 1), 2 – ПВС.
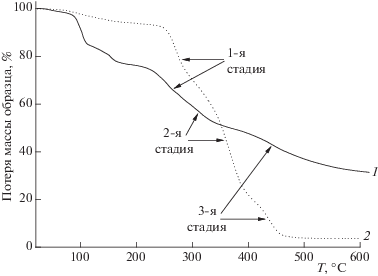
Рис. 3.
Зависимость скорости потери массы (ДТГ) при термической деструкции ПВС и композиции ПВС/БК в аргоне от температуры: 1 – ПВС/БК (1 : 1), 2 – ПВС. Заштрихованная область относится к процессу дегидратации БК.
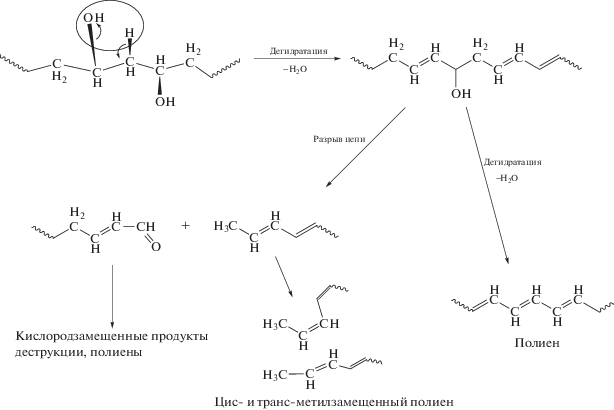
Хорошо известно, что термическая деструкция ПВС начинается с реакции дегидратации, сопровождающейся образованием сопряженных полиеновых структур [1, 4, 5]. При дальнейшем развитии процесса ненасыщенные полиеновые структуры, содержащие остаточные гидроксильные группы, подвергаются реакции разрыва цепи в α-положении у третичного атома углерода, в результате чего образуются полиеновые макрорадикалы различного химического строения (300–400 °С) [5]. Термодеструкция образовавшихся макрорадикалов с концевыми гидроксильными группами приводит к выделению низкомолекулярных кислородсодержащих продуктов: ацетальдегида, ацетона, акролеина и т.д., а термодеструкция полиеновых – к цис- и транс-замещенным производным – предшественникам ароматических структур [5] (Схема 2 ).
Схема 2 . Первичный процесс термодеструкции ПВС
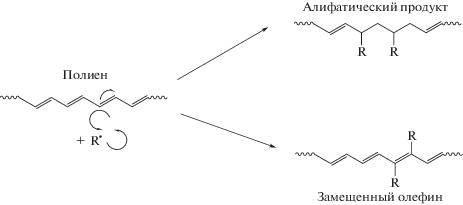
Альтернативным источником цис- и транс-замещенных полиенов служат продукты дальнейшей дегидратации первичных полиеновых структур (400–480 °С) по Схеме 3 .
Схема 3 . Трансформация полиенов в реакциях передачи цепи
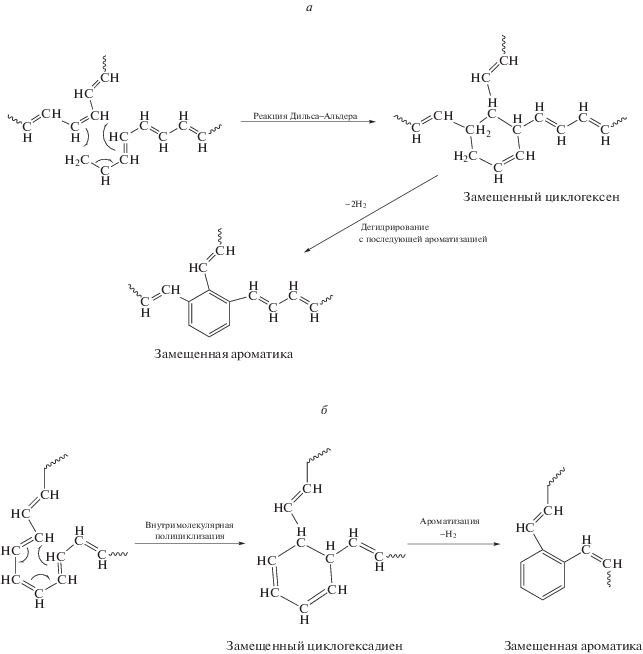
Образовавшиеся в таких условиях линейные фрагменты по механизму Дильса–Альдера (Diels–Alder) (Схема 4 а) и в результате внутримолекулярной циклизации (Схема 4 б) приводят к формированию полисопряженных ароматических структур – прекурсоров термостойкого кокса. На финальной стадии термической деструкции ПВС происходит конденсация полиароматических структур с их последующей карбонизацией (T > 430 °C).
Схема 4 . Реакции образования полисопряженных ароматических структур
Как отмечалось выше, термическая деструкция композиции ПВС/БК (1 : 1) принципиально не отличается от деструкции ПВС. Однако ускорение дегидратации ПВС в композиции с БК и термодеструкции цепных концевых гидроксилсодержащих макрорадикалов, а также торможение процессов распада коксового остатка на последней стадии разложения указывают на различный характер кинетических процессов для ПВС и его композиций с БК. Для сравнительной характеристики термостойкости и прогнозирования поведения в широком температурном интервале в настоящей работе был выполнен кинетический анализ термодеструкции композиции ПВС/БК (1 : 1) и исходного ПВС по данным ТГА при различных скоростях нагревания. Термогравиметрические исследования деструкции композиции ПВС/БК (1 : 1) проводились в динамических условиях при скоростях нагрева 3, 5 и 10 K/мин в инертной среде аргона (рис. 4).
Рис. 4.
Моделирование термодеструкции композиции ПВС/БК (1 : 1) с использованием нелинейного регрессионного анализа по трем скоростям: 3 (1), 5(2) и 10 K/мин (3). Точки – экспериментальные значения ТГА, а кривые – результат нелинейного регрессионного анализа.
Общепринято, что термическое разложение полимерных материалов удовлетворяет условиям основного кинетического уравнения [6]:
(1)
${{dc} \mathord{\left/ {\vphantom {{dc} {dt}}} \right. \kern-0em} {dt}} = - F(t,T,{{c}_{0}},{{c}_{f}}),$где t – время, T – температура, c0 – концентрация реагента, cf – концентрация конечного продукта. Уравнение F(t, T, c0, cf) может быть представлено в виде двух отдельных функций, k(T) и f(c0, cf):
Согласно основному уравнению Аррениуса,
(3)
$k\left( T \right) = A\exp \left( {{{ - E} \mathord{\left/ {\vphantom {{ - E} {RT}}} \right. \kern-0em} {RT}}} \right),$следовательно
(4)
${{dc} \mathord{\left/ {\vphantom {{dc} {dt}}} \right. \kern-0em} {dt}} = - A\exp \left( {{{ - E} \mathord{\left/ {\vphantom {{ - E} {RT}}} \right. \kern-0em} {RT}}} \right)f\left( {{{c}_{0}},{{c}_{f}}} \right).$Для одностадийных реакций f(c0,cf) уменьшается до известной формы, т.е. f(x), где c0 = 1 – x и cf = x (x – степень конверсии). Полное разделение переменных в уравнении (2) является возможным только для одностадийных реакций. Таким образом, аналитическое решение дифференциального уравнения (1) может также быть получено для одностадийных реакций. Для сложных многостадийных процессов дифференциальное уравнение (1) приводит к системе дифференциальных уравнений, для которой нет простого аналитического решения. В этом случае может применяться метод нелинейной регрессии, позволяющий выполнить прямое приближение к экспериментальным данным [7]. Кинетический анализ может быть основан на моделях, содержащих многостадийные процессы, описываемые независимыми, параллельными, конкурирующими или последовательными реакциями. Каждая стадия может быть связана с одним из следующих из табл. 1 типов классических гомогенных или гетерогенных реакций, рассматриваемых в условиях моделирования термической деструкции (табл. 1) [6, 7].
Таблица 1.
Рассматриваемые типы реакционных моделей, удовлетворяющих условиям основного кинетического уравнения dc/dt = –A exp(–RT)f(c0, cf)
| Обозначение реакции | f(c0, cf) | Реакционная модель |
|---|---|---|
| F1 | c | реакция первого порядка |
| F2 | c2 | реакция второго порядка |
| Fn | cn | реакция n-го порядка |
| R2 | 2c1/2 | двумерная реакция на границе раздела фаз |
| R3 | 3c2/3 | трехмерная реакция на границе раздела фаз |
| D1 | 0.5/(1 – c) | одномерная диффузия |
| D2 | –1/ln c | двумерная диффузия |
| D3 | 1.5e1/3(c–1/3 – 1) | трехмерная диффузия Яндера (Jander) |
| D4 | 1.5/(c–1/3 – 1) | трехмерная диффузия (Ginstling–Brounstein) |
| D1F | – | одномерная диффузия (закон Фика) |
| D3F | – | трехмерная диффузия (закон Фика) |
| B1 | c0cf | автокаталитическая реакция, описываемая уравнением Праута–Томкинса |
| Bna | $c_{0}^{n}c_{f}^{a}$ | реакция автокатализа степени a с реакцией n-го |
| порядка, описываемая уравнением Праута–Томкинса | ||
| C1 – X | c(1 + Kcat X) | реакция автокатализа первого порядка |
| Cn – X | cn (1 + Kcat X) | реакция автокатализа n-го порядка |
| A2 | 2c(–ln c)1/2 | двумерная нуклеация, уравнение Аврами–Ерофеева |
| A3 | 3c(–ln c)2/3 | трехмерная нуклеация, уравнение Аврами–Ерофеева |
| An | nc(–ln c)(n–1)/n | n-мерная нуклеация, уравнение Аврами–Ерофеева |
Выбор кинетической модели многостадийного процесса термодеструкции ПВС был основан на данных ТГА. Исходя из этих данных, а также из характера протекающих процессов (Схемы 2, 3, 4 ), предпочтение было отдано моделям термодеструкции, учитывающим протекание конкурирующих и последовательных стадий.
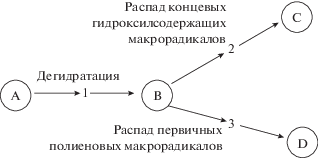
Схема 5 . Формальная модель термической деструкции ПВС
Процесс термической деструкции ПВС в инертной среде удовлетворительно описывается трехстадийной схемой (Схема 5 ). Методом многовариантной нелинейной регрессии был проведен расчет эффективных кинетических параметров термодеструкции ПВС в инертной среде и на воздухе. Кинетические параметры термодеструкции ПВС представлены в табл. 2.
Таблица 2.
Кинетические параметры термодеструкции ПВС
| Реакционная модель | Параметр | Значение | Коэффициент корреляции |
|---|---|---|---|
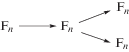 |
lg A1, с–1 | 8.8 | 0.99898 |
| E1, кДж/моль | 136.9 | ||
| n1 | 1.43 | ||
| lg A2, с–1 | 12.3 | ||
| E2, кДж/моль | 148.4 | ||
| n2 | 1.56 | ||
| lg A3, с–1 | 14.0 | ||
| E3, кДж/моль | 247.3 | ||
| n3 | 0.54 |
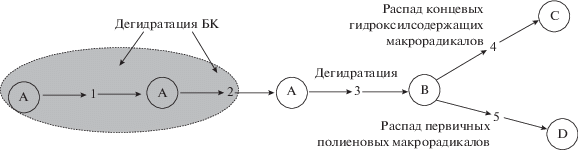
Выбор модели термической деструкции композиции ПВС с БК (1 : 1) был в первую очередь основан на данных ТГА (рис. 1, 3). В связи с этим предполагалось, что суммарная модельная система должна включать пять стадий, две начальные из которых описывают сложный процесс дегидратации БК. В результате этого в момент инициирования терморазложения ПВС в системе присутствует полиоксид бора, который выступает в роли кислотного катализатора дегидратации ПВС. При расчете кинетических параметров термодеструкции композиции ПВС с БК (1 : 1) использовалась кинетическая модель, представленная Схемой 6 .
Схема 6 . Модель термодеструкции композиции ПВС/БК
В этой модели учитывалось ускорение процесса карбонизации системы в “мягких” условиях нагревания за счет каталитического влияния полиоксида бора на дегидратацию ПВС (реакция автокатализа n-го порядка, Сn).
Расчет эффективных кинетических параметров термодеструкции композиции ПВС/БК (1 : 1) в инертной среде аргона был проведен по методу многовариантной нелинейной регрессии, как и для ПВС. Результаты нелинейного регрессионного анализа с учетом набора реакционных моделей f(c0, cf) из табл. 1 для многостадийного процесса позволили определить значения эффективных кинетических параметров, отвечающие наилучшей аппроксимации экспериментальных значений ТГА рассчитанными значениями (рис. 4, табл. 3).
Таблица 3.
Кинетические параметры термодеструкции композиции ПВС/БК (1 : 1)
| Реакционная модель | Параметр | Значение | Коэффициент корреляции |
|---|---|---|---|
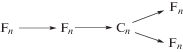 |
lg A1, с–1 | 7.3 | 0.99982 |
| E1, кДж/моль | 69.7 | ||
| n1 | 0.58 | ||
| lg A2, с–1 | 7.6 | ||
| E2, кДж/моль | 79.3 | ||
| n2 | 2.16 | ||
| lg A3, с–1 | 6.7 | ||
| E3, кДж/моль | 148.4 | ||
| n3 | 3.02 | ||
| lg A4, с–1 | 9.0 | ||
| E4, кДж/моль | 119.2 | ||
| n4 | 2.59 | ||
| lg A5, с–1 | 13.5 | ||
| E5, кДж/моль | 210.7 | ||
| n5 | 2.65 |
В дополнение к этому кинетические параметры термодеструкции композиции ПВС/БК (1 : 1), рассчитанные в настоящей работе, использовали для прогнозирования поведения композиции при изотермическом нагреве в температурном диапазоне 300–400 °С (рис. 5). Из рис. 5 видно, что в изотермических условиях пиролиза этой композиции в указанном температурном диапазоне характер зависимости потери массы от времени значительно отличается от данных для чистого ПВС. Очевидно, что в присутствии полиоксида бора ускоряется процесс дегидратации гидроксилсодержащей компоненты ПВС, что не только приводит к более раннему формированию полиеновых структур (рис. 2), но также способствует ускорению распада концевых гидроксилсодержащих фрагментов (макрорадикалов). В итоге карбонизованный остаток формируется на ранних стадиях термодеструкции композиции ПВС/БК (1 : 1) и представляет собой более термостойкую систему, чем в случае ПВС (рис. 2). Это подтверждается результатами ТГА, из которых следует, что ПВС в условиях динамического нагревания в инертной среде до 500 °С разлагается практически без остатка, тогда как при термодеструкции композиции ПВС с БК (1 : 1) в аналогичных условиях коксовый остаток составляет примерно 10 мас.% (рис. 1, 2).
Рис. 5.
Расчетные зависимости степени превращения от времени в условиях изотермической термодеструкции ПВС – кривые 1–3 и композиции ПВС/БК (1 : 1) – кривые 4–6: 1, 4 – 300 °С, 2, 5 – 350 °С, 3, 6 – 400 °С.
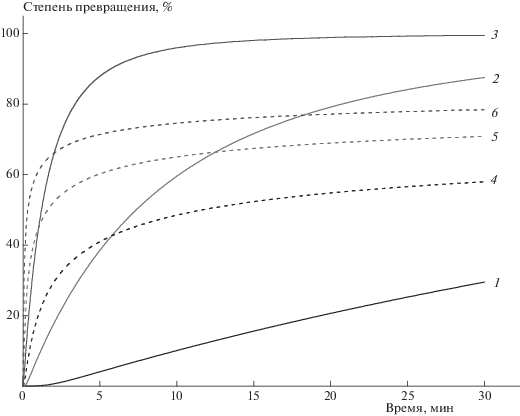
Вне всякого сомнения, модельный кинетический анализ термодеструкции системы ПВС–БК является существенным инструментом для изучения механизма термодеструкции и прогнозирования поведения системы в различных температурных условиях. Однако формальный кинетический подход к механизму без подробного изучения химического состава продуктов деструкции не позволяет перейти к глубокому пониманию существа происходящих при термодеструкции процессов. В последующей работе с помощью метода пиролитической хромато-масс-спектрометрии, позволяющего проводить количественный анализ летучих продуктов пиролиза, предполагается детально рассмотреть влияние БК на механизм термодеструкции ПВС.
ЗАКЛЮЧЕНИЕ
В данной работе проведено кинетическое моделирование термодеструкции композиции борной кислоты с поливиниловым спиртом, учитывающее каталитический характер процесса дегидратации и ускоренную карбонизацию. Установлены характерные особенности протекающих процессов.
Работа выполнена в рамках государственного задания ФАНО России по темам 0082-2014-0009 № АААА-А17-117040610309-0 и № 0120125305.
Список литературы
Шаулов А.Ю., Ломакин С.М., Рахимкулов А.Д., Коверзанова Е.В., Глушенко П.Б., Щеголихин А.Н., Шилкина Н.Г., Берлин Ал.Ал. // ДАН. 2004. Т. 398. № 1. С. 231.
Шаулов А.Ю., Ломакин С.М., Зархина Т.С., Рахимкулов А.Д., Шилкина Н.Г., Муравлев Ю.Б., Берлин Ал.Ал. // Там же. 2005. Т. 403. № 6. С. 1.
Opfermann J. // Rechentechnik/Datenverarbeitung. 1985. B. 22. № 1. S. 26.
Polyvinyl Alcohol. Properties and Applications / Ed. Finch C.A. London: John Wiley, 1973.
Gilman J.W., Vander Hart D.L., Kashiwagi T. // Proc. ACS Sympos. Ser. 599: Fire and Polymers II. 1995. P. 161.
Opfermann J. // J. Thermal Anal. Cal. 2000. V. 6. № 3. P. 641.
Opfermann J., Kaisersberger E. // Thermochim. Acta. 1992. V. 11. № 1. P. 167.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика