Химическая физика, 2019, T. 38, № 5, стр. 54-70
Образование хиральных и суперспирализованных структур в фотоинициированной формозной реакции в модели de novo
С. В. Стовбун 1, *, А. М. Занин 1, А. А. Скоблин 1, М. А. Трегубова 1, В. А. Твердислов 2, О. П. Таран 3, 4, 5, В. Н. Пармон 4, 6, 7
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Институт химии и химической технологии Сибирского отделения Российской академии наук
Красноярск, Россия
4 Институт катализа им. Г.К. Борескова Сибирского отделения Российской академии наук
Новосибирск, Россия
5 Сибирский федеральный университет,
Красноярск, Россия
6 Новосибирский государственный университет
Новосибирск, Россия
7 Томский государственный университет
Томск, Россия
* E-mail: s.stovbun@chph.ras.ru
Поступила в редакцию 10.11.2017
После доработки 27.08.2018
Принята к публикации 20.09.2018
Аннотация
В работе при физико-химическом моделировании de novo посредством фотолиза концентрированного раствора формальдегида и последующей конденсации продукта впервые показан синтез биологически значимых сахаров и других хиральных соединений без каких-либо химических инициаторов; обнаружена оптически активная конденсированная фаза; установлено расщепление энантиомеров по знаку хиральности в момент конденсации; выявлена иерархическая (трехуровневая) спирализованная структура оптически активной анизометрической фазы (струн), в которой струны большего диаметра спирально сплетены из струн меньшего диаметра; установлено, что направление закрутки струн при их спиральном сплетении из струн предыдущего уровня иерархии определяется их супрамолекулярной хиральностью (знаком избытка лево- или правоспиральных супрамолекулярных субмикроскопичекских структур); показано, что структурообразование в системах, подобных предбиологическим, может идти через механизм суперспирализации уже в водном растворе сахаров с молекулярными массами μ ~ 102 Да, т.е. существенно раньше, чем сформировались линейные хиральные макромолекулы. Результаты получены в условиях, отвечающих современным представлениям о форме и векторе предбиологической эволюции, поэтому могут иметь фундаментальное значение для молекулярной биологии.
ВВЕДЕНИЕ
Соединения с оптически активными (“хиральными”) атомами углерода лежат в основе биопоэза – процесса превращения неживой природы в живую. Формирование хиральных структур – это одна из наиболее значимых сквозных тенденций химической и биологической эволюции [1]. Так, полипептидная цепь белков состоит из остатков L-аминокислот, а D-дезоксирибоза формирует полимерные цепи двойной спирали ДНК. За исключением специальных случаев, гомохиральны также углеводы и липиды. Основой хиральности молекулярных структур в живых системах является углерод в sp3-гибридизации. Системно он мог интегрироваться в процессы предбиологической химической эволюции по разным траекториям, но один из наиболее реальных путей – давно обсуждающийся путь через углеводы [2]. В структурных иерархиях белков, нуклеиновых кислот, целлюлозы при повышении уровня организации хиральность асимметричного углерода сменяется на хиральность спиральных и суперспиральных структур [3–5]. Важнейшая функционально-биологическая роль суперспирализации определяется биоинформационными и структурными процессами биопоэза, например компактизацией, репликацией и транскрипцией ДНК, созданием сверхпрочных спиральных перехлестов коммутирующих элементов в природных и биомиметических системах за счет эффекта Эйлера [6–9] и т.д.
Вероятнее всего, суперспирализация предбиологических структур предшествует возникновению структурных дискретных иерархий в молекулярно-биологических системах. В этом смысле суперспирализация является единственно известным инвариантом в рамках физического формализма, связывающим предбиологическую и биологическую стадию эволюции, отвечающим идеям сквозной эволюции материи и имеющим функционально-биологическое значение [4, 5, 10]. Эмпирически установленным на всех известных молекулярно-биологических системах, но пока не доказанным строго теоретически является факт смены знака хиральности при суперспирализаци на разных иерархических уровнях (масштабах). Относительно строгое доказательство этого факта проведено при исследовании макроскопической динамики неустойчивости скручивания и образования петель на супрамолекулярных гомохиральных струнах [5, 11].
В биомиметических гомо- и гетерохиральных системах суперспирализация, а также смена знака хиральности при суперспирализации были показаны нами экспериментально, причем для соединений с малой молекулярной массой μ [4, 5, 10, 12, 13]. Так, например, в низкоконцентрированных (~1 мг/мл) растворах гомохиральных трифторацетилированных аминоспиртов (ТФААС, μ ~ 200 Да), имеющих изометрическую ван-дер-ваальсовую поверхность, минимальную ахиральную периферию [5] и дипольный момент более 3Д [5, 14], спонтанно формируются макроскопические, длиной ~102–103 мкм, суперспирализованые супрамолекулярные струны (рис. 1) с несколькими разномасштабными уровнями хиральной иерархии [5, 10, 15–19]. Таким образом, было экспериментально установлено, что структурообразующая функция хиральности на макроскопическом масштабе обусловлена суперспирализацией, обнаруженной для всех известных молекулярно-биологических и многих биомиметических систем [4, 18]. При этом открытым остается следующий вопрос: шло ли структурообразование в предбиологических системах через механизм суперспирализации еще до образования макромолекул, или этот механизм включился только с момента образования линейных хиральных макромолекул?
Следуя этой логике, было бы чрезвычайно интересно получить суперспирализованные структуры (например, струны) не просто в растворе хиральных биомиметиков, а в системе, моделирующей процессы возникновения хирального атома углерода в атмосфере планетозимали [20]. Ранее нами экспериментально было показано, что в низконцентрированных рацемических растворах ТФААС такие гомохиральные суперспирализованные струны формируются в результате спонтанного расщепления антиподов [21, 22]. Как показали расчеты методом молекулярной динамики, спонтанное расщепление антиподов в рацемическом растворе происходит на стадии нуклеации гомохиральных струн в наноразмерных каплях с достаточно большой подвижностью молекул ТФААС [5, 23, 24]. При этом сами зародыши нуклеации могут иметь спиральную структуру [22, 25]. В свою очередь, это означает возможность формирования оптически активных фаз и суперспирализованных структур (в том числе и анизометрических, типа струн) за счет химических реакций с рацемическими продуктами и без какого-либо дополнительного фактора асимметрии.
Асимметричный углерод мог включиться в органический мир на стадии первичной атмосферы планетозимали, содержавшей формальдегид (ФА) [20], например посредством автокаталитческой реакции Бутлерова, а в зарубежной терминологии – формозной реакции (формоза – смесь синтетических углеводов – сахаров, получаемых из формальдегида в ходе реакции Бутлерова; см. обзоры [26–29]), в которой в качестве автокатализатора (“затравки”) могут выступать любые моносахариды или другие органические соединения, способные к образованию ендиольных форм [30, 31]. В этих химических реакциях был обнаружен набор моносахаридов, начиная с простейшего, содержащего два атома углерода, вплоть до моносахарида, содержащего восемь атомов углерода. С другой стороны, инициировать превращения формальдегида в сахара можно с помощью физического воздействия: радиолиза [32] или УФ-облучения [33–37]. Объединяющим эти работы фактором является обязательное использование основных катализаторов: CaCO3, Ca(OH)2, Na2CO3, NaHCO3, NaOH, Mg(OH)2 (исключение составляет работа [37], где катализаторы не использовались), а также использование разбавленных водных растворов. С точки зрения физико-химического моделирования синтеза макромолекул из максимально простых предшественников (de novo), конечно, предпочтительнее проводить формозную реакцию под действием ультрафиолета (УФ) в парогазовой или эквивалентно концентрированной водной фазах, содержащих только молекулы ФА.
Хорошо известно, что полоса поглощения карбонильной группы молекулы формальдегида имеет максимум при 260 нм с коэффициентом экстинкции ε < 100 л/(моль ⋅ см) [37]. Однако в водном растворе формальдегид взаимодействует с молекулами воды с образование метилен гликоля (МГ), поглощающего излучение с меньшей длиной волны, концентрация которого в разбавленных растворах существенно выше концентрации свободных молекул формальдегида. Поэтому поглощение молекулой ФА кванта света с длиной волны λ ≤ 260 нм приводит к разрыву связей O–H и С=O в молекулах МГ и ФА, соответственно, с образованием реакционноспособных частиц. При этом естественно предположить одновременное протекание как минимум двух групп параллельных реакций:
1) полимеризации МГ (СН2(ОH)2) с образованием параформа (ПФ);
2) олигомеризации ФА (СН2О) с образованием моно-, ди- и полисахаридов.
Эти процессы можно проиллюстрировать, например, предельно упрощенной схемой:
(1)
$\begin{gathered} {\text{Н О }}{\kern 1pt} --{\kern 1pt} {\text{С }}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\text{О Н }} + {\text{Н О }}{\kern 1pt} --{\kern 1pt} {\text{С }}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\text{О Н }} + \\ + \,\,{\text{Н О }}{\kern 1pt} --{\kern 1pt} {\text{С }}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\text{О Н }} + {\text{и }}\,\,{\text{т }}{\text{.д }}{\text{.}} \to {{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{CO}}} \right)}_{n}} + n{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(2)
$\begin{gathered} {\text{Н }}{\kern 1pt} --{\kern 1pt} {\text{С Н }}{\kern 1pt} = {\kern 1pt} {\text{О }} + {\text{Н }}{\kern 1pt} --{\kern 1pt} {\text{С Н }}{\kern 1pt} = {\kern 1pt} {\text{О }} \to \\ \to {\text{С }}{{{\text{H}}}_{{\text{2}}}}{\text{О Н }}{\kern 1pt} --{\kern 1pt} {\text{С Н }}{\kern 1pt} = {\kern 1pt} {\text{О }} + {\text{С }}{{{\text{H}}}_{2}}{\kern 1pt} = {\kern 1pt} {\text{О }} \to \\ \to {\text{С }}{{{\text{H}}}_{{\text{2}}}}{\text{О Н }}{\kern 1pt} --{\kern 1pt} {\text{С Н О Н }}{\kern 1pt} --{\kern 1pt} {\text{С Н }}{\kern 1pt} = {\kern 1pt} {\text{О }} + \ldots .{\text{ и т }}{\text{.д }}. \\ \end{gathered} $Вышеизложенные предпосылки и послужили основанием для постановки данной работы по определению наличия хиральных продуктов в реакции УФ-фотолиза формальдегида, а также особенностей спонтанного формирования их оптически активных фаз. Такие макроскопические фазы на стадии de novo могли играть роль хиральных органических матриц для синтеза гомохиральных предшественников биомакромолекул. Вполне очевидно, что проведение такого физико-химического моделирования интересно с точки зрения как физикохимии, так и понимания процессов биопоэза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ И МЕТОДЫ
В опытах использовался предельно концентрированный (95%) раствор ФА в воде, полученный в результате разложения параформа при 160–170 °С в течение 1.5 ч. Масса исходного раствора составляла 600 г. Открытая поверхность раствора подвергалась УФ-облучению лампой ДРШ-100 при непрерывном перемешивании. Расстояние между лампой и поверхностью раствора составляло 10 см. Для исключения самопроизвольного низкотемпературного перехода ФА в ПФ температура термостатирования была выбрана равной 70 °С. Эксперимент завершался спустя 8.5 ч после полного затвердевания исходного раствора. Основной по массе образующийся продукт – параформ. Эта побочная для нас реакция идет по схеме (1) . Ввиду предполагаемой малости выхода образующихся сахаров по пути (2) и с целью минимизации потерь для отделения искомых углеводов от ПФ была выбрана сублимация полученного при облучении ПФ, усиленная вакумированием. Остаточное давление паров ПФ позволило это осуществить в достаточно “мягких” условиях (70–80 °С), но в течение длительного времени – 265 ч. Общий выход нелетучих продуктов составил не менее 0.7 мас.%. Далее этот продукт будем называть “аналит-1”. Качественный анализ на содержание сахаров аналита-1 проводили с применением классического реактива Фелинга1)1). Для определения состава органических продуктов реакции использовался газожидкостный хромато-масс-спектрометрический (ГЖХ–МС) анализ с предварительной дериватизацией методом силилирования. Исходный образец (аналит-1) был разделен путем растворения в воде при комнатных условиях на две фракции: водорастворимую (с последующим выпариванием) – аналит-2 и водонерастворимую (выпавшую в осадок за 24 ч, далее количество осажденного вещества не изменялось) – аналит-3.
Образцы аналита-2 и аналита-3 для анализа ГЖХ–МС готовили двумя способами:
1) навеску 20 мг каждого из образцов растворяли в 2 мл дистиллированной воды.
2) проводили гидролиз полученных при облучении образцов (олигомерных соединений) с целью получения мономерных молекул. Для этого навески каждого из образцов массой 20 г помещали в 150 мл 1 М раствора HCl и при постоянном перемешивании на магнитной мешалке нагревали на кипящей водяной бане в течение 2 ч. Для предотвращения упаривания воды и других компонентов реакционной смеси были использованы обратные холодильники.
Анализ образцов аналита-2 и аналита-3 и их гидролизатов на содержание моносахаридов и других органических соединений проводили методом ГЖХ–МС с предварительной дериватизацией методом силилирования [38]. Хромато-масс-спектрометрический анализ дериватизированных образцов проводили на приборе Agilent 7000B (США), оснащенном капиллярной колонкой Hp-5ms размерами 30 м × 0.25 мм × 0.25 мкм. Условия хроматографирования: градиентный нагрев колонки от 80 до 280 °С со скоростью 8 °С/мин.
Температуры фазовых переходов определяли c помощью дифференциальной хромель-алюмелевой термопары, микроамперметра Ф116/2 и цифрового микроскопа Digital Microscope U800Х. Также для исследований использовали тонкослойную хроматографию.
Исследовалась оптическая активность водных растворов (дисперсий) аналита-1, аналита-2 и аналита-3, для чего использовался поляриметр с кюветой длиной 20 см. Проводилось оптическое микроскопирование в проходящем свете (с помощью микроскопа МИКМЕД-6) ксерогелей (или дисперсных осадков) аналита-1, аналита-2 и аналита-3, полученных путем медленного высушивания их водных растворов (дисперсий) на предметном стекле. Между источником света и предметным стеклом помещался поляризатор, между предметным стеклом и объективом микроскопа – анализатор (т.е. второй поляризатор). Оси поляризатора и анализатора выставлялись под углом 90° (режим темного поля), в ходе микроскопирования ось поляризатора вращалась. Угол поворота поляризатора оценивался при вращении микровинта предметного столика микроскопа.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Полученный в результате облучения исходного раствора ФА УФ-светом продукт (аналит-1) имеет коричневатый цвет. Продукт практически нерастворим в гексане, этилацетате, ацетоне, глицерине, аммиаке, перекиси водорода, малорастворим в воде, но хорошо растворим в бензоле, циклогексане, хлороформе, четыреххлористом углероде. Растворы или дисперсии аналита-1 оптически неактивны. Водорастворимая часть продукта также оптически неактивна (аналит-2) – вязкое при комнатной температуре вещество белого цвета с температурой кипения 118 °С при 760 Торр. Водонерастворимая фракция (аналит-3) – кристаллическое вещество бежевого цвета с температурой плавления 137.5 °С; его водная дисперсия также оптически неактивна. Отсутствие оптической активности растворов или дисперсий – совершенно ожидаемый факт, так как в исследуемой реакции отсутствует сколько-нибудь значимый асимметрический фактор и продукты реакций рацемичны.
Качественный анализ на содержание моносахаридов в аналите-1 проводился с использованием свежеприготовленного реактива Фелинга. Анализ основан на восстанавливающих свойствах сахаров [39]. Он показал присутствие в этом продукте редуцирующих углеводов. Общеизвестно, что к таковым относятся все моносахариды и лишь часть дисахаридов (лактоза, мальтоза и целлобиоза). Поэтому естественно предположить наличие каких-то из этих биологически значимых сахаров, содержащих асимметричный атом углерода, в аналите-1.
Также была предпринята оценка типа сахаров в аналите-1 с помощью тонкослойной хроматографии с использованием сорбента SiO2 и элюэнта, состоящего из смеси циклогексан : бензол : метанол, взятых в объемных соотношениях 2 : 3 : 1. При сравнении фактора задержки Rf, полученного по хроматограммам для аналита-1 (0.935) и ряда пробных сахаров (рамнозы с числом атомов С6 (0.944), глюкозы-С6 (0.947), арабинозы-С5 (0.976), ксилозы-С6 (0.977) и сахарозы-С12 (0.923)), видно что тестируемые сахара, содержащиеся в аналите-1, могут относиться к группе сахаров с числом атомов углерода в пределах 12, что не противоречит данным, полученным в реакции Фелинга.
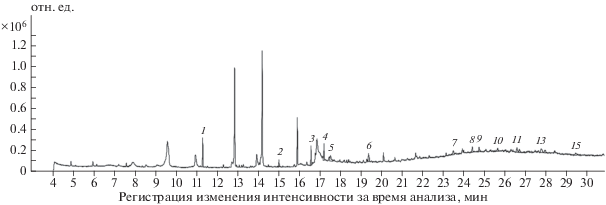
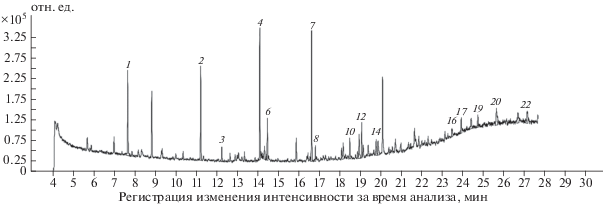
Более точно качественный состав продуктов, полученных при фотолизе, определялся методом ГЖХ–МС. Результаты анализа образцов аналита-2 и аналита-3, приготовленных первым способом, т.е. растворенных в дистиллированной воде и дериватизированных, представлены на рис. 1, 2 и в табл. 1, 2 соответственно. В этих таблицах приведена расшифровка хроматографических пиков, включающая времена выхода и площади пиков, а также процентное содержание отдельных пиков относительно суммарной площади всех пиков.
Таблица 1.
Компоненты образца аналита-2 с указанием нумерации пиков, времен выхода, площадей пиков и их процентного содержания относительно суммарной площади пиков
| № пика | Время удерживания, мин | Площадь пиков, отн. ед. | Площадь, % | Соединение |
|---|---|---|---|---|
| 1 | 11.292 | 455 251 | 13.82 | глицерин |
| 2 | 15 | 81 010 | 2.46 | |
| 3 | 16.559 | 299 785 | 9.1 | (L, D)-ксилопираноза |
| 4 | 17.192 | 300 088 | 9.11 | β-(L,D)-(+)-ксилопираноза |
| 5 | 17.512 | 238 904 | 7.25 | |
| 6 | 19.357 | 246 149 | 7.47 | |
| 7 | 23.478 | 206 333 | 6.26 | |
| 8 | 24.402 | 166 998 | 5.07 | |
| 9 | 24.728 | 140 863 | 4.28 | |
| 10 | 25.636 | 146 532 | 4.45 | |
| 11 | 26.574 | 166 790 | 5.06 | |
| 12 | 26.681 | 157 450 | 4.78 | |
| 13 | 27.746 | 216 093 | 6.56 | |
| 14 | 27.933 | 162 195 | 4.92 | |
| 15 | 29.421 | 132 042 | 4.01 | |
| 16 | 36.269 | 177 290 | 5.38 |
Таблица 2.
Компоненты образца аналита-3 с указанием нумерации пиков, времен выхода, площадей пиков и их процентного содержания относительно суммарной площади пиков
| № пика | Время удерживания, мин | Площадь пиков, отн. ед. | Площадь, % | Соединение |
|---|---|---|---|---|
| 1 | 7.643 | 440 590 | 11.8 | гликолевая кислота |
| 2 | 11.202 | 401 763 | 10.76 | глицерин |
| 3 | 12.232 | 69 146 | 1.85 | полиол?? |
| 4 | 14.084 | 517 897 | 13.87 | (L, D)-фруктоза |
| 5 | 14.319 | 83 669 | 2.24 | |
| 6 | 14.457 | 167 139 | 4.48 | гликолевый альдегид |
| 7 | 16.61 | 527 763 | 14.14 | сахар? |
| 8 | 16.796 | 74 051 | 1.98 | |
| 9 | 18.151 | 96 235 | 2.58 | |
| 10 | 18.475 | 99 470 | 2.66 | |
| 11 | 18.929 | 133 416 | 3.57 | |
| 12 | 19.058 | 144 972 | 3.88 | сахар? |
| 13 | 19.373 | 72 876 | 1.95 | галактоза? |
| 14 | 19.765 | 88 557 | 2.37 | |
| 15 | 19.855 | 104 707 | 2.8 | |
| 16 | 23.456 | 67 562 | 1.81 | |
| 17 | 23.91 | 91 200 | 2.44 | |
| 18 | 24.396 | 94 838 | 2.54 | |
| 19 | 24.721 | 77 624 | 2.08 | |
| 20 | 25.63 | 165 912 | 4.44 | |
| 21 | 26.672 | 106 083 | 2.84 | |
| 22 | 27.131 | 108 029 | 2.89 |
Образец аналита-2 (рис. 1, табл. 1). Согласно результатам ГЖХ–МС-анализа идентифицированы 3 пика из 16, что суммарно составило 32% от суммарной площади всех пиков. Отметим, что здесь и далее обозначение D(L) вводится для того, чтобы подчеркнуть что ГЖХ–МС не различает антиподы. Показано, что около 13.8% соответствует глицерину, 9.1% – D(L)-ксилопиранозе и 9.1% – β-D(L)-(+)-ксилопиранозе (9.1%).
Образец аналита-3 (рис. 2, табл. 2). Идентифицированы 8 пиков из 22, что суммарно составило 63% от общей площади всех пиков. Полиспиртам глицерину и полиолу неустановленной структуры (пик 3) соответствует 12.6%, гликолевой кислоте – 11.8%, гликолевому альдегиду – 4.5%. Относительное содержание моносахаридов близко к 34%: два из них не были идентифицированы (пики 7 и 12), фруктоза – 13.9%, галактоза ~2%.
Результаты ГЖХ–МС-анализа дериватизированного гидролизата образца аналита-2 представлены на рис. 3. Расшифровка наиболее вероятных соединений, соответствующих хроматографическим пикам, показана в табл. 3. Следует отметить, что 16 из 17 пиков идентифицированы. В соответствии с полученными данными полиспирты являются преимущественными продуктами: диолы (пики 1, 3, 5–8), глицерин (пик 4), рибитол (пик 12), неидентифицированный полиол (пик 13), эритритол (пик 14). Суммарное содержание полиолов, найденное по общей площади всех пиков составило 76.1%, из них наибольшее содержание (37.2%) соответствует глицерину, далее идут 2-бутен-1,4-диол (13.1%), 3-метилен-1,4-диол-бутан (10.3%) и др. Обнаружены следующие сахара: фруктоза (12.4%), ксилоза (0.9%) и дисахарид сахароза (1.1%).
Рис. 3.
Хроматограмма образца аналита-2, дериватизированного методом силилирования после кислотного гидролиза 1 М HCl в течение 2 ч.
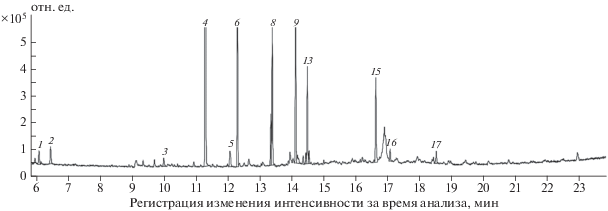
Таблица 3.
Компоненты гидролизата образца аналита-2 с указанием нумерации пиков, времен выхода, площадей пиков и их процентного содержания относительно суммарной площади пиков
| № пика | Время удерживания, мин | Площадь пиков, отн. ед. | Площадь, % | Соединение |
|---|---|---|---|---|
| 1 | 6.073 | 103 749 | 1.17 | этиленгликоль |
| 2 | 6.431 | 131 994 | 1.49 | этиллактат |
| 3 | 9.971 | 74 874 | 0.84 | диол* |
| 4 | 11.272 | 3 299 798 | 37.22 | глицерин |
| 5 | 12.039 | 167 528 | 1.89 | диол* |
| 6 | 12.273 | 1 163 630 | 13.13 | 2-бутен-1,4-диол |
| 7 | 13.318 | 297 939 | 3.36 | 2-пропанон(1,3)-диол |
| 8 | 13.361 | 912 410 | 10.29 | 3-метилен-1,4-диол-бутан |
| 9 | 14.092 | 1 099 177 | 12.4 | фруктоза |
| 10 | 14.152 | 107 002 | 1.21 | |
| 11 | 14.331 | 66 029 | 0.74 | сахар* |
| 12 | 14.412 | 65 543 | 0.74 | рибитол |
| 13 | 14.459 | 570 575 | 6.44 | полиол*? |
| 14 | 14.511 | 76 797 | 0.87 | эритритол |
| 15 | 16.6 | 553 715 | 6.25 | 4-кетоглюкоза?? |
| 16 | 17.049 | 79 435 | 0.9 | ксилоза |
| 17 | 18.488 | 94 526 | 1.07 | сахароза |
Результаты ГЖХ–МС-анализа дериватизированного гидролизата образца аналита-3 представлены на рис. 4, расшифровка наиболее вероятных соединений, соответствующих хроматографическим пикам, показана в табл. 4. Установлена структура 18 пиков из 31, что составляет 49% от суммарной площади пиков. Обнаружено пять различных полиолов: наибольшее содержание соответствует глицерину – 33.8%, этиленгликолю – 0.73%, 2-бутен-1,4-диолу – 0.57%, эритритолу – 1.12% и рибитолу – 0.5%. Общее процентное содержание разветвленных дезоксисахаров (D(L)-эритро-пентитол-2-дезокси, D(L)-пентофураноза-2-дезокси, D(L)-арабиногекситол-2-дезокси) составило 3.3%. Содержания молочной кислоты (пик 2) и молочного альдегида (пик 16) близки и составляют 1.3 и 1.1% соответственно. Идентифицированы дисахариды трегалоза и мальтоза (суммарным содержанием 1.5%), моносахариды ликсопираноза (1.7%), талопираноза (0.17%), гликопираноза (0.9%), фруктоза (0.64%) и сахар неустановленной структуры (пик 23) – 0.72%.
Рис. 4.
Хроматограмма образца аналита-3, дериватизированного методом силилирования после кислотного гидролиза 1 М HCl в течение 2 ч.

Таблица 4.
Компоненты гидролизата образца аналита-3 с указанием нумерации пиков, времен выхода, площадей пиков и их процентного содержания относительно суммарной площади пиков
| № пика | Время удерживания, мин | Площадь пиков, отн. ед. | Площадь, % | Соединение |
|---|---|---|---|---|
| 1 | 6.078 | 204 113 | 0.73 | этиленгликоль |
| 2 | 6.437 | 348 061 | 1.25 | молочная кислота |
| 3 | 9.984 | 200 382 | 0.72 | |
| 4 | 10.923 | 87 073 | 0.31 | |
| 5 | 11.291 | 9 395 519 | 33.78 | глицерин |
| 6 | 12.291 | 3 455 734 | 12.42 | |
| 7 | 13.088 | 158 491 | 0.57 | 2-бутен-1,4-диол |
| 8 | 13.381 | 3 050 557 | 10.97 | |
| 9 | 13.888 | 97 263 | 0.35 | |
| 10 | 14.113 | 3 974 000 | 14.29 | (L, D)-фруктоза |
| 11 | 14.172 | 176 658 | 0.64 | |
| 12 | 14.203 | 152 499 | 0.55 | |
| 13 | 14.349 | 222 474 | 0.8 | |
| 14 | 14.432 | 251 139 | 0.9 | |
| 15 | 14.48 | 2 295 983 | 8.25 | |
| 16 | 14.532 | 293 513 | 1.06 | молочный альдегид |
| 17 | 14.909 | 311 569 | 1.12 | эритритол |
| 18 | 16.13 | 121 680 | 0.44 | |
| 19 | 16.416 | 113 041 | 0.41 | |
| 20 | 16.919 | 168 934 | 0.61 | |
| 21 | 17.057 | 478 846 | 1.72 | ликсопираноза |
| 22 | 17.563 | 140 672 | 0.51 | рибитол |
| 23 | 17.965 | 200 599 | 0.72 | сахар? |
| 24 | 18.361 | 126 112 | 0.45 | (L, D)-эритропентитол, 2-дезокси? |
| 25 | 18.384 | 450 204 | 1.62 | (L, D)-эритро-пентофураноза, 2-дезокси-? |
| 26 | 18.478 | 335 549 | 1.21 | (L, D)-арабиногекситол, 2-дезокси? |
| 27 | 18.847 | 274 633 | 0.99 | β-(L, D)-метилфруктофуранозид? |
| 28 | 18.878 | 162 409 | 0.58 | трегалоза |
| 29 | 18.936 | 48 612 | 0.17 | β-(L, D)-(+)-талопираноза |
| 30 | 19.692 | 270 387 | 0.97 | мальтоза? |
| 31 | 20.066 | 247 706 | 0.89 | глюкопираноза? |
Таким образом, образцы аналита-2 и аналита-3 содержат в значительных количествах полиолы различной структуры, моносахариды, дисахариды, а в образце аналита-2 обнаружены дезоксисахара. Гидролиз обоих образцов позволил уточнить перечень мономерных соединений, входящих в полимерные структуры. Оптические изомеры (энантиомеры) практически всех обнаруженных в реакции хиральных продуктов имеют важное функциональное значение в природных системах (см. табл. 5) [40].
Таблица 5.
Биологическое значение полученных в реакции веществ
| № п. п. |
Вещество | Функциональное значение |
|---|---|---|
| 1 | глицерин | является основой, из которой образуются триглицериды, являющиеся важными компонентами в процессе обмена веществ в живых организмах |
| 2 | ксилоза | участвует в процессах взаимных превращений углеводов, содержится в эмбрионах растений в качестве эргастического вещества |
| 3 | фруктоза | содержится в меде и некоторых фруктах, используется для выработки энергии в печени в процессе гликолиза; в качестве моносахаридного звена входит в состав сахарозы и лактулозы |
| 4 | сахароза | естественный углевод, употребляемый в пищу; является основной составляющей тростникового сахара и сахарной свеклы |
| 5 | гликолевая кислота | входит в группу фруктовых альфа-гидроксильных кислот |
| 6 | гликолевый альдегид | является предшественником многих биологически активных соединений, например аминокислоты глицина; в качестве промежуточного вещества участвует в некоторых биохимических процессах, например при катаболизме пуринов |
| 7 | галактоза | входит в состав олигосахаридов (мелибиозы, рафинозы, стахиозы), некоторых гликозидов, растительных и бактериальных полисахаридов (камедей, слизей, галактанов, пектиновых веществ, гемицеллюлоз); в организме животных и человека входит в состав лактозы, группоспецифических полисахаридов, цереброзидов, кератосульфата и др.; в животных и растительных тканях может включаться в гликолиз, превращаясь в глюкозо-1-фосфат, который и усваивается |
| 8 | многоатомные спирты | содержатся грибах, фруктах и овощах, а также в организме человека и животных (эритриол); рибитол входит в состав рибофлавина и флавинадениндинуклеотидов и находится в клеточных стенках грамположительных бактерий |
| 9 | дезоксисахара | являются компонентами гликозидов, олиго- и полисахаридов; важнейший их представитель 2-дезокси-D-рибоза входит в состав дезоксирибонуклеиновых кислот (ДНК) |
| 10 | молочная кислота | формируется при распаде глюкозы, образуется в мышцах |
| 11 | трегалоза | на клеточном уровне обладает терапевтическими свойствами, регулируя развертывание белков; в личинках хирономиды Polypedilum vanderplanki, способных переносить высыхание, накопление в клетках большой концентрации трегалозы является одним из механизмов устойчивости к высушиванию |
| 12 | мальтоза | в животном и растительном организмах мальтоза образуется при ферментативном расщеплении крахмала и гликогена |
| 13 | лископираноза | в природе встречается крайне редко, например в качестве компонента некоторых бактериальных гликолипидов |
| 14 | глюкопираноза | мономер, из которого образуются два наиболее важных полисахарида: крахмал и целлюлоза |
Для исследования оптической активности продуктов фотолиза формальдегида использовали ксерогели (дисперсные осадки) аналита-1, водорастворимого (аналит-2) и водонерастворимого (аналит-3) продуктов, полученные путем медленного высушивания их водных растворов (дисперсий) на предметном стекле. Результаты оптической микроскопии ксерогеля (дисперсного осадка) аналита-1 в поляризованном свете представлены на рис. 5. Хорошо видно, что значительная часть полученных структур ксерогеля, или дисперсного осадка, пропускает свет при расположении анализатора перпендикулярно плоскости поляризации проходящего через образец света, т.е. в режиме темного поля (рис. 5). Это означает наличие оптической активности в конденсированной фазе структур ксерогеля образца аналита-1. При этом доля оптически неактивных структур ксерогеля аналита-1, согласно визуальной оценке (рис. 5), пренебрежимо мала.
Рис. 5.
Микрофотография (увеличение ×40) ксерогеля (дисперсного осадка) аналита-1 в скрещенных под углом 90° поляризаторе и анализаторе (режим темного поля). Соотношение бело-черного контраста свидетельствует о значительно большей доле оптически активных конденсированных фаз в ксерогеле в сравнении с оптически неактивными фазами.

Результаты оптической микроскопии дисперсного осадка водонерастворимого аналита-3 в поляризованном свете представлены на рис. 6а и б, при поворотах поляризатора соответственно влево и вправо на 3° относительно режима темного поля. Осадок представляет собой массив, разбитый на квазиодномерные, визуально плоские структурные элементы. По крайней мере некоторые из этих структурных элементов образованы молекулами с разной хиральностью, о чем свидетельствует вращение ими плоскости поляризованного света в противоположные стороны (примерно на 3°). Действительно, эти элементы полностью темнеют при повороте на угол ~3°, однако направления поворота для различных образований (элементов) различаются (см. отмеченные стрелками структурные элементы на рис. 6).
Рис. 6.
Микрофотографии (увеличение ×40) дисперсного осадка водонерастворимого аналита-3, полученные в скрещенных поляризаторе и анализаторе, при повороте поляризатора относительно режима темного поля на 3° (а – поворот влево, б – поворот вправо). На фотографиях видно изменение контраста структурных элементов, например указанных стрелками, при смене направления поворота поляризатора.

Величину удельного вращения [λ] визуально плоских структурных элементов толщиной d ~ ~ 10–15 мкм и плотностью ρ ~ 1 г/см3, вызывающего вращение света на угол ψ ~ 3°, оценивали по формуле для непрерывной вращающей среды [34]:
(3)
$\left[ \alpha \right] = {\psi \mathord{\left/ {\vphantom {\psi {d\rho }}} \right. \kern-0em} {d\rho }}.$Полученная величина [α] = 20 000–30 000 град ∙ ∙ см3/дм ∙ г значительно (на порядки)превышает величину оптической активности молекул сахаров. Например, у тростникового сахара для желтой линии паров натрия (λ = 589.3 нм), [α] = 66 град ∙ ∙ см3/дм ∙ г [41]. Такая величина [α] также не может быть отнесена на счет известных эффектов перестройки плоскости поляризации для холистериков, так как в видимом диапазоне не наблюдается брэгговское отражение, сопровождаемое эффектами типа радуги [42]. Это означает, что основной вклад во вращение плоскости поляризации вносят спиральные супрамолекулярные структуры, имеющие диаметр и шаг, много меньшие длинны волны (λ ~ 400 нм) [5, 43].
Результаты оптической микроскопии ксерогеля водорастворимого аналита-2 в поляризованном свете представлены на рис. 7а и б, при поворотах поляризатора соответственно влево и вправо на 3° относительно режима темного поля. Осадок представляет собой массив, состоящий как из визуально плоских структурных элементов, так и анизометрических (квазиодномерных) элементов, имеющих визуально цилиндрические огибающие. Два таких элемента отмечены стрелками. По аналогии со структурными элементами в растворах ТФААС мы будем называть их струнами.
Рис. 7.
Микрофотографии (увеличение ×40) ксерогеля водорастворимого аналита-2, полученные в скрещенных поляризаторе и анализаторе, при повороте поляризатора относительно режима темного поля на 3° (а – поворот влево, б – поворот вправо). Струны указаны стрелками. Видно изменение контрастности изображения струн на светлое/темное при смене направления поворота поляризатора.

На рис. 8 приведен увеличенный фрагмент рис. 7б, на котором представлена отмеченная стрелкой струна, наклоненная влево от вертикали на угол, близкий к 45°. Хорошо видна ее составная спиральная структура. Действительно, изображение струны на значительном протяжении как выше, так и ниже стрелки состоит из чередующихся наклонных светлых и темных полосок, идущих по отношению к оси струны справа снизу влево вверх. Более широкие светлые полоски являются изображениями тонких струн, спирально сплетенных в более толстую составную струну, а более узкие темные полоски – изображениями промежутков между витками тонких струн. Направление наклона полосок указывает на то, что намотка тонких струн по ходу формирования составной струны идет против часовой стрелки. Непосредственно выше точки касания стрелки к струне видны два почти параллельных светлых участка (правый – несколько ниже, левый – несколько выше), которые принадлежат двум разным тонким струнам. Эти струны пересекаются немного ниже стрелки. Приведенный фрагмент изображения доказывает, что толстая струна сплетена по меньшей мере из двух различных тонких струн.
Отметим далее, что тонкая струна, которая выше точки пересечения двух струн расположена слева, в точке пересечения проходит над второй струной, которая выше точки их пересечения расположена справа. Это обстоятельство подтверждает, что скручивание тонких струн идет против часовой стрелки. Таким образом, направление скручивания, определенное по наклону тонких струн, совпало с направлением скручивания, определенным по их пересечению.
Диаметр d рассматриваемой составной струны равен ~12 мкм. Шаг h визуализированной спиральной структуры составляет величину ~20–30 мкм. Диаметр тонких струн примерно в два раза меньше диаметра составной струны: d ' ~ 5–6 мкм.
На рис. 9 приведен увеличенный фрагмент рис. 7а, на котором представлена отмеченная стрелкой вертикальная струна. Ее спиральная структура также хорошо видна. Действительно, изображение струны практически на всем протяжении приведенного фрагмента состоит из чередующихся наклонных светлых и темных полосок, идущих по отношению к оси струны слева снизу вправо вверх. Как и на рис. 8, более широкие светлые полоски являются изображениями тонких струн, спирально сплетенных в более толстую составную струну, а более узкие темные полоски – изображениями промежутков между витками струн. Отметим, что наклон светлых и темных полосок по отношению к оси струны здесь обратный по сравнению с рис. 8. Следовательно, изображенные на этих рисунках струны имеют противоположное направление спиральной закрутки формирующих их тонких струн, т.е. разный знак спиральности.
Структура струны, изображенной на рис. 9, перестраивается приблизительно на середине длины приведенного фрагмента. В нижней части диаметр струны d ~ 12–15 мкм; спиральная структура контрастно выделена, ее шаг h ~ 50–60 мкм; диаметр составляющих струн d ' ~ 6–8 мкм. В верхней части струны диаметр почти в 2 раза меньше d ~ 7–8 мкм; спиральная структура выделена менее контрастно; угол наклона спиральных элементов к оси струны такой же, как в нижней части струны; соответственно, шаг спирали h ~ 25–30 мкм; диаметр составляющих струн (или одной составляющей струны, закрученной в спираль – по изображению уточнить невозможно) близок к диаметру основной струны: d ' ~ 5–6 мкм.
Изображения струн, аналогичные приведенным на рис. 8, 9, регулярно встречаются при микроскопировании образцов ксерогеля водорастворимого аналита-2. Таким образом, нами прямым микроскопированием установлено, что струны, спонтанно формирующиеся при испарении воды из продуктов формозной реакции, образуют иерархическую систему, содержащую как минимум два уровня, причем струны последующего уровня сформированы путем спирального сплетения из более тонких струн предыдущего уровня. Этот результат показывает, что структура струн, формирующихся в продуктах формозной реакции, в достаточной степени подобна исследованной ранее иерархической структуре струн, формирующихся в растворах ТФААС (см. рис. 10–12) [5, 12, 13, 16, 18].
Рис. 10.
Микрофотография струны ТФААС диаметром ~100 нм, спирально сплетенной из струн диаметром ~50 мкм. Ксерогель раствора ТФААС в гептане. Атомно-силовое микроскопирование. Подложка – слюда.

Рис. 11.
Микрофотография струны ТФААС диаметром ~1 мкм. Спиральная структура струны визуализирована чередованием наклонных темных и светлых полос. Раствор ТФААС в гептане. Проходящий свет. Предметное стекло помещено между поляризатором и анализатором, скрещенными под углом 90°.

Рис. 12.
Микрофотография короткой струны диаметром ~4 мкм, сплетенной из более тонких струн, далее практически параллельных. Раствор ТФААС в гептане.

Изображение наклонной струны, выделенной на рис. 7а и б стрелками и приведенной на рис. 8, максимально затемнено на рис. 7а (при повороте поляризатора на 3° влево) и является существенно более светлым на рис. 7б (при повороте на 3° вправо). Это указывает, что струна вращает плоскость поляризации света, проходящего сквозь нее поперек ее оси, вправо. Подставляя в формулу (3) значения угла полного затемнения ψ ~ 3°, диаметра струны d ~ 12 мкм и плотности материала струны ρ ~ 1 г/см3, получаем величину удельного вращения: [α] = 25 000 град ∙ см3/дм ∙ г. Поскольку измеренная величина [α] лежит в том же диапазоне, что и ранее (т.е. у квазиодномерных структурных элементов на рис. 6), к ней применимы те же самые рассуждения и вывод, аналогичный сделанному выше, при анализе рис. 6а и б для более плоских конструкций, с той лишь разницей, что контрастность по отношению к определению угла поворота (из-за дисперсии длины оптического пути перпендикулярно оси цилиндра) будет не такая резкая, как в случае плоских структур (ср. рис. 7 и 6). Это означает, что в составе струн, сформированных в продуктах формозной реакции, присутствуют супрамолекулярные спирали с диаметром и шагом, много меньшими λ. Формальная теория вращения света в неупорядоченной фазе, которая объясняет эффект вращения плоскости поляризации, включая его знак, наличием таких субмикроскопических спиралей разной хиральности, была построена в [44].Таким образом, состав оптически активных конструкций (рис. 6, 7) представлен избытком некоторых лево- или правовращающих, либо спиральных супрамолекулярных структур, имеющих субмикроскопический размер [5, 45].
Как отмечено выше, вертикальная струна, отмеченная стрелками на рис. 7а, б и приведенная на рис. 9, имеет направление спирализации, противоположное направлению наклонной струны, приведенной на рис. 8. При этом ее изображение является ярким на рис. 7а (поворот поляризатора влево) и несколько темнеет на рис. 7б (поворот поляризатора вправо). Это указывает, что струна вращает плоскость поляризации света, проходящего сквозь нее поперек ее оси, на некоторый угол влево, т.е. в направлении, протвоположном вращению плоскости поляризации струны, приведенной на рис. 8. Из этого наблюдения следует, что знак спиральности микроскопической струны определяется ее супрамолекулярной хиральностью, т.е. знаком избытка лево- или правоспиральных супрамолекулярных субмикроскопических структур, как это имеет место и для супрамолекулярных струн, формирующихся в растворах ТФААС [4, 5, 10].
Физическая природа описанной выше оптической активности продуктов формозной реакции становится еще более наглядной с учетом правильной геометрической формы анизометрических структур – струн (рис. 7), которая указывает на их кристалличность. Заметим, что кристалличность супрамолекулярных струн ТФААС была показана нами ранее [46, 47]. Это означает, что и сами спиральные субмикроскопические структуры регулярны и, в свою очередь, образованы супрамолекулярными структурами с хиральной группой симметрии. При этом в анизометрических структурах (струнах), формирующихся как в продуктах формозной реакции (рис. 7–9), так и в растворах ТФААС (рис. 10–12), субмикроскопические спирали образуют микроскопические суперспирализованные структуры.
Очевидно, что единственной причиной формирования обнаруженных спиральных структур может быть избыток левых или правых энантиомеров, образующихся при фотолизе. Таким образом, в анизометрической конденсированной фазе экспериментально выявлены по крайней мере еще три уровня хиральной иерархии (кроме самих хиральных продуктов реакции): это субмикроскопические спирали (наличие которых доказывается величиной оптической активности вещества струн, на порядки превосходящей оптическую активность молекул сахаров) и микроскопические спирали двух уровней иерархии (непосредственно наблюдаемые при микроскопирвании). При этом разное направление вращения плоскости поляризации света естественно связано с избытком лево- или правовращающих энантиомеров, а знак спиральности микроскопических струн наиболее высокого уровня иерархии (т.е. направление закрутки при их спиральном сплетении из струн предыдущего уровня иерархии) определяется их супрамолекулярной хиральностью, т.е. знаком избытка лево- или правоспиральных супрамолекулярных субмикроскопических структур. Следовательно, фаза струн суперспирализована, так как струны высшего уровня иерархии спирально скручены из струн предыдущего уровня иерархии, которые сами имеют спиральную структуру (определяемую знаком их супрамолекулярной хиральности).
С учетом рацемичности продуктов и гомогенности процессов конденсации по отношению к знаку антипода, различие в направлении вращения плоскости поляризации связано с пространственным разделением антиподов аналогично расщеплению монокристаллов по знаку хиральности в известных опытах Пастера. Небезынтересно также отметить, что такие анизометрические структуры с визуальными микроскопическими признаками суперспирализации (рис. 7–9) наблюдаются только в ксерогелях образцов аналита-2, содержащих дезоксисахара. Это замечание связано с фундаментальным функциональным значением суперспирализации для молекулярно-биологических систем, а также, по-видимому, и их предшественников на добиологической стадии [2–5, 7–11].
Поскольку в данном случае речь идет о достаточно реалистичной модели процессов в первичной атмосфере Земли, этот экспериментдемонстрирует, что структурообразование в системах, подобных предбиологическим, может идти через механизм суперспирализации уже в водном растворе сахаров с молекулярными массами μ ~ 102 Да, т.е. существенно раньше, чем сформировались линейные хиральные макромолекулы.
Далее, этот эксперимент показывает возможный путь формирования органических хиральных матриц для синтеза и репликации предшественников биомакромолекул. В соответствии с результатами данного эксперимента можно утверждать, что формирование системы супрамолекулярных суперспирализованных матриц инициировалось достаточно жесткой, а именно, УФ-компонентой солнечного спектра. В то же время функционирование биологических макромолекул (в частности, фотосинтез) обеспечивается более мягкой (соответствующей видимому свету) компонентой спектра, а УФ-излучение является для большинства сложных биологических макромолекул слишком жестким и разрушает их структуру.
При этом, как показали эксперименты и расчеты, формирование многоуровневых суперспиральных иерархий квазиодномерных хиральных структур контролируется диффузией и занимает, по крайней мере в растворах ТФААС, от ~10–2 с (формирование системы элементарных струн на масштабе порядка размера биологической клетки) до ~103–104 с (формирование развитой иерархии струн на макроскопическом масштабе) [5, 11, 16, 48]. Поскольку коэффициент диффузии для сахаров с молекулярной массой μ ~ 102 Да имеет тот же порядок величины, что и для молекул ТФААС, эти оценки переносятся на формирование суперспиральных иерархий в растворах хиральных сахаров. Далее, синтез макромолекул на имеющейся матрице также, очевидно, контролируется диффузией и протекает на таких же временны́х масштабах. Поэтому нельзя исключить, что фактическое формирование системы предбиологических, а возможно, и биологических макромолекул протекало на сформированных суперспиральных матрицах и заняло примерно такое же время, что и формирование матриц, т.е. произошло мгновенно по геохронологической шкале времени. Также следует отметить, что практически нерастворимые в воде оптически активные частицы аналита-1 или аналита-3, вероятно, согласно схеме реакции (2), являются полисахаридами.
ЗАКЛЮЧЕНИЕ
Таким образом, в работе при физико-химическом моделировании de novo посредством фотолиза концентрированного раствора формальдегида и последующей конденденсации продукта формозной реакции получены следующие экспериментальные результаты:
1) впервые осуществлен синтез биологически значимых сахаров и других хиральных соединений без каких-либо инициаторов в инициируемой УФ реакции формальдегида в водном растворе;
2) обнаружена оптически активная конденсированная фаза, обусловленная атомом углерода в состоянии sp3-гибридизации;
3) показано, что конденсированная фаза (и в том числе ее анизометрическая составляющая)содержит разные доли левых и правых энантиомеров, что означает расщепление энантиомеров по знаку хиральности в момент конденсации;
4) выявлена иерархическая (трехуровневая) спирализованная структура оптически активной анизометрической фазы (струн),в которой струны большего диаметра спирально сплетены из струн меньшего диаметра;
5) установлено, что знак спиральности микроскопических струн наиболее высокого уровня иерархии (т.е. направление закрутки при их спиральном сплетении из струн предыдущего уровня иерархии) определяется их супрамолекулярной хиральностью (знаком избытка лево- или правоспиральных супрамолекулярных субмикроскопических структур);
6) показано, что структурообразование в системах, подобных предбиологическим, может идти через механизм суперспирализации уже в водном растворе сахаров с молекулярными массами μ ~ 102 Да, т.е. существенно раньше, чем сформировались линейные хиральные макромолекулы.
Далее, в работе высказано предположение, что фактическое формирование системы предбиологических, а возможно, и биологических макромолекул протекало на сформированных суперспиральных матрицах и заняло примерно такое же время, что и формирование матриц, т.е. произошло мгновенно по геохронологической шкале времени.
Спонтанная суперспирализация супрамолекулярных анизометрических структур, обнаруженная в этой работе, а также ранее в низкоконцентрированных растворах ТФААС, наблюдается для всех биологически значимых макромолекул и может быть инвариантом, связывающим химическую и биологическую стадии эволюции. Данные экспериментальные результаты получены в условиях, отвечающих современным представлениям о форме и векторе предбиологической эволюции, поэтому могут иметь фундаментальное значение для молекулярной биологии.
Работа выполнена при поддержке ФАНО России (проект V.47.1.3).
Список литературы
Гольданский В.И., Кузьмин В.В. // УФН. 1989. Т. 157. № 1. С. 3.
Твердислов В.А., Сидорова А.Э., Яковенко Л.В. Биофизическая экология. М.: URSS, КРАСАНД, 2012; ISBN 978-5-396-00419-1
Твердислов В.А. // Биофизика. 2013. Т. 58. № 1. С. 159.
Cтовбун C.В., Cкоблин А.А., Твердислов В.А. // Там же. 2014. Т. 59. № 6. С. 1079.
Стовбун С.В. Структурообразование в растворах хиральных биомиметиков. Дис. … д-ра физ.-мат. наук. М.: ИХФ РАН, 2012.
Артоболевский И.И. Теория механизмов и машин. М.: Наука, 1988.
Стовбун С.В., Скоблин А.А., Литвин Я.А. и др.// Хим. физика. 2014. Т. 33. № 11. С. 41.
Скоблин А.А., Стовбун С.В. // Бюл. эксперим. биологии и медицины. 2015. Т. 159. № 5. С. 561.
Стовбун С.В., Скоблин А.А., Литвин Я.А., Михалева М.Г., Твердислов В.А. // Вестн. МГУ. Сер. 3, Физика, астрономия. 2015. № 1. С. 45.
Стовбун С.В., Скоблин А.А., Твердислов В.А. // Там же. 2011. № 12. С. 643.
Стовбун С.В., Скоблин А.А., Занин А.М. // Хим. физика. 2014. Т. 33. № 5. С. 21.
Стовбун С.В., Скоблин А.А., Занин А.М. и др. // Бюл. эксперим. биологии и медицины. 2012. Т. 154. № 7. С. 41.
Стовбун С.В., Скоблин А.А. // Вестн. МГУ. Сер. 3, Физика, астрономия. 2012. № 3. С. 35.
Зленко Д.В., Стовбун С.В. // Хим. физика. Т. 33. № 8. С. 37.
Стовбун С.В. // Хим.физика. 2011. Т. 30. № 8. С. 3.
Стовбун С.В., Скоблин А.А. //Вестн. МГУ. Сер. 3, Физика, астрономия. 2012. № 4. С. 3.
Стовбун С.В., Занин А.М.,Скоблин А.А., Михайлов А.И., Берлин А.А. // Докл. АН. 2012. Т. 442. № 5. С. 645.
Стовбун С.В., Михалева М.Г., Скоблин А.А., Твердислов В.А. Структурообразование в хиральных системах. Супрамолекулярные струны. М.: МГУ, 2016.
Михалева М.Г. Cуперспирализованные анизометрические фазы в системах биомиметиков и целлюлозе. Дис. … канд. физ.-мат. наук. М.: ИХФ РАН, 2017.
Сафронов В.С. Эволюция допланетного облака и образование Земли и планет. М.: Наука, 1969.
Литвин Я.А., Скоблин А.А., Стовбун С.В. // Хим. физика. 2017. Т. 36. № 1. С. 43.
Литвин Я.А. Моделирование спонтанного формирования гомохирального мира в низкоконцентрированных растворах трифторацетилированных аминоспиртов. Дис. … канд. физ.-мат. наук. // М.: МГУ, 2016.
Зленко Д.В., Михалева М.Г., Стовбун С.В // Хим. физика. 2016. Т. 35. № 5. С. 84.
Зленко Д.В., Трегубова М.А., Стовбун С.В. // Хим. физика. 2017. Т. 36. № 3. С. 65.
Занин А.М., Зленко Д.В., Литвин Я.А., Скоблин А.А., Стовбун С.В. // Хим. физика. 2018. Т. 37. № 6. С. 9.
Бутлеров А.М. Сочинения. Т. 1. М.: Изд-во АН СССР, 1953. С. 63–67.
Хоменко Т.И., Сахаров М.М., Головина О.А. // Успехи химии. 1980. Т. XLIX. С. 1079.
Pestunova O.P., Simonov A.N., Snytnikov V.N., Parmon V.N. // Biosphere Origin and Evolution / Eds. Dobretsov N., Kolchanov N., Rozanov A., Zavarzin G. Springer-Verlag, 2008. P. 103.
Delidovich I.V., Simonov A.N., Taran O.P., Parmon V.N. // ChemSusChem. 2014. V. 7. № 7. P. 1833.
Socha R.F., Weiss A.H., Sakharov M.M. // J. Catal. 1981. V. 67. P. 207.
Симонов А.Н., Пестунова О.П., Матвиенко Л.Г., Пармон В.Н. // Кинетика и катализ. 2007. Т. 48. № 2. С. 261.
Irie A. // Carbohydr. Res. 1989. V. 190. P. 23.
Baly E.C. // Ind. Eng. Chem. 1924. V. 16. P. 1016.
Shigemasa Y., Matsuda Y., Sakazawa C., Matsura T. // Bull. Chem. Soc. Jap. 1977. V. 50. № 1. P. 222.
Pestunova O., Simonov A., Snytnikov V., Stoyanovsky V., Parmon V. // Space Life Sciences: Astrobiology: Steps toward Origin of Life and Titan before Cassini / Eds. Bernstein M., NavarroGonzalez R., Raulin R. 2005. P. 214.
Delidovich I.V., Taran O.P., Simonov A.N., Matvienko L.G., Parmon V.N. // Adv. Space Res. 2011. V. 48. № 3. P. 441.
Snytnikova O.A., Simonov A.N., Pestunova O.P., Parmon V.N., Tsentalovich Y.P. // Mendeleev Commun. 2006. V. 15. № 1. P. 9.
Оболенская А.В. Лабораторные работы по химии древесины и целлюлозы. М.: Эколотия, 1991.
Куцева H.К. // Химическая энциклопедия в 5 т. М.: Сов. энцикл. (тт. 1–2); Большая Рос. энцикл. (тт. 3–5), 1988–1998; ISBN 5-85270-008-8
Лонгмор М., Уилкинсон Я., Раджагопалан С. Оксфордский справочник по клинической медицине. Пер. с англ. М.: БИНОМ. Лаборатория знаний, 2009.
Ландсберг Г.С. Оптика. М.: Физматлит, 2003; ISBN 5-9221-0314-8
Клеман М., Лаврентович О.Д. Основы физики частично упорядоченных сред: жидкие кристаллы, коллоиды, фрактальные структуры, полимеры и биологические обьекты. М.: Физмалит, 2007.
де Жен П. Физика жидких кристаллов. М.: Мир, 1977.
Стовбун С.В., Скоблин А.А. // Хим. физика. 2012. Т. 31. № 7. С. 7.
Стовбун С.В., Занин А.М., Скоробогатько Д.С. и др. // Хим. физика. 2012. Т. 31. № 5. С. 11.
Стовбун С.В., Занин А.М., Скоблин А.А. и др. // Хим. физика. 2013. Т. 32. № 1. С. 21.
Стовбун С.В., Скоблин А.А., Занин А.М. и др. // Докл. АН. 2013. Т. 450. № 5. С. 451.
Скоблин А.А., Занин А.М., Стовбун С.В. // Хим. физика. 2014. Т. 33. № 6. С. 10.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика