Химическая физика, 2019, T. 38, № 5, стр. 23-28
Исследование побочных реакций, сопутствующих озонолизу органических соединений в реакторе барботажного типа
Н. Г. Таганов 1, *, В. Г. Федотов 1, Т. В. Гриневич 1
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: nikolaytaganov@yahoo.com
Поступила в редакцию 22.08.2018
После доработки 22.08.2018
Принята к публикации 20.09.2018
Аннотация
Исследована кинетика озонолиза непредельных углеводородов в проточном реакторе барботажного типа с использованием четыреххлористого углерода в качестве растворителя. Установлено, что в системе протекает побочная реакция озона с растворителем, имеющей первый порядок по озону. Из сопоставления теоретических и экспериментальных данных следует, что данная реакция не влияет на измерение количества озона, израсходованного непосредственно на озонолиз пробы. Делается вывод, что побочная реакция протекает на стадии, предшествующей взаимодействию озона с непредельными углеводородами в жидкой фазе реактора.
ВВЕДЕНИЕ
Статья посвящена проблемам использования метода озонолиза для решения аналитических задач и исследования кинетики окислительных процессов, основанных на способности органических соединений быстро присоединять озон по месту расположения реакционноспособных связей (непредельность, эфирная связь и т.п.). Данный метод может быть использован для экспресс-анализа в различных областях химии (пиролиз и крекинг нефтепродуктов, анализ ненасыщенности полимеров, гидрирование жиров и масел, производство смазочных материалов и присадок и т.п.) и биохимии, а также в медицине (ненасыщенность липидов плазмы и клеток крови) и пищевой промышленности.
Введение в барботажный проточный реактор приборов типа анализатора двойных связей (АДС) [1] растворителя (используемого для растворения исследуемых непредельных углеводородов и их жидкофазного озонолиза) приводит к значительному падению концентрации озона на выходе из реактора по сравнению с его концентрацией на входе. Это указывает на наличие побочных каналов расходования озона, природа и кинетическое проявление которых в настоящее время мало изучено. Неучет расхода озона в этих побочных реакциях, сопутствующих озонолизу анализируемого образца, может привести к значительным погрешностям в определении кинетических параметров озонолиза и концентраций функциональных групп, реагирующих с озоном [2]. В настоящей работе предпринята попытка кинетического исследования влияния этих побочных реакций на результаты озонолиза непредельных углеводородов в реакторе барботажного типа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Работа проводилась на модифицированной модели прибора типа АДС [3]. В этой модели озон образуется в зоне коронного разряда в воздухе. Измерение концентрации озона осуществляли фотометрическим способом по поглощению УФ-излучения на длине волны 253.7 нм в двух одинаковых оптических кюветах, толщина поглощающего слоя в каждой из которых составляет 10 см. Концентрация озона регистрируется одновременно на входе и выходе из реактора. Озонолиз проводили в стеклянном реакторе барботажного типа объемом 2.5 см3 с пористым фильтром в качестве дна. Реактор заполняли 0.5 мл CCl4 и через него пропускали озоно-воздушную смесь с объемной скоростью 4 мл/мин. Пробы анализируемого вещества (1–5 мкл 10–6 N раствора) вводили в жидкую фазу реактора. В качестве вещества, моделирующего непредельный углеводород, использовали стильбен, реакция которого с озоном хорошо изучена [4].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
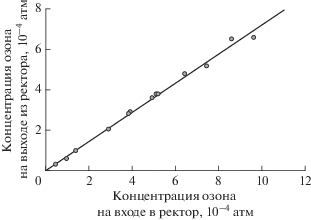
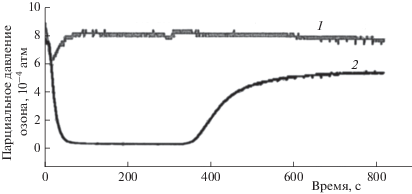
Известно [5], что при пропускании озоновоздушной смеси через растворитель после завершения периода первичного озонирования, в течение которого озон почти полностью поглощается им, устанавливается некоторая стационарная концентрация озона на выходе из реактора, которая существенно меньше его концентрации на входе (рис. 1). Это уменьшение концентрации озона на стационарном участке значительно превышает ожидаемое за счет перепада давления между кюветами измерения и сравнения при введении растворителя в реактор. Первичное озонирование (нестационарный участок падения концентрации озона на рис. 1) обычно связывали [6] с наличием в растворителе неконтролируемых примесей, способных быстро реагировать с озоном. Остаточное озонирование, проявляющееся в стационарном расхождении концентраций озона на входе и выходе из реактора при больших временах озонирования, по-видимому, связано с протеканием реакций озона с примесями в растворителе или с продуктами первичного озонирования, концентрация которых в дальнейшем не претерпевает каких-либо изменений. Из опытов, в которых при постоянной скорости подачи озоновоздушной смеси варьировалась концентрация озона (рис. 2), следует, что реакции остаточного озонирования имеют ярко выраженный первый порядок по озону. На это указывает пропорциональность концентрации озона на выходе из реактора его концентрации на входе.
Рис. 1.
Типичная кривая поглощения озона в реакторе барботажного типа в ответ на введение в реактор свежей порции CCl4. Концентрация озона на входе в реактор (1) и на выходе (2) из него.
Для изучения влияния этой псевдомономолекулярной реакции расходования озона на результаты озонолиза вводимых проб непредельных углеводородов нами был проведен теоретический анализ кинетики озонолиза проб в реакторе барботажного типа с учетом протекания этой реакции. Рассматривались два крайних случая описания процесса:
1. Кинетически контролируемый процесс озонолиза, когда скорость диффузии компонентов реакционной смеси много выше скорости химических реакций. При этом химические реакции протекают в объеме жидкой фазы реактора с растворенным озоном, поступающим из пузырьков озоновоздушной смеси, проходящих через жидкость.
2. Диффузионно-контролируемый процесс, когда протекание химических реакций озона с другими компонентами системы обусловлено в основном явлениями массопереноса реагентов. При этом озон реагирует с другими реагентами вблизи границы раздела жидкой и газовой фаз реактора.
В случае кинетически контролируемого процесса рассматривалась следующая кинетическая схема:
Для получения аналитических решений системы кинетических дифференциальных уравнений, соответствующих этой схеме, использовались следующие предположения: 1) озон, растворенный в жидкой фазе реактора, равномерно распределен по всему объему, и его концентрация не зависит от глубины (барботирование озоновоздушной смесью растворителя приводит к активному его перемешиванию); 2) концентрация озона в жидкой фазе реактора мало изменяется за время прохождения пузырька газа через реактор и в течение времени жизни одного пузырька может считаться неизменной; 3) пузырьки газа мало отличаются друг от друга по размеру и могут считаться одинаковыми. При этих предположениях соответствующая система дифференциальных кинетических уравнений будет иметь следующий вид:
(2)
$\frac{{dy}}{{dt}} = \frac{1}{V}\sum\limits_{i = 1}^N {({{k}_{1}}{{x}_{i}} - {{k}_{2}}y)S - {{k}_{p}}cy - {{k}_{0}}y} ,$При описанных выше условиях уравнение (1) может быть проинтегрировано, и для концентрации озона на выходе из реактора $(x)$ может быть получено следующее выражение:
где $\alpha = {{{{k}_{2}}} \mathord{\left/ {\vphantom {{{{k}_{2}}} {{{k}_{1}}}}} \right. \kern-0em} {{{k}_{1}}}}$ (величина, обратная коэффициенту Генри), ${{x}_{0}}$ – концентрация озона в озоновоздушной смеси на входе в реактор, $\varepsilon = \exp ({{ - {{k}_{1}}S\tau } \mathord{\left/ {\vphantom {{ - {{k}_{1}}S\tau } \text{v}}} \right. \kern-0em} \text{v}}),$ $\tau $ – среднее время прохождения пузырьком газа жидкой фазы реактора. Таким образом, уравнение (5) устанавливает связь между концентрацией озона на выходе из реактора и его концентрацией в жидкой фазе.Уравнение (2), учитывая материальный баланс по озону, может быть переписано более удобном для дальнейших выводов виде:
где $w$ – объемная скорость подачи озоновоздушной смеси. Первое слагаемое справа описывает скорость поглощения озона жидкостью при прохождении через нее озоновоздушной смеси.Уравнение (6), положив $c = 0,$ можно использовать для описания “холостых” опытов, в которых варьировалась концентрация озона в озоновоздушной смеси при постоянной скорости ее подачи. Действительно, при установлении равновесной концентрации озона на выходе из реактора, соответствующей заданной его концентрации на входе, ${{dy} \mathord{\left/ {\vphantom {{dy} {dt}}} \right. \kern-0em} {dt}} = 0,$ и можно получить следующее соотношение:
Подставив в уравнение (7) выражение для $y$ из уравнения (5), после соответствующих преобразований, получим
(8)
$x = {{x}_{0}}\left( {\frac{w}{V} + \frac{{{{k}_{0}}\varepsilon }}{{\alpha (1 - \varepsilon )}}} \right){{\left( {\frac{w}{V} + \frac{{{{k}_{0}}}}{{\alpha (1 - \varepsilon )}}} \right)}^{{ - 1}}}.$Рассмотрим, как побочное поглощение озона может влиять на измерение концентрации связей $ - {\text{C = C}}{\kern 1pt} - $ при введении пробы анализируемого органического соединения. Вычитая уравнение (3) из уравнения (6), получим уравнение
(9)
$\frac{{dy}}{{dt}} - \frac{{dc}}{{dt}} = \frac{w}{V}\left( {{{x}_{0}} - x} \right) - {{k}_{0}}y,$в котором разность скоростей изменения концентраций озона и связей $ - {\text{C = C}}{\kern 1pt} - $ в жидкой фазе выражается через текущее значение концентрации озона в газовой фазе на выходе из реактора. После подстановки выражения для $y$ из уравнения (5) и замены $x = {{x}_{{00}}} - z$ ($z$ – текущее значение падения концентрации озона на выходе из реактора в ответ на ввод раствора ненасыщенного углеводорода по сравнению с ${{x}_{{00}}}$ – его концентрацией до ввода) уравнение (9) принимает следующий вид:
(10)
$\frac{{dy}}{{dt}} - \frac{{dc}}{{dt}} = z\left( {\frac{w}{V} + \frac{{{{k}_{0}}}}{{\alpha (1 - \varepsilon )}}} \right).$Проинтегрировав это уравнение по времени от момента ввода в реактор раствора исследуемого органического соединения, получим
(11)
$y - {{y}_{0}} - c + {{c}_{0}} = \left( {\frac{w}{V} + \frac{{{{k}_{0}}}}{{\alpha (1 - \varepsilon )}}} \right)\int\limits_0^t {zdt} ,$где ${{c}_{0}}$ – концентрация введенных в жидкую фазу реактора связей $ - {\text{C = C}}{\kern 1pt} - ,$ ${{y}_{0}}$ – равновесная (до ввода анализируемого образца) концентрация озона в жидкой фазе. И при больших временах (по исчерпании реакционноспособных групп анализируемого образца и установлении равновесных концентраций озона в жидкой фазе и на выходе из реактора) получим следующее выражение для количества связей $ - {\text{C = C}}{\kern 1pt} - $ в анализируемом образце:
(12)
${{c}_{0}}V = \left[ {w + \frac{{{{k}_{0}}V}}{{\alpha (1 - \varepsilon )}}} \right]\int\limits_0^\infty {zdt} .$Как видно, это выражение отличается от обычно используемого для определения содержания связей $ - {\text{C = C}}{\kern 1pt} - $ в исследуемом образце [5]:
Уравнение (12) показывает, что протекание реакции псевдомономолекулярной гибели озона в жидкой фазе реактора должно приводить к значительным искажениям результатов озонолиза ненасыщенных углеводородов, получаемых по уравнению (13).
В качестве примера диффузионно-контролируемого процесса рассмотрим ситуацию, когда ${{k}_{0}}$ и ${{k}_{p}}$ очень велики и химическое взаимодействие озона с продуктами первичного озонирования и связями $ - {\text{C = C}}{\kern 1pt} - $ анализируемого образца в основном обусловлено переносом реагентов в зону реакции. Согласно “пленочной” модели газожидкофазных реакций [7], при больших значениях ${{k}_{0}},$ в отсутствие связей $ - {\text{C = C}} - ,$ весь растворенный озон реагирует в узкой пленке жидкости, окружающей пузырек газа, и расход озона в этом пузырьке может быть описан следующим уравнением:
где $k_{0}^{'} = {{\left( {{{D}_{0}}{{k}_{0}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$ ${{D}_{0}}$ – коэффициент диффузии озона в жидкости. Влиянием поверхностного сопротивления, связанного с процессами сорбции–десорбции озона поверхностью жидкости, мы здесь пренебрегаем, полагая концентрацию растворенного озона на поверхности жидкости равной ${{{{x}_{i}}} \mathord{\left/ {\vphantom {{{{x}_{i}}} \alpha }} \right. \kern-0em} \alpha }.$ Проинтегрировав это уравнение и учитывая, что(15)
$\begin{gathered} {{\left. {{{x}_{i}}} \right|}_{{t = 0}}} = {{x}_{0}}, \\ {{\left. {{{x}_{i}}} \right|}_{{t = {\tau }}}} = {{x}_{{00}}}, \\ \end{gathered} $Согласно указанной выше модели [7], при ${{k}_{p}}$ $ \gg $ 1 и ${{c}_{0}}$ $ \gg $ ${{x}_{0}}$ взаимодействие озона с непредельным углеводородом должно происходить на границе раздела фаз, скорость реакции не зависит от концентрации озона и реакция лимитируется скоростью диффузии непредельного углеводорода к поверхности жидкости. При этом концентрация растворенного озона стремится к нулю, что, в свою очередь, блокирует взаимодействие озона с продуктами первичного озонолиза. Поэтому после ввода в реактор пробы анализируемого вещества расход озона в пузырьке газа будет описываться следующим уравнением:
где $k_{p}^{'} = {{k}_{L}}{{{{D}_{c}}} \mathord{\left/ {\vphantom {{{{D}_{c}}} {{{D}_{0}}}}} \right. \kern-0em} {{{D}_{0}}}};$ здесь ${{k}_{L}}$ – коэффициент “физической массоотдачи” [7], ${{D}_{c}}$ – коэффициент диффузии непредельного углеводорода в жидкости. Интегрирование этого уравнения в предположении неизменности концентрации связей $ - {\text{C = C}}{\kern 1pt} - $ за время всплытия пузырька и с учетом (16) дает следующее соотношение между концентрацией озона x на выходе из реактора и текущим значением $c{\text{:}}$(18)
$x = {{x}_{0}} - \alpha \frac{{k_{p}^{'}}}{{k_{0}^{'}}}c\ln \frac{{{{x}_{0}}}}{{{{x}_{{00}}}}}.$При этом расход озона в единицу времени равен скорости расходования связей $ - {\text{C = C}} - ,$ т.е.
После подстановки $x$ из (18) в (19) и последующего интегрирования получим
(20)
$c = {{c}_{0}}\exp \left\{ { - \alpha \frac{{wk_{p}^{'}}}{{Vk_{0}^{'}}}\ln \frac{{{{x}_{0}}}}{{{{x}_{{00}}}}}t} \right\}.$Рассмотрим, как в этом случае площадь под кривой изменения концентрации озона в ответ на введение пробы непредельного углеводорода в реактор связана с количеством введенных связей $ - {\text{C = C}}{\kern 1pt} - .$ Для этого перепишем уравнение (19) в следующем виде:
(21)
$w\left( {{{x}_{0}} - {{x}_{{00}}}} \right) + w\left( {{{x}_{{00}}} - x} \right) = - V\frac{{dc}}{{dt}},$и проинтегрируем его по времени от нуля (момент ввода пробы) до бесконечности, учитывая, что концентрация озона до и после озонирования образца равна ${{x}_{{00}}}.$ Получим
(22)
$V{{c}_{0}} = w\int\limits_0^\infty {\left( {{{x}_{{00}}} - x} \right)dt + w\left( {{{x}_{0}} - {{x}_{{00}}}} \right)\Delta t} ,$(23)
$\Delta t = \alpha \frac{{k_{0}^{'}V}}{{k_{p}^{'}w}}\frac{{\ln \left( {{{{{c}_{0}}} \mathord{\left/ {\vphantom {{{{c}_{0}}} {{{c}_{k}}}}} \right. \kern-0em} {{{c}_{k}}}}} \right)}}{{\ln \left( {{{{{x}_{0}}} \mathord{\left/ {\vphantom {{{{x}_{0}}} {{{x}_{{00}}}}}} \right. \kern-0em} {{{x}_{{00}}}}}} \right)}}.$Далее, подставляя (23) в (22) и учитывая, что ${{x}_{{00}}} - x = z,$ получим соотношение, по своему характеру близкое к (12):
(24)
${{c}_{0}}V = w\int\limits_0^\infty {zdt} + \alpha \frac{{k_{0}^{'}}}{{k_{p}^{'}}}\left( {{{x}_{0}} - {{x}_{{00}}}} \right)\frac{{\ln \left( {{{{{c}_{0}}} \mathord{\left/ {\vphantom {{{{c}_{0}}} {{{c}_{k}}}}} \right. \kern-0em} {{{c}_{k}}}}} \right)}}{{\ln \left( {{{{{x}_{0}}} \mathord{\left/ {\vphantom {{{{x}_{0}}} {{{x}_{{00}}}}}} \right. \kern-0em} {{{x}_{{00}}}}}} \right)}}.$Из чего следует, что площадь под кривой изменения концентрации озона на выходе из реактора в ответ на введение пробы должна быть всегда меньше соотношения соответствующего количества введенных в реактор связей $ - {\text{C = C}}{\kern 1pt} - $ и скорости подачи озоновоздушной смеси. Это явление имеет более общее значение и обусловлено тем, что протекание целевой реакции всегда в той или иной степени понижает концентрацию озона в пузырьках газа и тем самым должно подавлять побочную реакцию при любых значениях констант скорости реакций и концентраций реагентов независимо от механизма массопереноса, осуществляемого в системе. Расход озона в побочной реакции, протекающей одновременно с целевой, всегда должен быть меньше величины $w\left( {{{x}_{0}} - {{x}_{{00}}}} \right)\Delta t$ – его расхода за время озонолиза пробы в отсутствие целевой реакции, что должно приводить к соотношениям типа (12) или (24).
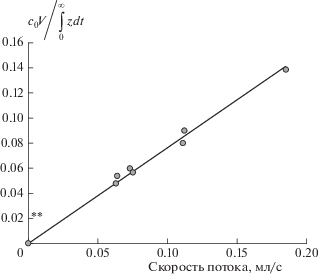
Для проверки влияния побочной реакции гибели озона на результаты измерения количества связей $ - {\text{C = C}}{\kern 1pt} - $ методом АДС нами была проведена серия опытов по озонолизу раствора стильбена (обычно используемого в качестве эталонного вещества) при различных скоростях подачи озоновоздушной смеси. Как видно из уравнений (12) и (24), график зависимости соотношения ${{{{c}_{0}}V} \mathord{\left/ {\vphantom {{{{c}_{0}}V} {\int_0^\infty {zdt} }}} \right. \kern-0em} {\int_0^\infty {zdt} }}$ от $w$ должен представлять собой прямолинейную зависимость с тангенсом угла наклона, равным единице, и отсечением на оси ординат, которое в случае уравнения (12) равно ${{{{k}_{0}}V} \mathord{\left/ {\vphantom {{{{k}_{0}}V} {\alpha (1 - \varepsilon )}}} \right. \kern-0em} {\alpha (1 - \varepsilon )}}.$ Соответствующие экспериментальные данные представлены на рис. 3. Как видно из этого рисунка, спрямление соответствующей экспериментальной зависимости дает отсечение на оси ординат, близкое к нулю. По крайней мере, оно значительно меньше значений ${{{{k}_{0}}V} \mathord{\left/ {\vphantom {{{{k}_{0}}V} {\alpha (1 - \varepsilon )}}} \right. \kern-0em} {\alpha (1 - \varepsilon )}},$ оцененных по соотношению ${x \mathord{\left/ {\vphantom {x {{{x}_{0}}}}} \right. \kern-0em} {{{x}_{0}}}}$ в данных экспериментальных условиях с использованием уравнения (8) (отметка на оси ординат на рис. 3). То есть уравнение (13) довольно точно описывает полученную экспериментальную зависимость.
Рис. 3.
Зависимость отношения количества стильбена, введенного в реактор, к площади под кривой зависимости ответного изменения концентрации озона от объемной скорости подачи озоновоздушной смеси.
Совокупность представленных данных указывает на явное противоречие: мы наблюдаем стационарную гибель озона при введении в реактор растворителя, но эта гибель не влияет на соотношение количества введенной пробы непредельного углеводорода и площади под кривой его озонолиза. Таким образом, количество озона, израсходованного в результате протекания побочных реакций в единицу времени, не зависит от его концентрации в жидкой фазе реактора, которая существенно снижается при введении в реактор непредельного углеводорода. Это возможно, если побочные реакции протекают не в объеме растворителя, а только на входе озоновоздушной смеси в реактор. По-видимому, эти реакции в основном протекают в зоне формирования пузырьков газа и либо имеют гетерофазную природу, либо их привязанность к этой зоне реактора может быть обусловлена продолжительностью контакта зарождающихся пузырьков озоновоздушной смеси с жидкостью. Время зарождения пузырьков газа значительно больше времени их прохождения через жидкость после их отрыва, а концентрация озона в них максимальна.
Таким образом, результаты работы показали, что озонолиз непредельных углеводородов в реакторе барботажного типа сопровождается одновременным протеканием побочных реакций гибели озона, которые имеют первый порядок по озону и тем не менее не влияют (в пределах погрешностей эксперимента) на результаты измерения кинетических параметров озонолиза.
Работа выполнена при финансовой поддержке Программой фундаментальных исследований ИХФ РАН № 46.15. Номер темы ФАНО 0082-2014-0005. Номер государственной регистрации ЦИТИС: АААА-А17-117091220076-4.
Список литературы
Brazhnikov E.M., Gerbich V.I., Lisitsyn D.M. et al. // US Patent 3,958,942. 1976 .
Федотов В.Г., Таганов Н.Г., Гриневич Т.В. // Хим. физика. 2010. Т. 29. № 4. С. 70.
Архипов А.Ю., Гриневич Т.В., Киселева Е.В., Позняк Т.И., Гарсиа Х.А. Спектрофотометр: Пат. 2273004 РФ // Б. И. 2006. № 9. С. 35.
Разумовский С.Д., Заиков Г.Е. Озон и его реакции с органическими соединениями. М.: Наука, 1974. С. 60.
Позняк Т.И. Разработка и применение экспериментальных методов исследования продуктов полимеризации на основе озонолитических реакций. Дис. … канд. хим. наук: М.: ИХФ РАН, 1980.
Гринберг А.А., Леонтьева С.А. Лисицын Д.М., Позняк Т.И., Дьячковский Ф.С. // Журн. аналит. химии. 1980. Т. 35. № 10. С. 2042.
Данквертс П.В. Газожидкостные реакции. М.: Химия, 1973. С. 115.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика