Химическая физика, 2019, T. 38, № 5, стр. 88-90
Инициирующая система на базе соединений Cu(II) и цетилтриметиламмоний бромида, генерирующая свободные радикалы при распаде гидропероксида третичного бутила в оптимальном температурном режиме
Л. А. Смурова 1, *, З. С. Карташева 1
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: smurova.lid@yandex.ru
Поступила в редакцию 24.10.2018
После доработки 05.12.2018
Принята к публикации 20.12.2018
Аннотация
Двухкомпонентная композиция, состоящая из комплексных соединений меди Cu(II) и катионного поверхностно-активного вещества цетилтриметиламмоний бромида (СТАВ), проявляет высокую каталитическую активность в процессе разложения гидроперокида третичного бутила. Особенность влияния бинарной системы Cu(II) + CTAB заключается в больших скоростях процесса без видимых признаков дезактивации при переработке значительных количеств реагента в оптимальном температурном режиме.
ВВЕДЕНИЕ
Основной проблемой для каталитических процессов является обеспечение высокой скорости, селективности и условий поддержания катализатора в активной форме в течение всего процесса. Многочисленные исследования последних лет показали, что добавки поверхностно-активных веществ (ПАВ) могут существенно влиять на скорость и механизм окисления углеводородов (этилбензол, лимонен); каталитическое действие ПАВ обусловлено ускоренным распадом гидропероксидов на свободные радикалы [1, 2]. Известно также, что соединения металлов переменной валентности являются эффективными генераторами свободных радикалов в реакциях распада гидропероксидов в результате образования промежуточных комплексов между реагентами [3].
Цель настоящей работы – экспериментальное исследование каталитической активности бинарной системы Cu(II) + CTAB, каждый компонент которой проявляет каталитическую активность в реакции разложения гидропероксида третичного бутила.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объектов исследования использовались соединения двухвалентной меди: бис-ацетилацетонат – Cu(acac)2 или бис(2-фенилиминометилен-3-оксибензо[b]тиофенат) – CuL2, предоставленный Институтом органической химии им. Н.Д. Зелинского РАН, и катионный ПАВ цетилтриметиламмоний бромид (СТАВ) фирмы “Serva”. Изучали реакцию разложения гидроперекиси третичного бутила (ГПТБ) в хлорбензоле с добавками данных соединений в отдельности и при совместном присутствии (Cu(II) + CTAB) в ячейке барботажного типа, продувая реакционную смесь инертным азотом.
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
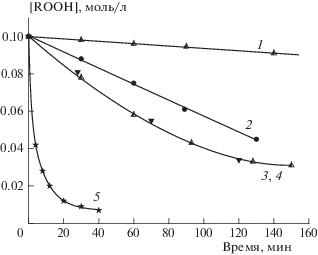
Результаты изучения вышеописанной реакции представлены на рис. 1 . Сравнение начальных скоростей термического распада ГПТБ (кривая 1) с W1 = 1.15 ∙ 10–6 моль/л ⋅ с и в присутствии соединений меди и СТАB, взятых в отдельности (кривые 2, 3, 4), с W1 = 6.9 ⋅ 10–6, W3, 4 = 1.11 · 10–5 моль/л ⋅ с свидетельствуют о каталитическом влиянии этих соединений на реакцию разложения ГПТБ.
В присутствии медных катализаторов Cu(acac)2 или CuL2 (каталитическая активность этих соединений в данной реакции практически одинакова – см. кривые 3 и 4 на рис. 1 ) скорость разложения ГПТБ в W3, 4/W1 = 10 раз превышает скорость ее термолиза (кривая 1) и в W2/W0 = 6 раз выше в случае распада в присутствии только СТАВ (опыты при температуре 60 °С).
Рис. 1.
Кинетические кривые распада ГПТБ без добавок (кривая 1) и в присутствии СТАВ (2), Cu(acac)2 (темные точки) или CuL2 (3, 4). Кривая 5 – распад ГПТБ при 37 °С в тройной системе ГПТБ + СТАВ + Cu(aca)2; [CTAB] = 10–2 M, [Cu(aca)2] = 2 ⋅ 10–4 M; [CuL2] = = 2 ⋅ 10–4 M; хлорбензол, 60 °С.
Основной реакцией, определяющей каталитическую активность СТАВ, является увеличение скорости распада ROOH на свободные радикалы с предварительным образованием микроагрегатов между реагентами c выходом пероксильных радикалов в реакционный объем [2]:
Инициирующая система на основе ГПТБ с тетраалкиламмонийбромидом Alk4NBr была исследована в работах [4, 5]. Методом ЯМР-спектроскопии было показано образование комплекса между компонентами и определены термодинамические параметры комплексообразования в исследуемой системе.
Образование комплексов [ион металла – гидропероксид] как стадии, предшествующей переносу электрона и распаду молекулы гидропероксида:
установлено различными кинетическими и физико-химическими методами [6].
При проведении реакции с одновременным присутствием Сu(II) + СТАВ в условиях эксперимента (т.е. при температуре 60 °С) распад пероксида происходит настолько быстро, что анализировать реакцию практически невозможно (проба, взятая примерно через 1 мин, показывает полное отсутствие гидропероксида). В связи с этим реакция в присутствии бинарной системы была проведена при температуре 37 °С (кривая 5 на рис. 1 ). Скорость распада ГПТБ в этом случае, W5 = 2.67 ⋅ 10–4 моль/л ⋅ с, многократно превышает скорость распада в присутствии каждого из компонентов бинарной системы, взятых в отдельности. Скорости распада в присутствии этих компонентов при температуре 37 °С пренебрежимо малы, и их можно не учитывать.
Из данного эксперимента можно сделать вывод, что эффект катализа в бинарной системе Cu(II) + CTAB не является суммарным каталитическим эффектом отдельно взятых компонентов, а предположительно, в процессе реакции образуется новая частица, обладающая своими эффективными каталитическими свойствами, или синергетический эффект обусловлен изменением механизма каталитического действия СТАВ и Cu(II), находящихся совместно в реакционной смеси. Интересной отличительной особенностью действия бинарной каталитической системы является расходование ГПТБ с высокими начальными скоростями практически до полного его исчезновения без проявления эффекта дезактивации (рис. 1 , кривая 5). Потеря каталитической активности d-металлов в процессе реакции является характерной особенностью гомогенного катализа и его большим недостатком.
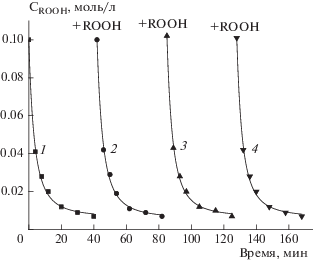
Об отсутствии дезактивации каталитической системы в данном эксперименте свидетельствуют опыты с периодическим многократным введением новых порций ROOH после полного расходования предыдущего количества. Проведено четыре цикла распада ГПТБ при температуре 37 °С (рис. 2 , кривые 1–4). Установлено, что скорость и полнота разложения ГПТБ не изменяются в условиях, когда в значительном количестве накапливаются продукты реакции, которые могли бы быть дезактивирующими компонентами. Известно, например, что для комплексных соединений Cu(II) дезактивация есть результат их вторичных и последующих превращений при взаимодействии со свободными радикалами и другими интермедиатами, образующимися в реакционной смеси [3].
Рис. 2.
Кинетические кривые четырех циклов (кривые 1–4) распада ГПТБ при 37 °С в хлорбензоле в условиях одновременного присутствия Cu(aca)2 и СТАВ; [CTAB] = 10–2 M, [Cu(aca)2] = 2 ⋅ 10–4 M. Момент ввода новой порции пероксида после практически полного расходования ГПТБ показан знаком “+ROOH”.
Исследуемая композиция Cu(II) + CТАВ обладает высокой каталитической активностью без видимых признаков дезактивации в условиях проведения эксперимента и способностью переработки большого количества реагента (“перекисная машина”). В целом же трехкомпонентная композиция Cu(II) + CTAB + ГПТБ является эффективной инициирующей системой, генерирующей свободные радикалы в оптимальном температурном режиме, и может быть использована для различных химических процессов (полимеризация, окисление органического сырья). При использовании различных d-металлов, ПАВ и гидропероксидов в качестве предполагаемых каталитических систем каждая композиция должна исследоваться отдельно.
Работа выполнена в рамках государственного задания ФАНО России (0082-2018-0006, № АААА-А18-118020890097-1).
Список литературы
Писаренко Л.М., Максимова Т.В., Касаикина О.Т. // Изв. АН. Сер. хим. 2005. № 8. С. 1802.
Касаикина О.Т., Потапова Н.В., Круговов Д.А., Писаренко Л.М. // Кинетика и катализ. 2017. Т. 58. № 5. С. 567.
Гагарина А.Б., Смурова Л.А., Дегтярев Е.Н., Козырева А.Г. // Хим. физика. 2009. Т. 28. № 11. С. 18.
Туровский Н.А., Берестнева Ю.В., Ракша Е.В., Опейда И.А., Зубрицкий М.Ю. // Изв. АН. Сер. хим. 2014. № 8. С. 1717.
Turovskij N.A., Raksha E.V., Gevus O.I. // Oxidation Commun. 2009. V. 32. № 1. P. 69.
Смурова Л.А., Гагарина А.Б., Эммануэль Н.М. // Докл. АН СССР. Т. 272. 1983. № 1. С. 141.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


