Химическая физика, 2019, T. 38, № 6, стр. 77-90
Адсорбция водорода на золото-никелевых наночастицах: моделирование и эксперимент
Н. В. Дохликова 1, М. В. Гришин 1, *, С. Ю. Сарвадий 1, Б. Р. Шуб 1
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: mvgrishin68@yandex.ru
Поступила в редакцию 29.08.2018
После доработки 29.08.2018
Принята к публикации 22.10.2018
Аннотация
В работе представлены результаты квантовохимического моделирования и экспериментов по изучению влияния адсорбированного водорода на наночастицах состава золото–никель. В численных экспериментах установлено, что благодаря перераспределению электронной плотности между золотом и никелем в биметаллических кластерах, наиболее энергетически устойчивые положения адсорбированных атомов водорода располагаются преимущественно в окрестностях атомов золота. При экспериментальном исследовании наноструктурированного золото-никелевого покрытия на графите предсказанные теоретически эффекты подтвердились.
ВВЕДЕНИЕ
Физико-химические свойства биметаллических наноструктурированных покрытий являются предметом исследований нанохимии и, в частности, нанокатализа. Впервые применение ультрадисперсных (наноразмерных) биметаллических катализаторов зафиксировано в 1969 г., когда палладиево-золотой катализатор использовался для конверсии углеводородов [1]. Позже были обнаружены и другие каталитические биметаллические системы, которые обладают заметным преимуществом перед монометаллическими [2–4]. Однако, несмотря на то, что биметаллические катализаторы уже находят применение в химической промышленности, причины их повышенной химической активности все еще остаются неясным.
В то же время варьирование элементного состава наноструктур открывает широкие возможности управления их физико-химическими и, в частности, адсорбционными свойствами. В некоторых случаях оказывается возможным предсказание характеристик таких систем методами квантовой химии. Например, в работе [5] представлены результаты исследования окисления СО на кластерах NiAu6, PtAu6 и PdAu6 с помощью квантовохимического моделирования. Оказалось, что замещенные атомы (Ni, Pt, Pd) вызывают дополнительный перенос заряда в кластере, который активирует адсорбированные молекулы кислорода. Также определены атомные структуры указанных кластеров, соответствующие глобальному минимуму системы по энергии. Похожая работа [6] посвящена исследованию атомной и электронной структур, а также адсорбционных свойств кластеров золота с добавленными атомами элементов группы платины (Ni, Pt, Pd). Расчеты показали, что выявленная тенденция к образованию планарных структур связана со степенью выраженности релятивистских эффектов: наиболее стабильная планарная структура у кластера золото–платина. Адсорбционные свойства биметаллических кластеров определяются особенностями взаимодействия внешних электронных орбиталей золотых и примесных атомов, а именно степенью перекрытия d-d и s-d состояний.
Физико-химические свойства малых кластеров никеля Nin (n = 4–6) с адсорбированными С, Н и О исследованы в работе [7]. В результате установлены наиболее устойчивые положения адсорбированных атомов: водород размещается над тремя атомами никеля, углерод – над четырьмя атомами никеля, кислород – над двумя и тремя атомами в кластерах Ni3 и Nix, x = 4 и 5 соответственно. Также были проведены подробные исследования структурных и электронных свойств анионов AunNi–, где n = 1–5 [8]. В этой работе определены конфигурации, соответствующие глобальному минимуму, причем у кластера Au5Ni– наиболее стабильным оказался планарный изомер. Стоит отметить обнаруженные осцилляции чет–нечет энергетических характеристик систем, таких как ширина HOMO-LUMO щели, при изменении числа атомов золота. Приведенные примеры исследований демонстрируют особенности, присущие биметаллическим кластерам, а также возможность их определения методами квантовой химии.
Ранее нами было проведено исследование трансформации атомной и электронной структур кластеров золота при взаимодействии с атомарным водородом [9]. Согласно полученным данным, адсорбция водорода на кластере золота вызывает локальное снижение плотности состояний вблизи уровня Ферми, что в рамках резонансной модели хемосорбции означает уменьшение химической активности кластера при том, что массивное золото является химически инертным материалом. В настоящем исследовании этот результат используется для сопоставления физико-химических свойств золотых и золото-никелевых кластеров. Цель нашей работы состоит в определении качественных тенденций изменения адсорбционных свойств биметаллических кластеров золото–никель на примере взаимодействия с атомарным водородом при варьировании элементного состава кластера и мест адсорбции атома водорода. Для краткости далее в статье положение и место адсорбции атома водорода на кластере будет называться сайтом.
МЕТОДИКА ИССЛЕДОВАНИЙ
Численный эксперимент, моделирующий взаимодействие водорода с биметаллическими наночастицами золото–никель, проведен в рамках теории функционала плотности в обобщенном градиентном приближении и с функционалом PBE. Для расчетов использовались программные пакеты QuantumEspresso 5.1.1 (QE) [10] и OpenMX 3.8 (OMX) [11]. Релятивистские поправки движения электронов учтены при генерации ультрамягкого псевдопотенциала. Энергия отсечки базисного набора в QE 24 Ry. Объем ячейки 20 × 20 × 20 Å3. Наборы примитивных базисных функций в пакете OMX примерно соответствовали двойному набору слэттеровских функций. Спиновая поляризация не учитывалась. Методика численного эксперимента также включает в себя расчет и сопоставление энергий связи с адсорбатом и локальных энергетических спектров атомов кластера. Контрольные расчеты димера золота и молекулы водорода показали, что при выбранных параметрах точность вычислений удовлетворяет требованиям экспериментов.
Поскольку известно, что кластеры металлов имеют большое количество близких по энергиям изомеров, их атомная структура фиксировалась в ходе расчетов оптимального положения атома водорода на их поверхности. Кроме того, взаимодействие с водородом может послужить причиной перехода одного изомера кластера в другой, что внесет неоднозначность в расчет энергии взаимодействия.
Экспериментальная часть работы выполнена на сверхвысоковакуумной установке (давление остаточных газов 2 ⋅ 10–10 Торр). Синтез наночастиц проводился методом пропитки; анализ структуры и электронного строения золото-никелевого покрытия определялся по результатам исследований в сканирующем туннельном микроскопе (СТМ) [12]. Для изучения результатов адсорбции и взаимодействия водорода с наноструктурированным покрытием в камеру подавался Н2 при давлении 1 ⋅ 10–6 Торр в течение 30 мин, после чего газ удалялся из камеры и проводились измерения в СТМ.
КВАНТОВОХИМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
В качестве исходных моделей биметаллических наночастиц использованы кластеры типа AunHm (n + m = 13). Атомная структура биметаллических кластеров создавалась путем замены атомов на поверхности икосаэдрических изомеров кластеров Au13 и Ni13 и последующей оптимизации с помощью квазиньютоновских методов [13]. Полученные биметаллические кластеры соответствовали локальным минимумам энергии.
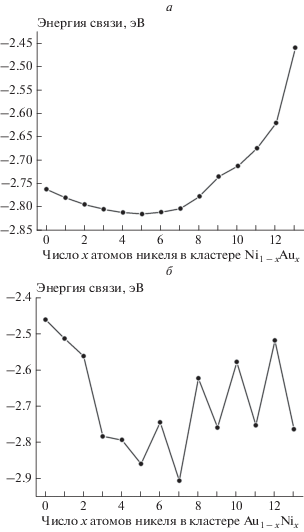
Замена на поверхности кластера Au13 произвольного атома золота атомом никеля приведет к появлению кластера Au12Ni1 с атомом золота в центре. В то же время замена на поверхности кластера Ni13 произвольного атома никеля атомом золота создаст кластер Ni12Au1 с центральным атомом никеля. Квантовохимический расчет показал, что при последовательной замене поверхностных атомов никеля золотом происходит плавное изменение средней энергии связи в системе (рис. 1а), а при замене поверхностных атомов золота никелем наблюдаются осцилляции среднего значения энергии связи (рис. 1б). Причина этого эффекта пока не ясна.
Рис. 1.
Зависимость энергии связи в биметаллических кластерах от соотношения золота и никеля: а – NinAum (n + m = 13) с центральным атомом никеля; б – AunNim (n + m = 13) с центральным атомом золота.
Для дальнейшего исследования физико-химических свойств среди полученных рядов биметаллических кластеров были отобраны следующие:
1) имитирующие единичные дефекты на поверхности наночастицы, Au12Ni1, Ni12Au1, с примесным атомом на поверхности кластера;
2) моделирующие наночастицу с примерно одинаковым числом атомов золота и никеля – Au7Ni6.
Исследование особенностей взаимодействия атома водорода с указанными выше кластерами проводилось путем расчета параметров связи и спроектированных плотностей состояний при различных положениях адсорбированного атома водорода на поверхности, т.е. на различных сайтах.
Кластеры Au13 и Ni13
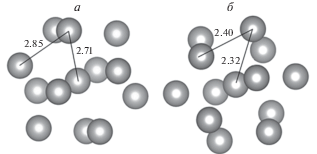
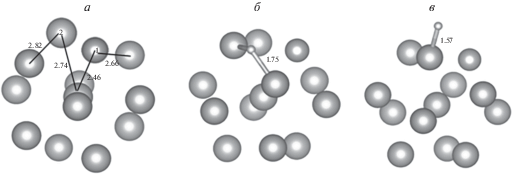
Для сопоставления результатов адсорбции водорода на кластерах различного состава вначале исследования были проведены расчеты адсорбции атома водорода на гомогенных икосаэдрических изомерах кластеров золота и никеля Au13, Ni13. На рис. 2 представлена структура этих кластеров. Характерные значения расстояний между соседними поверхностными атомами, а также центральным и поверхностным атомами составляют 2.85 и 2.71 Å для кластера золота и 2.40 и 2.32 Å для кластера никеля соответственно. Химические потенциалы этих кластеров равны –4.9 и –4.25 эВ соответственно. Следовательно, при непосредственном контакте этих кластеров золото приобретет отрицательный заряд, а никель – положительный. Данное обстоятельство будет иметь важное значение в дальнейшем.
В табл. 1 приведены значения энергии, длины связи и оптимального положения атома водорода на поверхности 13-атомных икосаэдрических изомеров золота и никеля. Как было отмечено в нашей предыдущей работе [14], наиболее энергетически выгодным положением хемосорбированного атома водорода над кластером золота является “bridge”. Однако для никеля энергетически более стабильным оказалось положение “hollow”.
Таблица 1.
Энергии взаимодействия и длины связи атома водорода с гомогенными кластерами
| Кластер | Энергия связи, эВ | Длина связи, Å | Положение атома Н на поверхности кластера |
|---|---|---|---|
| Au13 | –3.2 | 1.75 | “bridge” |
| Ni13 | –3.33 | 1.75 | “hollow” |
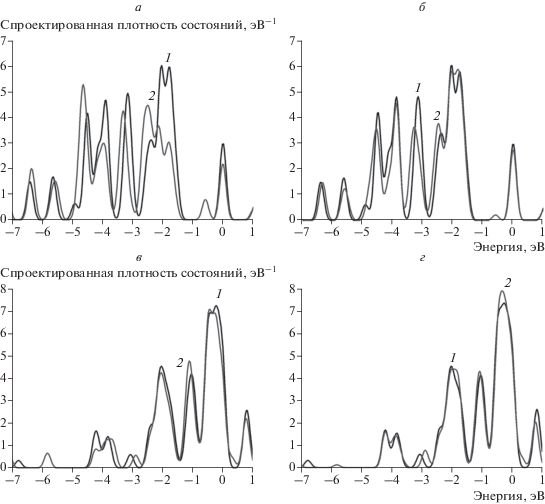
На рис. 3 представлены графики, иллюстрирующие вариации спроектированных плотностей состояний атомов золота и никеля, которые находятся на различных удалениях от адсорбированного атома водорода. Из данных, представленных на рис. 3, следует, что взаимодействие с водородом влияет на энергетические спектры атомов золота и никеля различным образом. Основная часть плотности d-состояний золота лежит ниже уровня Ферми, а плотность состояний в его окрестности образована в основном s-электронами (рис. 3а и 3б). Возмущение электронной структуры кластера золота при взаимодействии с атомом водорода локально: плотность состояний при образовании связи с атомом водорода снижается в основном на атоме золота, непосредственно взаимодействующим с атомом водорода (рис. 3а). На соседнем атоме золота плотность состояний при этом практически не меняется (рис. 3б). Более подробно результаты расчетов энергетических спектров кластеров золота приведены в нашей работе [9]. В то же время основная часть плотности d‑состояний никеля находится в околофермиевской зоне, поэтому при образовании связи с атомом водорода ее снижение значительно менее заметно, чем у золота (см. рис. 3в и рис. 3г).
Рис. 3.
Спроектированные плотности состояний на: а – атом золота, взаимодействующий с атомом водорода; б – атом золота из ближайшей окрестности сайта адсорбции водорода; в – атом никеля, взаимодействующий с атомом водорода; г – атом никеля из ближайшей окрестности сайта адсорбции водорода. На всех графиках 1 (черная кривая) – исходная спроектированная плотность состояний, 2 (серая кривая) – плотность состояний после адсорбции водорода.
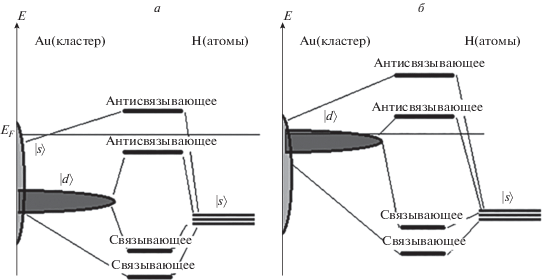
На основе рассчитанных энергетических спектров (рис. 3), можно схематично показать особенности строения связывающих и антисвязывающих состояний кластеров золота и никеля с адсорбированными атомами водорода (рис. 4). Отметим, что при взаимодействии водорода с кластером золота электроны d-зоны золота и s-орбиталей атомов водорода заполняют связывающее и антисвязывающее состояния, расположенные под уровнем Ферми. Однако из-за того, что плотность состояний кластера никеля вблизи уровня Ферми в основном образована d-зоной, антисвязывающее состояние, образованное d-зоной кластера никеля и s-орбиталями атомов водорода, лежит выше уровня Ферми и свободно. Эта особенность электронного строения адсорбционных комплексов никеля и золота с водородом может быть причиной того, что энергия связи кластера никеля с атомом водорода несколько больше (см. табл. 1), чем энергия связи золотого кластера и водорода. Кроме того, заполненное антисвязывающее состояние адсорбционного комплекса кластера золота и атомов водорода может также вносить свой вклад в сдвиг центра тяжести d-зоны от уровня Ферми.
Кластер Au12Ni1
Рассмотрим результаты замены поверхностного атома Au на атом Ni (кластер Au12Ni1). Атомная структура такого кластера представлена на рис. 5а. Сопоставляя рис. 2а и 5а, можно заметить, что в результате такой замены происходит увеличение расстояния от центрального атома до атомов золота на поверхности с 2.71 до 2.74 Å, а также уменьшение расстояния между ближайшими поверхностными атомами золота с 2.85 до 2.82 Å, что ожидаемо, поскольку равновесные расстояния между атомами в кластере Ni13 меньше равновесных расстояний в кластере Au13 (см. рис. 2). Анализ заселенности электронами атомных уровней по Малликену [15] показал, что атом никеля заряжен положительно, величина заряда примерно +0.5e.
Рис. 5.
Структура биметаллического кластера Au12Ni1 и адсорбционного комплекса Au12Ni1H: а – исходный кластер Au12Ni1; б – оптимизированное положение атома водорода вблизи атома никеля (сайт 1); в – оптимизированное положение атома водорода на соседнем с никелем атоме золота (сайт 2).
Исследована адсорбция атома водорода на двух сайтах кластера (атомы 1 и 2 на рис. 5а). Результаты этих исследований представлены на рис. 6 и 7, а также в табл. 2. Как видно, взаимодействие с водородом, адсорбированном на обоих сайтах, наиболее заметно влияет на плотность состояний ближайшего атома золота (рис. 6а и рис. 7а). При этом плотность состояний этих атомов вблизи энергии Ферми существенно уменьшается, однако при этом плотность состояний никеля (рис. 6б и рис. 7б), как и плотность состояний атома золота ближайшего окружения (рис. 6в и рис. 7в), практически не изменяется. Величины энергий связи для обоих сайтов имеют близкие значения: –3.2 и –3.16 эВ, соответственно, причем для положения “bridge” энергия связи несколько больше, чем для положения “atop” (см. табл. 2), что соответствует результатам исследования адсорбции водорода на гомогенных кластерах Au13 [12].
Рис. 6.
Спроектированная плотность состояний для атомов кластера Au12Ni1H для сайта 1 (рис. 5б): а – на атоме золота, взаимодействующим с атомом водорода; б – на соседнем атоме никеля; в – на соседнем атоме золота. На всех графиках 1 (черная кривая) – исходная спроектированная плотность состояний, 2 (серая кривая) – плотность состояний после адсорбции водорода.
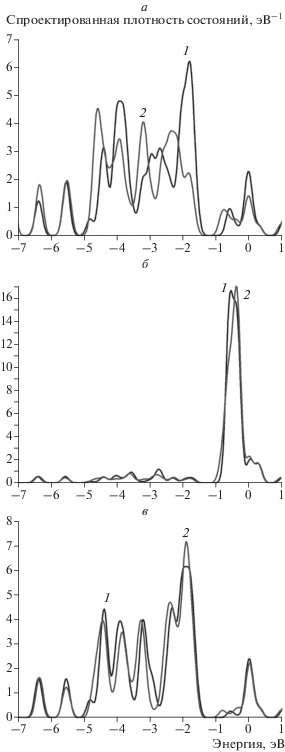
Рис. 7.
Спроектированная плотность состояний для атомов кластера Au12Ni1H для сайта 2 (рис. 5в): а – на атоме золота, взаимодействующим с атомом водорода; б – на соседнем атоме никеля; в – на соседнем атоме золота. На всех графиках 1 (черная кривая) – исходная спроектированная плотность состояний, 2 (серая кривая) – плотность состояний после адсорбции водорода.
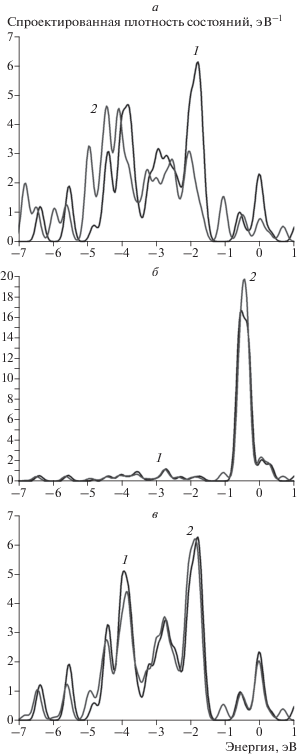
Таблица 2.
Энергии взаимодействия и длины связи для двух приведенных на рис. 5 сайтов
| Энергия связи, эВ | Длина связи, Å | Положение атома Н на поверхности кластера |
|---|---|---|
| –3.2 | 1.75 | “bridge” над атомами золота |
| –3.16 | 1.57 | “atop” над атомом золота |
Таким образом, согласно расчетам атомной структуры кластера Au12Ni1H (рис. 5), нахождение атома водорода в окрестности примесного атома никеля не является энергетически выгодным. Это связано с тем, что атом никеля обладает недостатком электронной плотности (положительным зарядом), вызванным взаимодействием с окружающими атомами золота. В то же время энергия связи водорода с золотом больше, а ее образование сопровождается снижением плотности состояний в околофермиевской зоне на ближайших к атому водорода атомах золота, что согласуется с проведенными ранее исследованиями [9]. Кроме того, взаимодействие атомов золота и никеля в кластере Au12Ni1 изменило распределение плотностей состояний по сравнению с распределениями плотностей тех же атомов в гомогенных кластерах Au13 и Ni13 (рис. 3): плотность состояний атома никеля существенно уменьшилась, а плотность состояний золота сдвинулась от уровня Ферми к отрицательным значениям за счет образования связи с атомом никеля.
Кластер Au7Ni6
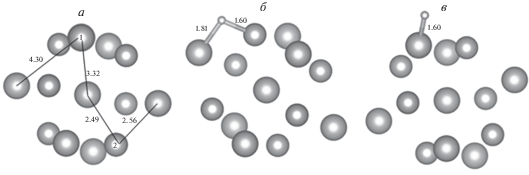
Рассмотрим результаты моделирования адсорбции водорода на кластере Au7Ni6 с центральным атомом золота. Кластер построен таким образом, что на его поверхности атом золота окружен тремя атомами никеля, а атом никеля окружен тремя атомами золота (рис. 8). Данная атомная структура имитирует наиболее равномерное распределение различных типов атомов на поверхности наночастицы. Структура кластера характеризуется следующими параметрами: расстояние от центрального атома Au до поверхностных атомов составляет 3.32 Å (золото) и 2.49 Å (никель), расстояние между ближайшими поверхностными атомами золота – 4.30 Å, между атомами золота и никеля – 2.56 Å. Анализ заселенности электронных уровней по Малликену показал, что в этом кластере заряд атомов никеля – +0.4e, а заряд атомов золота – –0.3e.
Рис. 8.
Структура биметаллического кластера Au7Ni6 и адсорбционного комплекса Au7Ni6H: а – исходный кластер Au7Ni6; б – оптимизированное положение атома водорода на атоме никеля, окруженном тремя атомами золота (сайт 3); в – оптимизированное положение атома водорода на атоме золота, окруженном тремя атомами никеля (сайт 4).
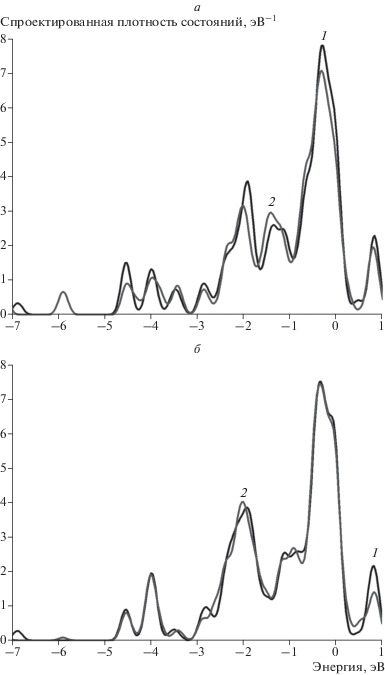
Адсорбция атома водорода на кластере Au7Ni6 исследована для двух наиболее различающихся сайтов, а именно на атоме никеля, окруженном тремя атомами золота (сайт 3), и на атоме золота, окруженном тремя атомами никеля (сайт 4). Как видно из рис. 9 и 10, адсорбция водорода также изменяет преимущественно энергетический спектр ближайшего атома золота (рис. 9а и рис. 10а). Однако для сайта 3 можно отметить снижение плотности состояний атома никеля вблизи уровня Ферми (рис. 9б), что обусловлено положением адсорбированного атома водорода. Величины энергий связи для обоих сайтов имеют близкие значения. Однако по абсолютной величине они меньше энергий связи атома водорода как с кластером золота, так и с кластером никеля (см. табл. 3).
Рис. 9.
Спроектированная плотность состояний для атомов Au и Ni кластера Au7Ni6 для сайта 3 (рис. 8б): а – на атоме золота, б – на атоме никеля. На всех графиках 1 (черная кривая) – исходная спроектированная плотность состояний, 2 (серая кривая) – плотность состояний после адсорбции водорода.
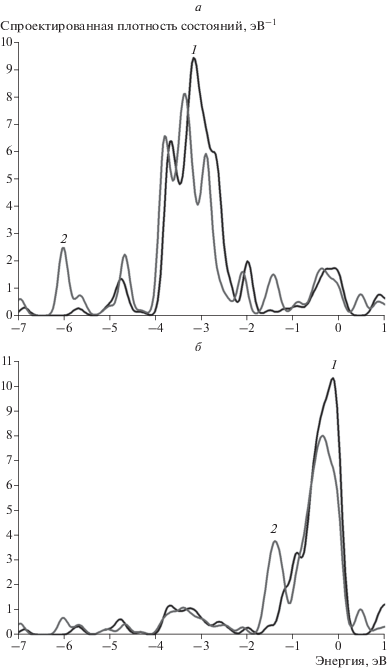
Рис. 10.
Спроектированная плотность состояний для атомов Au и Ni кластера Au7Ni6 для сайта 4 (рис. 8в): а – на атоме золота, б – на атоме никеля. На всех графиках 1 (черная кривая) – исходная спроектированная плотность состояний, 2 (серая кривая) – плотность состояний после адсорбции водорода.
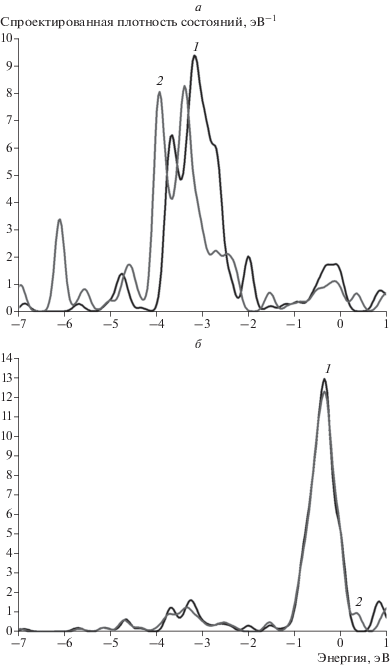
Таблица 3.
Энергии взаимодействия и длины связи для двух приведенных на рис. 8 сайтов
| Энергия связи, эВ | Длина связи, Å | Положение атома Н на поверхности кластера |
|---|---|---|
| –2.87 | 1.61 (Ni); 1.81 (Au) | “bridge” над атомами никеля и золота |
| –2.8 | 1.60 | “atop” над атомом золота |
Расчеты показали, что положение атома водорода вблизи атома никеля на сайте 3 энергетически выгодно, возможно, благодаря меньшему перетеканию электронной плотности в наносистеме, при этом расстояние до атома никеля меньше расстояния до атома золота на 0.2 Å (рис. 8).
Из рис. 9 видно, что при взаимодействии с атомом водорода плотность состояний атома никеля также как и атома золота испытывает трансформацию, хотя и в меньшей степени. При адсорбции водорода на сайте 4 снижение плотности состояний происходит только на атоме золота, что ожидаемо (рис. 10). Также можно отметить более сильный, чем в кластере с одним замещенным атомом Au12Ni1, сдвиг плотностей состояний атома золота в целом, появление которого обусловлено взаимодействием с атомами никеля. Такое изменение энергетического спектра может являться одним из факторов уменьшения величины энергии связи атома водорода с кластером Au7Ni6 относительно кластеров с единичным замещенным атомом (табл. 2, 4).
Таблица 4.
Энергии взаимодействия и длины связи в трех приведенных на рис. 11 случаях
| Энергия связи, эВ | Длина связи, А | Положение атома Н на поверхности кластера |
|---|---|---|
| –3.02 | 1.60 | “atop” над атомом золота |
| –3.35 | 1.75 | “hollow” над атомами никеля |
Кластер Ni12 Au1
Рассмотрим результаты замены единственного поверхностного атома в кластере Ni13 атомом золота. Атомная структура такого кластера представлена на рис. 11а. Сопоставляя рис. 2б и 11а, можно видеть, что в результате замены происходит небольшое увеличение расстояния от центрального атома до атома никеля на поверхности с 2.32 до 2.33 Å (Ni–Ni) и уменьшение расстояния между поверхностными атомами c 2.40 до 2.35 Å, что также обусловлено различием длин связи между атомами золота и никеля в соответствующих кластерах. Анализ заселенности электронами энергетических уровней по Малликену показал, что произошел перенос электронной плотности на атом золота. Величина избыточного заряда составляет –0.2е.
Рис. 11.
Структура биметаллического кластера Ni12 Au1 и адсорбционного комплекса Ni12 Au1H: а – исходный кластер Ni12 Au1; б – оптимизированное положение атома водорода на атоме золота (сайт 5); в – оптимизированное положение атома водорода на соседнем с атомом золота атоме никеля (сайт 6).
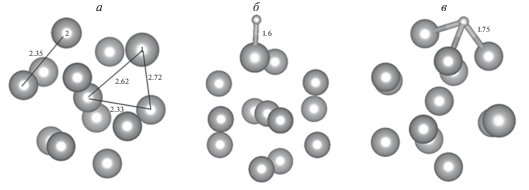
Исследована адсорбция атома водорода на двух сайтах кластера (атомы 1 и 2 на рис. 11а). Результаты представлены на рис. 12 и 13, а также в табл. 4. Взаимодействие атома водорода с единичным примесным атомом золота энергетически выгодно (сайт 5, рис. 11б). После оптимизации атом водорода занимает положение близкое к “atop”. Однако в этом случай сдвиг плотности состояний атома золота от уровня Ферми намного меньше, чем при адсорбции атома водорода на кластере золота, что также коррелирует с уменьшением величины энергии связи (табл. 4). Изменения энергетического спектра и энергия связи для сайта 6 на кластере Ni12 Au1 (рис. 11в) и для кластера Ni13 схожи, однако можно отметить, что для негомогенного кластера энергия связи на 0.02 эВ больше.
Рис. 12.
Спроектированная плотность состояний для атомов кластера сайта 5 (рис. 11б): а – на атоме золота, б – на атоме никеля. На всех графиках 1 (черная кривая) – исходная спроектированная плотность состояний, 2 (серая кривая) – плотность состояний после адсорбции водорода.
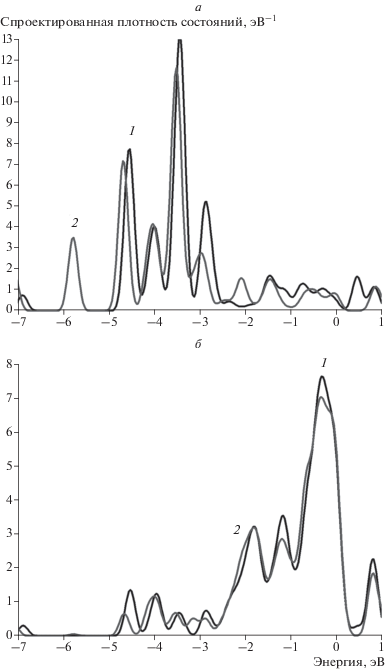
Рис. 13.
Спроектированная плотность состояний для атомов кластера для сайта 6 (рис. 11в): а – на атоме никеля, взаимодействующим с атомом водорода, б – на соседнем атоме никеля. На всех графиках 1 (черная кривая) – исходная спроектированная плотность состояний, 2 (серая кривая) – плотность состояний после адсорбции водорода.
Квантовохимические расчеты показали, что положение атома водорода на сайте 6 энергетически выгодно, а энергия связи на 0.02 эВ больше энергии связи атома водорода с кластером Ni13 (рис. 10в). Сайт 5 также является стабильным, в отличие от сайта на атоме никеля в кластере Au12Ni1, благодаря избытку электронной плотности на золоте.
Из рис. 12 можно сделать вывод о том, что в данном случае трансформация плотности состояний атома золота, взаимодействующего с атомом водорода (сайт 6), меньше, чем в кластерах Au13, Au12Ni1 и Au7Ni6. Одним из факторов такого поведения энергетического спектра может оказаться сильный сдвиг плотности состояний в целом от уровня Ферми, вызванный взаимодействием атома золота с атомами никеля. У атомов никеля, взаимодействующих с водородом (рис. 13), плотность состояний вблизи уровня Ферми снижается за счет образования связи с водородом, причем в случае кластера Ni12Au1 трансформация энергетического спектра заметней, чем в кластере Ni13.
ЭКСПЕРИМЕНТ
Исследования наноструктурированного покрытия, состоящего из наночастиц золота и никеля на поверхности высокоупорядоченного пиролитического графита (ВОПГ) выполнены методами сканирующей туннельной микроскопии и спектроскопии. Оказалось, что на ВОПГ наночастицы образуют гомо- и гетерогенные скопления различного размера. Среди них именно последние, состоящие из наночастиц золота и никеля, ближе всего к рассмотренным выше системам. Типичное изображение изучаемого образца приведено на рис. 14.
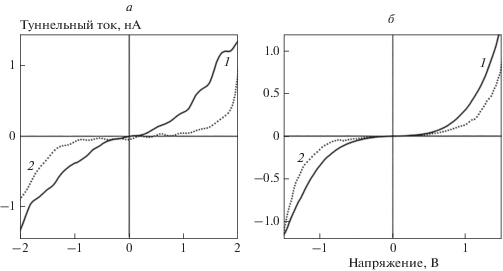
Взаимодействие покрытия с атомами водорода в целом соответствует результатам расчетов. Экспозиция в молекулярном водороде приводит к перестройке электронного строения золота и практически не влияет на состояние наночастиц никеля (см. рис. 15). В результате диссоциативной адсорбции водорода на зависимостях туннельного тока от напряжения на наноконтакте СТМ, содержащем наночастицу золота, появился участок с нулевым током (рис. 15а). В соответствии с изложенными выше результатами моделирования участок нулевого тока связан с изменением электронного строения золота под действием адсорбированного атома водорода. Однако на аналогичных зависимостях, полученных для наночастиц никеля, участок нулевого тока не наблюдается (рис. 15б). Действительно, согласно данным квантовохимического моделирования, влияние адсорбированного водорода на электронное строение никеля минимально. “Водородный” тест, в частности, позволяет разделять наночастицы в гетерогенных кластерах по их элементному составу, что практически невозможно сделать другими методами.
ЗАКЛЮЧЕНИЕ
В результате квантовохимического моделирования предсказаны эффекты взаимодействия золото-никелевых кластеров Au12Ni1, Ni12Au1 и Au7Ni6 с атомарным водородом. Выявлены особенности атомной структуры таких кластеров, а именно:
1. Поскольку длина связи Ni–Ni меньше длины связи Au–Au, кластер биметалла испытывает трансформацию атомной структуры, что приводит к уширению распределения плотности состояний атомов золота и сужению плотности состояний атомов никеля. В целом это приводит к уменьшению величины энергии связи в окрестности атомов золота и увеличению величины энергии связи в окрестностях атомов никеля.
2. Происходящее в биметаллических кластерах перераспределение электронной плотности, обусловленное в том числе разницей химических потенциалов золотой и никелевой подсистем, приводит к тому, что золото приобретает отрицательный заряд, а никель – положительный. Благодаря такому перераспределению заряда, наиболее стабильные сайты адсорбции водорода располагаются преимущественно в окрестностях атомов золота биметаллических кластеров.
3. В результате исследований наноструктурированного золото-никелевого покрытия на графите с помощью методов сканирующей туннельной микроскопии и спектроскопии эффекты, предсказанные теоретически, подтвердились. В частности, на зависимостях туннельного тока от напряжения на наноконтакте СТМ с золотыми наночастицами в результате адсорбции водорода появляется участок нулевого тока. Для наночастиц никеля аналогичный эффект не обнаружен.
При расчетах использовались ресурсы Межведомственного суперкомпьютерного центра РАН.
Работа выполнена в рамках государственного задания ИХФ РАН (тема 45.9, 0082-2014-0011, АААА-А17-117111600093-8), а также при частичном финансировании за счет грантов Российского фонда фундаментальных исследований №№ 17-03-00275, 18-03-00060, 18-53-00013.
Список литературы
Barnett A.E., Dembinski G.W., Sinfelt J.H. Isomerization process utilizing a gold-palladium alloy in the catalyst: Патент США 3442973. 1969.
Augustine S.N., Sachler W.M.H. // J. Phys. Chem. 1987. V. 91. P. 5953.
Diaz G., Gomezcortes A., Benaisa M. // Catal. Lett. 1996. V. 38. P. 63.
Huang Y.Y., Sachtler W.M.H. // J. Catal. 1999. V. 188. P. 215.
Nigam S., Sahoo S.K., Sarkar P., Majumder Ch. // Chemical Physics Lett. 2013. V. 584. P. 108.
Yuan D.W., Wang Y., Zeng Zh. // J. Chem. Phys. 2005. V. 122. P. 114310.
Petkov P.St., Vayssilov G.N., Kruger S., Roch N. // Chem. Phys. 2008. V. 348. P. 61.
Guo J.-J., Yang J.-X., Die D. // J. Mol. Struct. – THEOCHEM. 2009. V. 896. P. 1.
Дохликова Н.В., Колченко Н.Н., Гришин М.В., Шуб Б.Р. // РН. 2016. Т. 11. № 1–2. С. 6.
Giannozzi P., Baroni S., Bonini N., Calandra M., Car R. // J. Phys.: Condens. Matter. 2009. V. 21. P. 395502.
Ozaki T. // Phys. Rev. B. 2003. V. 67. P. 5108.
Гатин А.К., Гришин М.В., Сарвадий С.Ю., Шуб Б.Р. // Хим. физика. 2018. Т. 37. № 3. С. 48.
Гилл Ф., Мюррей У., Райт М. Практическая оптимизация / Пер. с англ. М.: Мир, 1985.
Гатин А.К., Гришин М.В., Дохликова Н.В., Колченко Н.Н., Шуб Б.Р. // ДАН. 2016. Т. 470. № 1. С. 1.
Заградник Р., Полак Р. Основы квантовой химии. М.: Мир, 1979.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика