Химическая физика, 2019, T. 38, № 6, стр. 3-7
Моделирование фотофизических свойств компонентов FRET-пар на основе флавинсодержащих флуоресцентных белков и их аналогов
Ю. И. Метелешко 1, А. В. Немухин 1, 2, М. Г. Хренова 1, 3, *
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
3 Институт биохимии им. А.Н. Баха при Федеральном исследовательском центре
“Фундаментальные основы биотехнологии” Российской академии наук
Москва, Россия
* E-mail: khrenova.maria@gmail.com
Поступила в редакцию 19.11.2018
После доработки 25.12.2018
Принята к публикации 21.01.2019
Аннотация
Для флуоресцентных белков на основе iLOV с полосами поглощения и флуоресценции, смещенными в длинноволновую область, методами молекулярного моделирования определены фотофизические свойства, необходимые для рационального дизайна FRET-пар.
ВВЕДЕНИЕ
Флуоресцентные белки на основе флавина становятся все более популярными маркерами для молекулярной биологии [1], а также являются перспективными объектами для использования в оптогенетике [2] и для дизайна FRET-пар (FRET – фёрстеровский резонансно-индуктивный перенос энергии). Они получены из LOV2-домена белка фототропина 2 растения A. thaliana введением специфической мутации C450A и последующим случайным мутагенезом [3, 4]. В результате были достигнуты улучшенные значения квантового выхода и фотостабильности. В частности, одним из наиболее перспективных вариантов оказался белок iLOV [3].
Известно, что все белки семейства LOV имеет близкие максимумы полос поглощения (около 450 нм) и флуоресценции (около 495 нм), обусловленными их хромофором – флавинмононуклеотидом. Эти значения находятся далеко от окна прозрачности (650–900 нм), в котором свет проникает через ткани млекопитающих, что затрудняет использование этих белков в живых организмах. Также эти белки невозможно использовать в многоцветной визуализации, для которой необходимо, чтобы максимумы полос флуоресценции были разнесены не менее чем на 50–60 нм. Поэтому расширение цветовой палитры и разработка новых вариантов флуоресцентных белков на основе флавина со спектрами флуоресценции, смещенными в красную область, являются актуальными задачами.
В наших предыдущих работах [5–7] методы молекулярного моделирования использованы для исследования белковых систем с флавином и его производными, а также для систем с дополнительными точечными мутациями аминокислотных остатков в хромофорсодержащей области белка. В результате предложены варианты белка iLOV со смещенными в более длинноволновую область спектра полосами поглощения и флуоресценции. Для мутантных форм с флавинмонуклеотидом в качестве хромофора смещения рассчитанных энергий вертикальных переходов S0, max–S1 (поглощение) (см. табл. 2 и 3 в [5]) и S1,min–S0 (флуоресценция) составили соответственно до 50 и до 40 нм (см. табл. 2 и 3 в [5]), а для мутантных форм с аналогами флавина – от 50 до 160 нм и от 40 до 360 нм для энергий вертикальных переходов S0,min–S1 и S1,min–S0 (см. табл. 7 и 8 в [6]) соответственно.
Фёрстеровский резонансно-индуктивный перенос энергии происходит между двумя близко расположенными в пространстве хромофорами. Его эффективность зависит от индивидуальных фотофизических свойств хромофоров, а также от взаимной ориентации дипольных моментов перехода для флуоресценции донора и поглощения акцептора [8]. Для эффективного переноса энергии необходимо, чтобы полоса флуоресценции донора значительно перекрывалась с полосой поглощения акцептора, а также важны высокий квантовый выход флуоресценции донора и большой коэффициент экстинкции акцептора. Взаимное расположение донора и акцептора определяется ориентационным фактором – величиной, принимающей значения от 0 до 4 в зависимости от взаимной ориентации дипольных моментов перехода для флуоресценции донора и поглощения акцептора.
Среди рассматриваемых систем наиболее перспективными для создания новых FRET-пар являются [6]: 1) iLOV с iLOV-K489t (Q489K/L470T) и iLOV с iLOV-K392 (V392K/F410V/A426S), содержащие флавинмононуклеотид в качестве хромофора; 2) iLOV-a с iLOV-aK392 (V392K/F410V/ A426S/Q489A) и iLOV-a c iLOV-aK489ss (Q489K/ L470S/G487S), содержащие 8-аминофлавин. Для этих пар рассчитанные энергии вертикального электронного перехода S1, min–S0 донора близки к энергиям вертикального перехода S0, min–S1 акцептора.
Цель данной работы – предоставление новых данных о флуоресцентных белках на основе флавина и его аналогов, которые необходимы для рационального дизайна FRET-пар, а также для разработки новых мутантов со спектрами поглощения и флуоресценции, смещенными в длинноволновую область.
МОДЕЛИ И МЕТОДЫ
Для исследуемых систем равновесные геометрические конфигурации, включающие белковую макромолекулу, хромофор и слой воды толщиной 5 Å, были рассчитаны в работах [5–7] комбинированным методом квантовой механики и молекулярной механики (КМ/ММ) в варианте КМ (PBE0-D3/cc-pvdz)/ММ(AMBER) в программном пакете NWChem [9–12]. В качестве хромофоров рассматривались флавин, 8-аминофлавин, 8-метиламинофлавин и 1-деазафлавин. В квантовую часть входили изоаллоксазиновое кольцо хромофора и боковые цепи аминокислот, образующих водородные связи с хромофором, а для мутантных форм также боковая цепь лизина 392 или 489 и боковые цепи аминокислот и молекулы воды, образующие водородные связи с ним.
Дипольные моменты перехода рассчитаны методом XMCQDPT2/CASSCF(12/12)/cc-pvdz [13] для систем с флавином, 8‑аминофлавином и 8‑метиламинофлавином и XMCQDPT2/CASSCF(2/2)/cc-pvdz для систем с 1‑деазафлавином в программном пакете Firefly QC [14], частично основанном на исходном коде GAMESS (US) [15]. Равновесные геометрические конфигурации молекулярных кластеров для расчетов были взяты из работ [5–7].
Атомные заряды рассчитывались по схеме Малликена для основного электронного состояния, волновые функции были получены в расчетах CASSCF(12/12)/cc-pvdz [13] для систем с флавином, 8-аминофлавином и 8-метиламинофлавином и CASSCF(2/2)/cc-pvdz для систем с 1-деазафлавином с усреднением по двум низшим синглетным состояниям.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Дипольные моменты перехода
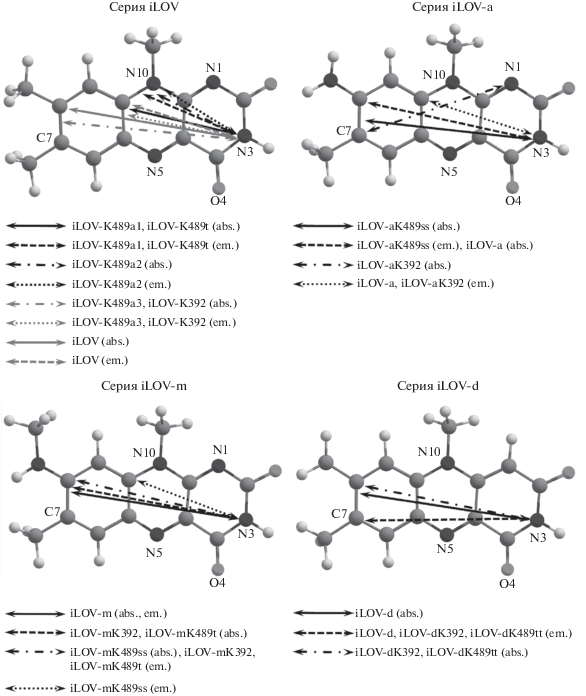
В работе рассматривается 16 модельных систем: четыре их них не содержат точечных мутаций в белковой макромолекуле и различаются хромофорами, двенадцать – содержат точечные мутации и различные хромофоры. Все дипольные моменты переходов, рассчитанные для исследуемых систем, находятся в плоскости изоаллоксазинового кольца хромофора (рис. 1). Для систем серий iLOV-m с 8-метиламинофлавином в качестве хромофора и iLOV-d с 1-деазафлавином направление дипольных моментов переходов меняется незначительно при введении точечных мутаций в белковую макромолекулу. Для систем серии iLOV-a наблюдается большая вариативность – для мутантной формы iLOV-aK489ss направление дипольного момента перехода S0, min–S1 сильно отличается от остальных систем. Возможно, это связано с окружением хромофора – набор мутаций для данной системы (V392K/F410V/A426S/Q489A) не повторяется полностью в системах с другими хромофорами и содержит мутацию в положении 489 на неполярную аминокислоту, в то время как в остальных моделях в позиции 489 находится полярная аминокислота. Для всех систем, кроме iLOV-aK489ss, направления дипольных моментов перехода лежат в промежутке между условно проведенными линиями, соединяющими атомы N3−N10 и N3−C7.
Заряды на атомах хромофора
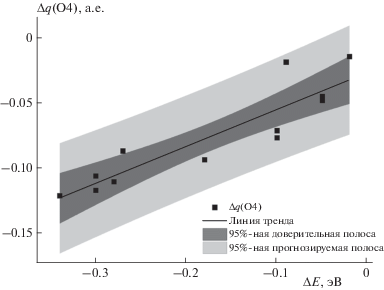
Для исследованных систем рассчитывались атомные заряды по Малликену и изучалась их зависимость от величины сдвига полос поглощения (табл. 1). Каждая мутантная форма содержит основную замену на лизин в положении 392 или 489, за счет которой и возникает красный сдвиг в спектрах поглощения и флуоресценции; образуются дополнительные водородные связи между атомами O4 или O4 и N5 хромофора и положительно заряженной аминогруппой лизина. Дополнительные компенсирующие замены аминокислот в хромофорсодержащей области предназначены для фиксации функциональной группы лизина вблизи хромофора. При возбуждении системы в первое синглетное возбужденное состояние наиболее значительные изменения электронной плотности происходят в области атомов O4, N5 и N1 [7]. При этом на атомах O4 и N5 электронная плотность увеличивается, а на атоме N1 – уменьшается. Эти атомы были выбраны для более детального анализа. Нами не было обнаружено зависимостей между сдвигами энергий вертикальных переходов S0, min–S1 и S1, min–S0 переходов мутантных форм по отношению к флуоресцентным белкам с неизмененной аминокислотной последовательностью (∆Eabs) и изменениями зарядов на атомах. В основном электронном состоянии заряд на атоме N1 практически не изменяется при введении точечных мутаций в белок, что, по всей видимости, связано с отсутствием изменений локального окружения этого атома. Заряд на атоме N5 изменяется в более широком диапазоне значений, однако четкой зависимости со сдвигом энергии вертикального электронного перехода не просматривается. Вероятнее всего, это связано с тем, что в части структур присутствует водородная связь атома азота с протонированной группой лизина, а в других – нет. Подтверждением этому является наличие закономерности между изменением заряда на атоме O4 и смещением энергии вертикального перехода S0, min–S1; атом O4 во всех мутантных формах образует водородную связь с лизином (рис. 2). Эта зависимость является общей для зарядов на атоме O4 всех мутантных форм с флавином или его аналогами. Полученная зависимость (рис. 2) является линейной и демонстрирует, что концентрация отрицательного заряда на атоме O4 приводит к уменьшению энергии вертикального перехода S0, min–S1.
Таблица 1.
Рассчитанные вертикальные энергии переходов S0, min–S1 (Eabs) [5–7] и атомные заряды по Малликену (q) в основном электронном состоянии для исследованных систем
| Система | Eabs, эВ | ∆Eabs, эВ | q(O4), а.е. | ∆q(O4), а.е. | q(N5), а.е. | q(N1), а.е. |
|---|---|---|---|---|---|---|
| iLOV-out | 2.82 | 0 | –0.36 | 0 | –0.24 | –0.52 |
| iLOV-K489a3 | 2.80 | –0.02 | –0.38 | –0.01 | –0.36 | –0.50 |
| iLOV-K489a2 | 2.77 | –0.05 | –0.41 | –0.05 | –0.32 | –0.54 |
| iLOV-K489a1 | 2.73 | –0.09 | –0.38 | –0.02 | –0.33 | –0.53 |
| iLOV-K489t | 2.64 | –0.18 | –0.46 | –0.09 | –0.24 | –0.51 |
| iLOV-K392 | 2.52 | –0.3 | –0.47 | –0.11 | –0.31 | –0.49 |
| iLOV-a | 2.70 | 0 | –0.31 | 0 | –0.26 | –0.53 |
| iLOV-aK392 | 2.42 | –0.28 | –0.42 | –0.11 | –0.33 | –0.50 |
| iLOV-aK489SS | 2.36 | –0.34 | –0.43 | –0.12 | –0.35 | –0.49 |
| iLOV-d | 2.36 | 0 | –0.36 | 0 | –0.15 | – |
| iLOV-dK392 | 2.09 | –0.27 | –0.44 | –0.09 | –0.23 | – |
| iLOV-dK489TT | 2.06 | –0.3 | –0.48 | –0.12 | –0.27 | – |
| iLOV-m | 2.59 | 0 | –0.38 | 0 | –0.24 | –0.54 |
| iLOV-mK489SS | 2.54 | –0.05 | –0.43 | –0.04 | –0.28 | –0.53 |
| iLOV-mK392 | 2.49 | –0.1 | –0.46 | –0.08 | –0.28 | –0.52 |
| iLOV-mK489T | 2.49 | –0.1 | –0.45 | –0.07 | –0.26 | –0.51 |
Рис. 2.
Зависимость изменения заряда Δq = 0.284ΔE – 0.0265 на атоме O4 хромофора в основном электронном состоянии в мутантных формах от величины сдвига энергии вертикального перехода S0,min–S1 мутантных форм по отношению к флуоресцентным белкам с соответствующими хромофорами без мутаций; R2 = 0.8113.
ЗАКЛЮЧЕНИЕ
Методами молекулярного моделирования определены направления дипольных моментов переходов, соответствующих поглощению и флуоресценции белков на основе iLOV. Установлена зависимость между изменением значения заряда на атоме O4 хромофора в основном электронном состоянии и сдвигом вертикальной энергии перехода S0, min–S1 в случае добавления точечных мутаций в белковую макромолекулу.
Работа выполнена при финансовой поддержке Российским научным фондом (проект № 17-13-01051) с использованием оборудования Центра коллективного пользования сверхвысокопроизводительными вычислительными ресурсами МГУ им. М.В. Ломоносова.
Список литературы
Elgamoudi B.A., Ketley J.M. // Res. Microbiol. 2018. V.169. P. 108.
Losi A., Gardner K.H., Möglich A. // Chem. Rev. 2018. V. 118. P. 10659.
Chapman S., Faulkner C., Kaiserli E. et al. // Proc. Natl. Acad. Sci. U. S. A. 2008. V. 105. P. 20038.
Christie J.M., Hitomi K., Arvai A.S. et al. // J. Biol. Chem. 2012. V. 287. P. 22295.
Khrenova M.G., Meteleshko Y.I., Nemukhin A.V. // J. Phys. Chem. B. 2017. V. 121. P. 10018.
Meteleshko Y.I., Nemukhin A.V., Khrenova M.G. // Photochem. Photobiol. Sci. 2018; https://doi.org/10.1039/ c8pp00361k
Khrenova M.G., Nemukhin A.V., Domratcheva T. // J. Phys. Chem. B. 2015. V. 119. P. 5176.
Lakowicz J.R. Principles of Fluorescence Spectroscopy. 3rd ed. Berlin: Springer, 2006.
Adamo C., Barone V. // J. Chem. Phys. 1999. V. 110. P. 6158.
Grimme S., Antony J., Ehrlich S., Krieg H. // Ibid. 2010. V. 132. P. 154104.
Cornell W.D., Cieplak P., Bayly C.I. et al. // J. Amer. Chem. Soc. 1995. V. 117. P. 5179.
Valiev M., Bylaska E.J., Govind N. et al. // Comput. Phys. Comm. 2010. V. 181. P. 1477.
Granovsky A.A. // J. Chem. Phys. 2011. V. 134. P. 214113.
http://classic.chem.msu.su/gran/firefly/index.html
Schmidt M.W., Baldridge K.K., Boatz J.A. et al. // J. Comput. Chem. 1993. V. 14. P. 1347.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика