Химическая физика, 2019, T. 38, № 6, стр. 35-41
Переработка лигнина в энергоносители под действием электромагнитного излучения
П. А. Жарова 1, *, А. В. Чистяков 1, 2, С. В. Лесин 2, Г. И. Константинов 1, О. В. Арапова 1, М. В. Цодиков 1, 2
1 Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
Москва, Россия
2 Российский государственный университет нефти и газа им. И.М. Губкина
Москва, Россия
* E-mail: zharova@ips.ac.ru
Поступила в редакцию 30.11.2018
После доработки 17.01.2019
Принята к публикации 21.01.2019
Аннотация
В настоящей работе установлено, что нанесение солей железа (ацетилацетонат железа) на лигнин в крайне низких концентрациях, составляющих 0.1 мас.%, приводит к резкому увеличению поглощающей способности лигнином СВЧ-излучения при его мощности 1 кВт и превращению лигнина в водородсодержащий газ при степени извлечения водорода, достигающей 90% в расчете на водород, входящий в состав лигнина. Установлено, что нанесение металлов (Fe и Ni) на лигнин дает возможность направленно изменять селективность процесса его деструкции под воздействием СВЧ-излучения и, следовательно, классифицировать процесс как плазменно-каталитический. Полученные результаты позволяют минимизировать количество используемого катализатора и предложить эффективный путь производства водорода из отходов лигнина.
ВВЕДЕНИЕ
Одной из приоритетных задач в области нефтехимии и энергетики является разработка эффективных подходов к получению водорода и синтез-газа как наиболее экологически чистых энергоносителей. Переработка углеводородного сырья в водород и синтез-газ относится к стратегически важным промышленным производствам основных энергоносителей во всех развитых странах мира.
Лигнин – природный полимер, состоящий из фенилпропановых структур. Он является строительным материалом клеток и волокон растений. В древесине различных пород содержание лигнина варьируется от 20 до 40% [1]. Ежегодно за рубежом образуется порядка 70 млн т отходов лигнина, главным образом крафт-лигнина, являющегося побочным продуктом производства целлюлозы [2, 3]. Следует особо отметить, что серосодержащий лигнин (к которому относится крафт-лигнин) не поддается переработке, в результате чего накапливаются его значительные количества. Только на территории РФ накоплено более 95 млн т лигнина в качестве отходов ЦБК [3].
С точки зрения химической индустрии лигнин является перспективным сырьем для производства широкого ряда ароматических соединений, которые могут быть использованы в качестве компонентов топлив либо ценных химических соединений. В настоящее время разработка эффективной технологии переработки лигнина – одна из наиболее важных проблем, стоящих перед человечеством, с точки зрения устойчивого развития и глобальной экономики. Научным сообществом прорабатывается несколько основных каналов утилизации лигнина, таких как: пиролиз и газификация, направленные на получение водородсодержащего газа и биомасла, гидрогенолиз для производства индивидульных ароматических соединений и окисление, продуктами которого являются оксиды углерода, ароматические и алифатические спирты [4].
В рамках развития технологии пиролиза и газификации лигнина особое место занимает применение СВЧ-излучения, которое является источником энергии и одновременно инициирует поляризацию и переполяризацию функциональных групп молекул субстрата, что приводит к интенсификации разрыва полимерных структур лигнина [5]. Непосредственно лигнин имеет низкое значение тангенса угла диэлектрических потерь 0.15–0.25 и, как следствие, обладает крайне низкой способностью к поглощению СВЧ-излучения [6]. Вследствие этого для инициирования процесса крекинга лигнина необходимо применять излучение высокой мощности ~6 кВт [7] либо использовать катализаторы, обладающие способностью к поглощению волн СВЧ-диапозона [8–10]. В качестве таких материалов используются материалы на основе углерода [8] либо смешанных оксидов металлов [9, 10]. Недостатком используемых систем являются их сложность приготовления и высокое содержание в реакционной массе (20 мас.% и более), а также невозможность их регенерации в активное состояние [11].
В настоящей работе предложен способ модификации лигнина солями железа с целью увеличения его способности поглощать СВЧ-излучение. Проведен сравнительный анализ процесса конверсии лигнина под действием СВЧ-излучения с нанесенными частицами в случаях добавления углеродного поглотителя электромагнитных волн и конвективного нагрева.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве реагента использовали крафт-лигнин, полученный на Кировском деревоперерабатывающем заводе. Состав исходного лигнина, определенный с использованием С,Н,N,S-анализа на приборе C,H,N,S-OEA1108-ELEMENTAL ANALYZER с хроматографическим окончанием (хроматографическая фаза ПРОПА-Q-10, газ-носитель – He, детектор – катарометр), был следующим (мас.%): С – 58.1, H – 5.4, Al – 1.2, Si – 3.1, Ca – 0.6, Fe – 0.8, Mg – 0.04, S – 1.2, N – 0.2, O – 28.9, остальные – 0.5 (содержание каждого компонента менее 0.05%).
В качестве поглотителя СВЧ-излучения в реактор добавляли газовый уголь сферической формы (ГУС) с диаметром гранул 2–3 мм. Характеристики углеродного материала ГУС следующие: зольность (Аd) – 14%, общий объем пор (V∑) – 1.52 см3/г, объем сорбирующих пор (Vs) – 0.52 см3/г, объем макропор (Vma) – 1.00 см3/г.
Нанесение металлов на лигнин осуществляли методом пропитки по влагоемкости. В качестве исходных солей для нанесения использовали ацетат железа Fe(OAc)3 (Aldrich, 97%) и ацетат Ni(OAc)2 ⋅ 4H2O (Aldrich, 98%). Соли наносили из водных растворов, влагоемкость лигнина по воде составляла 4 см3/г. Влажный лигнин сушили на воздухе при комнатной температуре в течение 24 ч и в сушильном шкафу при температуре 110 °С в течение 2 ч.
Также методом пропитки были приготовлены комбинированные образцы, содержащие 1.5%Ni + + 0.5%Fe и 0.1%Fe + 1.5%Ni, в которых нанесение металлов проходило в две стадии. На первой стадии были нанесены 1.5%Ni и 0.1%Fe с последующей сушкой. На второй стадии на металлсодержащий лигнин наносились 0.5%Fe и 1.5%Ni, после чего образцы также подвергались сушке.
Фактическое содержание металла в приготовленных образцах определяли с помощью атомной абсорбционной спектрометрии (ААС) на спектрометре серии iCE 3000 фирмы “Thermo Scientific” (Швейцария). Относительная погрешность измерения содержания металлов методом ААС равна ±1%.
Опыты по конверсии лигнина проводились на установке по генерации СВЧ-излучения, представленной на рис. 1. В качестве источника СВЧ использовали применяющийся в бытовых микроволновых печах магнетрон М-140 мощностью 1 кВт, генерирующий излучение с частотой (2.45 ± ± 0.05) ГГц и плотностью тока 100–150 мА. Питание цепи анода магнетрона осуществляется с помощью однополупериодного выпрямителя с удвоением напряжения; блок питается от сети переменного тока напряжением 220 В (50 Гц). Напряжение на первичной обмотке высоковольтного трансформатора регулируется с помощью лабораторного автотрансформатора, что позволяет управлять уровнем генерируемой мощности в широких пределах. Мощность подаваемого излучения варьировали с помощью регулятора изменения плотности тока. В блоке питания магнетрона предусмотрено автоматическое выключение напряжения анода в случае отклонения от задаваемых принудительно режимов технологического процесса и самопроизвольного нарушения установленного режима питания магнетрона по цепи анода. Для измерения температуры реакционной зоны использовалась вольфрам-рениевая термопара, которая устанавливалась в карман реактора на полувысоте реакционной зоны. Индуцированная СВЧ температура при заданной плотности тока поддерживалась с помощью автоматического регулятора включения магнетрона.
Рис. 1.
Принципиальная схема установки по переработке лигнина под действием СВЧ-излучения: 1 – магнетрон и блок питания, 2 – волновод, 3 – поглощающая керамика, 4 – кварцевый реактор, 5 – термопара, 6 – камера поглощения остаточного СВЧ-излучения, 7 – охлаждаемый сепаратор, 8 – газовый хроматограф.
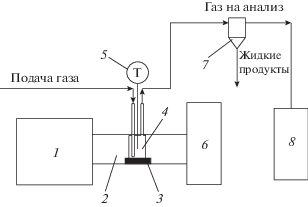
Для исследования реакции превращения лигнина был использован кварцевый реактор 4 (рис. 1) проточного типа объемом 15 см3, который был установлен на керамической подложке 3 по направлению движения электромагнитных волн, генерируемых магнетроном 1. На выходе из реактора остаточное излучение поглощалось водой в камере 6. В типовом эксперименте в нижнюю часть реактора с образцами лигнина подавали CO2 со скоростью 60 см3/мин при индуцированной температуре 700–750 °С. При достижении рабочего режима начинался отбор продуктов разложения, продолжавшийся до окончания опыта. Время экспозиции в рабочем режиме во всех экспериментах составляло 10 мин.
Для сравнения эффективностей воздействия СВЧ и традиционного термического нагрева использовали установку, снабженную печью конвективного нагрева. Схема установки представлена на рис. 2.
Рис. 2.
Схема экспериментальной установки конвективного нагрева: 1 – радиальная печь конвективного нагрева, 2 – кварцевый реактор, 3 – регулятор температуры, 4 – охлаждаемый сепаратор, 5 – хроматограф.
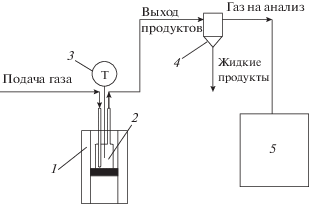
Опыты по конверсии лигнина при конвективном нагреве проводились в кварцевом реакторе, который помещали в печь, нагретую до 750 или 800 °С при подаче СО2 с расходом 60 см3/мин и выдерживали режим в течение 15 мин. Газообразные продукты реакции анализировали методом газовой хроматографии в режиме “on-line”.
Количественный анализ углеводородных газов С1–С5 проводили на хроматографе Кристалл-4000 (детектор – ПИД, расход газа-носителя He – 70 см3/мин, температура термостата – 120 °С, давление – 1.65 МПа, хроматографическая колонка HP-PLOT/AI2O3 – 50 м × 0.32 мм). Количественный анализ СО, СО2 и Н2 проводили на хроматографе Кристаллюкс-4000 М (детектор – ДТП, расход газа-носителя Ar (ОСЧ) – 30 мл/мин, колонка СКТ – 150 × 0.4 см, температура термостата – 130 °С). Количественный состав жидких органических продуктов реакции определяли методом газо-жидкостной хроматографии на Varian 3600 (колонка: Хромтэк SE-30 – 0.25 мм × 25 м, Df = 0.3 мкм, температурный режим – 50 °С (5 мин), 10 °/мин, 280 °С).
Изучение состава смеси жидких продуктов реакции проводили на хромато-масс-спектрометре Thermo Focus DSQ II (капиллярная колонка Varian VF-5ms, длина – 30 м, внутренний диаметр – 0.25 мм, толщина фазы – 0.25, энергия ионизации – 70 эВ, температура источника – 230 °С, сканирование в диапазоне 10–400 Да со скоростью 2 скан/с, разрешение единичное по всему диапазону масс). Для идентификации компонентов использовали референсные масс-спектры, представленные в базе данных NIST/EPA/NIH 17.
Для оценки параметров конверсии при СВЧ-излучении использовали приведенные ниже формулы.
Конверсия органической части лигнина (%)
Конверсия лигнина по водороду (%)
Селективность по синтез-газу (%)
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
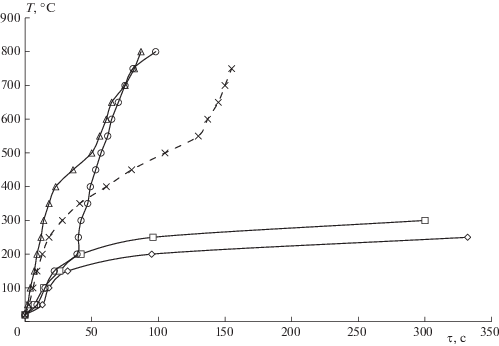
Динамика нагрева различных образцов, подвергнутых СВЧ-излучению, представлена на рис. 3. Как видно из этого рисунка, исходный лигнин не обладает достаточным уровнем поглощения СВЧ-излучения, в связи с чем его превращение осуществляли в смеси с углеродным адсорбентом.
Рис 3.
Динамика нагрева образцов лигнина: ◇ – лигнин, ◻ – лингин + 1.45%Ni, × – лигнин + сорбет + 1.45%Ni, ⚪ – лигнин + 0.1%Fe, △ – лигнин + 0.1%Fe + 1.45%Ni.
В атмосфере углекислого газа немодифицированный лигнин в присутствии углеродного материала ГУС при СВЧ-облучении превращается во фракции жидких углеводородов и воды, газообразных продуктов и твердого остатка. Как показали данные хромато-масс-спектрометрии и ИК-спектроскопии, фракция жидких углеводородов состоит преимущественно из фенильных, гваяцильных и ванилиновых производных, что наблюдается в большинстве работ по деструкции лигнина [12]. Газообразные продукты представлены главным образом водородом и монооксидом углерода, селективность образования которых составляет 36.8%, а также легкими углеводородами С1–С4 (табл. 1).
Таблица 1.
Материальный баланс конверсии лигнина
| № опыта | Доля активных компонентов, мас.% | Газовая среда | Жидкий продукт, мас.% | Газообразные продукты, мас.% | Твердый остаток, мас.% | Степень извлечения водорода, % | H2/CO |
|---|---|---|---|---|---|---|---|
| Лигнин + ГУС, СВЧ-воздействие | |||||||
| 1 | 0 | СО2 | 22.1 | 23.5 | 54.4 | 75.5 | 0.6 |
| 2 | 0 | Ar | 41.7 | 13.3 | 45.0 | 77.1 | 1.4 |
| Лигнин + катализатор + ГУС, СВЧ-воздействие | |||||||
| 3 | 1.45Ni | СО2 | 8.3 | 48.5 | 43.1 | 85.6 | 1.0 |
| 4 | 1.45Ni | Ar | 37.4 | 14.3 | 48.3 | 82.3 | 0.8 |
| Лигнин + катализатор, СВЧ-воздействие | |||||||
| 5 | 0.1Fe | Ar | 3.2 | 56.8 | 40.0 | 88.6 | 0.9 |
| 6 | 0.1Fe | СО2 | 3.5 | 54.2 | 42.3 | 87.7 | 0.8 |
| 7 | 0.Fe + 1.5Ni | СО2 | 3.3 | 56.4 | 40.3 | 90.0 | 0.8 |
| Конвективный нагрев | |||||||
| 8 | 0 | СО2 | 38.9 | 19.3 | 41.8 | 83.5 | 0.2 |
| 9 | 1.5Ni | СО2 | 39.9 | 16.3 | 43.9 | 86.6 | 0.5 |
Твердый остаток согласно данным ИК- и КР-спектроскопии представляет собой несовершенные графитоподобные и полифениленоксидные структуры. Степень извлечения водорода составляет 75.5%, при этом мольное отношение Н2/СО равно 0.6. Замена газовой среды диоксида углерода на аргон приводит к увеличению выхода жидких продуктов с 22.1 до 41.7% и уменьшению выхода газообразных продуктов на 10%. При воздействии СВЧ-излучения на механическую смесь лигнина с углеродным сорбентом плазма зажигается в порах сорбента, откуда тепловая энергия распространяется на весь объем реактора. Фактически при такой организации процесса лигнин превращается при средней температуре реактора, составляющей 700–750 °С, что аналогично организации процесса в режиме конвективного нагрева.
Нанесение на лигнин ацетата никеля не привело к увеличению его поглощающей способности СВЧ-излучения, поэтому для проведения экспериментов к лигнину был добавлен углеродный сорбент (опыты №№ 3, 4). Нанесение никеля увеличивает степень извлечения водорода до 82–86%; при этом наблюдается резкое изменение селективности процесса при использовании в качестве газовой среды диоксида углерода или аргона. В среде аргона выходы жидких и газообразных продуктов идентичны полученным при деструкции немодифицированного лигнина в среде аргона. При использовании в качестве газа-элюента диоксида углерода наблюдаются резкое уменьшение выхода жидких продуктов до 8.3% и увеличение селективности образования синтез-газа до 73% при мольном отношении водорода к оксиду углерода, равном единице. Наблюдаемое увеличение выхода водородсодержащего газа, вероятно, объясняется каталитическим действием никеля, который интенсифицирует процесс взаимодействия лигнина и жидких продуктов его деструкции (гваяцильных, фенильных и ванилиновых производных) с диоксидом углерода, что и приводит к увеличению выхода синтез-газа.
Нанесение небольшого количества железа (0.1 мас.%) на лигнин привело к резкому росту его поглощающей способности СВЧ-излучения, что видно из кривых скорости роста температуры (рис. 3) и превращения лигнина в отсутствие углеродного материала. Модифицирование лигнина железом при СВЧ-излучении приводит к уменьшению выхода фракции жидких углеводородов до 3% и увеличению выхода газообразных продуктов (табл. 1, 2). Выходы жидких и газообразных продуктов, полученные в ходе деструкции лигнина, модифицированного железом, в среде аргона и диоксида углерода, идентичны, что свидетельствует о высокой интенсивности процесса при инициировании плазмы непосредственно в теле лигнина. Однако по сравнению с аргоном в среде диоксида углерода наблюдаются увеличение селективности образования синтез-газа с 64 до 72% и пропорциональное уменьшение селективности образования легких углеводородов. То есть легкие углеводороды подвергаются фактически углекислотному риформингу в условиях эксперимента.
Таблица 2.
Состав газообразных продуктов конверсии лигнина
| № опыта | Активный компонент, мас.% | Среда | Состав газообразных продуктов, мольн.% | |||
|---|---|---|---|---|---|---|
| Н2 | СО | СН4 | С2–С4 | |||
| Лигнин + ГУС, СВЧ-воздействие | ||||||
| 1 | 0 | СО2 | 26.2 | 46.3 | 23.9 | 3.5 |
| 2 | 0 | Ar | 50.8 | 27.8 | 19.6 | 1.8 |
| Лигнин + катализатор + ГУС, СВЧ-воздействие | ||||||
| 3 | 1.45 | СО2 | 43.4 | 45.0 | 10.3 | 1.4 |
| 4 | 1.45 | Ar | 42.9 | 32.9 | 21.4 | 2.7 |
| Лигнин + катализатор, СВЧ-воздействие | ||||||
| 6 | 0.1Fe | Ar | 35.4 | 39.5 | 19.0 | 6.0 |
| 5 | 0.1Fe | СО2 | 35.4 | 45.6 | 15.3 | 3.8 |
| 7 | 0.1Fe + 1.5Ni | СО2 | 39.9 | 51.1 | 7.7 | 1.3 |
| Конвективный нагрев | ||||||
| 8 | 0 | СО2 | 12.3 | 56.4 | 28.4 | 3.0 |
| 9 | 1.5Ni | СО2 | 25.5 | 49.1 | 23.0 | 2.4 |
С целью увеличения глубины переработки лигнина и степени извлечения водорода был использован комбинированный способ: на лигнин, содержащий 0.1% железа, было нанесено 1.45 мас.% никеля. Каталитические тесты показали увеличение степени извлечения водорода до 90%, выхода водорода – до 22.5 мас.% и соотношения Н2/СО – до единицы. Выход твердого остатка остался практически неизменным (табл. 1).
При модифицировании лигнина железом последний начинает поглощать СВЧ-излучение, и плазма зарождается непосредственно в теле лигнина, т.е. эффект от СВЧ-облучения становится максимальным. Можно предположить, что на никель- и железосодержащих центрах подвергаются риформингу концевые метоксигруппы и образующиеся из лигнина газообразные органические молекулы, идентифицированные при конвективном нагреве. При этом возрастание степени конверсии и выхода синтез-газа в присутствии никельсодержащих центров в среде СО2 по сравнению с показателями, полученными при генерировании плазмы на немодифицированном лигнине, а также на лигнине, модифицированном никелем, в среде Ar, указывают на плазменно-каталитический характер протекания углекислотного риформинга.
Сравнение степеней конверсии модифицированного и исходного лигнина в условиях СВЧ-стимулирования и конвективного нагрева показывает, что выход твердого остатка в обоих случаях практически неизменен, т.е. глубина переработки лигнина не зависит от механизма передачи энергии. Однако наблюдается существенное изменение селективности образования жидких и газообразных продуктов. При конвективном нагреве выход жидких органических продуктов увеличивается до 40%. Последние, так же как и в случае СВЧ-воздействия, представлены фенильными, гваяцильными и ванилиновыми производными [13]. Выход водорода для модифицированного Ni и исходного лигнина составляет 4.2 и 2.4 мас.% соответственно. При конвективном нагреве выход СО для исходного лигнина и лигнина, модифицированного никелем, составляет 8–11 мас.%, что соответствует выходу оксида углерода при конверсии немодифицированного лигнина в условиях СВЧ-стимулирования. Стоит заметить, что нанесение на лигнин никеля или железа в условиях СВЧ-облучения приводит к резкому росту выхода СО до 20–30 мас.%, по всей вероятности, в результате интенсификации взаимодействия углекислоты с продуктами дегидрирования лигнина. Полученный результат указывает на плазменно-каталитический характер протекания углекислотного риформинга лигнина при СВЧ-облучении.
Таким образом, полученные экспериментальные данные показывают, что роль углеродного материала ГУС заключается в преобразовании энергии электромагнитных волн в тепловую энергию (табл. 1, 2, опыты №№ 1, 2, 8). Плазма зажигается внутри сорбента, а следовательно, внутри сорбента возникают горячие точки (локальный перегрев). От горячих точек тепло распространяется на весь объем реактора, т.е. лигнин фактически превращается при средней температуре реактора 700 °С. При этой температуре эндотермическая реакция Будуара
протекает медленно (опыт № 2). При введении в систему “внешнего” СО2 (опыт № 1), вероятно, сдвигается равновесие в сторону образования СО. Выход СО увеличивается с 3 до 11% при Т = = const в среде аргона и углекислого газа соответственно.
Состав и количество полученных продуктов при конверсии немодифицированного лигнина в смеси с ГУС идентичны полученным в ходе конвективного нагрева (опыт № 8). То есть вероятная природа и движущая сила химических процессов одинаковы.
При нанесении на лигнин никеля (опыты №№ 3, 4, 9) в ходе его конверсии образуется углеродный остаток, обогащенный металлом. Никель на остаточном углероде понижает энергию активации реакции Будуара, что не влияет на положение равновесия, но приводит к его скорейшему достижению. Поэтому при нанесении никеля на лигнин в среде аргона наблюдается незначительное увеличение выхода СО, а в среде СО2 выход увеличивается в разы. Разница в выходе СО для опытов № 3 и № 9 обусловлена, вероятно, тем, что в условиях СВЧ-излучения и конвективного нагрева температурный градиент в реакторе различный. То есть при внесении катализатора температурные колебания в небольшом диапазоне оказывают значительно большее влияние на выход продуктов, чем в некаталитическом эксперименте.
Нанесение железа инициирует зарождение плазмы в объеме лигнина (опыты №№ 5, 6, 7). То есть внутри субстрата температура значительно превосходит температуру, определяемую в реакторе. Увеличение температуры приводит к смещению равновесия реакции Будуара в сторону образования СО. Сравнение опытов № 5 и № 6 показывает, что выход СО в них примерно равный, так как монооксид углерода образуется главным образом за счет кислорода, входящего в структуру лигнина, и лишь немного (на ~2%) – за счет подаваемого в реактор диоксида углерода. При внесении никеля (эксп. 7) выход СО увеличивается еще на 4%, вероятно, за счет каталитического действия никеля. Можно даже предположить, что в условиях реакции выход СО, равный 29% (опыт № 7), близок к равновесному.
ЗАКЛЮЧЕНИЕ
Как было показано в работах [14–16], при СВЧ-воздействии, приводящем к генерированию плазмы, доминирует разрыв С–Н-связи органических субстратов, что полностью подтверждается и в случае лигнина. Этим объясняется возрастание селективности в образовании водородсодержащего газа. Таким образом, главное различие режимов конвективного нагрева и СВЧ-воздействия заключается в изменении селективности процесса, которая может быть направлена в сторону образования жидких органических субстратов при конвективном нагреве и в сторону образования водородсодержащего газа в случае СВЧ-воздействия.
Никель катализирует реакцию Будуара с участием поверхностного углерода лигнина, образуемого в ходе его дегидрирования, что, в свою очередь, приводит к увеличению выхода оксида углерода и снятию диффузионных затруднений на пути ионизированного газа к непрореагировавшему остатку лигнина. При нанесении железа на лигнин меняется химизм деструкции лигнина – увеличивается степень извлечения водорода, образование СО происходит за счет внутреннего (своего) кислорода лигнина, а не за счет вводимого СО2. Причина этого – зарождение плазмы и образование горячих точек происходит в теле лигнина, поэтому истинная температура его деструкции выше, чем при использовании сорбента, где плазма зарождается в теле сорбента.
Работа выполнена при финансовой поддержке Министерством науки и высшего образования Российской Федерации проектной части государственного задания (соглашение о предоставлении субсидии № 14.613.21.0073 от 23.10.2017, уникальный номер: RFMEFI61317X0073).
Список литературы
Rowell R.M., Pettersen R., Han J.S. et al. Handbook of wood chemistry and wood composites. Boca Raton. Fla.: CRC Press, 2005. P. 9.
Liu W.-J., Jiang H., Yu H.-Q. // Green Chem. 2015. V. 17. P. 4888.
Rabinovich M.L. // Proc. 2nd Nordic Wood Biorefinery Conference. Helsinki, Finland, 2009. P. 111.
Hu T.Q. Chemical Modification, properties, and usage of lignin. N.Y.: Springer, 2002.
Цодиков М.В., Передерий М.А., Карасева М.С. и др. // Рос. нанотехнологии. 2007.Т. 1. № 1–2. С. 153.
Buttress A.J., Binner E.P., Palade C.Y. et al. // Chem. Eng. J. 2016. V. 283. P. 215.
Robinson J., Dodds C., Stavrinides A. et al. // Energy Fuels. 2015. V. 29. P. 1701.
Bu Q., Lei H., Wang L. et al. // Bioresour. Technol. 2014. V. 162. P. 142.
Fan L., Chen P., Zhang Y. et al. // Ibid. 2017. V. 225. P. 199.
Liu S., Xie Q., Zhang B. et al. // Ibid. 2016. V. 204. P. 164.
Yunpu W., Leilei D., Liangliang F. et al. // J. Anal. Appl. Pyrolysis. 2016. V. 119 P. 104.
Mushtaq F., Mat R., Ani F.N. // Renew. Sust. Energ. Rev. 2014. V. 39. P. 555.
Collard F.X., Blin J. // Ibid. 2014. V. 38. P. 594.
Арапова О.В., Бондаренко Г.Н., Чистяков А.В. и др. // ЖФХ. 2017. № 9. С. 1520.
Цодиков М.В., Передерий М.А., Чистяков А.В. и др. // Химия твердого топлива. 2012. № 2. С. 55.
Цодиков М.В., Передерий М.А., Карасева М.С. и др. // Наукоемкие технологии. 2007. Т. 8. № 4. С. 58.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


