Химическая физика, 2019, T. 38, № 6, стр. 8-14
Исследование морфологических изменений клеток злокачественных новообразований при фотодинамическом воздействии методами цифровой голографической микроскопии
А. А. Жихорева 1, А. В. Белашов 1, *, Д. А. Горбенко 1, Н. А. Авдонкина 2, И. А. Балдуева 2, А. Б. Данилова 2, М. Л. Гельфонд 2, Т. Л. Нехаева 2, И. В. Семёнова 1, О. С. Васютинский 1
1 Физико-технический институт им. А.Ф. Иоффе Российской академии наук
Санкт-Петербург, Россия
2 Национальный медицинский исследовательский центр им. Н.Н. Петрова Минздрава России
Санкт-Петербург, Россия
* E-mail: belashov.andrey.93@gmail.com
Поступила в редакцию 19.11.2018
После доработки 06.12.2018
Принята к публикации 21.01.2019
Аннотация
Статья посвящена исследованию процессов гибели живых клеток и изменению их оптических и морфологических характеристик в результате фотодинамического воздействия, сопровождающегося внутриклеточной генерацией синглетного кислорода. Исследована реакция клеток рака почки, остеогенной саркомы и меланомы кожи на фотодинамическое воздействие. Продемонстрировано изменение их высоты, распределения показателя преломления и среднего фазового набега. Показано, что при дозе облучения 42 Дж происходит некроз клеток рака почки и остеогенной саркомы, в то время как существенных оптических и морфологических изменений в клетках меланомы кожи не наблюдается.
ВВЕДЕНИЕ
Рост заболеваемости злокачественными опухолями и большая частота рецидивов – важнейшие проблемы современной онкологии, которые определяют важность совершенствования методов лечения пациентов с данной патологией. Перспективным является использование фотодинамической терапии (ФДТ), действие которой основано на физико-химических свойствах фотосенсибилизаторов (ФС), способных селективно накапливаться в патологически измененных тканях с повышенным метаболизмом [1] и активироваться путем локального облучения светом с длиной волны, соответствующей пику поглощения молекул ФС. Эта активация вызывает генерацию синглетного (первого возбужденного состояния a1Δg молекулы O2) и других активных форм кислорода, губительно действующих на опухолевые клетки, что приводит к резорбции опухоли и абластике в ложе опухолевого очага [2, 3]. В настоящее время ФДТ активно используется в клинической практике как в качестве основного метода лечения, так и в комбинации с другими методами лечения злокачественных новообразований различных локализаций. В частности, в ряде работ было показано [4–6], что данный подход позволяет проводить эффективное лечение рака шейки матки, пищевода, трахеи и других видов злокачественных опухолей.
К настоящему времени разработано большое количество фотосенсибилизаторов (см., например, [7–10]) и проведены детальные исследования их физических и химических свойств, наиболее важными из которых являются квантовый выход генерации активных форм кислорода, спектр поглощения, стабильность при световом облучении, темновая фототоксичность, скорость элиминации из организма, а также область их внутриклеточной локализации [11–13]. Анализ эффективности ФС для ФДТ обычно включает в себя четыре этапа: 1) исследование фотофизических свойств ФС в растворах; 2) изучение реакции злокачественных клеток на фотодинамическое воздействие (ФДВ) с этими ФС in vitro и 3) in vivo; 4) проведение клинических исследований их эффективности при ФДТ.
С точки зрения современных исследований реакции клеток на ФДВ важно не только определять дозы и режимы воздействия, при которых происходит гибель клеток, но и надежно разделять механизмы их гибели. Как известно, некроз характеризуется разрушением органелл и плазматической мембраны, что приводит к попаданию внутриклеточного содержимого в межклеточное пространство и возникновению воспалительных процессов. Апоптоз характеризуется округлением клеток, более плотной упаковкой цитоплазмы и органелл, за которыми следуют интенсивное появление пузырьков на плазматической мембране (блеббинг) и образование отдельных апоптотических тел, которые in vivo фагоцитируются макрофагами или соседними нормальными клетками [14, 15].
Дифференциальная диагностика апоптоза или некроза клеток обычно осуществляется путем оценки целостности клеточной мембраны с использованием стандартных флуоресцентных красителей и посредством анализа на конфокальном флуоресцентном микроскопе. Другие подходы основаны на определении морфологических изменений клеток с помощью проточной цитометрии, оптической или электронной микроскопии (TEM) [14]. Однако большинство из используемых методов (TEM-микроскопия, проточная цитометрия) не позволяют оценивать изменения морфологии клеток в динамике, а предоставляют информацию о состоянии клетки в определенный момент времени. Флуоресцентные же методы оперируют со специальными флуоресцентными зондами, которые могут изменять клеточные характеристики.
Оптические методы, основанные на регистрации изменений фазы просвечивающего клетки излучения, являются невозмущающими и позволяют оценивать изменения клеточной структуры в динамике. Самый старый метод из этой группы – фазово-контрастная микроскопия (ФКМ) по-прежнему широко применяется в исследованиях. Этот метод позволяет получать изображения клеток без какого-либо окрашивания с существенно более высоким контрастом, чем обычная световая микроскопия. Однако количественные оценки клеточной морфологии при использовании ФКМ проблематичны.
Существенно более информативными являются методы количественной фазовой микроскопии (quantitative phase imaging), в частности цифровая голография, которые уже хорошо себя зарекомендовали при исследовании различных процессов на клеточном уровне (см., например, [16–24]). В отличие от методов флуоресцентной микроскопии с использованием красителей цифровая голографическая микроскопия и томография не требуют какой-либо подготовки образцов. Они позволяют исследовать клетки на основе изменений пространственного распределения показателя преломления, которые содержат в себе количественную информацию о важных клеточных характеристиках и распределениях структурных клеточных элементов, часть из которых невозможно определить, исследуя изменения показателя поглощения. В частности, методами цифровой голографической микроскопии и томографии можно определить форму клеток, их толщину, объем, сухую массу, площадь проекции, площадь поверхности мембраны, двумерное (2D) и трехмерное (3D) распределение показателя преломления [23, 24]. Важным преимуществом этих методов является работа с оригинальными образцами без использования каких-либо дополнительных красителей или химических агентов. Также голографические методы дают возможность проведения наблюдений в динамике в течение длительного времени, вплоть до нескольких часов или даже суток. Основные ограничения данного подхода – его высокая чувствительность к вибрациям оптической установки и использование когерентного излучения, которое приводит к формированию когерентного шума, иногда препятствующему качественному восстановлению фазового распределения.
В наших предыдущих работах [17, 25–27] были проведены исследования реакции клеток постоянных клеточных линий HeLa и A549 на ФДВ с использованием коммерческого фотосенсибилизатора хлоринового ряда Радахлорина. Было показано, что при увеличении дозы облучения последовательно реализуются разные механизмы гибели клеток: апоптоз, вторичный некроз, некроз. При этом при сохранении этой последовательности опухолевые клетки различных нозологических форм демонстрировали существенно разный отклик на ФДВ при одних и тех же дозах облучения светом.
Эти исследования, проведенные на традиционных лабораторных клеточных линиях, позволили перейти к исследованиям на культурах малигнизированных клеток, полученных от конкретных пациентов. В настоящей работе была проанализирована эффективность фотодинамического воздействия на клетки солидных опухолей: рака почки, остеогенной саркомы и меланомы кожи.
МЕТОДИКА ИССЛЕДОВАНИЯ
Выбор локализаций злокачественных новообразований – рака почки, остеогенной саркомы и меланомы определяется актуальностью поиска новых подходов к лечению этих онкологических заболеваний, отличающихся агрессивным течением, частым рецидивированием и развитием метастатической болезни. Материалом для приготовления клеточных культур служили фрагменты опухолевой ткани, полученные хирургическим путем у пациентов, проходивших лечение в НМИЦ онкологии им. Петрова. После механической дезагрегации тканевых образцов в Медимашине (Dako, Дания) клеточную суспензию пропускали последовательно через систему фильтров Filcon с размером пор 70 и 50 мкм (BD Bioscience, USA), после чего помещали ее в питательную среду DMEM/F12 с 20% телячьей эмбриональной сыворотки, содержащей глутамин (365 мг/л), инсулин (5 мкг/мл), трасферрин (5 мкг/мл), селен (5 нг/мл) (Invirtrogen, USA), пенициллин (100 eд./мл), стрептомицин (100 мкг/мл) (Sigma, USA), и непрерывно культивировали в газовой смеси 95% воздуха и 5% CO2, 100%-ной влажности во флаконах по методу Freshney [28]. После достижения монослоя клетки пересевали, используя раствор, содержащий равные доли (0.25%) трипсина и версена (Биолот, Россия). Культивировали клетки непрерывно не менее 10 пассажей.
На полученных клеточных культурах в экспериментах in vitro моделировали процесс фотодинамической терапии. В качестве ФС использовали Радахлорин, фотофизические свойства которого были детально исследованы нами ранее [29–31]. Фотосенсибилизатор в концентрации 12.25 мкг/мл добавляли непосредственно в чашки Петри с исследуемыми культурами клеток в культуральной среде DMEM. Далее клетки инкубировали в этом растворе в течение 2 ч при постоянной температуре 37 °С. Накопление ФС в клетках происходило за счет диффузии. По истечении 2 ч заменяли культуральную среду с ФС на чистую. Возбуждение молекул ФС осуществляли при облучении непрерывным лазерным излучением на длине волны 660 нм, соответствующей максимуму длинноволновой полосы поглощения Радахлорина, с плотностью мощности 100 мВт/см2 в течение 7 мин.
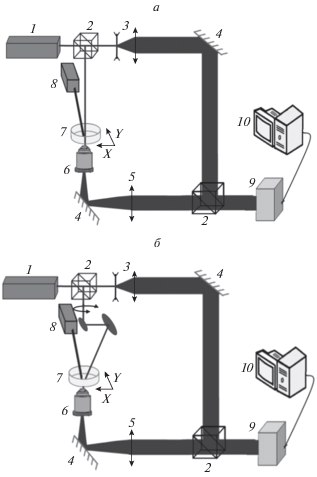
Исследование морфологических параметров клеток in vitro проводили с использованием инвертированного голографического микроскопа, построенного по схеме интерферометра Маха–Цандера, схема которого представлена на рис. 1а. Как показано на этом рисунке, предметный пучок проходит через исследуемые клеточные структуры, которые вносят сдвиг в фазу распространяющейся волны, а интерференционная картина опорного и предметного пучков регистрируется с помощью цифровой камеры. Численная обработка полученной голограммы позволяла получить данные о фазовом набеге, который пропорционален показателю преломления клеточных структур и их толщине. Анализ распределений фазового сдвига волнового фронта позволяет исследовать оптические и морфологические параметры клеток и динамику их изменения.
Рис. 1.
Оптические схемы цифрового голографического микроскопа (а) и голографического томографического микроскопа (б): 1 – лазер, 2 – делители пучка, 3 – телескопическая система, 4 – зеркала, 5 – линза, 6 – объектив, 7 – образец, 8 – лазер для ФДВ, 9 – цифровая камера, 10 – компьютер.
Как известно, при распространении световой волны из среды с показателем преломления n1 в образце с показателем преломления n2 и толщиной l фаза волны приобретает сдвиг, равный
где $\lambda $ – длина волны.Таким образом, распределение фазы в предметном пучке при прохождении через клеточные структуры изменяется согласно выражению (1). Для численных оценок оптической толщины клеток часто используют величину среднего фазового сдвига Δφ, представляющую собой фазовый сдвиг, усредненный по площади проекции клетки [17, 32]. Как было показано нами ранее [17, 25], этот параметр позволяет судить о механизме гибели клеток и скорости протекания клеточной смерти. Так, при гибели клеток путем некроза, протекающего с разрывом плазматической мембраны и вытеканием внутриклеточной среды наружу, происходит уменьшение толщины и интегрального показателя преломления клетки. Такие клеточные изменения приводят к значительному уменьшению среднего фазового сдвига, причем скорость спада пропорциональна скорости протекания некротических процессов [17]. Апоптоз, наоборот, протекает с увеличением среднего фазового сдвига [25–27].
Анализ среднего фазового сдвига позволяет также судить о динамике изменения сухой массы клеточных структур. Как было показано в работе [33], фазовый сдвиг в живой клетке напрямую зависит от ее сухой массы – массы обезвоженной клетки (DM), которая может быть оценена с помощью следующего выражения:
где $\alpha = {{\left( {{{\mu }_{p}} - {{\mu }_{s}}} \right)c} \mathord{\left/ {\vphantom {{\left( {{{\mu }_{p}} - {{\mu }_{s}}} \right)c} C}} \right. \kern-0em} C},$ ${{\mu }_{p}}$ – показатель преломления белковых компонентов, ${{\mu }_{s}}$ – показатель преломления растворителя, $C$ – количество сухой массы белков на 100 мл растворителя, ${{S}_{c}}$ – площадь проекции клетки. Анализируя динамику изменения сухой массы, можно судить о механизме клеточной гибели. Так, некроз протекает с выходом содержимого клетки наружу и, соответственно, с уменьшением сухой массы, а при апоптозе сухая масса клетки не изменяется.Существенным развитием метода цифровой голографической микроскопии является голографическая томография, позволяющая получать трехмерные распределения показателя преломления клеточных структур и определять такие важные характеристики клеток, как объем, площадь поверхности, площадь проекции и сухая масса. В наших исследованиях использовался голографический томографический микроскоп 3D Cell Explorer (Nanolive), базовая схема которого приведена на рис. 1б. Томографический микроскоп представляет собой инвертированный голографический микроскоп, в котором предметный пучок падает под углом к плоскости образца. В ходе эксперимента изменение угла падения происходит с фиксированным шагом, при этом на каждом шаге регистрируется голограмма. Численная обработка массива экспериментальный данных, основанная на трехмерном фурье-преобразовании и теореме о центральном сечении, позволяет получить трехмерное распределение показателя преломления клеток и клеточных структур [34]. На основе полученных распределений показателя преломления реконструируется поверхность клетки и определяются другие ее характеристики.
В наших экспериментах образцы клеточных культур инкубировали в растворе ФС, затем проводили регистрацию контрольных изображений фазового сдвига клеток и трехмерных распределений показателя преломления. После этого осуществляли облучение клеток с последующим наблюдением динамики изменения их характеристик в течение 90 мин на основе серии голограмм и/или голографических томограмм образцов, которые снимали с шагом в 15 мин. Сканирование образцов позволило получить данные по 30–50 клеткам. После обработки полученных голограмм определяли основные характеристики клеток до и после фотодинамического воздействия.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Обработка экспериментальных данных позволила определить динамику изменения среднего фазового сдвига, сухой массы, средней высоты клетки и распределения показателя преломления в клетках трех нозологических форм опухолей. На рис. 2 представлены статистические данные по среднему фазовому сдвигу в исследуемых клеточных культурах до ФДВ и через 1 ч после него. Сравнение выборок среднего фазового сдвига клеток до и после ФДВ проводили с помощью статистического теста Манна–Уитни с уровнем значимости p ≤ 0.01. Как видно из рис. 2, средний фазовый сдвиг клеток рака почки и остеогенной саркомы статистически уменьшается после ФДВ. Различие в фазовом сдвиге для клеток меланомы человека до и через 1 ч после терапии оказалось статистически недостоверным.
Рис. 2.
Графики распределения среднего фазового сдвига до и через 1 ч после ФДВ для клеток: а – рака почки, б – меланомы кожи, в – остеогенной саркомы. Звездочка соответствует доверительной вероятности <5%.
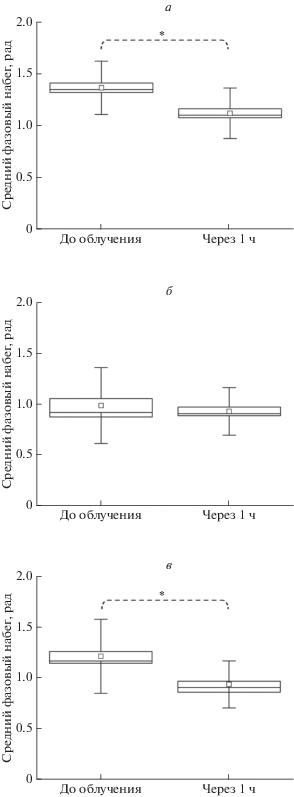
Как было сказано ранее, значительное уменьшение среднего фазового сдвига характерно для гибели клеток путем некроза. Таким образом, можно сделать вывод, что в наших экспериментальных условиях клетки рака почки и остеосаркомы гибнут путем некроза. Отсутствие изменений клеток меланомы кожи свидетельствует о большей резистентности этой опухоли к ФДВ.
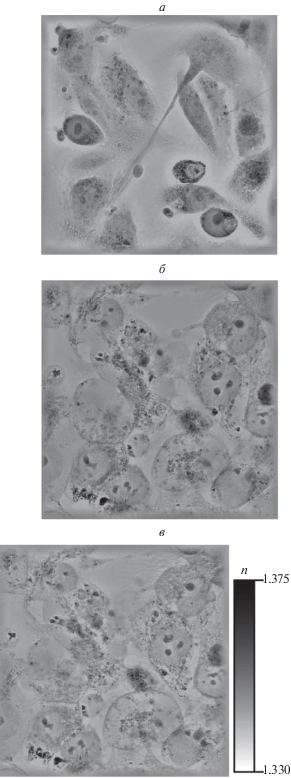
Более детальные исследования изменения клеток после ФДВ проводились на образцах рака почки. Использование голографического томографического микроскопа позволило отследить динамику изменения распределения показателя преломления, средней высоты и сухой массы клеток рака почки. На рис. 3 представлены z-срезы распределения показателя преломления группы клеток до ФДВ и спустя 15 и 30 мин после него. На этом рисунке хорошо видно образование пузырей на плазматической мембране и вытекание внутриклеточной среды наружу после ФДВ, что характерно для гибели клеток путем некроза.
Рис. 3.
Распределение показателя преломления n в клетках рака почки: а – до ФДВ, б – через 15 и в – через 30 мин после ФДВ.
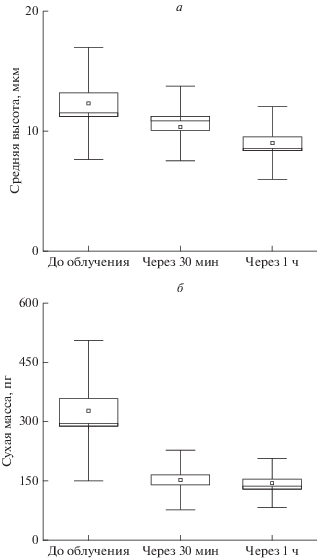
В ходе эксперимента были получены и усреднены по данным для 30–50 клеток значения сухой массы, реконструированы трехмерные поверхности клеток рака почки и рассчитана средняя высота клеток до и после ФДВ (рис. 4). Как видно, средняя высота и сухая масса клетки уменьшаются в течение 1 ч после ФДВ, что также подтверждает гибель клетки путем некроза, сопровождающегося разрывом мембраны и вытеканием внутриклеточной среды в межклеточное пространство.
Рис. 4.
Средняя высота (а) и сухая масса (б) клеток рака почки до ФДВ, через 30 мин и через 1 ч после ФДВ.
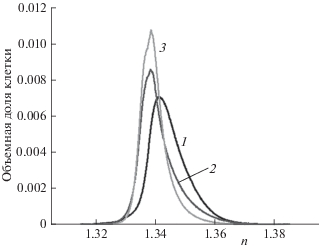
На рис. 5 представлены огибающие гистограмм распределения показателя преломления внутри клетки до ФДВ и через 30 и 60 мин после него. Как видно, распределение показателя преломления клетки сдвигается в сторону уменьшения после ФДВ. Изменение показателя преломления может быть связано с трансформацией внутриклеточных структур и изменением оптических свойств клеток при их гибели путем некроза.
ВЫВОДЫ
Таким образом, показано, что при одинаковой дозе фотодинамического воздействия изменения среднего фазового сдвига регистрирующего волнового фронта в клетках рака почки, остеогенной саркомы и меланомы существенно различны. При этом уменьшение фазового сдвига в клетках рака почки и остеогенной саркомы статистически доказано, что может ассоциироваться с гибелью клеток посредством некроза. Отсутствие изменений клеток меланомы свидетельствует о большей резистентности этого вида рака к фотодинамической терапии.
Было показано, что использование цифровой голографической микроскопии позволяет оценить эффективность фотодинамического воздействия на клетки злокачественных опухолей человека путем анализа динамики среднего фазового набега. Исследование дополнительных морфологических и оптических параметров клеток рака почки методом голографической томографии показало, что при используемой дозе происходит фотохимически опосредованная гибель опухолевых клеток путем некроза. При этом наблюдалось значительное уменьшение средней высоты клетки и сухой массы, что связано с разрывом мембраны и вытеканием внутриклеточной среды наружу. Зарегистрировано изменение распределений показателя преломления в клетках рака почки при ФДВ.
Полученные результаты и разработанные методики могут быть использованы для анализа резистентности солидных опухолей к ФДТ, а также для подбора доз ФС и доз светового облучения для конкретных пациентов с разными видами рака.
А.В. Белашов и А.А. Жихорева выражают благодарность Российскому фонду фундаментальных исследований за финансовую поддержку в рамках гранта № 18-32-00364.
Список литературы
Siboni G., Amit-Patito I., Weizman E. et al. // Cancer Lett. 2003. V. 196. № 1. P. 57.
Красновский А.А. // Биофизика. 2004. Т. 49. № 2. С. 305.
Gollnick S.O., Brackett C.M. // Immunol. Res. 2010. V. 46. № 1–3. P. 216.
Foroulis C.N., Thorpe J.A. // J. Cardiothorac Surg. 2006. V. 29. № 1. P. 30.
Gross S.A., Wolfsen H.C. // Gastrointest. Endosc. Clinics. 2010. V. 20. № 1. P. 35.
Гельфонд М.Л., Арсеньев А.И., Барчук А.С. // Рос. биотерапевт. журн. 2004. Т. 3. № 2. С. 49.
Соловьева А.Б., Савко М.А., Глаголев Н.Н. и др. // ЖФХ. 2018. T. 92. № 8. С. 1351.
Соловьева А.Б., Котова С.Л., Тимашев П.С. // ЖФХ. 2003. Т. 77. № 1. С. 104.
Abrahamse H., Hamblin M.R. // Biochem. J. 2016. V. 473. № 4. P. 347.
Chen Q., Tian S., Zhu J. et al. // Anti-Cancer Agents Med. Chem. 2016. V. 16. № 6. P. 763.
Beltukova D.M., Semenova I.V., Smolin A.G. et al. // Chem. Phys. Lett. 2016. V. 662. P. 127.
Jung H.S., Lee J.H., Kim K. et al. // J. Amer. Chem. Soc. 2017. V. 139. № 29. P. 9972.
Hackbarth S., Röder B. // Photochem. & Photobiol. Sci. 2015. V. 14. № 2. P. 329.
Elmore S. // Toxicol. Pathol. 2007. V. 35. № 4. P. 495.
Robertson C.A., Evans D.H., Abrahamse H. // J. Photochem. and Photobiol., B. 2009. V. 96. № 1. P. 1.
Lee K., Kim K., Jung J. // Sensors. 2013. V. 13. № 4. P. 4170.
Belashov A.V., Zhikhoreva A.A., Belyaeva T.N. et al. // Optics Lett. 2016. V. 41. № 21. P. 5035.
Belashov A.V., Zhikhoreva A.A., Bespalov V.G. et al. // JOSA B. 2017. V. 34. № 12. P. 2538.
Zhikhoreva A.A., Belashov A.V., Bespalov V.G. et al. // Biomed. Optics Express. 2018. V. 9. № 11. P. 5817.
Mir M., Bhaduri B., Wang R. et al. // Progress in Optics. 2012. V. 57. P. 133.
Marquet P., Depeursinge C., Magistretti P.J. // Neurophotonics. 2014. V. 1. № 2. P. 020901.
Ban S., Min E., Baek S. et al. // Biomed. Optics Express. 2018. V. 9. № 3. P. 921.
Girshovitz P., Shaked N.T. // Ibid. 2012. V. 3. № 8. P. 1757.
Cao R., Xiao W., Wu X. et al. // Ibid. 2018. V. 9. № 1. P. 72.
Belashov A.V., Zhikhoreva A.A., Belyaeva T.N. et al. // Biophotonics: Photonic Solutions for Better Health Care VI – International Society for Optics and Photonics. 2018. V. 10685. P. 1068505.
Semenova I.V., Belashov A.V., Belyaeva T.N. et al. // Imaging, Manipulation, and Analysis of Biomolecules, Cells, and Tissues XVI – International Society for Optics and Photonics. 2018. V. 10497. P. 104970D.
Belashov A.V., Zhikhoreva A.A., Belyaeva T.N. et al. arXiv preprint arXiv: 1810.12779. 2018.
Freshney R.I. Culture of animal cells: a manual of basic technique and specialized applications. N.Y.: John Wiley & Sons, 2015.
Belik V.P., Gadzhiev I.M., Semenova I.V. et al. // Spectrochim. Acta, Part A. 2017. V. 178. P. 181.
Beltukova D.M., Belik V.P., Vasyutinskii O.S. et al. // Optics and Spectroscopy. 2018. V. 124. № 1. P. 49.
Beltukova D.M., Vasyutinskii O.S., Glazov A.L. et al. // Optics and Spectroscopy. 2017. V. 122. № 2. P. 229.
Pavillon N., Kühn J., Moratal C. et al. // PloS ONE. 2012. V. 7. № 1. P. e30912.
Barer R. // Nature. 1952. V. 169. № 4296. P. 366.
Zhao S.R., Halling H.A. // Proc. 1995 IEEE Nuclear Science Sympos. and Medical Imaging Conf. Record. IEEE, New Jersey, USA, 1995. V. 2. P. 1287.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика