Химическая физика, 2019, T. 38, № 8, стр. 64-68
Кинетика термического разложения 2,4-бис(N,N-диметиламино)-6-тринитрометил-1,3,5-триазина
Б. Л. Корсунский 1, 2, *, Т. С. Ларикова 1, В. В. Захаров 1, В. В. Неделько 1, Н. В. Чуканов 1, **, А. В. Шастин 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
2 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: kors@polymer.chph.ras.ru
** E-mail: chukanov@icp.ac.ru
Поступила в редакцию 27.02.2019
После доработки 06.03.2019
Принята к публикации 20.03.2019
Аннотация
Кинетика термического разложения 2,4-бис(диметиламино)-6-тринитрометил-1,3,5-триазина изучена манометрическим и гравиметрическим методами в расплаве и в разбавленном растворе динонилфталата. Реакция протекает с самоускорением. Добавки N-фенилморфолина существенно ускоряют разложение. Сделан вывод, что диметиламиновые заместители в молекуле исходного вещества принимают непосредственное участие в стадиях, лимитирующих скорость реакции. При переходе от расплава к разбавленному раствору реакция сильно замедляется (что не характерно для термического разложения нитросоединений). Этот результат объяснен тем, что некоторые из лимитирующих стадий процесса являются бимолекулярными. Сказанное подтверждается значениями активационных параметров для начальных стадий термического разложения.
Вещества, содержащие тринитрометильную группу, принадлежат к числу перспективных энергоемких соединений, поскольку эта группа не только обуславливает значительное энерговыделение при термических превращениях, но и позволяет улучшить кислородный баланс во взрывчатых и топливных составах [1–6]. Среди многочисленных веществ этого класса несомненный интерес представляют тринитрометильные производные 1,3,5-триазина [7–10]. Недавно был синтезирован и подробно охарактеризован еще один представитель этого класса веществ – 2,4-бис(N,N-диметиламино)-6-тринитрометил-1,3,5-триазин [11]:
Авторы подробно исследовали полиморфизм этого соединения и методом дифференциальной сканирующей калориметрии ДСК охарактеризовали его термические свойства. В частности, было показано, что соединение I при 92 °C претерпевает полиморфное превращение, которому предшествует скачкообразное падение плотности. Полиморфное превращение происходит с разрушением кристаллов и сопровождается частичным механохимическим разложением соединения I. Плавление I при температуре около 123 °C приводит к резкому ускорению разложения.
Соединение I представляет интерес как модель, позволяющая выяснить, в какой мере одновременное присутствие диалкиламиногрупп и тринитрометильных заместителей в производных 1,3,5-триазина влияет на их термическую стабильность. Для ответа на этот вопрос в настоящей работе изучены кинетика и механизм изотермического разложения соединения I.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Поведение соединения I при нагревании изучали в расплаве и в растворе динонилфталата. Кинетику термического разложения исследовали манометрическим методом с использованием стеклянных мембранных манометров Бурдона и по потере массы с помощью автоматических термовесов АТВ-14М [12].
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
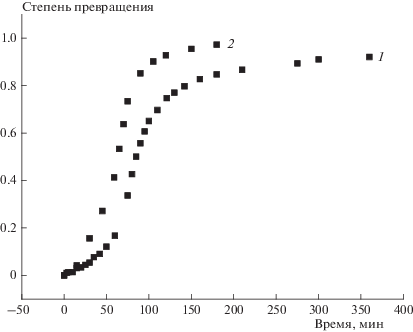
На рис. 1 приведены данные по кинетике термического разложения соединения I в 5%-ном растворе динонилфталата при 120 °C, полученные манометрическим и гравиметрическим методами. Из этого рисунка видно, что оба метода приводят к качественно сходным результатам. Как видно, кинетические кривые S-образны. Подобные зависимости наблюдались и при более высоких температурах. При этом с ростом температуры S‑образность постепенно скрадывается и становится малозаметной. Очень часто S-образность кинетических кривых свидетельствует о наличии автокатализа. Однако при термическом разложении соединения I кинетические зависимости уравнением автокатализа не описываются: как правило, удельные скорости реакции $\left( {{{d{\eta }} \mathord{\left/ {\vphantom {{d{\eta }} {dt}}} \right. \kern-0em} {dt}}} \right){{(1 - {\eta })}^{{ - 1}}},$ где η – степень превращения, как функции степени превращения растут лишь до точки перегиба кинетической кривой, а затем начинают убывать.
Рис. 1.
Кинетика термического разложения соединения I в 5%-ном растворе динонилфталата при 120 °C: 1 – манометрические данные, 2 – гравиметрические данные.
При обсчете кинетических зависимостей в рамках уравнения первого порядка, т.е. в координатаx ln(1 – η) – t, где t – время, спрямление наблюдается на самых начальных участках реакций, соответствующих нескольким процентам превращения, а затем полулогарифмическая анаморфоза отклоняется вниз, т.е. наблюдаемая константа скорости возрастает (“скрытое самоускорение”).
В табл. 1 приведены значения констант скорости первого порядка, соответствующие начальным стадиям разложения. Полученные величины могут быть описаны уравнением Аррениуса с Е = = (16.0 ± 2.3) ккал/моль и А = 104.6 ± 1.2 с–1 (r = = 0.971). Невысокое значение корреляционного коэффициента свидетельствует о весьма значительном разбросе экспериментальных данных. Это и неудивительно, поскольку константы скорости определялись по самым начальным участкам кинетических кривых. А так как сами эти кривые S-образны (рис. 1), нельзя исключить того, что реакции, обуславливающие S-образность, вносят некоторый вклад в наблюдаемые значения констант скорости даже на самых ранних ступенях процесса.
Таблица 1.
Значения констант скорости начальных стадий термического разложения 2,4-бис(диметиламино)-6-тринитрометил-1,3,5-триазина
| Температура, °C | Константа скорости, с–1 |
|---|---|
| 100 | 1.3 ⋅ 10–5 |
| 120 | 6.1 ⋅ 10–5 |
| 140 | 2.0 ⋅ 10–5 |
| 150 | 1.9 ⋅ 10–5 |
| 160 | 2.5 ⋅ 10–4 |
На рис. 2 сопоставлены кинетические кривые термического разложения соединения I при 120 °C в расплаве и в 5%-ном растворе динонилфталата. Как видно из этого рисунка, переход от расплава к разбавленному раствору сопровождается сильным замедлением процесса.
Рис. 2.
Кинетические кривые потери массы при термическом разложении соединения I в 5%-ном растворе динонилфталата (1) и в расплаве (2) при 120 °C.
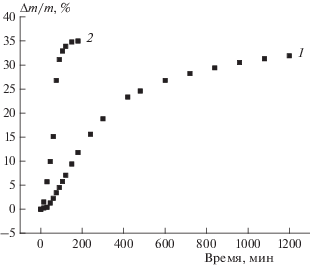
В термовесовых опытах было показано, что при полном разложении соединения I потеря массы составляет ~35% (см., например, рис. 2) – это немного. По-видимому, при образовании газообразных продуктов триазиновый цикл не затрагивается, а газы выделяют лишь заместители – тринитрометильная и диметиламиновая группы. Что же касается триазинового цикла, то в ходе разложения он либо не затрагивается, либо реагирует без газовыделения (через окисление, полимеризацию или еще какие-нибудь процессы).
С другой стороны, манометрические данные показали, что при полном разложении одного моля соединения I выделяется 3.4–3.8 моль газообразных продуктов. Это вполне разумная величина, характерная для многих нитросоединений.
Совместное рассмотрение манометрических и гравиметрических данных позволило заключить, что средний молекулярный вес газов, образующихся при разложении соединения I, равен 30.3, т.е. образующиеся газы – легкие. Это могут быть H2O, N2, NO, CO. Сделанный вывод хорошо согласуется с результатами масс-спектрометрического анализа продуктов пиролиза соединения I [11].
Кинетика термического разложения веществ, содержащих тринитрометильную группу, хорошо изучена [13]. В этих реакциях первой и лимитирующей стадией реакции является мономолекулярный гомолитический разрыв связи С–NO2 с энергией активации 35–40 ккал/моль и предэкспоненциальным множителем 1015–1017 с–1. Приведенные выше данные для активационных параметров распада соединения I показывают, что это вещество разлагается по совершенно иному механизму. Логично предположить, что причиной такого расхождения может быть присутствие в молекуле I диметиламиногруппы. Обладая основными и нуклеофильными свойствами, эта группа способна катализировать реакцию либо принимать непосредственное участие в лимитирующих стадиях разложения.
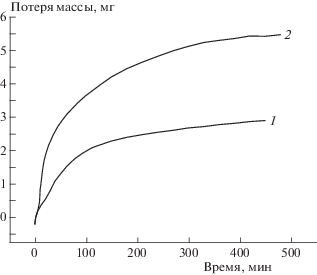
С целью проверки высказанного предположения было изучено термическое разложение соединения I в присутствии добавки амина, N-фенилморфолина. Полученные результаты представлены на рис. 3. Как видно, добавка N-фенилморфолина (кривая 2) действительно ускоряет процесс. Поскольку в условиях гравиметрических экспериментов на термовесах происходит медленное испарение динонилфталата, которое на поздних стадиях процесса проявляется в виде линейных участков кинетических кривых, это побочное явление было учтено “вычитанием” из кинетической кривой прямой линии, соответствующей кинетике испарения. Примечательно, что добавление N-фенилморфолина не только ускоряет реакцию, но и сопровождается увеличением потери массы. Таким образом, можно сделать вывод, что N-фенилморфолин, видимо, и катализирует реакцию, но, несомненно, что он вступает в прямое взаимодействие с субстратом. Какое это взаимодействие, ввиду сложности системы в настоящее время сказать трудно. Во всяком случае с высокой степенью достоверности можно утверждать, что диметиламиновый заместитель в молекуле I принимает непосредственное участие в лимитирующих стадиях его разложения. Возможно, например, прямое окислительно-восстановительное взаимодействие между тринитрометильной группой одной молекулы субстрата и диметиламиновой группой – другой.
Рис. 3.
Кинетические кривые потери массы при термическом разложении соединения I в растворе динонилфталата (1) и в расплаве (2) при 140 °C: 1 – система соединение I – динонилфталат, 2 – система соединение I – динонилфталат – N-фенилморфолин. Исходные навески: I – 8.1 мг, N-фенилморфолин – 16 мг, суммарная масса раствора – 160 мг.
Весьма примечательны данные, показанные на рис. 2. Во-первых, при переходе в раствор S‑образность кинетических кривых сохраняется. Для автокаталитических реакций это не характерно, поскольку разбавление уменьшает концентрацию автокатализатора и тем самым тормозит автокаталитический процесс. Во-вторых, что еще более удивительно, переход от расплава к раствору сопровождается существенным замедлением реакции. Поскольку термическое разложение нитросоединений обычно протекает гомолитически и мономолекулярно, свойства среды на скорость реакции, как правило, заметного влияния не оказывают. Полученный результат можно объяснить тем, что в лимитирующей стадии участвуют бимолекулярные процессы (например, упомянутые выше окислительно-восстановительные реакции с участием аминогруппы молекулы I). В этом случае разбавление при переходе к раствору действительно может тормозить разложение.
Заметный вклад бимолекулярных реакций позволяет понять и природу отмеченных выше аномально низких значений активационных параметров. Для подавляющего большинства бимолекулярных реакций в растворе вообще характерны значительно меньшие, чем для мономолекулярных реакций, энергии активации. В реакциях между нейтральными молекулами их значения чаще всего находятся в диапазоне 15–20 ккал/моль. Низкие значения предэкспоненциального множителя для этих реакций также часто встречаются. Классическим примером таких бимолекулярных реакций является реакция Меншуткина (алкилирование третичных аминов алкилгалогенидами с образованием четвертичных аммониевых солей).
Таким образом, при синтезе тринитрометилзамещенных 1,3,5-триазинов следует иметь в виду, что введение в их молекулы заместителей, содержащих аминогруппу, может привести к значительному снижению термической стабильности.
Работа выполнена в соответствии с темами государственного задания (номера государственной регистрации 0082-2016-0011 и 0089-2014-0019).
Список литературы
Нечипоренко Г.Н., Лемперт Д.Б., Согласнова С.И. // Хим. физика. 2005. Т. 24. № 3. С. 74.
Shastin A.V., Godovikova T.I., Golova S.P. et al. // Mendeleev Commun. 1995. V. 5. P. 17.
Dharavath S., Zhang J., Imler G.H. et al. // J. Materials Chem. A. 2017. V. 5. № 10. P. 4785.
Yuangang Xu, Cheng Shen, Qiuhan Lin et al. // J. Mater. Chem. A. 2016. V. 4. № 45. P. 17791.
Haiges R., Christe K.O. // Inorg. Chem. 2013. V. 52. № 12. P. 7249.
Yuan Wang, Cai Qi, Jian-Wei Song et al. // J. Molec. Model. 2013. V. 19. P. 1079.
Неделько В.В., Шастин А.В., Захаров В.В. // Матер. VII Всеросс. конф. “Энергетические конденсированные системы”. Черноголовка: ИПХФ РАН, 2014. С. 31.
Неделько В.В., Шастин А.В., Конькова Т.С. и др. // Горение и взрыв. Вып. 8 / Под ред. Фролова С.М. М.: Торус Пресс, 2015. С. 160.
Неделько В.В., Захаров В.В., Корсунский Б.Л. и др. // Хим. физика. 2015. Т. 34. № 12. С. 39.
Kon’kova T.S., Miroshnichenko E.A., Nedel’ko V.V. et al. Abstr. 18th Seminar on New Trends in Research of Energetic Materials. Pardubice, Czech Republic: Univ. Pardubice, 2015. P. 638.
Захаров В.В., Чуканов Н.В., Шилов Г.В., Малков Г.В., Шастин А.В., Корсунский Б.Л. // Хим. физика. 2019. Т. 38. № 4. С. 45.
Гальперин Л.Н., Колесов Ю.Р., Зеленов Н.А. // Измерит. техника. 1981. № 4. С. 23.
Манелис Г.Б., Назин Г.М., Рубцов Ю.И., Струнин В.А. Термическое разложение и горение взрывчатых веществ и порохов. М.: Наука, 1996.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика