Химическая физика, 2019, T. 38, № 8, стр. 3-11
Кинетическое моделирование закалки продуктов сгорания при получении ацетилена
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Национальный исследовательский ядерный университет “МИФИ”
Москва, Россия
* E-mail: troshin@chph.ras.ru
Поступила в редакцию 06.03.2019
После доработки 15.04.2019
Принята к публикации 22.04.2019
Аннотация
Методом компьютерного моделирования исследовано принудительное охлаждение промежуточных продуктов сгорания богатых кислородных смесей метана и его смесей с пропаном. Парциальное окисление углеводородного сырья проводится в режиме самовоспламенения при постоянном давлении в диапазоне температур от 773 до 973 K и давлениях от 0.1 до 5.0 МПа. Показано, что исчезновение ацетилена в промежуточных продуктах сгорания в процессе “закалки” может быть интенсивнее, чем при выходе их на равновесное состояние в адиабатических условиях. Принудительное охлаждение продуктов может привести к ускорению исчезновения ацетилена. Это может быть связано с тем, что прямые и обратные реакции взаимодействия ацетилена с активными частицами могут иметь различный порядок.
ВВЕДЕНИЕ
Широкое использование ацетилена в химической промышленности стимулирует поиски наиболее дешевых и производительных способов его производства. Способы получения ацетилена из углеводородного сырья подробно описаны в коллективной монографии [1, Гл. 3, стр. 62]. Одна из наиболее производительных технологий – технология немецкой фирмы BASF, основанная на реакции парциального окисления углеводородов кислородом [2]. В качестве сырья используются природный газ или попутные нефтяные газы (ПНГ). Реакция парциального окисления углеводородов кислородом реализуется в условиях повышенных начальных температур и давлений при самовоспламенении богатых смесей в специальных горелках.
Особенность метода обусловлена тем, что ацетилен является не конечным, а промежуточным продуктом этой реакции. С окончанием периода индукции, на стадии быстрого протекания химической реакции в неравновесном состоянии, концентрация ацетилена достигает максимального значения. Затем в ходе установления равновесного состояния ацетилен практически полностью исчезает, конвертируя в конечные продукты реакции, в частности в сажу. Тем не менее в течение некоторого времени концентрация ацетилена остается достаточно высокой. Время, в течение которого его концентрация превышает 6 об.% от общего состава продуктов, что соответствует промышленным требованиям, весьма ограничено. Поэтому наиболее существенным моментом в этом процессе является “закалка” или охлаждение продуктов неполного сгорания, временны́е рамки которой сильно ограничены техническими возможностями. Это вынуждает вносить определенные приспособления в конструкцию горелки. В зоне реакции устраивается система принудительного охлаждения промежуточных продуктов сгорания. Через специальные сопла в камеру подаются тонкие струи воды или масла. Такая охлаждающая завеса позволяет охладить промежуточные продукты сгорания в течение несколько миллисекунд. Выход ацетилена составляет до 8 об.% в обезвоженной смеси. По данным, приведенным в работе [2], производительность таких горелок на производстве ацетилена достигает 25 т/сут.
Потребность отечественной газохимической промышленности в ацетилене возрастает, что ставит задачу разработки подобных горелок. Однако литературных данных по техническим и кинетическим характеристикам процесса недостаточно для проектирования подобных устройств.
В равновесных продуктах сгорания ацетилен практически отсутствует. Расчеты, проведенные в работе [3], показывают, что концентрация ацетилена резко возрастает к моменту истечения задержки воспламенения, затем быстро спадает до ничтожных концентраций. Кинетические расчеты могут помочь найти оптимальные условия для получения достаточно высокого выхода ацетилена в продуктах сгорания, незначительно отличающегося от пиковых значений.
На стадии выхода продуктов сгорания на равновесный состав расход ацетилена вызван его участием в реакциях, связанных с образованием других промежуточных продуктов и в итоге конечных продуктов, в том числе сажи. Поскольку ацетилен является промежуточным продуктом, через который происходит формирование сажи [4], то картина динамики изменения концентрации ацетилена при охлаждении продуктов сгорания может оказаться полезной для понимания механизма образования сажи в различных технологических процессах, основанных на сжигании углеводородного сырья.
“Закалку” промежуточных продуктов сгорания невозможно осуществить мгновенно. По мере падения температуры протекание химических реакций в них продолжается. По причине того, что энергии активации реакций каждой стадии кинетического механизма значительно различаются, происходит их несинхронная “заморозка”. Достаточно быстрое охлаждение большой массы промежуточных продуктов сгорания до температуры, при которой прекращаются химические реакции с ацетиленом, представляется весьма сложной технической проблемой. Информация о влиянии начальных условий на время “закалки” и, таким образом, управлении им расширила бы возможности производства. Поэтому несомненный практический интерес представляет исследование влияния динамики охлаждения на характерное время выхода концентрации ацетилена на стационарный уровень, удовлетворяющий требованиям промышленного производства.
Нужно ответить на вопрос, как исходный состав углеводородного сырья в смеси с кислородом, начальные давление и температура влияют на время, необходимое для эффективной “закалки” промежуточных продуктов сгорания и обеспечивающее приемлемый, с точки зрения производства, выход целевого продукта. Необходимо помнить также, что эти параметры определяют задержки воспламенения используемых топлив в кислороде – важнейшего технологического параметра, от которого зависит организация охлаждения в горелках.
Одним из возможных путей повышения производительности рассматриваемого метода может быть повышение давления, обеспечивающего, очевидно, рост концентрации целевого продукта. При этом роль давления в динамике формирования и расходования ацетилена неочевидна.
В работе методом компьютерного моделирования исследуется влияние начальных условий на время, необходимое для охлаждения промежуточных продуктов сгорания и обеспечивающее приемлемый выход ацетилена, т.е. не менее 6 об.% от общего состава продуктов. Рассматриваются кислородные смеси модельных топлив природного газа и попутных нефтяных газов.
ОСНОВНЫЕ ДОПУЩЕНИЯ МОДЕЛИ
Состав природного газа и попутных нефтяных газов весьма разнообразный и может зависеть от конкретного месторождения и даже времени года. Специфика того или иного вида сырья определяется количественным содержанием в нем более тяжелых алканов: C2–C5. Поэтому целесообразно уделить внимание модельным топливным смесям.
Поскольку природный газ состоит в основном из метана и небольшого количества других примесей, для упрощения расчетов в качестве исходного сырья рассматривается метан, а в качестве моделей попутного газа – смеси метана и пропана следующих составов: 80% CH4 + 20% C3H8 и 60% CH4 + 40% C3H8.
Во всех случаях расчеты проводятся для кислородных смесей с коэффициентом избытка окислителя, равным 0.3, а самовоспламенение реализуется в условиях постоянного давления при начальных давлениях от 1 до 5.0 МПа и температурах от 773 до 973 K.
Кинетическое моделирование парциального окисления метана и модельных смесей ПНГ проводилось на основе детального кинетического механизма окисления простейших углеводородов C1–C3 [5]. Этот детальный механизм включает в себя только газофазные реакции. Такой подход при кинетическом моделировании данной задачи оправдан, поскольку формирование сажи в числе прочих конечных продуктов – наиболее длительный процесс, в то время как интерес представляют ранние стадии, протекающие непосредственно после истечения задержки воспламенения, когда еще не началось гетерогенное формирование равновесных продуктов сгорания.
Поскольку для решения поставленной задачи охлаждение промежуточных продуктов сгорания должно начинаться, когда концентрация ацетилена достигает максимального значения, расчет проводился таким образом, что в этот момент начинал работать блок программы, моделирующий теплопотери в реакторе. Охлаждение реализуется за счет отвода тепла в стенку реактора или взвешенные в объеме инертные поглотители тепла, которые условно можно считать стенкой реактора. Такое охлаждение моделируется уравнением Ньютона, которое включено в кинетическую программу самовоспламенения смеси:
(1)
$C{{dT} \mathord{\left/ {\vphantom {{dT} {dt}}} \right. \kern-0em} {dt}} = \alpha \left( {{{T}_{b}} - {{T}_{w}}} \right).$Рис. 1.
Изменения температуры и концентрации ацетилена в промежуточных продуктах сгорания при адиабатическом выходе на равновесный состав и при вынужденном охлаждении: 1 – допустимый уровень концентрации ацетилена; 2 и 4 – концентрация ацетилена и температура, соответственно, при адиабатическом выходе продуктов сгорания на равновесное состояние; 3 и 5 – концентрация ацетилена и температура, соответственно, при вынужденном охлаждении продуктов сгорания; 6 и 7 – концентрация ацетилена и температура, соответственно, при вынужденном охлаждении продуктов сгорания (коэффициент теплоотдачи уменьшен в 2 раза). а – топливо: 100% CH4,T0 = 923 K, P0 = 0.5 МПа, коэффициент теплоотдачи α = 0.011; б – топливо: 60% CH4 + 40% C3H8, T0 = 973 K, P0 = 0.5 МПа; коэффициент теплоотдачи α = 0.3; в – топливо: 100% CH4, T0 = 923 K, P0 = 5.0 МПа, коэффициент теплоотдачи α = 15.0; г – топливо: 60% CH4 + 40% C3H8, T0 = 973 K, P0 = 5.0 МПа, коэффициент теплоотдачи α = 110.0. Концентрация [C2H2] – в мольных долях.
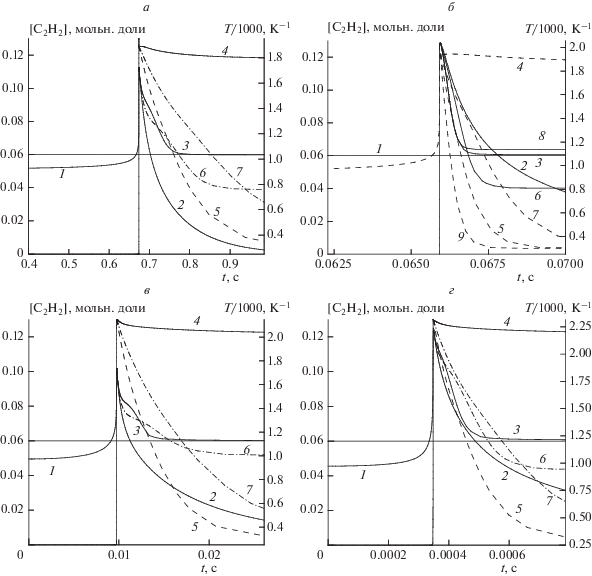
Расчеты проводились при постоянном давлении. Результаты моделирования “закалки” промежуточных продуктов сгорания целесообразно представить в сравнении с процессом их выхода на равновесный состав в условиях отсутствия теплоотвода в стенки реактора. Соответствующие кинетические расчеты были выполнены в адиабатических условиях.
РЕЗУЛЬТАТЫ КИНЕТИЧЕСКОГО МОДЕЛИРОВАНИЯ
Некоторые кинетические кривые для концентрации ацетилена и температуры при самовоспламенении модельных топлив и выходе продуктов на равновесный состав в адиабатических условиях показаны на рис. 1. Как видно из этого рисунка, концентрация ацетилена и температура достигают максимальных значений к моменту окончания задержки воспламенения. Затем, по мере выхода на равновесный состав, температура продуктов сгорания несколько уменьшается и выходит на стационарный уровень. Такое уменьшение температуры связано с протеканием экзотермических реакций, отвечающих за образование конечных продуктов. Концентрация ацетилена падает, асимптотически приближаясь к нулевому значению. Иными словами, время существования ацетилена в промежуточных продуктах сгорания, ta, весьма ограничено. Чтобы иметь наглядную характеристику величины этого времени, удобно выбрать время падения концентрации ацетилена до 6 об.% от общего состава продуктов, т.е. до уровня, приемлемого с точки зрения промышленного производства. Эта характеристика может иметь практическое значение для технологии, поскольку является ориентиром для организации охлаждения продуктов сгорания.
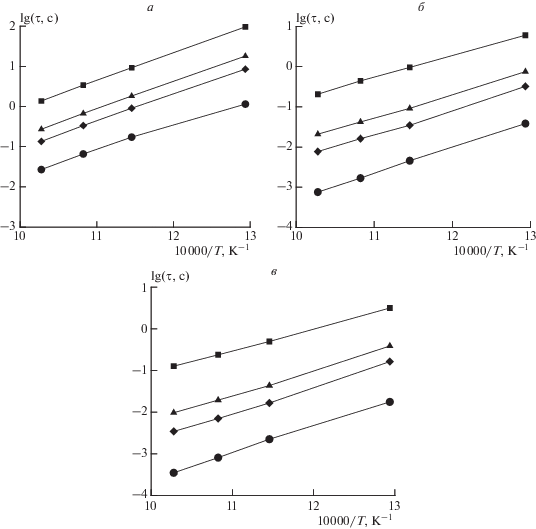
Кинетическое моделирование парциального окисления указанных углеводородных топлив в режимах самовоспламенения показало, что увеличение доли тяжелого компонента в исходном сырье приводит к уменьшению максимальной концентрации ацетилена (рис. 2), а также к сокращению задержек воспламенения во всем рассмотренном диапазоне давлений. Пример такого расчета при постоянном давлении 1.0 МПа приведен на рис. 3. Увеличение начального давления также вызывает сокращение задержек воспламенения (см. рис. 4) и характерного времени ta во всех топливных смесях.
Рис. 2.
Зависимость максимального содержания ацетилена в промежуточных продуктах сгорания от содержания пропана в исходном сырье для разных начальных давлений при температуре 973 K: ◼ – 0.1 МПа, ▲ – 0.5 МПа, ◆ – 5.0 МПа.
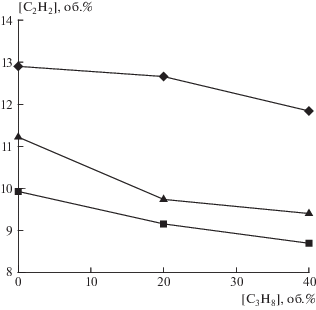
Рис. 3.
Температурная зависимость задержек воспламенения топлив с различным содержанием пропана в ПНГ: ◼ – 100% CH4, ▲ – 80% CH4 + 20% C3H8, ◆ – 60% CH4 + 40% C3H8. Расчет при постоянном давлении P = 1.0 МПа.
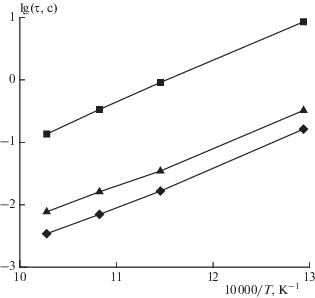
Рис. 4.
Влияние начального давления на температурные зависимости задержек воспламенения разных топлив: а – 100% CH4, б – 80% CH4 + 20% C3H8, в – 60% CH4 + 40% C3H8; ◼ – 0.1 МПа, ▲ – 0.5 МПа, ◆ – 1.0 МПа, ⚫ – 5.0 МПа.
Исследование влияния начальных параметров на величину характерного времени ta падения концентрации ацетилена показало следующее. Величина характерного времени ta имеет достаточно слабую температурную зависимость. Так, в смесях метана и кислорода эта величина падает в 2–3 раза с увеличением температуры на 200 K, а в модельных смесях ПНГ это падение может быть еще меньше.
Влияние начального давления на температурные зависимости характерного времени ta падения концентрации ацетилена представлены на (рис. 5). Зависимость характерного времени ta от содержания пропана в топливе для разных давлений представлена на рис. 6. Видно, что характерное время падает с увеличением доли пропана в топливе и с ростом давления.
Рис. 5.
Температурная зависимость характерного времени падения концентрации ацетилена, ta, в продуктах сгорания при адиабатическом выходе на равновесный состав (сплошные линии) и времени tc их охлаждения при “закалке” (штриховые) для разных топлив: а – 100% CH4, б – 80% CH4 + 20% C3H8, в – 60% CH4 + 40% C3H8, и разных начальных давлений P0 = 0.1 (◼), 0.5 (▲), 1.0 (◆) и 5.0 МПа (⚫).
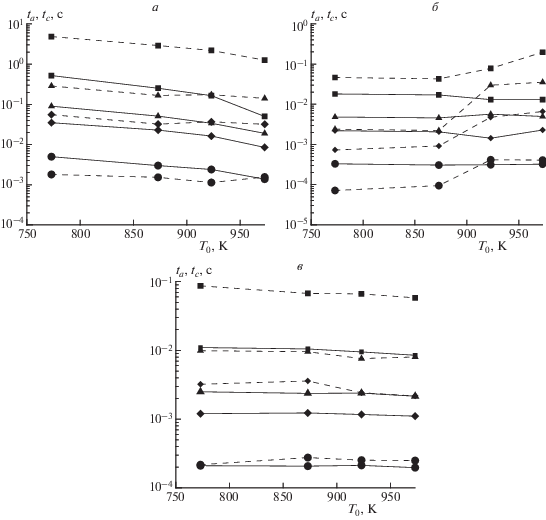
Рис. 6.
Время выхода концентрации ацетилена на уровень в 6% для разных топлив: ◼ – 100% CH4, ▲ – 80% CH4 + 20% C3H8, ◆ – 60% CH4 + 40% C3H8, при адиабатическом выходе продуктов сгорания на равновесное состояние (сплошные линии) и при “закалке” продуктов сгорания (штриховые). Начальная температура – 973 K.
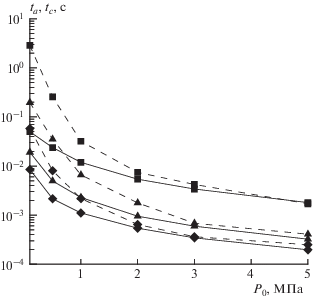
Таким образом, для увеличения производительности необходимо повышать давление и температуру процесса, а это приводит к сокращению времени существования приемлемой концентрации ацетилена в промежуточных продуктах сгорания. Очевидно, что в этом случае необходимо организовать достаточно быстрое охлаждение продуктов сгорания, что не всегда возможно с технической точки зрения.
Моделирование принудительного охлаждения или “закалки” промежуточных продуктов сгорания осуществлялось так, что этот процесс начинался в момент времени, когда концентрация ацетилена достигала максимального значения. Результаты моделирования показали, что по мере охлаждения промежуточных продуктов концентрация ацетилена продолжает падать до тех пор, пока температура не достигнет некоторого критического значения, и асимптотически выходит на стационарный уровень. Характерные кинетические кривые для концентрации ацетилена и температуры смеси показаны на рис. 1. Для различных условий средняя температура, при которой прекращается падение концентрации ацетилена, составляет 650 K. Величина стационарного уровня его концентрации зависит от коэффициента теплоотдачи, иными словами, от скорости охлаждения. Как уже отмечалось выше, коэффициент теплоотдачи подбирался таким образом, что бы этот уровень составлял 6 об.% от общей концентрации продуктов сгорания. При разных начальных условиях принудительное охлаждение промежуточных продуктов сгорания оказывает неоднозначное воздействие на динамику выхода концентрации ацетилена на стационарный уровень. Соотношение времени ta характерного падения концентрации ацетилена и времени “закалки” tc различно. Это при условии кратковременного существования приемлемой концентрации ацетилена (ta – малó) может создавать определенные затруднения в организации эффективного охлаждения промежуточных продуктов.
При использовании сырья, целиком состоящего из метана, при начальной температуре 773 K и давлениях, не превышающих 1.0 МПа, скорость падения концентрации ацетилена замедляется по сравнению со скоростью его падения при установлении равновесного состояния в адиабатических условиях. Время “закалки” tc больше характерного времени ta существования приемлемой концентрации ацетилена:
Несомненно, это может облегчить организацию процесса “закалки”.
Однако, как показали расчеты, не во всем рассматриваемом диапазоне температур и давлений это соотношение сохраняется. Существует некоторое пороговое значение давления, при котором соотношение (2) нарушается. Повышение давления при такой температуре изменит соотношение между tc и ta, и будет выполняться неравенство tc < ta, что потребует значительно интенсифицировать охлаждение. При начальной температуре 873 K соотношение (2) сохраняется при давлениях вплоть до 2.0 МПа, а при температуре 973 K – при давлениях до 5.0 МПа. Вне этих условий, в диапазоне температур ниже 973 K, при высоких давлениях скорость падения концентрации ацетилена при вынужденном охлаждении продуктов сгорания оказывается выше, чем при адиабатическом выходе продуктов сгорания на равновесный состав, что приводит к уменьшению времени ta по сравнению с tc (см. рис. 6). И лишь при температурах, начиная с 973 K, этот эффект в рассмотренном диапазоне давлений не проявляется.
При парциальном окислении топлив, содержащих 20% пропана, неравенство (2) нарушается при начальных давлениях выше 0.5 МПа и температурах ниже 923 K (см. рис. 5б). Если содержание пропана в топливе достигает 40% этот эффект не проявляется в рассмотренном диапазоне температур и давлений (см. рис. 5в). Таким образом, проявление эффекта изменения знака неравенства (2) связано с начальными температурой, давлением и составом топлива.
По всей видимости, состав топлива обуславливает, во-первых, температуру продуктов и, во-вторых, концентрацию водорода в зоне реакции. Наибольшая температура достигается к моменту окончания периода индукции в смесях с наибольшим содержанием пропана. Именно к этому параметру особенно чувствительны скорости отдельных стадий.
При парциальном окислении богатых смесей алканов к моменту окончания периода индукции наибольшая концентрация радикалов приходится на чрезвычайно активные радикалы H; кроме того, в промежуточных продуктах сгорания велика концентрация молекулярного водорода. Содержание водородных радикалов в промежуточных продуктах сгорания тем выше, чем больше пропана содержится в топливе.
Таким образом, наиболее вероятно, что в рассматриваемом кинетическом механизме основными каналами вывода ацетилена из реакции является его взаимодействие с водородными радикалами. То есть такие реакции, как
(3)
$\begin{gathered} {{{\text{C}}}_{2}}{{{\text{H}}}_{2}} + {\text{H}} + {\text{M}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{3}} + {\text{M}}, \\ {{k}_{{11}}} = 3.81 \cdot {{10}^{{40}}}{{T}^{{ - 7.27}}}{{e}^{{{{ - 3632} \mathord{\left/ {\vphantom {{ - 3632} T}} \right. \kern-0em} T}}}},\,\,{\text{с}}{{{\text{м}}}^{6}} \cdot {\text{мол}}{{{\text{ь}}}^{{ - 2}}} \cdot {{{\text{с}}}^{{ - 1}}}, \\ \end{gathered} $и соответствующая обратная стадия –
(4)
$\begin{gathered} {{{\text{C}}}_{2}}{{{\text{H}}}_{3}} + {\text{M}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{2}} + {\text{H}} + {\text{M}}, \\ {{k}_{{12}}} = 4.16 \cdot {{10}^{{41}}}{{T}^{{ - 7.49}}}{{e}^{{{{ - 22917} \mathord{\left/ {\vphantom {{ - 22917} T}} \right. \kern-0em} T}}}},\,\,{\text{с}}{{{\text{м}}}^{3}} \cdot {{\left( {{\text{моль}} \cdot {\text{c}}} \right)}^{{ - 1}}}. \\ \end{gathered} $Зависимость описанного эффекта от давления, по всей видимости, связана с тем, что прямые и обратные реакции отдельных стадий имеют разный порядок. Действительно, для примера обратим внимание на прямую и обратную реакции (3) и (4). Прямая реакция (3) – тримолекулярная, а обратная (4) – бимолекулярная. Для скоростей прямой и обратной реакций можно записать следующее неравенство:
(5)
${{\xi }_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}{{\xi }_{{\text{H}}}}P > 18.92R{{\xi }_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{3}}}}}}}{{T}^{{0.77}}}{{e}^{{{{ - 19285} \mathord{\left/ {\vphantom {{ - 19285} T}} \right. \kern-0em} T}}}}.$Здесь R – универсальная газовая постоянная, T – температура, P – давление, ${{\xi }_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}$ и ${{\xi }_{{\text{H}}}}$ – концентрации реагентов в мольных долях. Совершенно очевидно, что в зависимости от условий знак неравенства может меняться на противоположный, что и определяет характер динамики вывода ацетилена из реакции.
Кроме того, обращает на себя внимание тот факт, что энергии активации обратных стадий этих реакций значительно выше прямых. Это значит, что при интенсивном падении температуры в условиях принудительного охлаждения происходит несинхронное падение скоростей, или “заморозка” различных стадий механизма окисления. Этим можно объяснить то, что скорость выведения ацетилена из реакции при “закалке” может быть выше, чем при адиабатическом выходе продуктов сгорания на равновесный состав.
Таким образом, превышение некоторого порогового значения давления при “закалке” в случае использования сырья с низким содержанием тяжелых углеводородов может привести к увеличению скорости падения концентрации ацетилена по сравнению с адиабатическим выходом продуктов сгорания на равновесный состав. С увеличением содержания более тяжелых углеводородных фракций в сырье пороговое значение давления увеличивается. Для организации эффективной закалки промежуточных продуктов сгорания необходимо учитывать состав сырья, начальные температуру и давление.
В настоящей работе не дается количественной оценки величины порогового давления, при котором может проявляться этот эффект. Поскольку любая аналитическая оценка опиралась бы на литературные значения констант скорости прямой и обратной реакций (3), (4), которые в различных базах данных могут иметь существенные расхождения.
Интересно также иметь представление о том, каков состав промежуточных продуктов сгорания после “закалки”. Естественно, что он отличается от равновесного состава. В табл. 1 приведены результаты кинетического моделирования принудительного охлаждения промежуточных продуктов для различных топлив, полученные при самовоспламенении в условиях постоянного давления P = 2.0 МПа и начальной температуре T0 = 973 K. В табл. 1 не представлены вещества, содержание которых ниже 0.1%.
Таблица 1.
Содержание основных веществ (об.%) в промежуточных продуктах сгорания после “закалки”. Самовоспламенение при начальных температуре T0 = 973 K и давлении P = 2.0 МПа
| Сырье | H2, % | H2O, % | CO, % | CO2, % | CH4, % | C2H4, % | C2H2, % | Σ |
|---|---|---|---|---|---|---|---|---|
| 100% CH4 | 32.56 | 36.07 | 15.84 | 1.26 | 0.25 | 7.56 | 6.39 | 99.93 |
| 80% CH4 + 20% C3H8 | 34.84 | 29.15 | 19.65 | 3.04 | 0.17 | 6.80 | 6.13 | 99.78 |
| 60% CH4 + 40% C3H8 | 35.42 | 25.66 | 22.04 | 3.87 | 0.15 | 6.35 | 6.13 | 99.62 |
Как показывают расчеты, после “закалки” в промежуточных продуктах сгорания помимо целевого ацетилена примерно в таком же количестве присутствует этилен, а основной объем занимает синтез-газ (смесь H2 и CO), до 75% от объема сухого продукта.
ВЫВОДЫ
Интенсивное принудительное охлаждение промежуточных продуктов сгорания при некоторых начальных условиях может создавать неблагоприятные предпосылки для технической реализации процесса получения ацетилена.
Кинетический анализ процесса “закалки” промежуточных продуктов сгорания кислородных смесей углеводородного сырья показал следующее.
1. Время существования приемлемой, с точки зрения производства, концентрации ацетилена в промежуточных продуктах сгорания при адиабатическом выходе их на равновесный состав ограничено. Величина этого времени зависит от начальных давления, температуры и состава сырья.
2. Оказалось, что в зависимости от начальных условий при вынужденном охлаждении промежуточных продуктов сгорания время выхода концентрации ацетилена на стационарный уровень может быть как выше, так и ниже времени существования его приемлемой концентрации в адиабатических условиях. Различие порядков прямых и обратных реакций отдельных стадий кинетического механизма приводит к их зависимости от давления, что и вызывает такое поведение концентрации ацетилена при вынужденном охлаждении промежуточных продуктов сгорания.
3. Для данного кинетического механизма существует некоторое пороговое давление, определяющее скорость вывода ацетилена из промежуточных продуктов сгорания. Рост давления выше порогового значения приводит к тому, что время tc выхода целевого продукта на стационарный уровень становится меньше времени ta адиабатического падения его концентрации до этого уровня, т.е. “закалка” возможна, но с короткими временами.
4. Пороговое значение давления для метана тем выше, чем выше начальная температура и чем больше в исходном сырье содержание тяжелых фракций.
Работа выполнена за счет субсидии, выделенной ИХФ РАН на выполнение государственного задания по теме 0082-2014-0012 “Фундаментальные исследования процессов превращения энергоемких материалов и разработка научных основ управления этими процессами” (регистрационный код АААА-А17-117040610346-5).
Список литературы
Билера И.В., Буравцев Н.Н., Колбановский Ю.А., Россихин И.В. // Технологическое горение. М.: НИСО РАН, 2018. С. 612.
Pässler P., Hefner W., Buckl K. et al. // Acetylene. Ullmann’s Encycl. Ind. Chem. 7th ed. Weinheim: Wiley-VCH Verlag GmbH & Co., 2008. P. 9.
Борисов А.А., Борунова А.Б., Трошин К.Я., Колбановский Ю.А., Билера И.В. // Горение и взрыв. Вып. 7 / Под ред. Фролова С.М. М.: Торус Пресс, 2014. № 7. С. 100.
Li O., Wang T., Liu Y., Wang D. // Chem. Eng. J. 2012. V. 207–208. P. 235.
Борисов A.A., Скачков Г.И., Трошин К.Я. // Хим. физика. 1999. Т. 18. № 9. С. 45.
Tsang W., Hampson R.F. // J. Phys. Chem. and. Ref. Data. 1986. V. 15. P. 1087.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


