Химическая физика, 2019, T. 38, № 9, стр. 30-38
Особенности проявления множественной люминесценции органических соединений в фотоотвержденных акриловых полимерах
И. А. Матвеева 1, В. Т. Шашкова 1, А. В. Любимов 1, Г. В. Любимова 1, Л. С. Кольцова 1, А. И. Шиенок 1, Н. Л. Зайченко 1, *
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: zaina@chph.ras.ru
Поступила в редакцию 13.03.2019
После доработки 13.03.2019
Принята к публикации 20.03.2019
Аннотация
Исследовано влияние природы линейных акриловых полимеров, различающихся содержанием гидроксильных групп, на спектрально-люминесцентные свойства гибридного соединения, молекула которого объединяет два разных люминофорных фрагмента – гидроксизамещенный 2,4,5-триарилимидазольный и 8-азометин-7-гидроксикумариновый, и модельных соединений, соответствующих этим фрагментам. Подобраны оптимальные условия получения акриловых полимеров, содержащих исследуемые люминофоры, методом фотоотверждения. Установлена зависимость люминесцентных свойств материалов от количества гидроксильных групп.
ВВЕДЕНИЕ
В настоящее время органические люминесцентные материалы используются повсеместно в связи с прогрессом в области искусственного освещения и применения дисплеев и флуоресцентных биомедицинских инструментов [1]. Кроме того, соединения с множественной люминесценцией, зависящей от длины волны возбуждения, могут быть использованы для создания нового поколения так называемых “умных” материалов для молекулярной электроники, т.е. молекулярных переключателей, логических устройств и т.д. Среди соединений с множественной люминесценцией предпочтение отдается органическим материалам по сравнению с их неорганическими аналогами из-за их низкой стоимости, легкости настройки, возможности получения в растворах, низкой токсичности и значительной гибкости при получении устройств для молекулярной электроники [2].
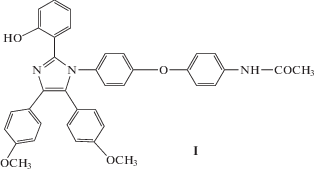
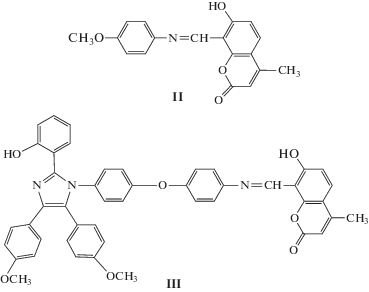
Множественная эмиссия от одного соединения возникает, когда оно может существовать больше чем в одной форме (например, в виде нескольких таутомеров) и общий профиль излучения может быть приписан комбинации отдельных процессов эмиссии от таутомеров [3, 4], а также когда наблюдается баланс двух одновременно генерируемых возбужденных состояний [5] и в некоторых типах люминесцентных диад [6]. В настоящей работе в качестве люминофоров использованы N-[4-[4-[2-(2-гидроксифенил)-4,5-бис(4-метоксифенил)-1Н-имидазол-1-ил]-фенокси] фенил]ацетамид (I), 7-гидрокси-8-(4-метоксифенилиминометил)-4-метил-1-бензопиран-2-он (II) и 7‑гидрокси-8-[4-[4-[2-(2-гидроксифенил)-4,5-ди(4-метоксифенил)-1Н-имидазол-1-ил]фенокси] фенилиминометил]-4-метил-1-бензопиран-2-он (III):
При этом в двух из них (II и III) наблюдается множественная люминесценция, зависящая от длины волны возбуждения.
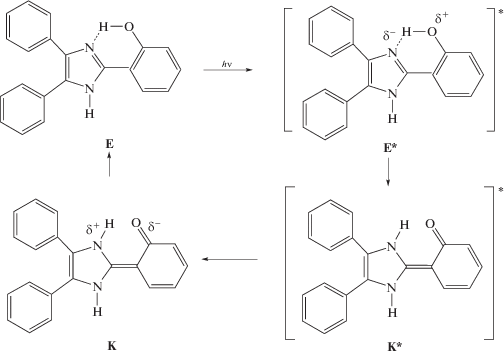
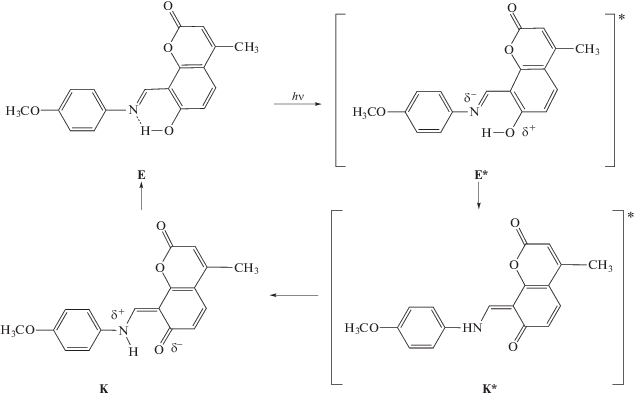
Стационарные оптические свойства соединений I–III были изучены нами ранее в неполярном апротонном растворителе CH2Cl2 и полярном растворителе EtOH, образующем водородные связи [7, 8]. В модельном соединении I наблюдается синяя люминесценция с максимумом около 455 нм в CH2Cl2 и около 445 нм в EtOH, что связано с процессом внутримолекулярного переноса протона (ВПП) гидроксильной группы на атом N гетероцикла в возбужденном состоянии (ВС) исходной енольной (Е) формы молекулы с образованием возбужденной молекулы в кетоформе (К*), которая и испускает люминесценцию. После перехода К* в основное состояние происходит обратный перенос протона и молекула возвращается в форму Е. На Схеме 1 представлен общий вид ВППВС в триарилимидазолах.
Схема 1 . ВППВС в триарилимидазолах
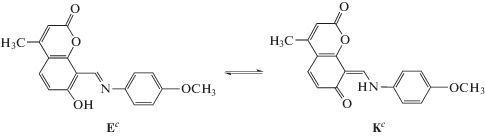
Соединение II в растворах существует в равновесии енол–кетон (Схема 2 ). Следует отметить, что в апротонных средах преобладает енольная форма (Ес), а содержание кетоформы (Кс), имеющей полосу поглощения около 450 нм, увеличивается в протонных растворителях, например в этаноле.
Схема 2 . Таутомерные формы соединения II
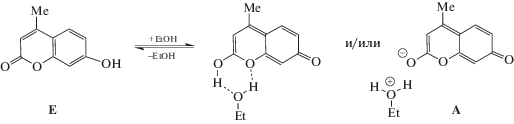
В CH2Cl2 наблюдается одна полоса люминесценции с максимумом при 535 нм, обусловленная ВППВС протона гидроксильной группы на атом N связи C=N (Схема 3 ). В этаноле наблюдается несколько полос, соотношение которых зависит от длины волны возбуждения: при возбуждении светом с длиной волны 330 нм – три полосы (390, 440 и 530 нм), при возбуждении 375 нм – две (440 и 530 нм) и при возбуждении 460 нм – одна с максимумом при 530 нм. Полоса люминесценции с максимумом при 390 нм – это люминесценция енольной формы кумаринового фрагмента, с максимумом при 440 нм – люминесценция ассоциата кумарина со спиртом или аниона А (Схема 4 ), с максимумом при 530 нм – люминесценция, возникшая в результате ВППВС [7].
Схема 3 . ВППВС в модельном соединении II
Схема 4 . Взаимодействие 4-метил-7-гидрокси кумарина с этанолом
Очевидно, что сочетание этих люминесцирующих фрагментов в диаде III позволяет ожидать проявления различных комбинаций люминесцентных откликов гибридного соединения на световое возбуждение в зависимости от условий возбуждения и природы среды. Действительно, синтезированная люминесцентная диада демонстрирует дуальную люминесценцию полос в CH2Cl2 с максимумами при 455 нм (ВППВС в имидазольном фрагменте) и 536 нм (ВППВС в азометинокумариновом фрагменте), соотношение интенсивностей которых зависит от длины волны возбуждения [8]. В этаноле при возбуждении светом с длиной волны 330 нм наблюдаются три полосы люминесценции с максимумами при 390 нм (люминесценция енольной формы кумаринового ядра), 445 и 530 нм, при возбуждении светом с длиной волны 375 нм – полосы две (445 и 530 нм) и с длиной волны 460 нм – одна полоса с максимумом при 530 нм.
Цель настоящей работы – изучение особенностей проявления люминесцентных свойств исследуемых люминофоров в матрицах линейных полимеров, различающихся количеством гидроксильных групп, полученных методом фотоотверждения акриловых композиций, который широко используется при производстве изделий различного назначения [9–11]. Такое исследование соединений с множественной люминесценцией проводится впервые.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединения I описан в работе [12], соединения II – в [7] и соединения III – в [8]. Для приготовления растворов исследуемых соединений использовали органические растворители фирмы “Acros” марки “для спектроскопии”.
Для получения полимерных пленок использовали низковязкие полимеризационно-способные акриловые мономеры: метакриловый эфир этиленгликоля (МЭГ) компании Sigma-Aldrich СН2=С(СН3)–СОО(СН2)2–ОН ([ОН] = 13%) и синтезированный нами его метакриловый аналог МОК-1 [13], не содержащий гидроксильные группы ([ОН] = 0%): СН2=С(СН3)–СОО(СН2)2–ОСООСН3. Для оценки влияния концентрации гидроксильных групп на люминесценцию в пленках использовали также полимерные матрицы, содержащие 4.9% ОН (МЭГ/МОК 4) и 7% ОН (МЭГ/МОК 7).
Полимерные пленки с добавкой исследуемых соединений приготовлены методом фотополимеризации мономеров МЭГ и МОК или их смесей в присутствии добавок люминофоров в метиленхлориде (с последующим его удалением) и фотоинициатора Дарокур 4265 компании Sigma-Aldrich. Фотоотверждение проводили при облучении УФ-лампой ДРТ-1000 через фильтр ПС 13 в течение 3 мин, что обеспечивало глубину отверждения ~92–98% и сохранность спектров поглощения люминофоров в мономере. Концентрация люминофора во всех экспериментах составляла 10–4 м/л, концентрация фотоинициатора – 1 вес.%. Толщина полученной полимерной пленки составляла ~800–900 мкм. Спектры поглощения растворов и пленок регистрировали на спектрофотометре Cary 50 Scan фирмы “Varian Inc.” (США). Спектры люминесценции регистрировали на спектрофлуориметре Cary Eclipse фирмы “Varian Inc.” (США). Ширины щели монохроматоров эмиссии и возбуждения – 5 нм.
Конверсию двойных связей при полимеризации контролировали по золь-фракции на гель-хроматографе системы “БРИЗ”.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Как известно [14], молекулы люминофоров могут трансформироваться под действием света. В зависимости от световой дозы диапазон этих изменений может быть очень широким – от небольших изменений структуры молекулы, связанных с нарушением слабых взаимодействий – водородных или гидрофобных связей – до ее разрушения в результате разрыва ковалентных связей. Чтобы избежать фотораспада исследуемых люминофоров в условиях фотооотверждения акриловых композиций, было изучено влияние времени облучения нефильтрованным светом УФ-лампы ДРТ-1000 на спектры поглощения люминофоров в растворе EtOH. Зафиксированные при этом существенные изменения спектров поглощения соединения III, а также соединений I и II, представляющих его фрагменты, исключают применение облучения нефильтрованным светом УФ-лампы с целью получения люминесцирующих полимерных материалов. В связи с полученными результатами была проведена работа по подбору фильтров для УФ-лампы ДРТ-1000, позволяющих, кроме сохранности люминофора, обеспечить при облучении распад введенного фотоинициатора и, соответственно, максимальную конверсию двойных связей в процессе фотополимеризации акриловых композиций.
Использованный нами фотоинициатор Дарокур 4265 состоит из двух компонентов (Дарокур ТРО – 50% и Дарокур 1173–50%) и характеризуется абсорбционными пиками в метаноле при 240, 272 и 380 нм. Оптимальное соотношение требуемых параметров было достигнуто при облучении через фильтр ПС 13, который использовали в дальнейшем для получения всех полимерных люминесцирующих образцов.
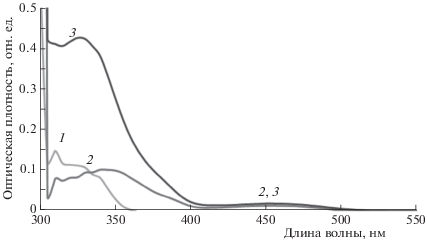
На рис. 1 представлены спектры поглощения соединений I–III в растворе МЭГ, из которых видно, что соединение I поглощает до 350 нм, а соединение II имеет максимум в спектре поглощения при 340–350 нм и поглощение с максимумом при 450 нм, характерное для Кс. В диаде III наблюдаются максимумы поглощения при 330 и 450 нм. В растворе МОК наблюдается поглощение в области только до 400 нм, и характер спектров остается такой же, как в МЭГ.
Рис. 1.
Cпектры поглощения: 1 – соединение I, 2 – соединение II, 3 – соединение III в растворе МЭГ. Концентрация I–III – 10–5 моль/л. Кювета длиной 0.5 см.
В табл. 1 приведены интенсивности и максимумы спектров люминесценции соединений I–III в полимерных матрицах разной природы при возбуждении светом с длиной волны 330 и 350 нм. Как видно из приведенных в этой таблице данных, все фотополимерные пленки, полученные при облучении лампой ДРТ-1000 через фильтр ПС 13, обладают люминесцентными свойствами.
Таблица 1.
Влияние природы полимерной матрицы на люминесцентные свойства пленки, фотоотвержденной в присутствии люминофора c концентрацией 10–4 моль/л (время облучения – 3 мин, светофильтр ПС 13)
| Соединение | Полимерная матрица | λex, нм | λfl, нм | I |
|---|---|---|---|---|
| I | МЭГ | 330 | 447 | 912 |
| 350 | 444 | 118* | ||
| I | МЭГ/МОК 7 | 330 | 452 | 536* |
| 350 | 449 | 292* | ||
| I | МЭГ/МОК 4 | 330 | 448 | 617* |
| 350 | 450 | 340* | ||
| I | МОК | 330 | 454 | 473* |
| 350 | 452 | 229* | ||
| II | МЭГ | 330 | 420 | 106 |
| 522 | 176 | |||
| 350 | 417 | 88 | ||
| 521 | 315 | |||
| II | МЭГ/МОК 7 | 330 | 418 | 88 |
| 524 | 198 | |||
| 350 | 418 | 78 | ||
| 531 | 328 | |||
| II | МЭГ/МОК 4 | 330 | 417 | 98 |
| 525 | 260 | |||
| 350 | 417 | 93 | ||
| 529 | 425 | |||
| II | МОК | 330 | 416 | 138 |
| 535 | 351 | |||
| 350 | 418 | 129 | ||
| 531 | 545 | |||
| III | МЭГ | 330 | 455 | 555 |
| 517 | 339 | |||
| 350 | 442 | 327 | ||
| 526 | 382 | |||
| III | МЭГ/МОК 7 | 330 | 451 | 711 |
| 520 | 409 | |||
| 350 | 449 | 402 | ||
| 525 | 408 | |||
| III | МЭГ/МОК 4 | 330 | 450 | 774 |
| 519 | 389 | |||
| 350 | 448 | 460 | ||
| 530 | 405 | |||
| III | МОК | 330 | 451 | 593 |
| 527 | 459 | |||
| 350 | 449 | 357 | ||
| 534 | 476 |
Как видно из полученных данных, люминофор I во всех изученных полимерных пленках характеризуется только синей люминесценцией с максимумом при 445–455 нм, обусловленной протеканием ВППВС (Схема 1 ), как и в растворах CH2Cl2 и EtOH [12]. Следует отметить, что интенсивность этой полосы в пленке МОК в ~2.3 раза превышает ее интенсивность в гидроксилсодержащей матрице МЭГ (см. табл. 1), так как гидроксилсодержащая среда препятствует протеканию ВППВС из-за образования водородных связей между люминофором и матрицей.
Соединение II во всех полимерных пленках характеризуется двумя полосами люминесценции: полосой с максимумом при 415–420 нм, которая относится к люминесценции ассоциата кумаринового ядра с гидроксилом или аниона, и полосой с максимумом при 521–538 нм, относящейся к люминесценции возбужденной цис-кетоформы, которая может образоваться либо в результате ВППВС из енольной формы, либо при прямом возбуждении цис-кетоформы [7]. Причем соотношение интенсивностей этих полос изменяется в зависимости от длины волны возбуждения (см. табл. 1) аналогично ситуации с раствором EtOH.
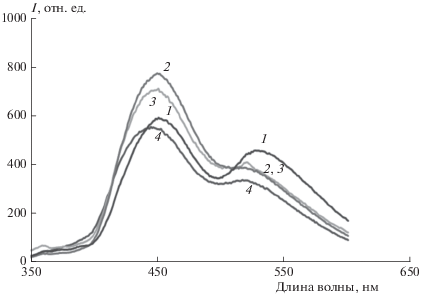
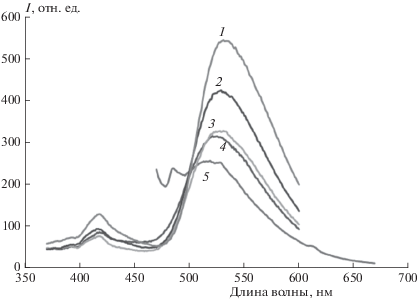
Для полимерных пленок, содержащих соединение II, следует отметить, что наличие гидроксила в матрице полимера (МЭГ) по-разному влияет на интенсивность полос люминесценции: почти не влияет на интенсивность люминесценции при 414–420 нм и существенно снижает люминесценцию возбужденной кетоформы (максимум при 520–540 нм), т.е. подавляет ВППВС за счет образования водородных связей с полимером (рис. 2). При возбуждении светом с длиной волны λ = 330 и 350 нм интенсивность люминесценции этой полосы неуклонно уменьшается при переходе в ряду концентраций ОН в полимере 0%, 4%, 7%, 13%, так как взаимодействие с ОН-группами полимера снижает эффективность ВППВС. Только в матрице МЭГ при возбуждении светом с длиной волны в интервале 430–450 нм (в полосу поглощения Кс) наблюдается одна длинноволновая полоса люминесценции (кривая 5 на рис. 2).
Рис. 2.
Спектры люминесценции соединения II в полимерных матрицах в зависимости от [ОН]: 1 – MOK, 2 – MЭГ/MOK 4, 3 – MЭГ/MOK 7, 4 – MЭГ при λex = 350 нм, 5 – MЭГ при λex = 450 нм.
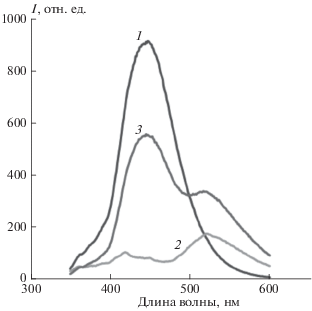
Люминесцентная диада III во всех полимерных матрицах характеризуется двумя полосами эмиссии, которые можно отнести к структурам с переносом протона в обоих фрагментах – имидазольном и азометинокумариновом (рис. 3). Наиболее интенсивная эмиссия имидазольного фрагмента с максимумом при 440–460 нм накладывается на менее интенсивную полосу люминесценции от кумаринового ассоциата или аниона с максимумом при 420 нм. Следует особо отметить, что при объединении фрагментов в диаду интенсивность обеих полос люминесценции существенно превысила соответствующую люминесценцию модели II.
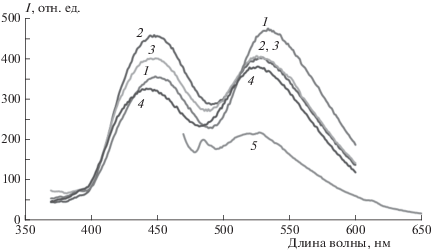
Рис. 3.
Спектры люминесценции соединений I–III в пленке МЭГ при λех = 330 нм: 1 – соединение I, 2 – соединение II, 3 – соединение III.
Из рис. 4 видно, что интенсивность длинноволновой полосы эмиссии понижается с увеличением [OH] в полимере, так же как и для соединения II. Коротковолновая полоса эмиссии демонстрирует более сложную зависимость. Соотношение этих полос зависит также от длины волны возбуждения – при возбуждении светом с λ = 330 нм (рис. 4) преобладает полоса с максимумом при 450 нм, обусловленная ВППВС в имидазольном фрагменте, а при λ = 350 нм (рис. 5) их интенсивности выравниваются. Как видно из спектров поглощения рассмотренных моделей (рис. 1), поглощение соединения I при λ = 330 нм выше, чем у соединения II, а при λ = 350 нм – наоборот. Это объясняет наблюдаемую для соединения III зависимость интенсивности полос люминесценции от длины волны возбуждения и свидетельствует об отсутствии передачи энергии между фрагментами диады. Следует отметить (см. рис. 5), что возбуждение светом с длиной волны ≥400 нм приводит, как и в случае соединения II, к проявлению только в МЭГ одной длинноволновой эмиссии (кривая 5).
ЗАКЛЮЧЕНИЕ
Оптимизированы условия получения люминесцирующих полимеров методом фотоотверждения акриловых композиций. Получены люминесцирующие полимерные пленки, содержащие гибридное органическое соединение, молекула которого объединяет два разных люминофорных фрагмента, или модельные соединения, соответствующие этим фрагментам. В случае двух соединений (II и III) наблюдается множественная люминесценция, зависящая от длины волны возбуждения и концентрации гидроксильных групп в линейных акриловых полимерах.
Работа выполнена в рамках госзадания 0082-2014-0015.
Список литературы
Krasovitskii B.M., Bolotin B.M. Organic Luminescent Materials. Weinheim: Wiley-VCH, 1988.
Klauk H. Organic electronics: materials, manufacturing, and applications. Weinheim: Wiley-VCH, 2006.
Brancato G., Signore G., Polli D. et al. // J. Phys. Chem. B. 2015. V. 119. P. 6144.
Mukherjee S., Thilagar P. // Dyes and Pigments. 2014. V. 110. P. 27.
Cao H., Chang V., Hernandez R., Heagy M.D. // J. Org. Chem. 2005. V. 70. P. 4929.
Park S., Kwon J.E., Kim S.H. et al. // J. Amer. Chem. Soc. 2009. V. 131. P. 14043.
Liubimov A.V., Venidiktova O.V., Valova T.M. et al. // Photochem. Photobiol. Sci. 2018. V. 17. P. 1365.
Зайченко Н.Л., Кольцова Л.С., Любимов А.В. и др. // Матер. Всерос. научн. конф. “Технологии и материалы для экстремальных условий”. М: МЦАИ РАН, С. 35.
Барачевский В.А., Котова А.В., Матвеева И.А. и др. Фотохромная полимеризационноспособная композиция, фотохромный сетчатый оптический материал и способ его получения: Патент РФ 2402578 // Б.И. 2010. № 30.
Матвеева И.А., Шашкова В.Т., Котова А.В. и др. // Все материалы. Энциклопедический справочник. 2015. № 9. С. 22.
Zaichenko N.L., Zapadinskii B.I., Kotova A.V. et al. // Additives in Polymers: Analysis and Applications. Waretown, Oakville: Apple Academic Press Inc., 2016. P. 21.
Любимов А.В., Любимова Г.В., Шиенок А.И. // Евразийский союз ученых. 2017. Т. 40. № 7. С. 19.
Берлин А.А., Королёв Г.В., Кефели Т.Я., Сивергин Ю.М. Акриловые олигомеры и материалы на их основе. М.: Химия, 1983.
Комлев И.В. Дис. … д-ра хим. наук. М.: РХТУ, 2016.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика