Химическая физика, 2019, T. 38, № 9, стр. 14-29
Новый сокатализатор для реакций полимеризации алкенов на металлокомплексных катализаторах
Л. А. Ришина 1, *, Y. V. Kissin 2, С. Ч. Гагиева 3, С. С. Лалаян 1
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Rutgers, The State University of New Jersey, Department of Chemistry and Chemical Biology
NJ, USA
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: rishina@polymer.chph.ras.ru
Поступила в редакцию 20.02.2019
После доработки 28.02.2019
Принята к публикации 20.03.2019
Аннотация
Изучен эффект сокатализатора в реакциях гомо- и сополимеризации алкенов на металлокомплексных катализаторах различного типа. Oбобщены результаты исследований реакций полимеризации этилена, пропилена и высших линейных 1-алкенов, а также сополимеризации этилена с линейными 1-алкенами на различных металлокомплексных катализаторах в сочетании с бинарным сокатализатором Al(C2H5)2Cl/Mg(C4H9)2 при [Al]:[Mg] > 2.5. Исследованы традиционные катализаторы: TiCl4, Ti(Oi-C3H7)4, TiCl3, и постметаллоценовые комплексы титана с различными органическими лигандами. Бинарный сокатализатор значительно увеличивает активность традиционных катализаторов по сравнению с Al(C2H5)2Cl и активность постметаллоценовых комплексов в сравнении с полиметилалюмоксаном (МАО). Активные центры этих каталитических систем неоднородны по кинетическим параметрам, стереоспецифичности и сополимеризующей способности. Эффективность сокатализатора Al(C3H5)2Cl/Mg(C4H9)2 связана с образованием in situ высокодисперсного MgCl2 и иммобилизацией катионных активных центров на его поверхности.
ВВЕДЕНИЕ
Комбинации AlR2Cl и ${\text{MgR}}_{2}^{'}$ при молярном отношении [Al]:[Mg] > 2.5 являются эффективными сокатализаторами для всех типов металлокомплексных катализаторов в реакциях полимеризации алкенов [1]. В этой работе мы обобщаем результаты последних исследований реакций полимеризации этилена, пропилена и высших линейных 1-алкенов, а также сополимеризации этилена с линейными 1-алкенами в присутствии различных металлокомплексных катализаторов в сочетании с бинарным сокатализатором Al(C2H5)2Cl/Mg(C4H9)2. Были исследованы традиционные катализаторы: TiCl4, Ti(Oi-C3H7)4, TiCl3, и постметаллоценовые (ПМЦ) комплексы титана с различными органическими лигандами. Для сравнения использовали традиционные активаторы металлокомплексных катализаторов Al(C2H5)2Cl и полиметилалюмоксан (МАО).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Этилен и пропилен полимеризационной степени чистоты (99.9 об.%.) Московского нефтеперерабатывающего завода применяли без дополнительной очистки. TiCl4, Ti(Oi-C3H7)4, Al(C2H5)2Cl (раствор в гептане 0.8 моль/л) и Mg(C4H9)2 (раствор в гептане 0.5 моль/л) фирмы “Acros” использовали без дополнительной очистки. Толуол квалификации “осч”, 1-гексен и 1-октен кипятили над Na и перегоняли в токе аргона. 1-децен выдерживали над молекулярными ситами и продували аргоном.
В табл. 1 приведены использованные в работе ПМЦ-комплексы. Синтез лигандов и комплексов описан в работах [2–4]. Комплексы II, III и V вводили в реакционную среду в чистом виде, а комплексы I и IV в виде суспензии в толуоле без выделения MgCl2, который является побочным продуктом синтеза.
Таблица 1.
Постметаллоценовые комплексы титана
| Kомплекс | Формула |
|---|---|
| Диоксолановый комплекс, I | [(4R,5R)-2,2-(CH3)2-α,α,α',α-тетра-(F5-фенил)-1,3-диоксолан-4,4-диметанол]TiCl2 |
| Hафталатный комплекс, II | 1,1'-ди-2-нафталат-бис(изо-пропокси)Ti |
| Феноксииминный комплекс, III | бис-[N-(3,5-t-Bu2-салицилиден)-2,3,5,6-F4-анилин]TiCl2 |
| Cалигениный комплекс, IV | {2-[α,α-(CF3)2-метанолато]-4,6-t-Bu2-фенолато}TiCl2 |
| Xинолиновый комплекс, V | {2-[оксалат(дифенил)метил]-8-гидроксихинолинат}TiCl2···(HOi-C3H7) |
Реакции полимеризации
Все реакции полимеризации проводили в стальном реакторе объемом 200 мл с мешалкой. Перед проведением экспериментов реактор вакуумировали в течение 1 ч при температуре опыта. Полимеризацию пропилена осуществляли в режиме полного заполнения реактора жидким мономером по методике, приведенной в работе [5]. В случае полимеризации этилена и сополимеризации этилена с 1-алкенами реактор заполняли толуолом (или н-гeптaнoм) или смесью рacтворитeля с 1-алкеном; объем жидкой фазы составлял 100 мл. Затем в реакционную среду последовательно вводили Al(C2H5)2Cl и Mg(C4H9)2. Полученную смесь насыщали этиленом и затем разбивали внутри реактора ампулу с катализатором. Давление в реакторе в ходе опытов поддерживали постоянным, компенсируя расход этилена подпиткой из калиброванной емкости. Полученные полимеры и сополимеры обрабатывали смесью этилового спирта с HCl (10%-ный раствор), затем многократно промывали водой и спиртом и сушили до постоянной массы.
Активность катализаторов оценивали по выходу полимера, отнесенного к молю Ti (кг/моль Ti). Эффективную константу скорости полимеризации рассчитывали как kэф = Rпол/(CмонCTi) (л/моль Ti ⋅ мин), где Rпол – скорость полимеризации (моль/л ⋅ мин), Cмон и CTi – концентрации мономера и соединения Ti (моль/л).
Анализ полимеров
Mолекулярные массы (ММ) и ММ распределение (ММР) полимеров были измерены гель-хроматографическим (ГПХ) методом в 1,2,4-трихлорбензоле при 135 °С на хроматографе “Waters GPCV-2000” с PL-gel колонкой. ММ рассчитывали по универсальной калибровочной кривой с использованием полистирольных стандартов.
Процедура разделения кривых ГПХ на кривые индивидуальных компонентов Флори описана ранее [6, 7]. Компонент Флори – это полимерный продукт, производимый одним типом активных центров.
Спектры ЯМР 13С 5%-ных растворов полимеров в о-дихлорбензоле при температуре 99 °C записывали на приборе “Bruker AVANCE III 400” (частота 100.613 МГц). Отнесение сигналов в cпектрax сополимеров этилена с 1-алкенами и полипропилена (ПП) было выполнено на основании литературных данных [8–12]. Из спектров ЯМР 13С образцов определяли содержание 1-алкена в сополимерах и содержание стерических пентад и гептад в ПП.
ИК-спектры полимеров снимали на Фурье-спектрометре “Perkin-Elmer”. Содержание 1-алкенов в сополимерах $C_{{\text{M}}}^{{{\text{сопол}}}}$ (мольн.%) определяли по соотношению оптической плотности полос 1380, 1368 и 722 см–1 (D1380/D1368 и D1380/D722) с использованием калибровочных кривых [13]. В качестве параметров стереорегулярности ПП использовали отношения оптической плотности полос 998, 841 и 973 см–1 (D998/D973 и D841/D973), которые характеризуют наличие в полимерной цепи изотактических последовательностей звеньев пропилена длиной более 11–13, 13–15 и 3–5 мономерных единиц [14, 15] соответственно.
Кривые плавления полимеров были записаны на ДСК-анализаторе “Netzsch DSC-209 F1” (образцы массой 3–5 мг) при скорости нагревания 10 °С/мин. Для детального анализа композиционной и структурной неоднородностей полимеров использовали данные, полученные при втором плавлении образцов (скорость нагревания 2 °С/мин) после медленной кристаллизации. Степень кристалличности χ полиэтилена (ПЭ), ПП и сополимеров этилена рассчитывали из теплоты плавления ΔHпл как (ΔHпл/$\Delta H_{{{\text{пл}}}}^{^\circ }$) · 100%, где $\Delta H_{{{\text{пл}}}}^{^\circ }$ для ПЭ и ПП рaвны соответственно 293 и 167 Дж/г.
Рентгеновские спектры (РСА) полимеров снимали на дифрактометре ДРОН-2 (Cu(Kα)-излучение, Ni-фильтр, скорость сканирования 1°(2θ)/мин). Степень кристалличности образцов находили по соотношению интегральной интенсивности кристаллической составляющей и общей интенсивности.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Реакции гомополимеризации этилена и сополимеризации этилена с 1-гексеном
В табл. 2 представлены основные результаты полимеризации этилена и сополимеризации этилена с 1-гексеном (Э/Г). В качестве сокатализаторов использовали Al(C2H5)2Cl и бинарный сокатализатор Al(C2H5)2Cl/Mg(C4H9)2. Во всех случаях, применение комбинации Al(C2H5)2Cl и Mg(C4H9)2 приводило к резкой активации этих катализаторов. Так, при использовании катализатора Циглера, TiCl4–Al(C2H5)2Cl (без Mg(C4H9)2), выход ПЭ составил 223 кг/моль Ti, а в случае Ti(Oi-C3H7)4 в этих условиях были получены только следы полимера. Однако добавление Mg(C4H9)2 при мольном отношении [Al]:[Mg] ~ 3 привело к резкому увеличению выхода ПЭ до ~1.4–1.5 т/моль Ti.
Таблица 2.
Сополимеризация этилена с 1-гексеномa
| Система | $C_{{\text{М}}}^{{{\text{мон}}}},$ моль/л | [Ti] ⋅ 105, моль | [Al] : [Ti], моль/моль | [Al] : [Mg], моль/моль | Выход, кг/мольTi | $C_{{\text{Г}}}^{{{\text{сопол}}}},$ мольн.%б |
|---|---|---|---|---|---|---|
| TiCl4–Al(C2H5)2Cl/Mg(C4H9)2 | 0 | 3.20 | 400 | – | 223 | 0 |
| 0 | 0.90 | 330 | 3.0 | 1380 | 0 | |
| 0.15 | 0.95 | 330 | 3.2 | 2280 | 2.1 | |
| 0.36 | 0.84 | 380 | 3.2 | 2130 | 6.0 | |
| 1.52 | 0.85 | 350 | 3.0 | 2310 | 21 | |
| Ti(Oi-C3H7)4–Al(C2H5)2Cl/Mg(C4H9)2 | 0 | 2.36 | 335 | – | – | 0 |
| 0 | 0.62 | 370 | 3.0 | 1480 | 0 | |
| 0.60 | 0.84 | 320 | 3.2 | 840 | 1.3 | |
| 0.90 | 0.84 | 320 | 3.2 | 2430 | 8.4 | |
| 1.5 | 0.79 | 290 | 3.0 | 3010 | 15.8 |
Кинетика полимеризации этилена в обоих случаях имеет ярко выраженный нестационарный характер: при 50 °С большая часть полимерного продукта образуется уже за первые 10 мин реакции. На рис. 1 приведены кинетические кривые полимеризации этилена в присутствии систем Ti(Oi-C3H7)4–Al(C2H5)2Cl/Mg(C4H9)2 и TiСl4–Al(C2H5)2Cl/Mg(C4H9)2.
Рис. 1.
Кинетические кривые полимеризации этилена для систем Ti(Oi-C3H7)4–Al(C2H5)2Cl/Mg(C4H9)2 (▲) и TiСl4–Al(C2H5)2Cl/Mg(C4H9)2 (⚫).
Выход сополимеров при использовании системы TiCl4–Al(C2H5)2Cl/Mg(C4H9)2 при 50 °С был равен ~2 т/моль Ti ⋅ ч, а системы Ti(Oi-C3H7)4–Al(C2H5)2Cl/Mg(C4H9)2) – в зависимости от состава мономерной смеси находился в диапазоне от 0.8 до ~3 т/моль Ti ⋅ ч. Cодержание 1-гексена в сополимерах варьировалось от ~1 до ~15–20 мольн.%. При больших концентрациях 1-гексена в присутствии этих систем наблюдали сомономерный эффект – увеличение активности катализатора в реакциях полимеризации этилена при добавлении 1-алкенов. Этот эффект хорошо известен как для гетерогенных катализаторов Циглера–Натта, так и для металлоценовых и ПМЦ-катализаторов [16–18].
Способность эффективно сополимеризовать 1-алкены с этиленом является важной характеристикой любого катализатора на основе Ti, используемого для синтеза ПЭ средней и низкой плотности. Сравнение составов мономерной смеси и сополимера позволило примерно оценить константы сополимеризации r1 в случае реакций при низком содержании 1-гексена:
(1)
${{r}_{1}} = {{{{k}_{{{\text{Э - Э}}}}}} \mathord{\left/ {\vphantom {{{{k}_{{{\text{Э - Э}}}}}} {{{k}_{{{\text{Э - Г}}}}}}}} \right. \kern-0em} {{{k}_{{{\text{Э - Г}}}}}}} \cong {{{{({{C}_{{\text{Э}}}}} \mathord{\left/ {\vphantom {{({{C}_{{\text{Э}}}}} {{{C}_{{\text{Г}}}}}}} \right. \kern-0em} {{{C}_{{\text{Г}}}}}}{{)}^{{{\text{сопол}}}}}} \mathord{\left/ {\vphantom {{{{({{C}_{{\text{Э}}}}} \mathord{\left/ {\vphantom {{({{C}_{{\text{Э}}}}} {{{C}_{{\text{Г}}}}}}} \right. \kern-0em} {{{C}_{{\text{Г}}}}}}{{)}^{{{\text{сопол}}}}}} {}}} \right. \kern-0em} {}}{{({{{{C}_{{\text{Э}}}}} \mathord{\left/ {\vphantom {{{{C}_{{\text{Э}}}}} {{{C}_{{\text{Г}}}}}}} \right. \kern-0em} {{{C}_{{\text{Г}}}}}})}^{{{\text{мон}}}}},$Этилен обладает самой высокой реакционной способностью в реакциях роста цепи по сравнению со всеми 1-алкенами, и значения r1 всегда больше 1. Для реакций, катализируемых TiCl4 и Ti(Oi-C3H7)4, они равны соответственно 16–20 и ~60.
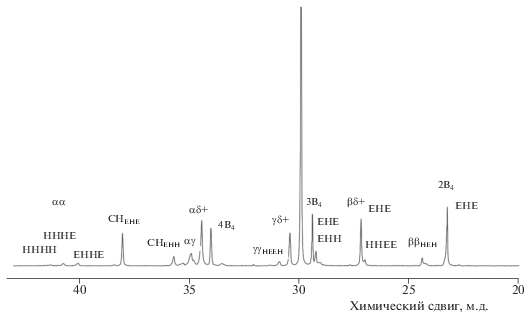
Проведен анализ спектров ЯМР 13С ПЭ и сополимеров Э/Г, сигналы отнесены согласно данным работы [9]. Из анализа спектра ЯМР 13С ПЭ следует, что это линейный полимер: его спектр содержит интенcивный сигнал групп –CH2– при 29.8 м.д. и слабые сигналы насыщенных линейных концевых групп. Сополимеры Э/Г с $C_{{\text{Г}}}^{{{\text{сопол}}}}$ = 1.3, 2.1 и 6.0 мольн.%, в основном, состоят из длинных последовательностей мономерных звеньев этилена, ~ЭЭЭЭЭЭЭ~ (сигнал δ,δ-CH2 при 29.8 м.д.), и изолированных звеньев 1-гексена, ~ЭЭЭГЭЭЭ~ (сигналы CH(ЭГЭ) при 38.1 м.д. и 3B4 CH2(ЭГЭ) при 29.5 м.д.). Только в спектре сополимера с $C_{{\text{Г}}}^{{{\text{сопол}}}}$ ~ 21 мольн.% (рис. 2) присутствуют слабые сигналы последовательностей ~ЭЭГГЭЭ~ (сигнал CH(ЭГГ) при 35.8 м.д., 3B4 CH2(ЭГГ) при 29.1 м.д. и α,α-CH2(ЭГГЭ) при 40.2 м.д.). Отношение интенcивнocтeй этих сигналов позволяет примерно определить значение произведения констант сополимеризации, r1r2 [19]. Например, отношения сигналов [ГГЭ]:[ЭГЭ] и [ЭГГЭ]:[ЭГЭ] для сополимера с $C_{{\text{Г}}}^{{{\text{сопол}}}}$ ~21 мольн.%, полученного в присутствии системы TiCl4–Al(C2H5)2Cl/Mg(C4H9)2 в н-гептане, равны соответственно 0.52 и 0.14; для сополимера того же состава, полученного в толуоле, эти отношения равны 0.45 и 0.15. Используя статистические уравнения для содержания различных триад и тетрад в сополимерах этилена с 1-алкенами как функций значений $C_{{\text{М}}}^{{{\text{сопол}}}}$ и r1r2 [19], было определено, что значение r1r2 находится в интервале 0.8–1.0. Это означает, что распределение мономерных звеньев в цепях сополимеров Э/Г является, в основном, статистическим.
Рис. 2.
Спектр ЯМР 13С сополимера Э/Г с $C_{{\text{Г}}}^{{{\text{сопол}}}}$ ~21 мольн.%. Система TiCl4–Al(C2H5)2Cl/Mg(C4H9)2. Положение групп CH2 относительно CH обозначено греческими буквами, положение групп CH2 в бутильных (B) боковых группах относительно CH3 обозначено цифрами.
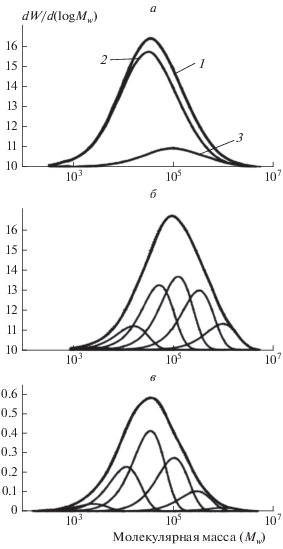
Увеличение содержания 1-гексена в сополимерах Э/Г приводит к уменьшению их ММ и эффективной температуры плавления Тпл, а также к резкому снижению теплоты плавления ΔHпл и степени кристалличности χ, как это характерно для реакций сополимеризации этилена и 1-алкенов в целом (табл. 3) [18, 19]. По данным ГПХ, как ПЭ, так и сополимеры Э/Г, имеют широкое ММР, которое отражает присутствие в катализаторах разных типов активных центров, отличающихся по кинетическим параметрам (рис. 3а). Вce эти полимерные продукты представляют собой смеси компонентов с разными ММ. Разложение кривых ГПХ на компоненты Флори позволяет оценить число типов активных центров, а также относительное количество полимера, производимое каждым типом центра. В качестве примера на рис. 3б и в табл. 4 представлены результаты разделения на компоненты Флори кривых ГПХ ПЭ и сополимеров Э/Г, полученных в присутствии системы Ti(Oi-C3H7)4–Al(C2H5)2Cl/Mg(C4H9)2. Из приведенных результатов видно, что введение 1-гексена в полимеризационную среду приводит к двум эффектам: некоторoму уменьшению значения Mw каждого компонента Флори и относительному увеличению доли активных центров, производящих макромолекулы с низкими ММ (компоненты III и IV).
Таблица 3.
Молекулярно-массовые и структурные характеристики ПЭ и сополимеров Э/Г
| $C_{{\text{Г}}}^{{{\text{сопол}}}},$ мольн.% | Мw ⋅ 10–3 | Мw/Мn | Tпл, °Ca | ΔHпл, Дж/гa | χ, %б |
|---|---|---|---|---|---|
| TiCl4–Al(C2H5)2Cl/Mg(C4H9)2 | |||||
| 0 | 134 | 142.6 | 60 | ||
| 2.1 | 222.5 | 8.1 | 124 | 99.5 | 42 |
| 6.0 | 161.2 | 7.6 | 124 | 57.7 | 24 |
| 21 | 154.6 | 7.5 | 123 | 19.0 | ~8 |
| Ti(Oi-C3H7)4–Al(C2H5)2Cl/Mg(C4H9)2 | |||||
| 0 | 446 | 24 | 133 | 190 | 65 |
| 1.3 | 400 | 19 | 127 | 125 | 43 |
| 8.4 | 354 | 11 | 123 | 44 | 15 |
| 15.8 | 142 | 20 | – | 16 | ~6 |
Рис. 3.
а – кривые ГПХ ПЭ (1) и сополимеров Э/Г с $C_{{\text{Г}}}^{{{\text{сопол}}}}$ = 1.3 (2) и 8.4 мольн.% (3); б – разделение кривой ГПХ сополимера с $C_{{\text{Г}}}^{{{\text{сопол}}}}$ = 8.4 мольн.% на компоненты Флори; точки – экспериментальные данные, линии – расчет.
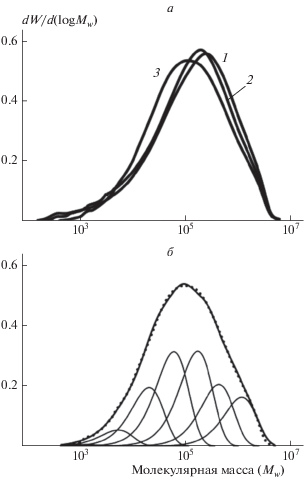
Таблица 4.
Разделение кривых ГПХ ПЭ и сополимеров Э/Гa
| Компонент Флори |
Мw ⋅ 10–3 | Содержание, % | Мw ⋅ 10–3 | Содержание, % | Мw ⋅ 10–3 | Содержание, % |
|---|---|---|---|---|---|---|
| $C_{{\text{Г}}}^{{{\text{сопол}}}}$ = 0 | $C_{{\text{Г}}}^{{{\text{сопол}}}}$ = 1.3, мольн.% | $C_{{\text{Г}}}^{{{\text{сопол}}}}$ = 8.4, мольн.% | ||||
| I | 1.8 | 2.1 | 1.8 | 2.0 | 1.6 | 0.4 |
| II | 7.6 | 4.3 | 7.2 | 5.6 | 6.7 | 4.3 |
| III | 28 | 10.8 | 27 | 10.4 | 26 | 15.6 |
| IV | 86 | 19.1 | 81 | 19.1 | 77 | 25.0 |
| V | 254 | 29.0 | 225 | 29.9 | 222 | 25.3 |
| VI | 660 | 20.4 | 600 | 20.0 | 550 | 16.4 |
| VII | 1700 | 14.3 | 1600 | 13.0 | 1600 | 13.0 |
| Средние значенияб |
$M_{w}^{{{\text{ср}}}}$ = 470 000 Mw/Mn = 24 |
$M_{w}^{{{\text{ср}}}}$ = 418 000 Mw/Mn = 22 |
$M_{w}^{{{\text{ср}}}}$ = 363 000 Mw/Mn = 14.5 |
|||
a Условия полимеризации приведены в табл. 2. б Рассчитаны из значений Mw компонентов Флори и их содержания.
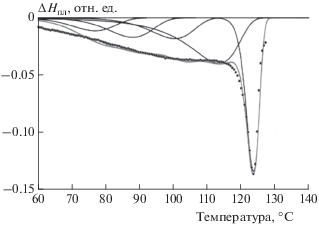
Наличие разных типов активных центров предполагает, что макромолекулы могут отличаться не только MM характеристиками, но и составом [19]. Для проверки этого предположения был использован метод ДСК. В работе [20] было показано, что положение максимума на кривой плавления ДСК и форма кривой плавления сополимеров этилена с 1-алкенами зависят от состава сополимеров и степени иx композиционной неоднородности. Однородные по составу сополимеры, получаемые на одноцентровых металлоценовых катализаторах, имеют относительно узкие кривые плавления, и значения их Тпл быстро уменьшаются с увеличением содержания 1-алкена в сополимере. В противоположность этому, неоднородные по составу сополимеры, синтезированные в присутствии многоцентровых гетерогенных катализаторов, имеют широкие кривые плавления (иногда они состоят из нескольких компонентов), а их Тпл относительно слабо зависят от состава сополимера. Этот подход позволяет разделить любой сополимер, синтезированный в присутствии многоцентрового катализатора, на два основных компонента: частично кристаллический компонент с низким содержанием 1-алкена (он может быть получен как на одном, так и на нескольких типах активных центров) и практически аморфный компонент. На рис. 4 приведены: кривая плавления сополимера Э/Г с $C_{{\text{Г}}}^{{{\text{сопол}}}}$ = 6.0 мольн.%, полученного в присутствии системы TiCl4–Al(C2H5)2Cl/Mg(C4H9)2, и разделение этой кривой на пять отдельных компонентов. Параметры этих компонентов приведены в табл. 5. Кристаллическая часть этого сополимера ($C_{{\text{Г}}}^{{{\text{сопол}}}}$ ~3.1 мольн.%) составляет ~50% от всего полимерного продукта, а остальная часть – полностью аморфный сополимер, который не регистрируется методом ДСК.
Реакции полимеризации пропилена
В табл. 6 приведены основные результаты полимеризации пропилена в присутствии катализаторов TiCl4, Ti(Oi-C3H7)4 и δ-TiCl3 с использованием в качестве сокатализаторов Al(C2H5)2Cl и комбинации Al(C2H5)2Cl/Mg(C4H9)2. Так же как в случаях гомо- и сополимеризации этилена, применение бинарного сокатализатора приводит к резкой активации этих катализаторов. Cистема Ti(Oi-C3H7)4–Al(C2H5)2Cl вообще не проявляла никакой активности, а выход ПП для классического катализатора Циглера, TiCl4–Al(C2H5)2Cl, составил всего ~8 кг/моль Ti. C комбинацией Al(C2H5)2Cl/Mg(C4H9)2 в обоих случаях он увеличивался до ~10 т/моль Ti. Выход ПП в присутствии δ-TiCl3 при использовании бинарного сокатализатора также возрастал в ~25 раз.
Таблица 6.
Полимеризация пропиленаa
| Катализатор | Сокатализатор | Ti ⋅ 105, моль | [Al] : [Ti], моль/моль | [Al] : [Mg], моль/моль | Выход, кг/моль Ti |
|---|---|---|---|---|---|
| TiCl4б | Al(C2H5)2Cl | 1.20 | 340 | – | ~8 |
| TiCl4 | Al(C2H5)2Cl/Mg(C4H9)2 | 0.54 | 440 | 2.5 | 10740 |
| Ti(Oi-C3H7)4 | Al(C2H5)2Cl | 1.25 | 326 | – | – |
| Ti(Oi-C3H7)4 | Al(C2H5)2Cl/Mg(C4H9)2 | 0.62 | 353 | 3.48 | 9680 |
| δ-TiCl3 | Al(C2H5)2Cl | 5.11 | 49 | – | 49 |
| δ-TiCl3 | Al(C2H5)2Cl/Mg(C4H9)2 | 4.72 | 60 | 2.96 | 1207 |
Все полученные продукты являются высокомолекулярными частично кристаллическими полимерами с Тпл = 151–153 °С (табл. 7). Фракционирование в кипящем гептане дает возможность разделить ПП на две фракции: растворимую фракцию (аморфный полимер) и нерастворимую фракцию, частично состоящую из кристаллического изотактического полимера. Наличие двух фракций говорит о том, что активные центры катализаторов отличаются по стереоспецифичности.
Таблица 7.
Свойства ПП и его фракций
| Образец | Содержание, % | Мw | Мw/Мn | [mmmm], %а | A998/A973б | A841/A973б | Тпл, °С | ΔHпл, Дж/г | χ, %в |
|---|---|---|---|---|---|---|---|---|---|
| TiCl4–Al(C2H5)2Cl/Mg(C4H9)2 | |||||||||
| Общий полимер | 54 700 | 4.8 | 0.40 | 0.33 | 154 | 12 | 6 | ||
| Нерастворимая фракция | 11 | 93 400 | 3.6 | 66 | 0.80 | 0.609 | 153 | 53.5 | 32 |
| Ti(Oi-C3H7)4–Al(C2H5)2Cl/Mg(C4H9)2 | |||||||||
| Общий полимер | 98 400 | 8.1 | 34 | 0.37 | 0.20 | ||||
| Нерастворимая фракция | 14 | 217 400 | 7.5 | 41 | 0.80 | 0.59 | 158 | 81.5 | 49 |
| Растворимая фракция | 86 | 80 400 | 7.8 | 21 | 0.30 | 0.14 | |||
Широкое ММР полимеров пропилена и их фракций отражает неоднородность активных центров по кинетическим параметрам. На рис. 5 в качестве примера представлена кривая ГПХ полимера, синтезированного в присутствии системы Ti(Oi-C3H7)4–Al(C2H5)2Cl/Mg(C4H9)2 при 50 °С, а также его растворимой и нерастворимой фракций. Разделение кривых ГПХ фракций ПП на компоненты Флори показало, что каждая фракция является смесью шести компонентов с разными ММ, которые соответствуют шести типам активных центров. Средние ММ нерастворимых фракций всегда выше, чем ММ растворимых фракций.
Рис. 5.
Кривые ГПХ ПП: а – общий полимер (1), растворимая фракция (2), нерастворимая фракция (3); б и c – разделение кривых ГПХ нерастворимой и растворимой фракций на компоненты Флори.
Полимеры пропилена, полученные в присутствии TiCl4 и Ti(Oi-C3H7)4 с Al(C2H5)2Cl/Mg(C4H9)2 в качестве сокатализатора, являются практически полностью аморфными и атактическими материалами, их не растворимые в гептане фракции составляют всего 10–15%.
Hа рис. 6 приведены спектры ЯМР 13С фракций ПП, синтезированного в присутствии системы TiCl4–Al(C2H5)2Cl/Mg(C4H9)2 при 50 °С. Спектр растворимой фракции типичен для спектров атактического ПП [8–10]. Сравнение спектров двух фракций на рис. 6a и 6б показывает, что нерастворимая фракция содержит те же сигналы стерео-нерегулярных последовательностей в области 22.1–19.2 м.д. и в тех же пропорциях, что и растворимая фракция. Это позволяет предположить, что нерастворимая фракция является смесью двух стерически различных полимеров – аморфного атактического и кристаллического изотактического. Этот атактический компонент имеет такую же структуру, что и растворимая фракция, но обладает большей MM, чем и объясняется его низкая растворимость. Спектр кристаллического компонента был выделен путем вычитания спектра растворимой фракции из спектра нерастворимой. После этой процедуры (рис. 6в) в спектре остались только три сигнала стерео-нерегулярных последовательностей: mmmr, mmrr и mrrm при 21.03, 20.52 и 19.28 м.д. в соотношении ~2 : 2 : 1. Пентады этого типа и в этом соотношении характерны для цепей преимущественно изотактического ПП с изолированными стерео-ошибками, т.е. для последовательностей типа ···mmmmrrmmm···. Такие стерео-ошибки типичны для ПП, получаемого на гетерогенных катализаторах Циглера–Натта и на мостичных рац-бис-инденильных комплексах циркония. Из этих данных можно сделать вывод об энантиоморфном механизме стереоконтроля роста цепи на рассматриваемых каталитических системах, когда каждая случайная стерическая ошибка исправляется в следующем акте роста полимерной цепи, например, ···DDDDLDDDD···.
Рис. 6.
Спектры ЯМР 13С (область сигналов CH3- грyппы) фракций ПП, полученного в присутствии системы TiCl4–Al(C2H5)2Cl/Mg(C4H9)2 при 40 °С: a – фракция, растворимая в кипящем гептане; б – нерастворимая фракция; c – изотатический компонент.
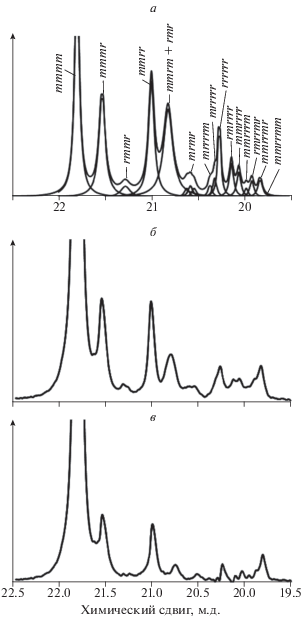
Содержание кристаллического компонента, который создается изоспецифическими центрами, не превышает 5–7%. Oсновную часть полимерного продукта, более 85% в растворимой фракции и ~50% в нерастворимой фракции, составляет атактический ПП.
Атактический ПП – важный коммерческий продукт, который используют для изготовления строительных клеев, замазок, уплотняющих мастик, дорожных покрытий и липких пленок. Возможность целенаправленного синтеза атактического ПП при использовании систем на основе общедоступных соединений титана (TiCl4 или Ti(Oi-C3H7)4) и бинарного сокатализатора Al(C2H5)2Cl/Mg(C4H9)2 представляет практический интерес. Достоинствами этой системы являются высокая активность, низкая стоимость и простота синтеза. Все компоненты этой системы – дешевые коммерческие продукты, растворимые в ароматических и алифатических углеводородах.
Реакции гомо- и сополимеризации этилена с 1-алкенами
В табл. 8 приведены основные результаты по сополимеризации этилена с 1-алкенами на ПМЦ-комплексах Ti с использованием в качестве сокатализаторов Al(C2H5)2Cl/Mg(C4H9)2 и МАО. Системы с бинарным сокатализатором Al(C2H5)2Cl/Mg(C4H9)2 более активны и обладают более высокой сополимеризующей способностью, чем при использовании МАО. Так, выход сополимеров Э/Г, полученныx для системы IV – Al(C2H5)2Cl/Mg(C4H9)2 и содержащих от 3.5 до ~22 мольн.% 1-гексена, составил 1.7–4.3 т/моль Ti, в то время как при использовании МАО в присутствии комплекса IV были получены сополимеры с $C_{{\text{Г}}}^{{{\text{сопол}}}}$ 0.3 и ~8–9 мольн.% при выходе 670–850 кг/моль Ti.
Таблица 8.
Сополимеризация этилена с 1-алкенами на ПМЦ-комплексаx Ti с сокатализаторами МАО и Al(C2H5)2Cl/Mg(C4H9)2а
| Система | $С_{{\text{М}}}^{{{\text{мон}}}},$ моль/л |
C мон, мольн.% |
[Ti] ⋅ 105, моль | [Al] : [Ti], моль/моль |
[Al] : [Mg], моль/моль |
Выход, кг/моль Ti |
$C_{{\text{М}}}^{{{\text{сопол}}}},$ мольн.%б |
|---|---|---|---|---|---|---|---|
| 1-гексен | |||||||
| IY–Al(C2H5)2Cl/Mg(C4H9)2 | – | – | 0.66 | 340 | 3.0 | 1720 | 0 |
| 0.24 | 39 | 0.66 | 340 | 3.0 | 1666 | 4.0 | |
| 1.6 | 81 | 1.02 | 320 | 3.4 | 2843 | 12.0 | |
| 4.4 | 92 | 0.75 | 360 | 3.2 | 4266 | 21.0 | |
| IY–МАО | – | – | 1.79 | 410 | – | 735 | 0 |
| 0.24 | 39 | 2.02 | 440 | – | 850 | 0.3 | |
| 1.6 | 81 | 2.27 | 460 | – | 696 | 9.0 | |
| 1-октен | |||||||
| IY–Al(C2H5)2Cl/Mg(C4H9)2 | 0.26 | 41 | 0.62 | 360 | 3.2 | 1774 | 1.7 |
| 1.7 | 82 | 0.77 | 350 | 3.2 | 3545 | 10.0 | |
| Y–Al(C2H5)2Cl/Mg(C4H9)2 | – | – | 1.17 | 390 | 3.0 | 1090 | 0 |
| 0.32 | 44.5 | 1.55 | 360 | 3.2 | 1875 | 2.6 | |
| 0.64 | 61.5 | 1.49 | 380 | 3.2 | 1865 | 5.1 | |
| 1.28 | 76.1 | 1.47 | 380 | 3.2 | 2040 | 10.4 | |
| 1-децен | |||||||
| IY–Al(C2H5)2Cl/Mg(C4H9)2 | 0.26 | 41 | 0.75 | 360 | 3.2 | 1400 | 1.3 |
| 1.7 | 82 | 0.77 | 350 | 3.2 | 3992 | 9.0 | |
| IY–МАО | 0.26 | 41 | 0.75 | 360 | – | 902 | 0.4 |
| 1.7 | 82 | 0.82 | 330 | – | 1223 | 0.7 | |
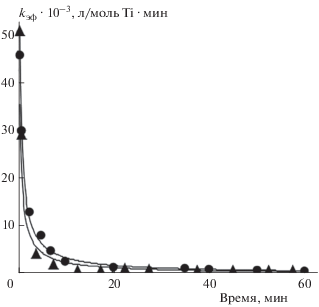
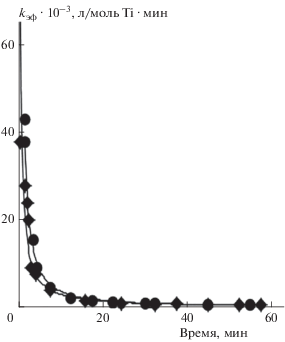
Каталитические системы на основе ПМЦ-комплексов Ti кинетически нестабильны. Нестабильность особенно выражена при использовании бинарного сокатализатора Al(C2H5)2Cl/Mg(C4H9)2. Эффективная константа скорости расхода этилена kэф в присутствии системе IV – Al(C2H5)2Cl/Mg(C4H9)2 уменьшается примерно в 10 раз, от ~38000 до ~3900 л/моль Ti ⋅ мин, в течение первых 10 минут рeaкции (рис. 7).
Рис. 7.
Кинетические кривые расхода этилена в присутствии системы IV–Al(C2H5)2Cl/Mg(C4H9)2 в рeaкции гомополимеризации (◆) и сополимеризации с 1-деценом ($C_{{\text{Д}}}^{{{\text{мон}}}}$ ~1.7 мол/л) (⚫).
Для сополимеров этилена и 1-алкенов, синтезированных в присутствии комплексов IV с бинарным сокатализатором, были оценены значения констант сополимеризации r1 с помощью уравнения (1):
Значение r1 постепенно возрастает с увеличением длины линейной алкильной группы в 1-алкене, т.е. реакционная способность 1-алкенов уменьшается в ряду 1-гексен > 1-октен > 1-децен. Подобный эффект также известен для реакций сополимеризации этилена с 1-алкенами в присутствии гетерогенных катализаторов Циглера–Натта [21].
Все полимеры, полученные с ПМЦ–комплексами Ti, имеют широкое ММР: образцы ПЭ и сополимеров состоят из пяти или шести компонентов Флори с различными ММ [22]. Содержание наиболее высокомолекулярных компонентов (Mw ~ (2.0–2.2) ⋅ 106) в ПЭ, полученном при использовании МАО, значительно выше (~22%), чем в образце, синтезированным с Al(C2H5)2Cl/Mg(C4H9)2 (~9%). В результате, значение Mw для первого полимера (~950 000) существенно выше, чем для второго (~530 000). Введение 1-алкенов в цепь ПЭ всегда приводит к уменьшению его ММ (табл. 9). При этом содержание различных компонентов Флори в сополимерах близкого состава не зависит от типа 1-алкена.
Таблица 9.
Молекулярно-массовые и структурные характеристики сополимеров этилена и 1-алкенов, полученных в присутствии комплекса IY с сокатализаторами МАО и Al(C2H5)2Cl/Mg(C4H9)2
| 1-алкен | $C_{{\text{М}}}^{{{\text{сопол}}}},$ мольн.% | Мw ⋅ 10–3 | Мw/Мn | Тпл, °С | ΔHпл, Дж/г | χ, % (РСА/ДСК) |
|---|---|---|---|---|---|---|
| Сокатализатор МАО | ||||||
| – | 0 | 951 | 6.2 | 136.0 | 172.7 | 56/59 |
| 1-гексен | 9.0 | 311 | 8.5 | 118.6 | 53.45 | 21/18 |
| 1-октен | 0.2 | 670 | 9.2 | 130.1 | 142.8 | 51/49 |
| 1-децен | 0.7 | 660 | 6.2 | 128.3 | 135.2 | 45/46 |
| Сокатализатор Al(C2H5)2Cl/Mg(C4H9)2 | ||||||
| – | 0 | 531 | 7.6 | 131.7 | 197.0 | 61/67 |
| 1-гексен | 13.0 | 64 | 8.4 | 118.0 | 36.9 | 21/13 |
| 1-гексен | ~21 | 74 | 9.6 | 118.5 | 7.4 | аморфный |
| 1-октен | 10.0 | 70 | 9.7 | 118.8 | 30.1 | 10/10 |
| 1-децен | 8.0 | 85 | 10.4 | 118.6 | 39.9 | 25/14 |
Из анализа спектров ЯМР 13С следует, что активные центры каталитических систем на основе ПМЦ-комплексов Ti и бинарного сокатализатора имеют выраженную тенденцию к созданию альтернантных сополимеров: r1r2 < 1. Молекулы 1-алкенов в сополимерах представлены, главным образом, изолированными звеньями в ~ЭЭЭМЭЭЭ~ последовательностях. В отличие от статистических сополимеров того же состава, в сополимерах практически полностью отсутствуют МММ триады, а количество ММ диад является очень небольшим.
Реакции полимеризации пропилена
Как видно из табл. 10, замена MAO, стандартного активатора для ПМЦ-комплексов, бинарным сокатализатором Al(C2H5)2Cl/Mg(C4H9)2 привoдила к значительномy увеличению активности этих катализаторов. В случае комплексов I и IV реактор был полностью заполнен полимером уже через ~10 мин после начала реакции. Активность комплекса III также увеличивалась в ~4 раза. На комплексе II в присутствии МАО были получены только следы олигомеров, в то время как использование комбинации Al(C2H5)2Cl/Mg(C4H9)2 привело к образованию твердого высокомолекулярного продукта.
Таблица 10.
Полимеризация пропилена на ПМЦ-комплексах Ti с сокатализаторами МАО и Al(C2H5)2Cl/Mg(C4H9)2
| Комплекс | Сокатализатор | Ti ⋅ 105, моль | [Al]:[Ti], моль/моль | [Al]:[Mg], моль/моль | Выход, кг/моль Ti |
|---|---|---|---|---|---|
| I | МАО | 3.5 | 130 | – | 1160 |
| I | Al(C2H5)2Cl/Mg(C4H9)2 | 4.3 | 56 | 2.5 | 2000a |
| II | МАО | 22.9 | 59 | – | – |
| II | Al(C2H5)2Cl | 22.9 | 42 | – | – |
| II | Al(C2H5)2Cl/Mg(C4H9)2 | 13.0 | 26 | 2.8 | 254 |
| III | МАО | 1.3 | 1170 | – | 620 |
| III | Al(C2H5)2Cl/Mg(C4H9)2 | 0.8 | 880 | 3.2 | 2370 |
| IV | МАО | 1.84 | 219 | – | 309 |
| IV | Al(C2H5)2Cl/Mg(C4H9)2 | 2.07 | 154 | 3.7 | 3500a |
| V | Al(C2H5)2Cl/Mg(C4H9)2 | 1.49 | 185 | 3.6 | 2285 |
Так же, как в случае простых титановых катализаторов (TiCl4, Ti(Oi-C3H7)4), ПП, синтезированный в присутствии ПМЦ-комплексов Ti, является сложной смесью полностью аморфного атактического полимера и частично кристаллического изотактического полимера. Однако содержание фракции, не растворимой в кипящем гептане, и степень кристалличности в образцах, полученных в присутствии ПМЦ-комплексов, значительно выше.
Из данных, приведенных в табл. 11, можно видеть, что MM ПП, синтезированного при использовании MAO в качестве сокатализатора, существенно выше, чем в случае комбинации Al(C2H5)2Cl/MgBu2. Так, значения Mw полимеров, полученных для систем I–MAO и I‒Al(C2H5)2Cl/Mg(C4H9)2 соответственно равны 319 000 и 150 000.
Таблица 11.
Молекулярно-массовые и структурные характеристики ПП, полученного в присутствии ПМЦ-комплексов Ti, и его фракций
| Образец | Содержание, % | Мw | Мw/Мn | [mmmm], %а | A998/A973б | A841/A973б | Тпл, °Св | ΔHпл, Дж/гв | χ, %в, г |
|---|---|---|---|---|---|---|---|---|---|
| I–МАО | |||||||||
| Общий полимер | 319 000 | 19.8 | 0.44 | 0.32 | 152 | 23.9 | 14/11 | ||
| Нерастворимая фракция | 24 | 676 000 | 5.4 | 58 | 154 | 58.2 | 35/26 | ||
| Растворимая фракция | 76 | 298 000 | 13 | ||||||
| I–Al(C2H5)2Cl/Mg(C4H9)2 | |||||||||
| Общий полимер | 150 000 | 110 | 0.48 | 0.43 | 152 | 36.2 | 21/13 | ||
| Нерастворимая фракция | 32 | 272 000 | 104 | 586 | 156 | 66.5 | 40/33 | ||
| Растворимая фракция | 68 | 92 500 | 86 | ||||||
| II–Al(C2H5)2Cl/Mg(C4H9)2 | |||||||||
| Общий полимер | 235 000 | 11.0 | 0.51 | 0.42 | 151 | 32.1 | 20/15 | ||
| Нерастворимая фракция | 46 | 272 000 | 10.4 | 52.5 | 153 | 54.5 | 32/25 | ||
| Растворимая фракция | 54 | 108 000 | 13.3 | ||||||
| III–MAO | |||||||||
| Общий полимер | 174 800 | 3.2 | ~8 | – | – | – | – | – | |
| III–Al(C2H5)2Cl/Mg(C4H9)2 | |||||||||
| Общий полимер | 83 300 | 3.6 | 34.4 | 0.49 | 0.41 | 151 | 17.2 | 10 | |
| Нерастворимая фракция | 34 | 120 000 | 6.4 | 49.3 | 153 | 40.6 | 24/20 | ||
| IV–МАО | |||||||||
| Нерастворимая фракция | 25 | 407 300 | 10.3 | 36.8 | 0.45 | 0.45 | 10 | ||
| Растворимая фракция | 75 | 221 300 | 0.14 | 0.17 | ~1 | ||||
| IV–Al(C2H5)2Cl/Mg(C4H9)2 | |||||||||
| Нерастворимая фракция | 19 | 356 700 | 6.8 | 74.7 | 0.81 | 0.62 | 41/32 | ||
| Растворимая фракция | 81 | 0.29 | 0.24 | ~4 | |||||
| V–Al(C2H5)2Cl/Mg(C4H9)2 | |||||||||
| Общий полимер | 20 400 | 2.7 | 0.46 | 0.37 | 153 | 18.8 | 11 | ||
| Нерастворимая фракция | 20 | 420 000 | 7.5 | 74 | 0.89 | 0.63 | 159 | 89.7 | 53 |
Результаты разделения кривых ГПХ растворимых и нерастворимых фракций ПП показывают, что MM компонентов Флори каждой фракции, синтезированной в присутствии MAO, выше ММ компонентов Флори фракций, полученных при использовании комбинации Al(C2H5)2Cl/Mg(C4H9)2 (табл. 12). Содержание высокомолекулярных компонентов в каждой фракции также выше в случае использования МАО. В результате, средние MM каждой фракции и MM общего полимера существенно различаются:
Таблица 12.
ГПХ-анализ образцов ПП, полученных в присутствии комплекса I
| Система | I–MAO | I–Al(C2H5)2Cl/Mg(C4H9)2 | |||
|---|---|---|---|---|---|
| $M_{w}^{{{\text{ср}}}}$ = 319 000, Mw/Mn= 19.8 | $M_{w}^{{{\text{ср}}}}$ = 150 000, Mw/Mn = 11 | ||||
| образец | компонент Флори |
Mw | содержание, % | Mw | содержание, % |
| Нерастворимая фракция | I | 9300 | 4.1 | ||
| II | 40 800 | 5.9 | 32 800 | 17.8 | |
| III | 106 300 | 18.7 | 92 400 | 30.8 | |
| IV | 347 100 | 41.0 | 289 600 | 30.8 | |
| V | 1 208 000 | 34.0 | 905 000 | 16.5 | |
| Растворимая фракция | I | 2200 | 1.0 | 1800 | 2.4 |
| II | 9100 | 5.4 | 7600 | 11.1 | |
| III | 30 300 | 19.0 | 25 500 | 32.0 | |
| IV | 85 100 | 29.5 | 69 400 | 34.0 | |
| V | 260 900 | 28.0 | 208 400 | 17.5 | |
| VI | 1 135 000 | 17.1 | 850 600 | 2.8 | |
I–MAO: Mw (нераств.) = 676500, Mw (раств.) = 298200, $M_{w}^{{{\text{ср}}}}$ = 319000;
I–Al(C2H5)2Cl/Mg(C4H9)2: Mw (нераств.) = 272100, Mw (раств.) = 92500, $M_{w}^{{{\text{ср}}}}$ = 150000.
Такая закономерность характерна для полимеров пропилена, полученных для всех ПМЦ-комплексов Ti. В присутствии комбинации Al(C2H5)2Cl/Mg(C4H9)2 существенно меняется и стереорегулярность полимеров. Так, при использовании комплекса I повышаются как ИК-параметры стереорегулярности ПП, так и содержание в нем фракции, нерастворимой в гептане. Особенно показательно стереорегулирующее действие Al(C2H5)2Cl/Mg(C4H9)2 при использовании комплекса III. В сочетании с МАО на этом катализаторе получается аморфный полимер, полностью растворимый в кипящем гептане. При использовании комбинации Al(C2H5)2Cl/Mg(C4H9)2 был получен частично кристаллический изотактический ПП с Тпл = 151 °С, содержащий 34% нерастворимой фракции. Таким образом, с помощью сокатализатора можно существенно регулировать свойства полимера.
Реакции полимеризации высших линейных 1-алкенов
В табл. 13 приведены основные результаты полимеризации трех линейных 1-алкенов. Эксперименты проводили в массе мономера при температуре 2 °С. В этих условиях комплекс IV активировался не только Al(C2H5)2Cl/Mg(C4H9)2 и MAO, но также и одним Al(C2H5)2Cl. Однако система IV– Al(C2H5)2Cl во всех случаях имела самую низкую активность. Бинарный сокатализатор оказался наиболее эффективным в реакции полимеризации 1-децена, а в реакциях полимеризации 1-октена и 1-гексена эффективность комбинации Al(C2H5)2Cl/Mg(C4H9)2 и MAO была примерно одинакова. Подобно ПП, полученному на ПМЦ-комплексах Ti, все полимеры высших 1-алкенов обладают средним уровнем изотактичности и имеют широкое ММР.
Таблица 13.
Реакции полимеризации высших линейных 1-алкенов в присутствии комплекса IV с различными сокатализаторами
| Сокатализатор | [1-алкен], моль |
[Ti] ⋅ 103, моль |
[Al] : [Ti], моль/моль |
[Al] : [Mg], моль/моль |
Конверсия, % | [η], дл/г |
Mη ⋅ 10–3 | [mmmm], ЯМР 13C |
|---|---|---|---|---|---|---|---|---|
| 1-децен | ||||||||
| MAO | 0.210 | 0.022 | 76 | 20.4 | 1.63 | 690 | 0.53 | |
| Al(C2H5)2Cl | 0.213 | 0.022 | 106 | 6.9 | 2.95 | 1500 | 0.60 | |
| Al(C2H5)2Cl/Mg(C4H9)2 | 0.213 | 0.022 | 117 | 3.2 | 69.3 | 3.30 | 1730 | |
| 1-октен | ||||||||
| MAO | 0.210 | 0.022 | 76 | 92.3 | 2.02 | 920 | 0.50 | |
| Al(C2H5)2Cl | 0.214 | 0.022 | 90 | 7.5 | 2.64 | 1300 | 0.52 | |
| Al(C2H5)2Cl/Mg(C4H9)2 | 0.210 | 0.022 | 106 | 2.4 | 70.6 | 1.50 | 620 | |
| 1-гексен | ||||||||
| MAO | 0.219 | 0.022 | 70 | 84.6 | 3.10 | 1596 | ||
| Al(C2H5)2Cl | 0.226 | 0.022 | 90 | 23.7 | 4.25 | 2404 | 0.62 | |
| Al(C2H5)2Cl/Mg(C4H9)2 | 0.220 | 0.009 | 175 | 3.1 | 76.9 | 1.04 | 386 | |
Дискуссия. Химические аспекты полимеризации алкенов
Любое соединение титана типа TiX4 активно реагирует с алюминийорганическими соединениями AlR3 и AlR2Cl с образованием множества растворимых и твердых продуктов [23]. Анализ продуктов взаимодействия TiCl4 и Al(C2H5)2Cl показал, что химический состав осадка постепенно изменяется от исходного [TiCl3C2H5] до [TiAl2Cl5] [24–30]. Валентное состояние Ti (смесь TiIV, TiIII и TiII) и эффективность катализатора TiCl4–Al(C2H5)2Cl также меняются в зависимости от продолжительности контакта. Реакции между Ti(OR)4 и алюминийорганическими соединениями также дают множество различных продуктов, которые имеют очень сложный химический состав [31–33].
В общих чертах, взаимодействие в системах TiX4–AlR3 и TiX4–AlR2Cl можно описать следующими реакциями:
1. Алкилирование TiX4:
(2)
$\begin{gathered} {\text{Ti}}{{{\text{X}}}_{4}} + {\text{Al}}{{{\mathbf{R}}}_{3}}({\text{или}}\,\,{\text{Al}}{{{\mathbf{R}}}_{2}}{\text{Cl}})~ \to ~ \\ \to {{{\text{X}}}_{3}}{\text{Ti}}{\text{--}}{\mathbf{R}} + {\text{Al}}{{{\mathbf{R}}}_{2}}{\text{X}}\,\,({\text{или}}\,\,{\text{Al}}{\mathbf{R}}{\text{XCl}}). \\ \end{gathered} $Реакции (2) очень быстры и необратимы [31–34 ]. При высоком отношении [Al]:[Ti], реакции алкилирования титановых соединений обычно продолжаются
(3)
$\begin{gathered} {{{\text{X}}}_{3}}{\text{Ti}}--{\mathbf{R}} + {\text{Al}}{{{\mathbf{R}}}_{3}}\,\,({\text{или}}\,\,{\text{Al}}{{{\mathbf{R}}}_{2}}{\text{Cl}})~ \to ~ \\ \to \,\,{{{\text{X}}}_{2}}{\text{Ti}}{{{\mathbf{R}}}_{2}} + {\text{Al}}{{{\mathbf{R}}}_{2}}{\text{X}}\,\,({\text{или}}\,\,{\text{Al}}{\mathbf{R}}{\text{XCl}}). \\ \end{gathered} $2. В некоторых случаях соединения X3Ti–R участвуют в реакциях конденсации. Если R = C2H5, конденсация приводит к образованию биядерных комплексов Ti:
(4)
$2{{{\text{X}}}_{3}}{\text{Ti}}--{{{\text{C}}}_{2}}{{{\text{H}}}_{5}}~\, \to ~{{{\text{X}}}_{3}}{\text{Ti}}--{\text{C}}{{{\text{H}}}_{2}}--{\text{C}}{{{\text{H}}}_{2}}--{\text{Ti}}{{{\text{X}}}_{3}} + {{{\text{C}}}_{2}}{{{\text{H}}}_{6}}.$3. Восстановление органических соединений титана X3TiIV–R и X2TiIVR2 алюминийорганическими соединениями до TiIIIX3 и X2TiIII–R. Все соединения Ti, образующиеся как в реакциях (2)–(4), так и в реакциях восстановления, создают многочисленные комплексы с одной или двумя молекулами AlR2X или AlRXCl. Некоторые из растворимых биядерных и триядерных комплексов TiIII, такие как [TiX3] ⋅ 2AlR2X, [TiX3]AlR2X и [X2Ti–R]AlRXCl, были детально охарактеризованы [30–33].
Комплексы Ti с бидентатными и мультидентатными лигандами могут быть представлены общими формулами LTiCl2 или L2Ti. Когда эти комплексы смешиваются с комбинациями AlR2Cl/${\text{Mg}}{\mathbf{R}}_{2}^{'}$ при отношении [Al] : [Mg] > 2.5, они быстро алкилируются до LTi(Cl)–R, или LTiR2, аналогично реакциям (3).
Эффективность комбинаций AlR2Cl и ${\text{Mg}}{\mathbf{R}}_{2}^{'}$ в качестве сокатализаторов можно объяснить двумя факторами. Во-первых, AlR2Cl и ${\text{Mg}}{\mathbf{R}}_{2}^{'}$ быстро реагируют с образованием высокодисперсного MgCl2, поверхность которого обладает льюисовской кислотностью [1, 2]:
(5)
${\text{Mg}}{\mathbf{R}}_{2}^{'} + 2{\text{Al}}{{{\mathbf{R}}}_{2}}{\text{Сl\;}} \to ~[{\text{MgC}}{{{\text{l}}}_{2}}] + 2{\text{Al}}{{{\mathbf{R}}}_{2}}{\mathbf{R}}{\kern 1pt} '.$Все используемые нами сокатализаторы были получены при соотношении [Al]:[Mg] > 2.5. Таким образом, соединение титана TiX4 или комплекс LTiX2, которые добавляли к смеси Al(C2H5)2Cl/Mg(C4H9)2 на последней стадии приготовления катализаторов, могут реагировать как с избытком AlR2Cl, так и с AlR2R', образующимся в реакции (5). Когда продукты X3TiIV–R, X2TiIII–R, LTi(Cl)–R, или их комплексы с алюминийорганическими соединениями адсорбируются на кислотной поверхности MgCl2, они могут ионизироваться с образованием катионных центров, содержащих связь Ti+–C:
(6)
$\begin{gathered} {{{\text{X}}}_{3}}{\text{Ti}}--{\mathbf{R}} + \left[ {{\text{MgC}}{{{\text{l}}}_{{\text{2}}}}} \right]~ \to \\ \to ~{{{{{[{{{\text{X}}}_{2}}{\text{T}}{{{\text{i}}}^{ + }}--{\mathbf{R}}]}}_{{{\text{адс}}}}}} \mathord{\left/ {\vphantom {{{{{[{{{\text{X}}}_{2}}{\text{T}}{{{\text{i}}}^{ + }}--{\mathbf{R}}]}}_{{{\text{адс}}}}}} {{{{[{\text{MgC}}{{{\text{l}}}_{2}} \cdots {\text{X}}]}}^{ - }}}}} \right. \kern-0em} {{{{[{\text{MgC}}{{{\text{l}}}_{2}} \cdots {\text{X}}]}}^{ - }}}}, \\ \end{gathered} $(7)
$\begin{gathered} {{{\text{X}}}_{2}}{\text{Ti}}--{\mathbf{R}} + \left[ {{\text{MgC}}{{{\text{l}}}_{{\text{2}}}}} \right]~ \to \\ \to {{{{{\left[ {{\text{XT}}{{{\text{i}}}^{ + }}--{\mathbf{R}}} \right]}}_{{{\text{адс}}}}}~} \mathord{\left/ {\vphantom {{{{{\left[ {{\text{XT}}{{{\text{i}}}^{ + }}--{\mathbf{R}}} \right]}}_{{{\text{адс}}}}}~} {{{{\left[ {{\text{MgC}}{{{\text{l}}}_{{\text{2}}}} \cdots {\text{X}}} \right]}}^{ - }}}}} \right. \kern-0em} {{{{\left[ {{\text{MgC}}{{{\text{l}}}_{{\text{2}}}} \cdots {\text{X}}} \right]}}^{ - }}}}, \\ \end{gathered} $(8)
$\begin{gathered} {\text{LTi}}\left( {{\text{Cl}}} \right)--{\mathbf{R}} + \left[ {{\text{MgC}}{{{\text{l}}}_{{\text{2}}}}} \right]~ \to \\ \to {{\left[ {{\text{LT}}{{{\text{i}}}^{ + }}--{\mathbf{R}}} \right]{{~}_{{{\text{адс}}}}}} \mathord{\left/ {\vphantom {{\left[ {{\text{LT}}{{{\text{i}}}^{ + }}--{\mathbf{R}}} \right]{{~}_{{{\text{адс}}}}}} {{{{\left[ {{\text{MgC}}{{{\text{l}}}_{{\text{2}}}} \cdots {\text{Cl}}} \right]}}^{ - }}}}} \right. \kern-0em} {{{{\left[ {{\text{MgC}}{{{\text{l}}}_{{\text{2}}}} \cdots {\text{Cl}}} \right]}}^{ - }}}}. \\ \end{gathered} $Такие катионные центры обычно рассматриваются в литературе как каталитически активные центры в реакциях полимеризации в присутствии катализаторов Циглера–Натта [24]. Второй возможной причиной высокой эффективности комбинаций AlR2Cl/${\text{Mg}}{\mathbf{R}}_{2}^{'}$ в качестве сокатализаторов является образование контактных ионных пар [MgR’]+ [${{{\mathbf{R}}}_{{\text{2}}}}{\mathbf{R}}_{{\text{2}}}^{{\text{'}}}{\text{Al}}$]− и [MgR']+ [RR'AlCl…${\text{Al}}{\mathbf{RR}}_{{\text{2}}}^{{\text{'}}}$]−. Такие ионные пары могут превращать алкилированные продукты X3TiIV–R, X2TiIII–R или LT(Cl)–R в катионные активные центры другого типа, например:
(9)
$\begin{gathered} {{{\text{X}}}_{{\text{3}}}}{\text{Ti}}--{\mathbf{R}} + {{[{\text{Mg}}{\mathbf{R}}{\kern 1pt} ']}^{ + }}{{[{{{\mathbf{R}}}_{2}}{\mathbf{R}}_{2}^{'}{\text{Al}}]}^{ - }} \to \\ \to \,[{{{\text{X}}}_{2}}{\text{T}}{{{\text{i}}}^{ + }}--{\mathbf{R}}]\,~{{[{{{\mathbf{R}}}_{2}}{\mathbf{R}}_{2}^{'}{\text{Al}}]}^{ - }} + {\text{Mg}}{\mathbf{R}}{\text{'X,}} \\ \end{gathered} $(10)
$\begin{gathered} \hfill {{{\text{X}}}_{3}}{\text{Ti}}--{\mathbf{R}} + {{[{\text{Mg}}{\mathbf{R}}{\kern 1pt} {\text{'}}]}^{ + }}{{[{\mathbf{RR}}{\kern 1pt} '{\text{AlC}}{{{\text{l}}}^{ \ldots }}{\text{Al}}{\mathbf{R}}{\kern 1pt} {\text{'}}{{{\mathbf{R}}}_{2}}]}^{ - }}~ \to \\ \hfill \to \,[{{{\text{X}}}_{2}}{\text{T}}{{{\text{i}}}^{ + }}--{\mathbf{R}}]\,[{\mathbf{RR}}{\kern 1pt} '{\text{AlC}}{{{\text{l}}}^{ \ldots }}{\text{Al}}{\mathbf{R}}{\kern 1pt} '{{{\text{R}}}_{2}}]{{~}^{ - }} + {\text{Mg}}{\mathbf{R}}{\kern 1pt} {\text{'X,}} \\ \end{gathered} $(11)
$\begin{gathered} {\mathbf{L}}{\text{Ti}}\left( {{\text{Cl}}} \right)--{\mathbf{R}} + {{[{\text{Mg}}{\mathbf{R}}{\kern 1pt} ']}^{ + }}{{[{{{\mathbf{R}}}_{2}}{\mathbf{R}}_{2}^{'}{\text{Al}}]}^{ - }}~ \to \\ \to \,\,[{\mathbf{L}}{\text{T}}{{{\text{i}}}^{ + }}--{\mathbf{R}}]~{{[{{{\mathbf{R}}}_{2}}{\mathbf{R}}_{2}^{'}{\text{Al}}]}^{ - }} + {\text{Mg}}{\mathbf{R}}{\text{'X}}. \\ \end{gathered} $Все каталитические системы, состоящие из TiCl4, Ti(OR)4 или ПМЦ-комплексов Ti и бинарных сокатализаторов AlR2Cl/${\text{Mg}}{\mathbf{R}}_{2}^{'},$ содержат различные типы активных центров, которые отличаются по кинетическим параметрам, стереоспецифичности и сополимеризующей способности. Можно предположить, что эти активные центры образуются в реакциях (2)–(11) из различных соединений XxTi–R, XyTiR2 и LTi(Cl)–R, содержащих как TiIV, так и TiIII.
ВЫВОДЫ
1. Комбинация Al(C2H5)2Cl/Mg(C4H9)2 при молярном соотношении [Al] : [Mg] > 2.5 является эффективным сокатализатором для таких соединений титана как TiCl4, Ti(Oi-C3H7)4, так и для ПМЦ-комплексов титана в реакциях полимеризации этилена, пропилена, высших 1-алкенов и в реакциях сополимеризации этилена с 1-алкенами.
2. Эффективность комбинации Al(C2H5)2Cl/ Mg(C4H9)2 в качестве сокатализатора в реакциях полимеризации 1-алкенов связана с образованием in situ высокодисперсного MgCl2 и иммобилизацией катионных активных центров на его поверхности.
3. Продуктами реакций полимеризации являются высокомолекулярный линейный ПЭ, преимущественно аморфный атактический ПП, высокомолекулярные полимеры высших 1-алкенов (1-гексен, 1-октен, 1-децен) и сополимеры этилена с высшими 1-алкенами.
4. Активные центры этих каталитических систем неоднородны по кинетическим параметрам, стереоспецифичности и сополимеризующей способности.
5. Реакция роста цепи на изоспецифических центрах происходит по энантиоморфному механизму, характерному для реакций полимеризации пропилена в присутствии гетерогенных катализаторов Циглера–Натта и металлоценовых катализаторов.
Работа выполнена в рамках государственного задания и поддержана Российским Научным Фондом (Проект № 18-13-00375).
Список литературы
Kissin Y.V., Mink R.I., Brandolini A.J., Nowlin T.E. // J. Polym. Sci. Part A: Polym. Chem. 2009. V. 47. № 13. P. 3271.
Rishina L.A., Galashina N.M., Gagieva S.C. et al. // Eur. Polym. J. 2013. V. 49. № 1. P. 147.
Rishina L.A., Lalayan S.S., Gagieva S.C. et al. // Polymer. 2013. V. 54. № 23. P. 6526.
Rishina L.A., Kissin Y.V., Lalayan S.S. et al. // J. Polym. Sci. Part A: Polym. Chem. 2017. V. 55. № 3. P. 1844.
Ришина Л.А., Галашина Н.М., Гагиева С.Ч. и др. // Высокомолекуляр. соед. 2008. Т. 50. № 2. С. 208.
Kissin Y.V. // J. Polym. Sci. Part A: Polym. Chem. 1995. V. 33. № 2. P. 227.
Kissin Y.V. Alkene Polymerization Reactions with Transition Metal Catalysts. Amsterdam: Elsevier. 2008. Ch. 2.
Hayashi T., Inoue Y., Chujo R., Asakura T. // Polymer. 1988. V. 29. № 1. P. 138.
Hsieh E.T., Randall J.C. // Macromolecules. 1982. V. 15. № 6. P. 1402.
Schilling F.S., Tonelli A.E. // Ibid 1990. V. 13. № 1. P. 270.
Busico V., Cipullo R., Monaco G. et al. // Ibid. 1997. V. 30. № 20. P. 6251.
Busico V., Cipullo R., Monaco G. et al. // Ibid. 1999. V. 32. № 13. P. 4173.
Nowlin T.E., Kissin Y.V., Wagner K.P. // J. Polym. Sci. Part A: Polym. Chem. 1988. V. 26. № 3. P. 755.
Kissin Y.V., Tsvetkova V.I., Chirkov N.M. // Eur. Polym. J. 1972. V. 8. № 4. P. 529.
Kissin Y.V., Rishina L.A. // Ibid J. 1976. V. 12. № 10. P. 757.
Nowlin T.E., Mink R.I., Brandolini A.J. // J. Polym. Sci. Part A: Polym. Chem. 1999. V. 37. № 23. P. 4255.
McDaniel M.P., Schwerdtfeger E.D., Jensen M.D. // J. Catal. 2014. V. 314. P. 109.
Kissin Y.V. // J. Polym. Sci. Part B: Polym. Phys. 2011. V. 49. № 3. P. 195.
Krentsel B.A., Kissin Y.V., Kleiner V.I., Stotskaya L.L. Polymers and Copolymers of Higher α-Olefins. New York. Hanser. 1997. Ch. 8.
Kissin Y.V., Beach D.L. // J. Polym. Sci. Part A: Polym. Chem. 1984. V. 22. P. 333.
Чирков Н.М. Матковский П.Е., Дьячковский Ф.С. Полимеризация на комплексных металлоорганических катализаторах. М.: Химия, 1976.
Rishina L.A., Lalayan S.S., Gagieva S.Ch. et al. // J. Res. Updates Polymer. Sci. 2014. V. 3. P. 216.
Rodriguez L. // Tetrahedron Lett. 1959. V. 17. № 1. P. 7.
Werber F.X., Benning C.J., Wszolek W.R. et al. // J. Polym. Sci. Part A: Polym. Chem. 1968. V. 6. № 4. P. 743.
Ziegler K., Martin H., Stedefeder I. // Tetrahedron Lett. 1959. V. 20. № 1. P. 15.
Overberger C.G., Ang F., Mark H. // J. Polym. Sci. 1959. V. 35. № 2. P. 381.
Ришина Л.А., Журавлева Е.Н., Киссин Ю.В. и др. // Высокомолекуляр. соед. 1974. Т (А) XYI. № 7. С. 1459.
Varadi J., Czajlik I., Baan A. et al. // J. Polym. Sci. Part C. Polym. Symp. 1967. № 16. Part. 4(1). P. 2069.
Czajlik I., Varadi J., Baan A. // J. Polym. Sci. Part B: Polym. Lett. 1966. V. 4. № 9. P. 661.
Natta G., Porri L., Carbonaro A. et al. // Macromol. Chem. 1964. V. 77(8). P. 114, 126, 216.
Dawes D.H., Winkler C.A. // J. Polym. Sci. Part A: Polym. Chem. 1964. V. 2. № 7. P. 3029.
Джабиев T.C., Дьячковский Ф.С., Шилов A.E. // Высокомолекуляр. соед. 1971. T. (A) 13. № 11. С. 2474.
Ono I., Keii T. // J. Polym. Sci. Part A: Polym. Chem. 1966. V. 4. № 10. P. 2441.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика