Химическая физика, 2019, T. 38, № 9, стр. 39-46
Биоразлагаемые полимерные материалы на основе полилактида
С. З. Роговина 1, *, К. В. Алексанян 1, Л. В. Владимиров 1, А. А. Берлин 1
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: s.rogovina@mail.ru
Поступила в редакцию 27.03.2019
После доработки 27.03.2019
Принята к публикации 22.04.2019
Аннотация
В условиях сдвиговых деформаций в смесителе типа “Брабендер” путем твердофазного смешения получены композиции полилактида с различными полисахаридами (крахмалом, микрокристаллической целлюлозой, этилцеллюлозой и хитозаном). Для увеличения эластичности композиций в них в качестве пластификатора был добавлен полиэтиленгликоль. Показано, что механические характеристики, водопоглощение и способность к биоразложению композиций зависят от соотношения компонентов и природы используемого полисахарида. На основании данных сканирующей электронной микроскопии и ИК-спектроскопии предложен механизм биодеструкции исследуемых композиций.
ВВЕДЕНИЕ
Разработка биоразлагаемых композитов на основе полимеров, получаемых из природного сырья, которые могли бы распадаться под действием окружающей среды на безвредные для природы вещества, является одним из приоритетных направлений создания нового поколения полимерных материалов. Интерес к подобным системам связан с постоянно возрастающими объемами производства синтетических полимеров и отходов переработки растительного сырья, приводящих к загрязнению окружающей среды и необходимости их утилизации, с одной стороны, и также необходимости постепенного замещения синтетических полимеров, получаемых из нефти, – с другой [1–3]. Радикальным решением этой проблемы является использование полимеров природного происхождения, а также их композиций для получения биоразлагаемых полимерных материалов.
Биодеструкция композиционных материалов подразумевает полный или частичный распад наполнителя и фрагментацию полимерной матрицы, а способность к биоразложению – один из основных факторов, определяющих перспективность использования конкретной композиции. Тем не менее биоразложение полимерных материалов в природных условиях представляет собой сложный процесс, в настоящее время недостаточно изученный.
Обычно биоразлагаемые полимеры подразделяются на два класса: природные полимеры (например, полисахариды и белки) и полимеры, синтезируемые из мономеров природного происхождения химическим (полилактид) или микробиологическим (полигидроксиалконоаты) путем. Особый интерес среди природных полимеров представляют природные полисахариды – целлюлоза, крахмал, хитин и его дезацетилированное производное хитозан.
Одним из наиболее перспективных пластиков, синтезируемых из природного сырья и нашедших широкое практическое применение, в настоящее время является полилактид – продукт полимеризации молочной кислоты, образующейся при ферментативном брожении кукурузы, картофеля, сахарной свеклы и других культур, которые являются возобновляемым сырьем биологического происхождения [4–6]. Полилактид обладает высокими механическими характеристиками, но он хрупок, обладает низкой термоустойчивостью, а высокая стоимость изделий на его основе снижает его конкурентоспособность по сравнению с синтетическими полимерами. Важным достоинством полилактида является то, что он представляет собой прозрачный, бесцветный термопластичный полимер, который может быть переработан всеми способами, применяемыми для переработки известных термопластов. Из листов полилактида путем термоформования можно получать пленки, волокна, упаковку для пищевых продуктов, импланты для медицины и т.д. [7–9].
При соответствующей пластификации полилактид становится эластичным и по своим свойствам приближается к полиэтилену, пластифицированному поливинилхлориду или полипропилену [6, 10]. Однако, несмотря на все перечисленные достоинства полилактида, широкое использование его как полимера бытового и технического назначения до последнего времени сдерживается относительно небольшими объемами выпуска, низкой производительностью технологических линий и, как следствие, высокой стоимостью. Кроме того, полилактид обладает ограниченной биоразлагаемостью и активно деструктирует только в агрессивных средах (компосте или морской воде).
В этой связи весьма перспективным представляется создание композиций полилактида с природными полисахаридами. Присутствие полисахаридов увеличивает биоразлагаемость полилактида, так как благодаря наличию ацетальных связей они в первую очередь легко подвергаются биодеструкции, инициируя последующую деструкцию менее подверженной биоразложению полилактидной матрицы. Так как скорость разложения полилактида зависит от природы и количества второго компонента в композиции, то правильный выбор этого полимера и состава композиции определяет перспективность их использования. Именно этим обстоятельством объясняется большое число работ, посвященных получению смесей полилактида с полимерами природного происхождения, позволяющими придать изделиям на их основе способность к биодеструкции, снизить стоимость и обеспечить необходимые физико-механические свойства [5, 6, 10–15].
Главным при производстве изделий на основе полилактида и полисахаридов (пленок, волокон, упаковок для пищевой промышленности) является соблюдение баланса между их потребительскими свойствами и способностью к биодеструкции при нахождения в грунте после окончания срока эксплуатации. Сложность создания материалов на основе полисахаридов связана с их неспособностью при нагревании переходить без разложения в вязкотекучее состояние, при котором обычно перерабатываются синтетические полимеры. Поэтому перспективным способом получения композиций на их основе является разработанный в Институте химической физики им. Н.Н. Семёнова РАН экологически чистый метод твердофазного измельчения и смешения полимеров в условиях высокотемпературного совместного воздействия на материал давления и сдвиговых деформаций в твердой фазе, позволяющий в отсутствие растворителей получать смеси с повышенным гомогенным распределением компонентов [16].
Поскольку в общем случае формирование структурноупорядоченных композиционных полимерных систем, включающих в себя компоненты различной природы, в значительной степени зависит от условий их получения, то изучение основных закономерностей образования таких композиций есть необходимое условие для проведения объективного и достоверного анализа их свойств. Определение механических характеристик, морфологии композиций и изучение их способности к биоразложению в зависимости от природы и состава входящих в них компонентов представляют собой задачи, требующие детального рассмотрения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
В работе использовали следующие материалы: полилактид марки 4042D фирмы “Nature Works” (США) с (Tпл = 155 °С, прозрачностью 2.1% и Mw = 1.6 ⋅ 105); картофельный крахмал с содержанием амилозы 19–24% (ООО Славная Трапеза Холдинг, Россия); порошковую микрокристаллическую целлюлозу (МКЦ) фирмы “MP Biomedicals” (Франция); хитозан (степень дезацетилирования – 0.87, ММ – 4.4 ⋅ 105) фирмы “Биопрогресс” (Россия); этилцеллюлозу (содержание этоксильных групп – 46.6%, динамическая вязкость 57) и низкомолекулярный полиэтиленгликоль (ПЭГ) фирмы “SIGMA” (Германия) с Мw = 600; 1000 и 4000.
Получение композиций
Смешение полилактида с полисахаридами, а также с ПЭГ под действием сдвиговых деформаций проводили в смесителе типа “Brabender” (Plastograph EC, Германия) при 160 °С в течение 10 мин. Из полученных композиций были отпрессованы пленки толщиной 0.18–0.25 мм на прессе CARVER (США) при 160 °С и давлении 10 МПа в течение 10 мин с последующим охлаждением под давлением со скоростью ∼15 °С/мин.
Механические испытания
Механические свойства полученных композиций были изучены на разрывной машине “Инстрон-3365” (Великобритания) в режиме растяжения при постоянной скорости перемещения верхнего траверса 50 мм/мин и комнатной температуре. Результаты усредняли по шести-семи образцам.
Водопоглощение
Измерение водопоглощения проводили по ГОСТ 4650-80, согласно которому пленочные образцы, помещенные в воду, выдерживали в термостате при 30 °С и взвешивали через определенные промежутки времени.
Исследование биодеструкции
Испытания на грибостойкость. Лабораторные испытания образцов на стойкость к воздействию плесневых грибов проводили по ГОСТ 9.049-91, позволяющему оценивать степень развития грибов при отсутствии минеральных и органических загрязнений. Суть метода заключается в выдерживании материалов, зараженных спорами плесневых грибов, в оптимальных для их роста условиях и последующей оценке степени их развития. Для проведения испытаний использовались тест-организмы из фонда Всероссийской коллекции микроорганизмов. Оценка грибостойкости по интенсивности развития грибов на образцах проводилась по шестибалльной шкале.
Экспонирование образцов в почве. Для изучения биоразлагаемости полимерных композиций в условиях, моделирующих процессы, происходящие в окружающей среде, исследуемые образцы помещали в контейнеры с влажной почвой, предназначенной для выращивания растений, с рН = 7 и выдерживали в термостате при 30 °С. Потерю массы образцов определяли путем взвешивания, проводя измерения через определенные промежутки времени.
Сканирующая электронная микроскопия (СЭМ). Морфологию образцов после их выдерживания в почве в течение нескольких месяцев исследовали методом СЭМ с использованием сканирующего электронного микроскопа SEM JEOL SM-70001F (Япония).
ИК-спектроскопия. Сравнительное изучение образцов методом ИК-спектроскопии до и после экспонирования проводили с помощью Фурье-спектрометра Vertex 70 (Bruker, США). Спектры регистрировали при разрешении 2 или 4 см–1 методом нарушенного полного внутреннего отражения (НПВО) c использованием приставки GladiATR (Pike Technologies, USA) и алмазного элемента внутреннего отражения (число отражений n = 2, 4; угол падения излучения – 45°). Регистрацию спектров и все дальнейшие манипуляции с ними проводили с помощью пакета программ Bruker Opus (Version 7.1).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Композиции полилактида с крахмалом, МКЦ, хитозаном и этилцеллюлозой были получены путем твердофазного смешения компонентов под действием сдвиговых деформаций в смесителе типа “Брабендер” при температуре 160 °С. Результаты механических испытаний пленок, полученных прессованием композиций, представлены в табл. 1, из которой видно, что добавление полисахаридов как более жестких полимеров к полилактиду приводит к увеличению модуля упругости и падению разрывного напряжения и удлинения при разрыве. При этом изменение механических параметров происходит симбатно увеличению содержания полисахарида. В общем случае величина механических характеристик композиций полисахаридов с полилактидом определяется как соотношением компонентов, так и природой используемого полисахарида.
Таблица 1.
Механические характеристики композиций полилактид–полисахарид и полилактид–полисахарид–ПЭГ
| Состав смеси | Соотношение компонентов, мас.% | Е, МПа | σр, МПа | εр, % |
|---|---|---|---|---|
| Полилактид | – | 2625 ± 65 | 52 ± 1.0 | 4.7 ± 0.05 |
| Полилактид–крахмал | 80 : 20 | 3070 ± 86 | 48.6 ±1.5 | 2.12 ± 0.1 |
| 70 : 30 | 3120 ± 72 | 37.1 ± 2.9 | 1.92 ± 0.14 | |
| 60 : 40 | 3230 ± 84 | 42 ± 2.0 | 2.0 ± 0.05 | |
| Полилактид–МКЦ | 70 : 30 | 3640 ± 111 | 40.6 ± 1.7 | 1.9 ± 0.03 |
| 60 : 40 | 3900 ± 106 | 34.5 ± 1.8 | 1.5 ± 0.1 | |
| Полилактид–этилцеллюлоза | 80 : 20 | 2260 ± 163 | 40.1 ± 5.4 | 3.34 ± 0.32 |
| 70 : 30 | 2620 ± 89.4 | 32.7 ± 1.0 | 1.9 ± 0.13 | |
| Полилактид–хитозан | 80 : 20 | 2900 ± 246 | 15.1 ± 0.4 | 1.15 ± 0.1 |
| 70 : 30 | 3110 ± 90 | 45.5 ± 2.2 | 2.5 ± 0.2 | |
| Полилактид–крахмал–ПЭГ600 | 60 : 20 : 20 | 715 ± 19.8 | 10.4 ± 0.2 | 19.8 ± 2.6 |
| 55 : 20 : 25 | 875 ± 17.5 | 10.6 ± 0.2 | 5.72 ± 0.9 | |
| Полилактид–МКЦ–ПЭГ600 | 60 : 30 : 10 | 2040 ± 42.1 | 19.4 ± 0.6 | 1.7 ± 0.05 |
| 60 : 20 : 20 | – | – | – | |
| Полилактид–МКЦ–ПЭГ1000 | 60 : 30 : 10 | 1890 ± 79.1 | 19.0 ± 0.8 | 1.8 ± 0.10 |
| 60 : 20 : 20 | 1150 ± 29.7 | 7.0 ± 0.5 | 0.9 ± 0.05 | |
| Полилактид–МКЦ–ПЭГ4000 | 60 : 30 : 10 | 1910 ± 24.1 | 21.0 ± 0.6 | 1.75 ± 0.1 |
| 60 : 20 : 20 | 1400 ± 47 | 9 ± 0.5 | 1.0 ± 0.1 | |
| Полилактид–этилцеллюлоза–ПЭГ600 | 60 : 30 : 10 | 1500 ± 74 | 12.9 ± 0.4 | 1.8 ± 0.13 |
| 60 : 20 : 20 | 252 ± 17 | 4.9 ± 0.2 | 20.1 ± 1.6 | |
| 55 : 20 : 25 | 1150 ± 24 | 12.2 ± 0.8 | 3.4 ± 0.4 | |
| Полилактид–хитозан–ПЭГ600 | 60 : 30 : 10 | 1370 ± 60 | 17.6 ± 0.3 | 3.2 ± 0.2 |
| 60 : 20 : 20 | 106 ± 11 | 8.9 ± 0.1 | 57.5 ± 2.0 | |
| 52 : 21 : 27 | 181 ± 28 | 3.6 ± 0.05 | 29.5 ± 2.2 |
С целью улучшения эластичности, биоразлагаемости и, следовательно, расширения областей потенциального применения получаемых материалов в композицию полилактид–МКЦ был добавлен пластификатор ПЭГ различной молекулярной массы ММ = 600, 1000, 4000. В результате введения ПЭГ, независимо от его молекулярной массы, происходит падение модуля упругости и разрывного напряжения, зависящее от количества добавленного ПЭГ; при этом практически не происходит изменения удлинений при разрыве. Аналогичные результаты были получены нами ранее для композиций полиэтилена низкой плотности с различными полисахаридами, содержащими ПЭГ [17].
При изучении влияния ПЭГ на значения удлинения при разрыве, εp, была обнаружена аномальная зависимость между количеством введенного ПЭГ и значением εр. Так, для композиций, содержащих 20 мас.% ПЭГ, наблюдается резкое увеличение значений удлинения. Например, для композиции полилактид–хитозан–ПЭГ (60 : 20 : 20 мас.%) по сравнению с композицией полилактид–хитозан–ПЭГ (60 : 30 : 10 мас.%) удлинение возрастает с 3.2 до 57.5%, однако при дальнейшем увеличении содержания ПЭГ в смеси до 27 мас.% происходит падение удлинения до 29.5% (табл. 1). Такая же закономерность наблюдалась и для композиций полилактида с другими полисахаридами. Наблюдаемый эффект может быть связан с фазовым разделением компонентов в смесях при увеличении содержания пластификатора. Если количество добавленного ПЭГ составляет менее 20%, происходит возрастание сегментарной подвижности полилактида и, как следствие, рост удлинения при разрыве; однако дальнейшее увеличение содержания ПЭГ приводит к расслоению смеси.
Способность к водопоглощению – важная характеристика биоразлагаемых композиций, поскольку она является косвенной характеристикой, указывающей на их способность к биоразложению. Полученные результаты по водопоглощению двойных композиционных пленок на основе полилактида и крахмала и полилактида и МКЦ представлены на рис. 1.
Рис. 1.
Зависимость водопоглощения пленками, полученными из двойных композиций полилактид–крахмал (а) и полилактид–МКЦ (б), от времени выдерживания в воде при следующих соотношениях компонентов: а – 80 : 20 (1), 70 : 30 (2), 60 : 40 мас.% (3); б – 70 : 30 (1), 60 : 40 мас.% (2).
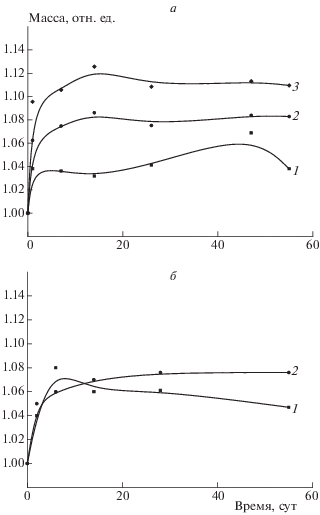
Для определения количества воды, поглощенной пленкой, ее помещали в воду, а затем взвешивали через определенные промежутки времени. Как видно из рассмотрения соответствующих кривых, наибольшим водопоглощением среди двойных композиций обладают пленки, содержащие максимальное количество крахмала (40 мас.%); при этом максимальное содержание воды на 14-е сутки составляло 12.6% (рис. 1а). Необходимо отметить, что полученные кривые характеризуются максимумом водопоглощения, причем, если для композиций, содержащих 40 и 30 мас.% крахмала, максимум наблюдается на 14-е сутки, то для композиции, в состав которой входит 20 мас.% крахмала, максимальное водопоглощение происходит на 47-е сутки. Такой характер кривых связан с различным содержанием в композициях крахмала, поглощающего воду. Аналогичные закономерности водопоглощения отмечены и для тройных композиций с ПЭГ, причем характер кривых остается неизменным.
Как и следовало ожидать, двойные композиции полилактид–МКЦ в меньшей степени поглощают воду, чем композиции, содержащие крахмал (рис. 1б). Наиболее высокие значения (примерно 9%) водопоглощения отмечены у тройных композиций полилактид–МКЦ–ПЭГ600 (60 : 20 : 20 мас.%) после 15 сут выдерживания образцов; затем система приходит в равновесие и дальнейшего роста водопоглощения не наблюдается.
Разработка новых и совершенствование существующих физико-химических подходов к контролю свойств композиционных биоразлагаемых систем, подвергающихся разрушению в условиях реальной эксплуатации под воздействием температурных, климатических и микробиологических факторов, является фундаментальной проблемой, решение которой имеет большое практическое значение. Изучение биоразлагаемости пленок, полученных из смесей полилактида с полисахаридами, проводили несколькими независимыми методами: испытаниями на грибостойкость, закапыванием в грунт с последующим контролем потери массы образцов, исследованием образцов до и после выдерживания в почве методами СЭМ и ИК-спектроскопии.
Оценка стойкости образцов к воздействию плесневых грибов проводилась с использованием шестибалльной шкалы по методике, описанной в работе [18]. Кроме того, в ходе проведения испытаний оценивались изменения окраски, формы и текстуры образцов.
В процессе исследований был установлен вид грибов, развивающихся на поверхности и в объеме пленок, содержащих различные полисахариды. Так, для пленок, содержащих крахмал и целлюлозу, в наибольшем количестве обнаружены споры, характерные для грибов рода Aspergillus brasiliensis, известного как продуцент амилаз. В то же время в течение более длительного времени проведения теста для образцов МКЦ характер микроколоний изменяется и появляются структуры, характерные для грибов Penicillium. Однако, несмотря на то, что на всех образцах, содержащих МКЦ, после 45 сут испытаний отмечалось развитие грибов (мицелиальный рост и слабое спороношение, различимое под микроскопом), рассмотренные системы обладают высокой устойчивостью к воздействию последних, что, по-видимому, обусловлено особенностями морфологии системы.
Наилучшие результаты по развитию грибов были получены для пленок, содержащих хитозан (рис. 2). В этом случае наблюдалась их эффективная деградация в процессе развития плесневых грибов, сопровождающаяся глубоким прорастанием гифа мицелия грибов в объем полимерной матрицы, а интенсивность развития грибов в этом случае была оценена наивысшим баллом – 5.
Рис. 2.
Оптические микрофотографии поверхностей композиционных пленок из композиций полилактид–хитозан (70 : 30 мас.%) – а и полилактид–хитозан–ПЭГ600 (60 : 20 : 20 мас.%) – б (×15), зараженных микроспорами грибов.

Потерю массы определяли у двойных композиций полилактид–полисахарид и их тройных композиций с ПЭГ после экспонирования в грунте при 30 °С в течение нескольких месяцев. Характер кривых для всех исследуемых систем практически остается неизменным, а основная потеря массы происходит в течение первых двух месяцев. Визуально на пленках отчетливо видно появление микротрещин и пятен, причем особенно большие изменения также были отмечены у образцов, содержащих хитозан.
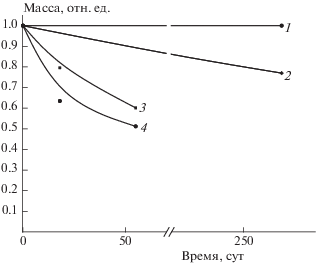
На рис. 3 приведены кривые потери массы двойных и тройных композиций полилактида с крахмалом и МКЦ. Как видно из рисунка, биоразложение композиций, содержащих крахмал, протекает с большей скоростью. Так, за 60 сут потеря массы композиции полилактид–крахмал (70 : 30 мас.%) составляет 40%, в то время как для композиции полилактид–МКЦ аналогичного состава потери массы за этот промежуток времени не происходит. В то же время добавление ПЭГ600 приводит к увеличению потери массы для обеих композиций и оценивается приблизительно в 50% за 60 сут для смеси на основе крахмала и в 25% за 260 сут для смеси на основе целлюлозы.
Рис 3.
Кривые потери массы двойных композиций полилактид–МКЦ – кривая 1, полилактид–крахмал (70 : 30 мас.%) – кривая 3 и тройных композиций полилактид–МКЦ–ПЭГ600 (60 : 30 : 10 мас.%) – кривая 2, полилактид–крахмал–ПЭГ600 (60 : 20 : 20 мас.%) – кривая 4 после выдерживания в почве.
Для сравнительной оценки процессов деструкции, протекающих при экспонировании образцов в почве, морфология композиций на основе четырех использованных полисахаридов была исследована методом СЭМ. На рис. 4 представлены микрофотографии поверхности пленок тройных композиций полилактид–крахмал–ПЭГ600 и полилактид–МКЦ–ПЭГ4000 (60 : 20 : 20 мас.%). Как видно из рис. 4а, на пленках полилактид–крахмал–ПЭГ600 после экспонирования в почве образуются микротрещины, также указывающие на биодеградацию полилактидной матрицы. Кроме того, на этих пленках присутствуют не только следы плесневых грибов, но и кластеры, зараженные микроколониями бактерий. Таким образом, одна группа микроорганизмов продуцирует субстрат для другой, что способствует более интенсивной деструкции материала, приводящей к появлению микротрещин.
Рис. 4.
Электронные микрофотографии поверхности пленки из композиций полилактид–крахмал–ПЭГ600 – а и полилактид–МКЦ–ПЭГ4000 (60 : 20 : 20 мас.%) – б после выдерживания в почве (×2000).

На поверхности пленки из композиции на основе МКЦ (рис. 4б) после экспонирования в почве в течение 137 сут отчетливо видны образовавшиеся в результате деструкции сквозные углубления. Это указывает на начальную стадию фрагментации образцов, приводящей к их последующему разрушению вследствие протекания процесса биодеструкции.
Анализ композиций проводился также с использованием метода ИК-спектроскопии, позволяющего, в частности, оценить изменение степени кристалличности полилактида и морфологии пленочных смесевых композиций в процессе биодеструкции. На рис. 5 представлен фрагмент ИК-спектров исходного полилактида (1), крахмала (2), композиции полилактид–крахмал (60 : 40 мас.%) до (3) и после экспонирования в почве (4). Для анализа была выбрана область спектра 1500–800 см–1, содержащая наиболее характерные полосы полилактида и крахмала.
Рис. 5.
ИК-спектры полилактида (1), крахмала (2), композиции полилактид–крахмал (60 : 40 мас.%) до (3) и после экспонирования в почве (4).
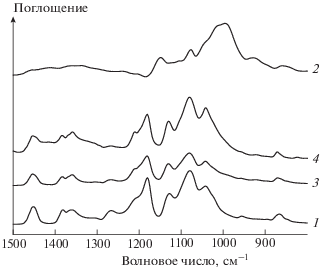
Как видно из рис. 5, спектр поверхности исходной пленки полилактида (кривая 1) неотличим от спектра полилактида, в котором наиболее интенсивные полосы расположены в области 1200–1080 см–1 и относятся к валентным колебаниям связей С–О (С–О–С и/или С–О(Н)), а также к валентным колебаниям связей С–С, т.е. на поверхности пленки присутствует только аморфный полилактид, а исходная композиция представляет собой, таким образом, крахмал, капсулированный в пленке полилактида. Сравнительная оценка изменений аналитических полос спектров композиции до и после выдерживания в почве (рис. 5, кривые 3 и 4) показывает увеличение интенсивности полосы при 1220 см–1, чувствительной к степени кристалличности полилактида [19], что свидетельствует о росте его степени кристалличности, происходящей за счет деструкции аморфных областей при экспонировании образцов в почве.
На спектре исходного крахмала (рис. 5, кривая 2) присутствуют характерные широкие полосы с максимумами при 1416 и 1365 см–1, относящиеся к смешанным по форме колебаниям связей CН–OH и интенсивная полоса с максимумом 995 см–1, представляющая собой сумму ряда полос валентных колебаний связей С–О и С–С. Эта полоса в спектре смесевой композиции лежит в области более низких частот по сравнению с группой полос, аналогичных по форме колебаниям полилактида. В результате в спектре пленки смесевой композиции после экспозиции в почве наблюдается низкочастотное уширение полосы полилактида, что свидетельствует о появлении на поверхности пленки крахмала (рис. 5, кривая 4). Этот факт подтверждается также увеличением интенсивности поглощения в области 1470–1250 см–1, обусловленным спектральным вкладом крахмала, набухшего в содержащейся в почве воде [20].
Полученные результаты подтвердились также при проведении качественной йодной реакции на крахмал. Оказалось, что в отличие от пленки, подвергшейся экспонированию и окрашивающейся при взаимодействии с йодом в синий цвет, подобного окрашивания поверхности исходной композиции не происходит, т.е. крахмал на поверхности пленки отсутствует. Таким образом, исходные пленки представляют собой крахмал, капсулированный в полилактидную матрицу, который при экспонировании благодаря присутствующей в почве воде набухает, прорывает оболочку полилактида и выходит на поверхность, инициируя тем самым его последующую деградацию, приводящую к разрушению образца.
ЗАКЛЮЧЕНИЕ
Полученные в условиях сдвиговых деформаций в смесителе типа “Брабендера” композиции полилактида с различными полисахаридами являются биоразлагаемыми системами, что подтверждается проведенными исследованиями по изучению их устойчивости к воздействию плесневых грибов, измерением потери массы при экспонировании в почве, а также данными СЭМ и ИК-фурье-спектроскопии. Биоразложение композиций, представляющих собой полисахарид, капсулированный в полилактидную матрицу, протекает в результате деструкции макромолекул и последующей фрагментации образцов, сопровождающейся увеличением их кристалличности. Присутствие пластификатора ПЭГ способствует интенсификации процесса биодеструкции.
Работа выполнена в рамках госзадания: № госрегистрации АААА-А17-117040610309-0.
Список литературы
Raquez J.-M., Narayan R., Dubois P. // Macromol. Mater. Eng. 2008. V. 293. № 6. P. 447.
Rogovina S.Z. // Polym. Sci. Ser. C. 2016. V. 58. № 1. P. 68.
Lin C.S.K., Platzgraff L.A., Herrero-Davila L. et al. // Energy Environ. Sci. 2013. V. 6. P. 426.
Rasal R., Janorkar A., Hirt D. // Prog. Polym. Sci. 2010. V. 35. P. 338.
Yu L., Chen L. // Biodegradable Polymer Blends and Composites from Renewable Resources / Ed. Yu. L. New Jersey: Wiley, 2009. P. 1.
Soulestin J., Prashantha K., Lacrampe M.F., Krawczak P. // Handbook of Bioplastics and Biocomposites Engineering Applications / Ed. Pilla S. .New Jersey: Wiley Scrive-ner Publ., 2011. Pt. II. P. 77.
Ren J. Biodegradable poly(lactioc acid): synthesis, modification, processing and applications. Beijing: Tsinghua University Press; Berlin, Heidelberg: Springer-Verlag, 2010.
Da Silva D. Kaduri M., Poley M., Adir O. et al. // Chem. Eng. J. 2018. V. 340. P. 9.
Gonzalez E.A.S., Olmos D., Lorente M.A., Velaz I., Gonzalez-Benito J. // Polymers. 2018. V. 10. № 12. P. 1365.
Ljungberg N., Wesslen B. // Biomacromolecules. 2005. V. 6. P. 1789.
Koyama Y., Doi Y. // Polymer. 1997. V. 38. P. 1589.
Ohkoshi I., Abe H., Doi Y. // Ibid. 2000. V. 41. P. 5985.
Kozlowski M., Masirek R., Piorkowska E., Gazicki-Lipman M. // J. Appl. Polym. Sci. 2007. V. 105. P. 269.
Suyatma N.E., Copinet A., Tighzert L., Coma V. // J. Polym. Environ. 2004. V. 12. № 1. P. 1.
Bonilla J., Fortunati E., Vargas M., Chiralt A., Kenny J.M. // J. Food Eng. 2013. V. 119. P. 236.
Ениколопян Н.С. // Докл. АН СССР. 1985. Т. 283. С. 897.
Rogovina S., Aleksanyan K., Vladimirov L., Prut E., Ivanushkina N., Berlin A. // J. Polym. Environ. 2018. V. 26. № 4. P. 1727.
Роговина С.З., Алексанян К.В., Новиков Д.Д., Прут Э.В., Ребров А.В. // Высокомолекуляр. соединения. А. 2009. Т. 51. № 5. С. 813.
Krikorian V., Pochan D.J. // Macromolecules. 2005. V. 38. P. 6520.
Warren F.J., Gidley M.J., Flanagan B.M. // Carbohydr. Polym. 2016. V. 139. P. 35.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


