Химическая физика, 2020, T. 39, № 1, стр. 47-51
Термохимические свойства производных [1,2,4]триазоло[4,3-b][1,2,4,5]тетразина
Т. С. Конькова 1, *, Ю. Н. Матюшин 1, Е. А. Мирошниченко 1, А. Б. Воробьев 1, Н. В. Палысаева 2, А. Б. Шереметев 2
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Институт органической химии им. Н.Д. Зелинского Российской академии наук
Москва, Россия
* E-mail: taskon@mail.ru
Поступила в редакцию 23.01.2019
После доработки 01.03.2019
Принята к публикации 20.03.2019
Аннотация
Методом бомбовой калориметрии измерены энергии сгорания и рассчитаны энтальпии образования в стандартном состоянии производных [1,2,4]триазоло[4,3-b][1,2,4,5]тетразина, включающих фуразаниламинный заместитель. На основе полученных данных проведена оценка вклада [1,2,4]триазоло[4,3-b][1,2,4,5]тетразинового фрагмента в энтальпию сгорания его производных.
ВВЕДЕНИЕ
В последние десятилетия полиазотистые гетероциклические соединения, такие как фуразаны, триазолы, тетразолы, триазины, тетразины и др., широко исследуются как перспективная основа для конструирования новых компонентов высокоэнергетических материалов. В ряду таких соединений 1,2,4,5-тетразины (s-тетразины) занимают заметное место.
Производные s-тетразина находят широкое применение в органическом синтезе [1], а представители этого класса соединений, включающие обогащенные азотом и кислородом заместители, представляют интерес в качестве энергоемких материалов [2–7]. В противоположность традиционным энергоемким соединениям, энергия, аккумулированная в полиазотистых соединениях, обусловлена наличием в них большого количества N–N и C–N связей. Имея высокие положительные энтальпии образования, подобные соединения при взрыве или горении высвобождают эту энергию, а в качестве продуктов разложения дают преимущественно азот. Для сжигания имеющегося в них небольшого количества углерода и водорода требуется лишь немного кислорода. Большое содержание азота в полиазотистых соединениях привлекательно также с экологической точки зрения [8, 9].
В структуре s-тетразина имеется четыре атома азота, что составляет ~70% от массы этого гетероцикла. При этом его производные, как правило, являются весьма стабильными соединениями, обладающими высокой плотностью и термической стабильностью. Введением азотсодержащих заместителей содержание азота может быть еще повышено с одновременным снижением процентного содержания углерода.
Большинство производных s-тетразина, предлагаемых в качестве потенциальных компонентов энергоемких материалов, обладают приемлемой чувствительностью к механическим воздействиям и высокой термостойкостью. На основе s-тетразина получен ряд интересных термостойких [10] и светочувствительных взрывчатых веществ [3, 4], быстрогорящих компонентов ракетных топлив [11].
Весьма перспективной группой энергоемких s-тетразинов являются его гибридные производные, включающие другие азотистые гетероциклы, будь то аннелированные производные или линейные ансамбли разных гетероциклов. Однако имеющиеся в литературе сведения о них весьма скудны. В настоящей работе впервые сообщается о термохимических исследованиях соединений такого типа.
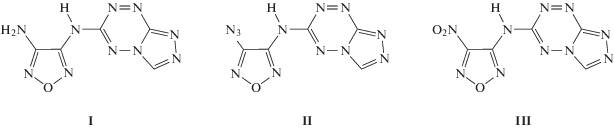
Методом калориметрии сжигания нами измерены энергии сгорания производных [1,2,4]триазоло[4,3-b][1,2,4,5]тетразина, включающих фуразаниламинный заместитель:
Рассчитаны энтальпии образования этих соединений в стандартном состоянии. На основе полученных термохимических данных рассчитан вклад [1,2,4]триазоло[4,3-b][1,2,4,5]тетразинового фрагмента в энтальпию сгорания его производных.
Следует отметить, что получение прецизионных экспериментальных значений стандартных энтальпий образования в твердой фазе $\Delta H_{{f(cr)}}^{^\circ }$ для новых энергоемких соединений, в частности, на основе [1,2,4]триазоло[4,3-b][1,2,4,5]тетразина, дополняет имеющуюся базу данных и позволяет повысить точность оценки энтальпий образования гипотетических аналогов, в том числе методом групповых вкладов, сочетающим в себе простоту и надежность.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтезы соединений I (3-{N-([1,2,4]триазоло[4,3-b]-[1,2,4,5]тетразин-3-ил)амино-4-аминофуразан, C5H4N10O1, М.в. 220.15, Тпл = 276–278 °С), II (3-{N-([1,2,4]триазоло[4,3-b]-[1,2,4,5]тетразин- 3-ил)амино-4-азидофуразан, C5H2N12O1, М.в. 246.15, Тпл = 194–195 °С) и III (3-{N-([1,2,4]триазоло[4,3-b]-[1,2,4,5]тетразин-3-ил)амино-4-нитрофуразан, C5H2N10O3, М.в. 250.14, Тпл = 235–236 °С) были проведены по известным методикам [12, 13]. Для термохимического изучения образцы очищены многократной перекристаллизацией и вакуумной сушкой. Структура и чистота соединений установлены на основе данных ЯМР 1H, 13C и 14N, масс-спектрометрии и элементного анализа.
Калориметрическое измерение энергий сгорания азотсодержащих соединений проводили на прецизионном автоматическом калориметре сжигания с изотермической оболочкой [14]. Образцы исследуемых веществ сжигали в платиновом тигле. Взвешивали образец вещества на микроаналитических весах с погрешностью 10–6 г, затем помещали в калориметрическую бомбу и наполняли бомбу кислородом. Начальное давление кислорода при сжигании всех веществ составляло около 3 МПа. Перед проведением эксперимента в бомбу вводили 1 мл дистиллированной воды для создания давления насыщенного пара и растворения образующихся в процессе сгорания окислов азота. Подробная методика подготовки образцов и проведения эксперимента по сжиганию их в калориметрической бомбе приведена в работе [15]. Энергии сгорания в условиях калориметрической бомбы для исследуемых соединений приведены в табл. 1.
Таблица 1.
Энтальпии сгорания в стандартном состоянии производных [1,2,4]триазоло[4,3-b][1,2,4,5]тетразина
| Соединение I | ||||||||
|---|---|---|---|---|---|---|---|---|
| Номер эксперимента | m0 | ΔТ | Q | qa | qi | qN | qcot | $--U_{B}^{'}$ |
| 1 | 0.058569 | 2.07243 | 1110.88 | 918.28 | 0.524 | 2.20 | 8.95 | 3489.3 |
| 2 | 0.077835 | 1.54681 | 829.14 | 615.32 | 0.524 | 2.21 | 6.64 | 3490.8 |
| 3 | 0.052574 | 1.97516 | 1058.74 | 771.21 | 0.524 | 3.31 | 6.50 | 3489.3 |
| 4 | 0.057949 | 1.92314 | 1030.86 | 838.15 | 0.524 | 2.20 | 6.71 | 3486.1 |
| 5 | 0.058569 | 1.77387 | 950.85 | 739.66 | 0.524 | 2.48 | 6.38 | 3482.5 |
| $\Delta U_{B}^{'}$ = –3488 ± 4 кал ∙ г–1 | ||||||||
| Соединение II | ||||||||
| Номер эксперимента | m0 | ΔТ | Q | qa | qi | qN | qcot | $--U_{B}^{'}$ |
| 1 | 0.059549 | 1.71285 | 909.76 | 709.64 | 0.524 | 3.11 | 7.70 | 3170.3 |
| 2 | 0.078625 | 1.94597 | 1033.58 | 773.43 | 0.524 | 3.38 | 6.31 | 3178.8 |
| 3 | 0.051267 | 1.74004 | 924.20 | 749.63 | 0.524 | 3.67 | 7.62 | 3174.7 |
| $\Delta U_{B}^{'}$ = –3175 ± 8 кал ∙ г–1 | ||||||||
| Соединение III | ||||||||
| Номер эксперимента | m0 | ΔТ | Q | qa | qi | qN | qcot | $--U_{B}^{'}$ |
| 1 | 0.091588 | 1.92618 | 1023.07 | 755.17 | 0.524 | 2.32 | 5.24 | 2836.8 |
| 2 | 0.058396 | 1.74306 | 925.81 | 752.17 | 0.524 | 1.55 | 6.30 | 2830.1 |
| 3 | 0.059464 | 1.73402 | 931.93 | 752.05 | 3.824 | 1.68 | 5.82 | 2834.6 |
| 4 | 0.056955 | 1.72842 | 928.92 | 754.65 | 3.824 | 1.74 | 7.39 | 2832.4 |
| 5 | 0.061584 | 1.79848 | 966.58 | 780.28 | 3.824 | 1.71 | 6.28 | 2833.3 |
| $\Delta U_{B}^{'}$ = –2833 ± 3 кал ∙ г–1 | ||||||||
Примечание: m0 – масса навески исследуемого вещества, приведенная к вакууму, г; ΔT – исправленный подъем температуры в калориметре, усл. град; Q – количество теплоты, измеренное в опыте, кал; qi – энергия поджига, кал; qa – тепловыделение от сгорания вспомогательного вещества – бензойной кислоты, кал; qN – поправка на образование азотной кислоты, кал; qcot – тепловыделение от сгорания хлопчатобумажной нити, кал; $\Delta U_{B}^{'}$ – энергия сгорания вещества в условиях бомбы, кал ∙ г–1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Реакции сгорания соединений протекают согласно следующим уравнениям:
(1)
$\begin{gathered} {{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{{\text{4}}}}{{{\text{N}}}_{{{\text{10}}}}}{{{\text{O}}}_{{1(cr)}}} + 5.5{{{\text{O}}}_{{2(g)}}} \to \\ \to 5{\text{C}}{{{\text{O}}}_{{2(g)}}} + 2{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{(l)}}} + 5{{{\text{N}}}_{{2(g)}}}, \\ \end{gathered} $(2)
$\begin{gathered} {{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{N}}}_{{{\text{12}}}}}{{{\text{O}}}_{{1(cr)}}} + 5{{{\text{O}}}_{{2(g)}}} \to \\ \to 5{\text{C}}{{{\text{O}}}_{{2(g)}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{(l)}}} + 6{{{\text{N}}}_{{2(g)}}}, \\ \end{gathered} $(3)
$\begin{gathered} {{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{N}}}_{{{\text{10}}}}}{{{\text{O}}}_{{3(cr)}}} + 4{{{\text{O}}}_{{2(g)}}} \to \\ \to 5{\text{C}}{{{\text{O}}}_{{2(g)}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{(l)}}} + 5{{{\text{N}}}_{{2(g)}}}, \\ \end{gathered} $Энтальпии образования исследованных соединений (I, II, III) рассчитаны, исходя из энтальпий сгорания в соответствии со стехиометрией следующих реакций:
(4)
$\begin{gathered} \Delta H_{f}^{^\circ }{{\left[ {{{{\text{C}}}_{5}}{{{\text{H}}}_{4}}{{{\text{N}}}_{{10}}}{{{\text{O}}}_{1}}} \right]}_{{(cr)}}} = 5\Delta H_{f}^{^\circ }{{\left[ {{\text{C}}{{{\text{O}}}_{2}}} \right]}_{{(g)}}} + \\ + \,\,2\Delta H_{f}^{^\circ }{{\left[ {{{{\text{H}}}_{2}}{\text{O}}} \right]}_{(}}_{{l)}} + {\text{ }}5\Delta H_{f}^{^\circ }{{\left[ {{{N}_{2}}} \right]}_{{(g)}}} - \Delta H_{c}^{^\circ }, \\ \end{gathered} $(5)
$\begin{gathered} \Delta H_{f}^{^\circ }{{\left[ {{{{\text{C}}}_{5}}{{{\text{H}}}_{2}}{{{\text{N}}}_{{12}}}{{{\text{O}}}_{1}}} \right]}_{{(cr)}}} = 5\Delta H_{f}^{^\circ }{{\left[ {{\text{C}}{{{\text{O}}}_{2}}} \right]}_{{(g)}}} + \\ + \,\,~\Delta H_{f}^{^\circ }{{\left[ {{{{\text{H}}}_{2}}{\text{O}}} \right]}_{(}}_{{l)}} + 6\Delta H_{f}^{^\circ }{{\left[ {{{{\text{N}}}_{2}}} \right]}_{{(g)}}}^{~} - \Delta H_{c}^{^\circ }, \\ \end{gathered} $(6)
$\begin{gathered} \Delta H_{f}^{^\circ }{{\left[ {{{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{2}}{{{\text{N}}}_{{10}}}{{{\text{O}}}_{3}}} \right]}_{{(cr)}}} = 5\Delta H_{f}^{^\circ }{{\left[ {{\text{C}}{{{\text{O}}}_{2}}} \right]}_{{(g)}}} + \\ + \,\,\Delta H_{f}^{^\circ }{{\left[ {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right]}_{(}}_{{l)}} + 5\Delta H_{f}^{^\circ }{{\left[ {{{{\text{N}}}_{2}}} \right]}_{{(g)}}} - \Delta H_{c}^{^\circ }, \\ \end{gathered} $В табл. 2 представлены полученные термохимические характеристики для исследованных соединений. С использованием полученных термохимических величин проведена оценка вклада в энтальпию сгорания в стандартном состоянии тетразинотриазолового фрагмента:
Таблица 2.
Термохимические характеристики в стандартном состоянии производных [1,2,4]триазоло[4,3-b][1,2,4,5]тетразина, включающих фуразаниламинные заместители
| Соединение | $--\Delta U_{B}^{'},$ кал ∙ г–1 | $ - \Delta H_{с}^{^\circ },$ ккал ∙ моль–1 | $\Delta H_{f}^{^\circ },$ ккал ∙ моль–1 |
|---|---|---|---|
| C5H4N10O1 (I) | 3488 ± 4 | 764.2 ± 0.8 | 157.3 ± 0.8 |
| C5H2N12O1 (II) | 3175 ± 8 | 777 ± 2 | 238 ± 2 |
| C5H2N10O3(III) | 2833 ± 3 | 704.1 ± 0.7 | 165.5 ± 0.7 |
Так, на основе термохимических данных соединения I и с учетом известных величин термохимических вкладов в энтальпии сгорания фуразанильного фрагмента (–175.4 ккал ∙ моль–1, который определен из данных для 3,4-диметилфуразана [17] и аминогруппы (–90 ккал ∙ моль–1), что рассчитано по аминопроизводным бензола [18]), вклад тетразинотриазолового фрагмента в энтальпию сгорания составил (–408.8 ккал ∙ моль–1). Согласно расчету на основе термохимических данных соединения II вклад искомого фрагмента в энтальпию сгорания составил –408.4 ккал ∙ моль–1. Для расчета были использованы указанные выше величины вкладов фуразанильного фрагмента, аминогруппы и вклад азидогруппы, который по данным лаборатории термодинамики высокоэнергетических систем ИХФ РАН составляет –103 ккал ∙ моль–1.
Вклад [1,2,4]триазоло[4,3-b][1,2,4,5]тетразинового фрагмента из термохимических данных соединения III п оценке составил –409.6 ккал ∙ моль–1. Этот расчет проведен с использованием соответствующего вклада 3-нитрофуразанильного фрагмента [19]. Можно констатировать, что величины вклада [1,2,4]триазоло[4,3-b][1,2,4,5]тетразинового фрагмента в энтальпию сгорания в стандартном состоянии по результатам оценки разных производных демонстрируют хорошую сходимость (максимальное отклонение составило 1.2 ккал ∙ моль–1). Средняя величина вклада этого фрагмента в энтальпию сгорания в стандартном состоянии из трех рассчитанных значений составила –409.0 ккал ∙ моль–1 при максимальном отклонении 0.6 ккал ∙ моль–1. Следует отметить, что значения энтальпий образования энергоемких соединений, полученные разными авторами, могут различаться более чем на 20 ккал ∙ моль–1 [20, 21].
ВЫВОДЫ
1. Впервые определены энтальпии сгорания производных [1,2,4]триазоло[4,3-b][1,2,4,5]тетразина, включающих фуразаниламинный заместитель, что позволяет рассчитывать энтальпии образования этих соединений с погрешностями в пределах 3–5 ккал ∙ моль–1, приемлемыми для большинства практических целей.
2. На основе полученных термохимических данных впервые удалось достоверно оценить вклад [1,2,4]триазоло[4,3-b][1,2,4,5]тетразинового фрагмента в энтальпию сгорания его производных. Вклад данного высокоэндотермичного фрагмента составляет –409.0 ккал ∙ моль–1 (это соответствует –3.35 ккал ∙ г–1), что делает его весьма привлекательным блоком для конструирования новых энергоемких соединений.
Работа выполнена частично за счет субсидии, выделенной ИХФ РАН на выполнение государственного задания по теме 44.8 “Фундаментальные исследования процессов превращения энергоемких материалов и разработка научных основ управления этими процессам тема (0082-2014-0012)” и “Создание синтетических жидких топлив для военной авиации и ракетно-космической техники и разработка новых технологий получения компонентов специальных топлив тема (0082-2018-0004)”.
Список литературы
Stanovnik B., Groselj U., Svete J. // Comprehensive Heterocyclic Chemistry III / Eds. Katritzky A., Ramsden C., Scriven E., Taylor R. Oxsford, UK: Elsevier, 2008. V. 9. P. 641.
Рудаков Г.Ф., Устинова Т.В., Козлов И.Б., Жилин В.Ф. // Химия гетероцикл. соединений. 2014. Т. 50. С. 59.
Myers T.W., Snyder C.J., Chavez D.E., Scharff R.J., Veauthier J.M. // Chem. Eur. J. 2016. V. 22. P. 10590.
Myers T.W., Brown K.E., Chavez D.E., Scharff R.J., Veauthier J.M. // Inorg. Chem. 2017. V. 56. P. 2297.
Кешавар М.Х., Абади Я.Х., Есмаилпур К., Дамири С., Офтадех М. // Химия гетероцикл. соединений. 2017. Т. 53. С. 797.
Рудаков Г.Ф., Моисеенко Я.А., Спесивцева Н.А. // Там же. С. 802.
Chen D., Yang H., Yi Z. et al. // Angew. Chem. Intern. Ed. 2018. V. 57. P. 2081.
Green Energetic Materials / Ed. Brinck T. Chicher, UK: Wiley, 2014.
Kuchurov I.V., Zharkov M.N., Fershtat L.L., Makhova N.N., Zlotin S.G. // ChemSusChem. 2017. V. 10. P. 3914.
Chavez D.E., Hiskey M.A., Naud D.L. // Propellants, Explosives, Pyrotechnics. 2004. V. 29. P. 209.
Sinditskii V.P., Smirnov S.P., Egorshev V.Yu. et al. // Thermochimica Acta. 2017. V. 651. P. 83.
Sheremetev A.B., Palysaeva N.V., Struchkova M.I., Suponitsky K.Yu., Antipin M.Yu. // Eur. J. Org. Chem. 2012. V. 12. P. 2266.
Palysaeva N.V., Kupman K.P., Struchkova M.I., Dalinger I.L., Kormanov A.V., Aleksandrova N.S., Chernyshev V.M., Pyreu D.F., Suponitsky K.Yu., Sheremetev A.B. // Org. Lett. 2014. V. 16. P. 406.
Иноземцев Я.О., Воробьев А.Б., Иноземцев А.В., Матюшин Ю.Н. // Горение и взрыв / Под ред. Фролова С.М. Т. 7. М.: Торус Пресс, 2014. С. 260.
Конькова Т.С., Мирошниченко Е.А., Матюшин Ю.Н. и др. // Горение и взрыв / Под ред. Фролова С.М. Т. 8(2). М.: Торус Пресс, 2015. С. 174.
CODATA key values for thermodynamics: Final Rep. of the CODATA Task group on key values for thermodynamics / Eds. Cox J.D., Wagman D.D., Medvedev V.A. New York, Washington, London: Hemisphere, 1989.
Матюшин Ю.Н., Пепекин В.И., Голова С.И., Годовикова Т.И., Хмельницкий Л.И. // Изв. АН СССР. Сер. хим. 1971. Т. 1. С. 181.
Pedley J.B. Thermochemical data and structures of organic compounds. V. 1. Texas, USA: Thermodynamic Research Center. College Station, 1994.
Мирошниченко Е.А., Конькова Т.С., Матюшин Ю.Н., Берлин А.А. // Докл. АН. 2014. Т. 456. № 6. С. 673.
Matyushin Y.N., Kon’kova T.S., Miroshnichenko E.A., Vorob’ev A.B., Inozemtsev J.O. // Nonequilibrium Processes in Plasma, Combustion and Atmosphere. M.: Torus Press, 2012. P. 262.
Matyushin Y.N., Kon’kova T.S., Miroshnichenko E.A., Vorob’ev A.B. et al. // Proc. 45th Intern. Annual Conf. of ICT. Karlsruhe, Germany, 2014. P. 59.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика