Химическая физика, 2020, T. 39, № 1, стр. 52-56
Влияние заряда аниона на биологическую активность гетерополикислот Кеггина
О. А. Лопатина 2, И. А. Суетина 2, М. В. Мезенцева 2, Л. И. Руссу 2, С. А. Ковалевский 1, Е. М. Балашов 1, С. А. Уласевич 3, А. И. Кулак 3, Д. А. Кулемин 3, Н. М. Ивашкевич 3, Ф. И. Далидчик 1, *
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 “Национальный исследовательский центр эпидемиологии и микробиологии
имени почетного академика Н.Ф. Гамалеи”, Министерство здравоохранения РФ
Москва, Россия
3 Институт общей и неорганической химии Национальной академии наук Беларуси
Минск, Республика Беларусь
* E-mail: domfdal@mail.ru
Поступила в редакцию 30.01.2019
После доработки 12.02.2019
Принята к публикации 20.02.2019
Аннотация
Методами МТТ и полимеразной цепной реакции изучены ингибирующая и иммуномодулирующая активности фосфорных и кремниевых гетерополикислот с анионами Кеггина ([ХМ(1)12 –nМ(2)nО40]–m, где X = P, Si; M = Мо, W, V; m = 3, 4, 5) в отношении клеток фибробластов эмбриона человека. Продемонстрирована и интерпретирована корреляция ингибирующей активности гетерополикислот с зарядами их анионов.
ВВЕДЕНИЕ
Класс полиоксометаллатов (ПОМ), к которому относятся и гетерополикислоты (ГПК) с комплексообразующими атомами (P, Si, Al и др.) – неисчерпаемое множество наноразмерных структур, физические и химические свойства которых, в зависимости от состава и архитектуры, варьируются в широких пределах и допускают тонкую подборку [1, 2]. Давно известные как эффективные катализаторы, сегодня ПОМ активно изучаются как новые, возможно, наиболее перспективные наноматериалы ХХI-го века [3]. Область известных и планируемых применений ПОМ охватывает все направления нанотехнологий, включая нанобиологию и наномедицину.
Открытия в 70–90-х годах высокой антивирусной, противоопухолевой и антибактериальной активности ПОМ [4] стимулировали интенсивные исследования, нацеленные на создание новых лекарственных препаратов, дешевых и эффективных, необходимых для борьбы со многими заболеваниями нашего времени и прежде всего с раком и СПИДом. На разных уровнях (in vitro и in vivo) к началу “нулевых” годов уже было продемонстрировано общее важное свойство ПОМ – способность этих препаратов эффективно подавлять активность вирусов и разрушать патологические клетки. Одновременно стали ясны принципиальные недостатки ПОМ – высокая токсичность в отношении здоровых клеток и сложность в подборе ПОМ-соединения в каждом конкретном случае его применения как малотоксичного и, в то же время, эффективного лекарственного средства направленного терапевтического действия.
В последние десятилетия поиски малотоксичных, биологически активных ПОМ ориентируются в основном на многокомпонентные соединения, неорганические [5] или композитные, органо-неорганические [6]. Эти поиски подобны тем, что ранее велись для металлооксидов, свойства которых зависят от степени их совершенства, т.е. природы и количества различных точечных дефектов [7]. Известно, что все свойства ПОМ-соединений зависят от их молекулярных параметров и характеристик, таких как ионные размеры, форма, анионные заряды, редокс-потенциалы и др. Природа этих зависимостей, т.е. микроскопические механизмы физических и биохимических процессов, идущих при взаимодействиях ПОМ с клетками, нуждается в тщательном изучении. Цель настоящего сообщения – исследовать и объяснить возможный механизм влияния заряда анионов ПОМ на их биологические свойства на примере взаимодействия ГПК Кеггина с клетками фибробластов эмбриона человека (ФЭЧ).
МАТЕРИАЛЫ И МЕТОДЫ
В экспериментах, результаты которых приводятся ниже, были использованы стерильные водные сантимолярные растворы ГПК Кеггина (H3PW12O40, H3PMo12O40, H4SiW12O40, H4SiMo12O40) фирмы “Biochem”(Франция), а также их ванадий-замещенные аналоги (№ 1 – Н4PMo11VO40, № 2 – Н5PMo10V2O40, № 3 – Н4PMo11${\text{VO}}_{{40}}^{*},$ синтезированные в Институте общей и неорганической химии НАН Беларуси. Тестирование биологических свойств (цитотоксичности и иммуномодулирующей активности) осуществляли на перевиваемых линиях клеток фибробластов эмбриона человека (ФЭЧ), которые были получены из коллекции культур клеток “ФНИЦЭМ им. Н.Ф. Гамалеи” МЗ РФ. Во всех экспериментах клетки первоначально культивировали в течение 24 ч (37 °С, 5% CO2) в питательных средах Игла ДМЕМ (“Биолот”, Санкт-Петербург, Россия) с добавлением 10%-ной эмбриональной телячьей сыворотки (ЭТС) (Gibco/Life Technologies, США). Исследовали влияние химического состава ГПК на жизнеспособность клеток ФЭЧ (их пролиферацию и гибель) и клеточный иммунитет.
Для качественной оценки цитотоксичности и визуализации процесса гибели клеток использовали метод прижизненной окраски клеточных материалов бромистым этидием, EtBr. Молекулы этого интеркалирующего агента способны проникать лишь в клетки с поврежденной цитоплазматической мембраной. Проникая в объем, EtBr образует комплекс с ДНК, который флюоресцирует в красной области спектра, тем самым позволяя регистрировать погибшие клетки.
В экспериментах по изучению гибели клеток под действием ГПК использовали следующий протокол. В 6-луночную панель с покровным стеклом вносили культуральную среду (КС) с 10%-ной ЭТС, содержавшей ФЭЧ в концентрации 200 тыс. клеток/мл. Спустя 24 ч после начала инкубации(37 °С, 5% CO2) в лунки вносили водные растворы ГПК различных концентраций. Бромистый этидий, необходимый для оценки количества погибших клеток, вносили в лунки одновременно с ГПК в конечной концентрации 1 мкг/мл.
Для количественных оценок цитотоксичности ГПК применяли МТТ–тестирование [8]. Стандартный метод МТТ-теста основан на способности митохондриальных и цитоплазматических дегидрогеназ живых, метаболически активных клеток восстанавливать бесцветный водорастворимый МТТ-реагент до голубого формазана, кристаллизующегося внутри клеток. Кристаллы формазана переводят в раствор с помощью органического растворителя диметилсульфоксида (ДМСО) с последующей спектрофотометрией. Таким образом, восстановленный клетками МТТ-реагент является показателем жизнеспособности клеток в изучаемой культуре, что позволяет количественно оценить гибель клеток под воздействием тестируемой ГПК.
В наших экспериментах применяли следующий протокол. Зрелые клетки ФЭЧ переносили на 96-луночную панель фирмы “Costar” (США) в концентрации 200 тыс. клеток/мл в каждую лунку в объеме 100 мкл среды с 10%-ной ЭТС и помещали в СО2-инкубатор при 37 °С. Через 24 ч после посадки клеток в лунки вносили по 100 мкл раствора изучаемого препарата в заданных разведениях. Контролем служили интактные клетки, культивируемые параллельно с опытными. После инкубации клеток в КС с выбранной ГПК культуральную среду отсасывали из лунок, добавляли по 100 мкл среды с 20 мкл МТТ (3[4,5-диметилтиазол-2-ил]-2.5-дифенилтетразолия, “Sigma”) в исходной концентрации 5 мг/мл и инкубировали в течение 4 ч. Затем среду с МТТ удаляли и добавляли по 100 мкл ДМСО для растворения образовавшихся кристаллов формазана. Осадок клеток ресуспендировали в течение 5 мин пипетированием. Жизнеспособность клеток оценивали по интенсивности окраски раствора, измеряя оптическую плотность в каждой лунке при длине волны 545 нм фотометра Immunochem 2100 (США). Каждую концентрацию выполняли в трех повторах. Статистическую обработку результатов проводили с использованием программного обеспечения MS Excel, “Statistica 6.0”. Достоверность различия средних величин устанавливали с помощью t-критерия Стьюдента при уровне значимости р < 0.05.
Вместе с цитотоксичностью в работе изучали также иммунный отклик клеток на действие ГПК. В работе [9] было показано, что, стимулируя экспрессию генов цитокинов, ГПК могут влиять на клеточный иммунитет. Оценка этого влияния важна для поисков оптимальных вариантов применения ПОМ-препаратов для лечения инфекционных и неврологических заболеваний. Для решения вопроса о возможной роли анионных зарядов мы поставили новые эксперименты с применением ванадий-замещенных ГПК с повышенными значениями анионных зарядов. Методами обратной транскрипции и полимеразной цепной реакции (ОТ–ПЦР) с использованием для детекции результатов маркера J1758 фирмы “Promega” (США) в этих экспериментах наблюдали ПОМ-стимулированную экспрессию генов интерлейкинов, фактора некроза опухолей и интерферонов. Полученные результаты (в сравнении с известными для других ГПК [9]) приводятся в табл. 1 и 2.
Таблица 1.
Жизнеспособность клеток (% выживших клеток ФЭЧ после их инкубации с ГПК) в течение 1 ч (по данным МТТ-теста)
| ГПК | Жизнеспособность клеток, % | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 5000* | 2500* | 1250* | 625* | 312* | 156* | 78* | 39* | 19.5* | 9.8* | 4.9* | |
| Н4PMo11VO40 | 67 ± 1.0 | 74 ± 2.6 | 89 ± 3.5 | 97 ± 2.0 | 99 ± 1.1 | 95 ± 1.0 | 99 ± 1.5 | 98 ± 1.9 | 97 ± 1.0 | 96 ± 3.0 | 105 ± 1.3 |
| Н5PMo10V2O40 | 61 ± 0.9 | 80 ± 2.0 | 90 ± 1.4 | 95 ± 2.0 | 95 ± 2.0 | 99 ± 0.7 | 98 ± 1.0 | 101 ± 1.0 | 104 ± 3.0 | 105 ± 1.0 | 106 ± 1.0 |
| Н4PW11VO40 | 80 ± 4.0 | 88 ± 1.0 | 88 ± 2.0 | 89 ± 2.0 | 94 ± 3.0 | 90 ± 4.0 | 94 ± 3.0 | 93 ± 2.0 | 92 ± 3.0 | 106 ± 5.0 | 109 ± 1.0 |
| H4SiMo12O40 | 97 ± 1.0 | 100 ± 2.0 | 100 ± 3.0 | 99 ± 2.0 | 105 ± 3.0 | 103 ± 3.0 | 101 ± 3.0 | 97 ± 2.0 | 98 ± 2.0 | 100 ± 1.0 | 112 ± 2.0 |
* Концентрация ГПК, мкМ (здесь и в табл. 2).
Таблица 2.
Жизнеспособность клеток ФЭЧ по данным МТТ-теста (% выживших после инкубации в растворах ГПК в течение 48 ч)
| ГПК | Жизнеспособность клеток, % | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 5000 | 2500 | 1250 | 625 | 312 | 156 | 78 | 39 | 19.5 | 9.8 | 4.9 | |
| Н4PMo11VO40 | 0 | 0 | 33 ± 4 | 30 ± 1 | 29 ± 3 | 43 ± 1 | 62 ± 2 | 82 ± 3 | 90 ± 4 | 109 ± 4 | 120 ± 11 |
| Н5PMo10V2O40 | 0 | 0 | 21 ± 1 | 21 ± 1 | 20 ± 1 | 34 ± 1 | 57 ± 2 | 59 ± 4 | 88 ± 4 | 91 ± 8 | 104 ± 1 |
| Н4PW11VO40 | 0 | 34 ± 3 | 30 ± 2 | 40 ± 1 | 68 ± 1 | 72 ± 4 | 95 ± 5 | 95 ± 1 | 101 ± 1 | 110 ± 2 | 120 ± 4 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Оценивая всю совокупность результатов, приведенных на рис. 1 и в табл. 1–4, можно прийти к выводу о весьма сильной зависимости цитотоксичности ГПК от анионного заряда, m (см. табл. 1 и 2, которые наглядно демонстрируют, что с ростом m токсичность быстро увеличивается). Из данных табл. 3 и 4 следует вывод о слабой, в наших экспериментах не выявленной, зарядовой зависимости иммуномодулирующей активности тестировавшихся соединений (см. табл. 3 и 4). Иммуномодулирующие свойства ГПК, в отличие от их токсичности, оказываются зависящими от элементного состава этих соединений. К такому выводу можно прийти, сравнивая данные, приведенные в табл. 3 и 4.
Рис. 1.
Флюоресценция поврежденных клеток ФЭЧ после их инкубации с ГПК H4SiMo12O40: а – через 20 мин, б – через 40 мин, в – через 1 ч.
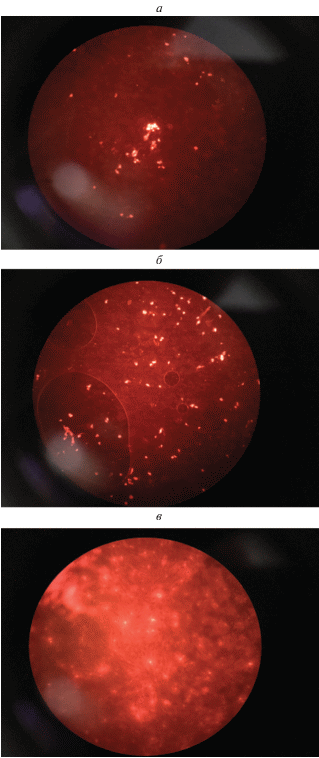
Таблица 3.
Экспрессия генов цитокинов в клетках ФЭЧ под действием ПОМ
| ПОМ | Наличие (+)/отсутствие(–) мРНК цитокинов в клетках ФЭЧ | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| ИФН-α | ИФН-β | ИФН-γ | ИФН-λ | ИЛ-1β | ИЛ-8 | ИЛ-10 | ИЛ-18 | ФНО-α | |
| H3PW12O40 | + | + | + | + | + | + | – | + | + |
| H4SiW12O40 | + | + | + | + | + | + | – | + | + |
| H4SiMo12O40 | + | + | + | + | + | + | – | + | + |
| H3PMo12O40 | + | + | + | + | + | + | – | + | + |
| Контроль клеток без ПОМ | – | – | – | – | – | – | + | – | – |
Таблица 4.
Обнаружение (+) или отсутствие (–) экспрессии генов цитокинов в клетках ФЭЧ под действием ванадий-содержащих ПОМ
| ПОМ | Наличие (+)/отсутствие (–) мРНК цитокинов в клетках ФЭЧ | |||||||
|---|---|---|---|---|---|---|---|---|
| ИФН-α | ИФН-β | ИФН-γ | ИФН-λ | ИЛ-1β | ИЛ-8 | ИЛ-6 | ИЛ-18 | |
| Н4PMo11VO40 | + | + | – | – | – | – | + | + |
| Н5PMo10V2O40 | + | + | – | – | – | – | + | + |
| Н5PMo10V2O40 | + | + | – | – | – | – | + | + |
| Н4PW11VO40 | + | + | – | – | – | – | + | + |
| Контроль клеток без ПОМ | + | + | – | – | – | – | + | + |
Оценивая цитотоксичность ГПК в целом, видно, что умеренно токсичная кремнемолибденовая кислота (m = 4) оказывает заметное воздействие на клетки. Из рис. 1в, видно, что уже спустя 2 ч после сокультивирования клеток ФЭЧ в питательном растворе, содержавшим H4SiMo12O40, в ансамбле клеток происходит лизис, свидетельствующий об их полной гибели. (Первые признаки токсического воздействия H4SiMo12O40 – единичные повреждения клеточных ДНК – становятся заметными спустя 10–20 мин после начала действия этой кислоты (см. рис. 1б)).
Обсудим теперь природу обнаруженной зарядовой зависимости цитотоксичности ГПК по отношению к клеткам ФЭЧ. Согласно современным представлениям воздействие ПОМ на живые клетки может быть связано с локальными нарушениями функциональных возможностей различных клеточных структур, которые оказываются в роли поражаемых биологических мишеней (в качестве примера см. рис. 13 из работы [10]).
Во многих случаях цитотоксичность препаратов, например, цисплатина [11], находит объяснение в предположении об образовании этими препаратами связанных с ДНК достаточно прочных комплексов. Последние сшивают звенья ДНК и затрудняют (или исключают) акты репликации, что неизбежно приводит к гибели клетки. Ясно, что с ростом заряда аниона прочность ДНК–ГПК комплексов и, соответственно, эффективность механизма “сшивки”, должны возрастать, что и наблюдается на опыте (см. табл. 1 и 2). Это также следует из результатов работы [12], в которой изучался механизм воздействия на раковые клетки ванадий-содержащих солей ГПК Кеггина. Среди последних максимально эффективными оказались соединения с наибольшими зарядами анионов.
ЗАКЛЮЧЕНИЕ
Отметим в заключение, что процесс взаимодействия многозарядного аниона с ДНК, возможно, основной, но не единственный этап в цепочке физико-химических, зарядово-зависимых процессов, которыми определяется цитотоксичность ПОМ. Можно указать, по крайней мере, еще два процесса, каждый из которых тем более вероятен, чем больше анионный заряд. Первый – прохождение анионом мембраны клетки, чья скорость зависит от заряда и повышается с его увеличением (см. работу [13]). Второй – этап перемещения высокозарядного аниона от места прохождения мембраны до ДНК, вероятность которого зависит от гидролитической стабильности аниона [14], которая зависит от валентности гетероатома, влияющей на анионный заряд.
Работа выполнена в рамках государственного задания по теме “Фундаментальные основы создания наноструктурированных систем нового поколения с уникальными эксплуатационными электрическими и магнитными свойствами” № 0082-2018-0003 (рег. номер АААА-А18-118012390045-2) и при финансовой поддержке Российским фондом фундаментальных исследований (грант № 18-54-00004 Бел_а) и Белорусским фондом фундаментальных исследований (договор № Х18Р-110).
Список литературы
Поп М.С. Гетерополи- и изополиметаллы. / Пер. с англ. Новосибирск: Наука, 1990.
Далидчик Ф.И., Балашов Е.М., Буданов Б.А. // Хим. физика. 2010. Т. 29. № 11. С. 21.
Pope M.T. Polyoxometalates / Encyclopedia of Inorganic & Bioinorganic Chemistry. 1st ed. Somerset, NJ, USA: John Wiley & Sons, 2011.
Hasenknopf B. // Front. Biosci. 2005. V. 10. P. 275.
Haapala D.K., Jasmin C., Sinoussi F. et al. // Biomedicine. 1973. V. 19. № 1. P. 7.
Dolbecq A., Dumas E., Mayer C.R. et al. // Chem. Rev. 2010. V. 98. P. 6009.
Далидчик Ф.И., Балашов Е.М., Шуб Б.Р. // Хим. физика. 2008. Т. 27. № 12. С. 10.
Подчерняева Р.Я., Суетина И.А., Михайлова Г.Р. и др. // Вопр. вирусологии. 2012. Т. 57(5). С. 46.
Лопатина О.А., Исаева Е.И., Суетина И.А. и др. // Наноматериалы и наноструктуры – XXI век. 2016. Т. 7. № 1. С. 36.
Bijelic A., Aureliano M., Rompel A. // Angew. Chem. Intern. Ed.; https://doi.org/10.1002/anie.201803868
Rosenberg B., Vancamp L., Krigas T. // Nature. 1965. V. 205(4972). P. 698.
Qi W., Zhang B., Qi Y. et al. // Molecules. 2017. V. 22. № 9. P. 1535; https://doi.org/10.3390/molecules22091535
Li-Tang Yan L.-T., Yu X. // ACS Nano. 2009. V. 3. № 8. P. 2171.
Ковалевский С.А., Лопатина О.А., Далидчик Ф.И. и др. // Рос. нанотехнол. 2018. Т. 13. № 7–8. С. 51.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


