Химическая физика, 2020, T. 39, № 1, стр. 7-18
Состав и структура гидратов, образующихся в водных растворах диметилацетамида
В. Д. Майоров 1, *, Г. И. Волошенко 1, И. С. Кислина 1, Е. Г. Тараканова 2, **
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
Москва, Россия
* E-mail: proton@chph.ras.ru
** E-mail: egtar@igic.ras.ru
Поступила в редакцию 04.02.2019
После доработки 04.02.2019
Принята к публикации 20.06.2019
Аннотация
Методами ИК-спектроскопии и квантовой химии исследованы особенности гидратации и определены концентрационно-структурные зоны в водных растворах диметилацетамида. Путем анализа концентрационных зависимостей ИК-поглощения этих растворов на разных частотах показано, что в них последовательно образуются гетероассоциаты со стехиометрическими соотношениями компонентов, равными 2 : 1, 1 : 1, 1 : 2 и 1 : 4. На основании результатов расчета методом теории функционала плотности девятнадцати гидратов установлены состав, строение, энергии образования и относительные прочности гетероассоциатов, реализующихся в растворах. Показано, что стабильность гидратов диметилацетамида тем больше, чем выше в них относительное содержание молекул воды.
ВВЕДЕНИЕ
Исследование структуры водных растворов диметилацетамида (ДМАА), состава, строения и условий образования в них гидратных комплексов имеет фундаментальное и практическое значение для многих областей химии, химической технологии, биологии и медицины [1–8]. Для этой цели были использованы различные экспериментальные методы, в том числе: калориметрия [9], диэлектрическая релаксация [10], определение избыточного объема [11–14], ЯМР- и колебательная спектроскопия [15–18], ультраакустические исследования [12, 14, 19], а также методы квантовой химии [16, 20, 21].
Согласно имеющимся данным в водных растворах ДМАА в зависимости от соотношения компонентов могут образовываться гидраты различного состава, наиболее стабильными из которых принято считать гетероассоциаты (ГА) ДМАА ∙ 2H2O [9, 15, 20]. Однако основное внимание в большинстве работ уделялось изучению зависимости макроструктуры растворов от концентрации компонентов. Так, например, в работе [22] предполагается существование в системе ДМАА–H2O трех концентрационных зон: с преимущественным сохранением структурной сетки чистой воды (0–40 мольн.% ДМАА), структурной сетки чистого ДМАА (60–100 мольн.% ДМАА) и промежуточной зоны, в которой сосуществуют структурные сетки чистой воды и чистого ДМАА.
Большинство использованных методов регистрируют макроскопические параметры системы ДМАА–H2O, что не позволяет судить о микроструктуре растворов – составе и строении образующихся в них гидратных комплексов. Детальная информация о межкомпонентном взаимодействии в растворах может быть получена при совместном использовании метода колебательной спектроскопии в широком диапазоне частот и составов растворов и квантово-химических расчетов (см., например, [23–29]). Такой подход реализован и в настоящей работе. Имеющиеся в литературе данные по ИК-спектрам водных растворов ДМАА относятся к ограниченной области частот и концентраций компонентов.
Строение обнаруженных нами в системе ДМАА–H2O гетероассоциатов определяли из данных о закономерностях комплексообразования, общих для изученных ранее водных [23–25] и неводных [26–29] растворов. Эти закономерности сводятся к следующему: все, обнаруженные методом колебательной спектроскопии, устойчивые (время жизни ≥10–12 с) молекулярные ГА в растворе имеют циклическое или полициклическое (в том числе объемное) строение; каждый из них является наиболее стабильным в ряду изомеров, содержит ненапряженные водородные связи и имеет наибольшую плотность “упаковки” молекул среди ГА с близким числом молекул в сольватной оболочке; при изменении концентрации растворителя структура следующего, образующегося в растворе комплекса, вытекает из структуры предыдущего; в некоторых интервалах концентраций в растворе одновременно присутствуют два-три ГА.
Цель настоящей работы – установление зависимости молекулярного строения и относительной стабильности гидратных комплексов, образующихся в водных растворах диметилацетамида, от их состава и выделение отдельных концентрационно-структурных зон в системе ДМАА–H2O. В основу исследования положены: а) измерение ИК-спектров растворов ДМАА–H2O; б) определение из концентрационных зависимостей ИК-поглощения на разных частотах стехиометрического состава и областей существования различных ГА; в) расчет методом теории функционала плотности структуры энергетических параметров и ИК-спектров стабильных гидратов молекул ДМАА; г) сопоставление и анализ результатов расчета и эксперимента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали образцы ДМАА марки “ХЧ” (“Экос”, Россия) с последующей перегонкой под вакуумом (содержание воды в очищенном ДМАА составляло 0.02%). Рабочие растворы с различным содержанием ДМАА и H2O готовили весовым разбавлением. Для вычисления мольных концентраций компонентов использовали плотности растворов. ИК-спектры получали при температуре 30 °С методом многократного нарушенного полного внутреннего отражения (МНПВО) [30] на приставке с призмой из Ge, которая обеспечивала угол падения излучения 30° и число отражений, равное 4 или 8, при заполнении раствором одной или двух полостей, примыкающих к кристаллу Ge. Эффективная толщина поглощающего слоя на частоте 2000 см–1 составляла 1.66 и 3.33 мкм соответственно. Спектры регистрировали в диапазоне частот от 900 до 4000 см–1. Оптические плотности полос (D) измеряли с использованием базовых линий. Точность определения D составляла 5−7%.
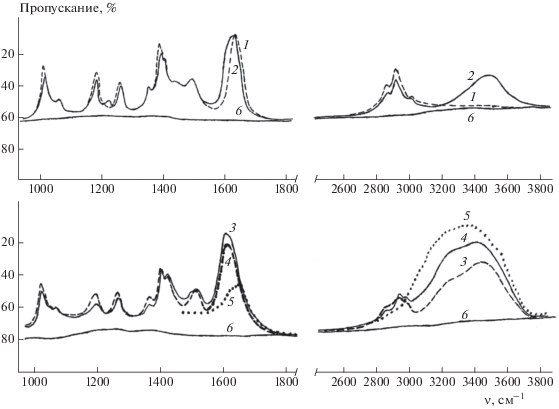
В ИК-спектре исходного ДМАА в изученном диапазоне частот присутствует ряд полос различной интенсивности, отнесение которых было дано по результатам выполненных в настоящей работе квантовохимических расчетов: 1013(α(NСН)s-α(CCH)), 1038(α(HСН))(C), 1062 (α(NСН)as), 1172 (α(HСН)s)(N), 1187 (α(NСН)s + α(CCH)), 1265 (ν(NC)as), 1356 (α(HСН)s)(C), 1392 (α(HCH)s sph)(N), 1409(α(HCH)s aph)(N), 1443 (α(HCH)s sph)(N) + + α(HСН)(C)), 1493 (α(HСН)(C)), 1500 (ν(NC(O)), 1515 (α(HCH)sph)(N), 1640 (ν(СO)), 2860 (ν(CH)s aph)(N), 2928 (ν(CH)s sph)(N) и 3020 (ν(CH)as sph)(N). По мере разбавления ДМАА водой происходит смещение большинства полос поглощения молекул ДМАА в сторону высоких частот на 8–12 см–1, полоса при 1409 см–1 расщепляется на две полосы: при 1397 и 1414 см–1. Полоса ν(СO) при 1640 см–1 смещается в сторону низких частот на 33 см–1 (до 1607 см–1). В спектрах появляются широкие полосы валентных колебаний молекул воды в диапазоне 3000–3600 см–1 (рис. 1).
Рис. 1.
ИК-спектры водных растворов диметилацетамида: 1 – ДМАА, 2 – ДМАА : Н2О = 2 : 1, 3 – ДМАА : Н2О = 1 : 2, 4 – ДМАА : Н2О = 1 : 4, 5 – Н2О, 6 – пустая кювета.
Для получения зависимостей оптических плотностей полос ДМАА и Н2О от состава растворов были измерены величины D всех интенсивных полос ДМАА, а также поглощение воды на частотах 3350 и 3540 см–1. Наиболее показательные из рассмотренных концентрационных зависимостей представлены на рис. 2–4.
Рис. 2.
Зависимости оптических плотностей Dν от концентрации ДМАА для следующих частот, см–1: а – 1013 (1) и 1392 (2); б – 1187 (1) и 2928 (2).
РАСЧЕТНАЯ ЧАСТЬ
Оптимальные структуры, полные энергии, и ИК-спектры всех изученных молекулярных комплексов рассчитывали по программе GAUSSIAN-09 [31] методом теории функционала плотности с трехпараметрическим функционалом B3LYP в базисе 6-31++G(d,p). Из анализа стационарных точек на поверхностях потенциальной энергии (ППЭ) всех комплексов (за исключением двух) следует, что они являются минимумами. В случае самых крупных ГА – 4ДМАА ∙ 4H2O и 4ДМАА ∙ 8H2O – не удалось рассчитать частоты нормальных колебаний, однако можно предположить, что полученные в результате оптимизации структурно-энергетические параметры этих комплексов также соответствуют минимумам на ППЭ.
При определении строения присутствующих в системе ДМАА–H2O ГА в соответствии с результатами работ [23–29] рассчитывали преимущественно циклические и полициклические изомеры mДМАА ∙ nH2O. Их составы – 2 : 1, 1 : 1, 2 : 2, 4 : 4, 1 : 2, 2 : 4, 4 : 8, 1 : 4 и 2 : 8 – отвечали стехиометрическим соотношениям молекул в ГА, обнаруженных путем анализа концентрационных изменений ИК спектров исследованных растворов (рис. 2–4). В итоге были рассчитаны девятнадцать молекулярных комплексов, энергии образования, параметры водородных связей и краткое описание строения которых приведены в табл. 1. Значения энергии EH, позволяющие оценить относительную устойчивость ГА разных составов, получали путем деления энергии образования гидратного комплекса на число содержащихся в нем H-связей. На рис. 5 приведены структуры гидратов ДМАА, представляющих наибольший интерес для настоящего исследования.
Таблица 1.
Строение и энергии образования (ΔE) гидратов ДМАА, средние прочности их водородных связей (EH) и расстояния между молекулами ДМАА и воды в комплексе (r(O⋅⋅⋅H(OH)), r(N⋅⋅⋅H(OH))
| Гидрат ДМАА | Строение | ΔE, ккал/моль | EH, ккал/моль | r(O⋅⋅⋅H(OH)), Å [r(N⋅⋅⋅H(OH))], Å |
|---|---|---|---|---|
| 2ДМАА ∙ H2O* | бициклический, молекула H2O наряду с двумя связями H⋅⋅⋅O(=C) образует связи (H2)O⋅⋅⋅H(CH2) с двумя ацетатными группами CH3 (рис. 5а) | 13.00 | 3.25 | 1.930 1.931 |
| 2ДМАА ∙ H2O* | бициклический, молекула H2O наряду с двумя связями H⋅⋅⋅O(=C) образует связи (H2)O⋅⋅⋅H(CH2) с ацетатной и амидной группами CH3 | 12.31 | 3.08 | 1.925 1.950 |
| 2ДМАА ∙ H2O | бициклический, молекула H2O наряду с двумя связями H⋅⋅⋅O(=C) образует связи (H2)O⋅⋅⋅H(CH2) с двумя амидными группами CH3 | 11.61 | 2.90 | 1.944 1.944 |
| 4ДМАА ∙ 4H2O* | четыре ГА ДМАА ∙ H2O*, молекулы воды которых объединены в оптимальный
(с учетом кооперативных эффектов) цикл (рис. 5г) |
58.22 | 4.85 | 1.890, 1.890 1.891, 1.893 |
| ДМАА ∙ H2O* | циклический, со связями (C=)O⋅⋅⋅H(OH) и (H2)O⋅⋅⋅H(CH2) (рис. 5б) | 7.90 | 3.95 | 1.837 |
| 2ДМАА ∙ 2H2O* | трициклический, два ГА ДМАА ∙ H2O* образуют цикл с чередующимися молекулами ДМАА и H2O (рис. 5в) | 22. 38 | 3.73 | 1.943, 1.947 1.972, 1.996 |
| 2ДМАА ∙ 2H2O* | трициклический, два ГА ДМАА ∙ H2O* образуют цикл с расположенными попарно молекулами ДМАА и H2O | 21.60 | 3.60 | 1.775 2.049 |
| ДМАА ∙ H2O | циклический, со связями (C=)O⋅⋅⋅H(OH) и (H2)O⋅⋅⋅H(CH2) | 7.16 | 3.58 | 1.859 |
| ДМАА ∙ H2O** | линейный, со связью N⋅⋅⋅H(OH) | 3.41 | 3.41 | [2.115] |
| 2ДМАА ∙ 4H2O* | трициклический, молекулы воды двух ГА ДМАА ∙ 2H2O* объединены в оптимальный (с учетом кооперативных эффектов) цикл (рис. 5ж) | 46.51 | 5.81 | 1.841 1.902 |
| ДМАА ∙ 2H2O* | циклический, димер воды образует связи (HO)H⋅⋅⋅O(=С) и (H2)O⋅⋅⋅H(CH2) (рис. 5е) | 17.19 | 5.73 | 1.758 |
| 4ДМАА ∙ 8H2O* | к четырем вертикальным ребрам “кубика” из молекул воды присоединены четыре молекулы ДМАА | 112.19 | 5.61 | 1.848, 1.849, 1.848, 1.849 |
| 2ДМАА ∙ 4H2O* | трициклический, молекулы воды двух ГА ДМАА ∙ 2H2O* объединены в неоптимальный цикл | 41.62 | 5.20 | 1.678 1.965 |
| ДМАА ∙ 2H2O* | бициклический, молекула ДМАА образует связи (C=)O⋅⋅⋅H(OH) с двумя молекулами воды (рис. 5д) | 14.04 | 3.51 | 1.859 1.882 |
| ДМАА ∙ 2H2O** | циклический, димер воды образует H-связи с атомами O и N молекулы ДМАА | 9.68 | 3.23 | 2.217 [2.220] |
| 2ДМАА ∙ 8H2O* | к двум соседним ребрам “кубика” из молекул воды присоединены две молекулы ДМАА (рис. 5и) | 97.75 | 6.11 | 1.813 1.813 |
| ДМАА ∙ 4H2O | бициклический, цикл ДМАА ∙ 2H2O* образует связи (HO)H⋅⋅⋅O(H2) и (H2)O⋅⋅⋅H(OH) с димером воды (рис. 5з) | 36.33 | 6.06 | 1.687 |
| ДМАА ∙ 4H2O*** | бициклический, молекула ДМАА образует две связи (C=)O⋅⋅⋅H с цепочкой из четырех молекул воды | 34.85 | 5.81 | 1.765 2.008 |
| ДМАА ∙ 4H2O** | бициклический, молекула ДМАА образует связи (C=)O⋅⋅⋅H(OH) и N⋅⋅⋅H(OH) со связанными между собой четырьмя молекулами воды | 29.52 | 4.75 | 2.040 [2.167] |
* Во взаимодействии с молекулой воды участвует ацетатная группа CH3. ** Гетероассоциат содержит водородную связь N⋅⋅⋅H. *** Атом кислорода молекулы ДМАА дважды выступает в роли акцептора протона. Примечание: в квадратных скобках приведены расстояния r(N⋅⋅⋅H(OH)) между молекулами ДМАА и молекулами воды.
Рис. 5.
Строение гидратов 2ДМАА ∙ H2O (а), ДМАА ∙ H2O (б), 2ДМАА ∙ 2H2O (в), 4ДМАА ∙ 4H2O (г), ДМАА ∙ 2H2O бициклический (д), ДМАА ∙ 2H2O циклический (е), 2ДМАА ∙ 4H2O (ж), ДМАА ∙ 4H2O (з), 2ДМАА ∙ 8H2O (и).

Для того чтобы охарактеризовать точность воспроизведения в расчете экспериментальных ИК-спектров (в области 1013–3020 см–1), вычисленные частоты колебаний молекулы ДМАА сравнили с частотами максимумов его полос поглощения в экспериментальном спектре (табл. 2). При этом использовали два независимых параметра – среднее относительное отклонение рассчитанных частот от измеренных (α, %) и взаимное расположение полос в спектре (σ, %). Значения σ находили, приняв величину частотного интервала Δ, содержащего анализируемые полосы колебаний, за 100%, выразив в процентах расстояния (νj – νi) между всеми соседними парами полос и вычислив среднее отклонение полученных в расчете значений (νj – νi)/Δ от экспериментальных. В итоге было получено хорошее согласие расчета с экспериментом: α = 1.88%, σ = 1.19%, что позволяет считать надежным отнесение полос поглощения молекул ДМАА, приведенное в табл. 2.
Таблица 2.
Частоты полос поглощения ДМАА и его гидратов различного состава
| Форма колебания | ν, см–1 | |||||
|---|---|---|---|---|---|---|
| молекула ДМАА | ДМАА | 2 : 1 | 1 : 1 | 1 : 2 | 1 : 4 | |
| ${\alpha }_{{{\text{NCH}}}}^{s}$-αCCH | 1023 | 1013 c. | 1016 | 1018 | 1020 | 1022 |
| αHCH (C) | 1048 | 1038 сл. | 1038 | 1038 | 1040 оч. сл. | 1042 оч. сл. |
| ${\alpha }_{{{\text{NCH}}}}^{{as}}$ | 1079 | 1062 сл. | 1062 сл. | 1062 сл. | 1062 сл. | 1062 сл. |
| ${\alpha }_{{{\text{NCH}}}}^{s}$ + αCCH | 1198 | 1187 | 1188 | 1189 | 1192 | 1192 |
| ${\alpha }_{{{\text{HCH}}}}^{s}$ (N) | 1173 | 1172 | 1174 | 1177 оч. сл. | ||
| ${\nu }_{{{\text{NC}}}}^{{as}}$ | 1281 | 1265 | 1264 | 1264 | 1263 | 1262 |
| ${\alpha }_{{{\text{HCH}}}}^{s}$ (C) | 1390 | 1356 | 1357 | 1360 | 1361 | 1364 |
| ${\alpha }_{{{\text{HCH}}}}^{{s\,sph}}$ (N) | 1430 | 1392 | 1392 | 1390 | 1390 оч. сл. | – |
| ${\alpha }_{{{\text{HCH}}}}^{{s\,aph}}$ (N) | 1439 | 1409 | 1397 1414 |
1398 1415 |
1400 1420 |
1401 1420 |
| ${\alpha }_{{{\text{HCH}}}}^{{sph}}$ (N) + αHCH (C) | 1467 | 1443 сл. | 1443 | 1443 | 1443 оч. сл. | – |
| αHCH (C) | 1488 | 1493 | 1494 | 1494 | – | – |
| νNC(O) | 1545 | 1500 | 1502 | 1503 | 1500 | 1500 |
| νC=O | 1724 | 1640 | 1607 1627 |
1607 1627 |
1606 1614 |
1607 1628 |
| ${\nu }_{{{\text{CH}}}}^{{s{\text{ }}aph}}$ (N) | 3012 | 2860 | 2860 | 2855 | 2856 | 2856 |
| ${\nu }_{{{\text{CH}}}}^{{s{\text{ }}sph}}$ (N) | 3021 | 2928 | 2930 | 2932 | 2930 | 2928 |
| ${\nu }_{{{\text{CH}}}}^{s}$ (C) | 3048 | 2960 | 2968 | 2960 | 2955 | 2958 |
| ${\nu }_{{{\text{CH}}}}^{{as{\text{ }}sph}}$ (N) | 3055 | 3020 | 3020 | 3020 | 3020 оч. сл. | 3027 оч. сл. |
Примечания: в столбцах 1 и 2 приведены результаты расчета, а в столбцах 3–7 – данные, полученные из ИК-спектров растворов; жирным шрифтом выделены наиболее интенсивные полосы. Обозначения (C) и (N), принятые при записи форм колебаний, указывают на то, что колебание совершают атомы ацетатной и амидных метильных групп соответственно; ν – валентное колебание, α – деформационное колебание, s и as – симметричное и антисимметричное колебания, sph и aph – синфазное и антифазное колебания одинаковых естественных координат в двух амидных метильных группах; “с.” – сильная, “сл.” – слабая, “оч. сл. “– очень слабая – характеристика интенсивности полос в экспериментальном ИК-спектре.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ ИК-спектров водных растворов диметилацетамида
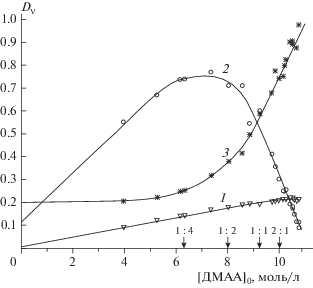
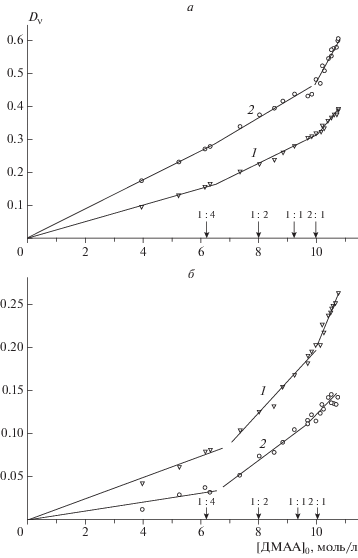
Определение стехиометрического состава, строения и областей существования исследуемых гидратных комплексов проводили путем детального анализа концентрационных зависимостей оптических плотностей полос в ИК-спектрах водных растворов ДМАА (рис. 2–4). Из полученных данных следует, что в разных диапазонах концентраций компонентов образуются гидраты молекул ДМАА различного состава. Так, графики зависимостей оптических плотностей полос для частот 1013 и 1187 см–1 от концентрации ДМАА имеют два явных излома вблизи значений [ДМАА]0 = 10 моль/л и [ДМАА]0 = 6.3 моль/л. Этим концентрациям соответствуют мольные соотношения компонентов ДМАА : Н2О, равные 2 : 1 и 1 : 4. На других зависимостях (рис. 2) наблюдается только один явный излом: при соотношении компонентов 2 : 1 для значения D1392 и соотношении 1 : 4 для значения D2928. Столь хорошее соответствие результатов, полученных для четырех различных колебаний, позволяет заключить, что в водных растворах ДМАА образуются гидраты указанных стехиометрических составов.
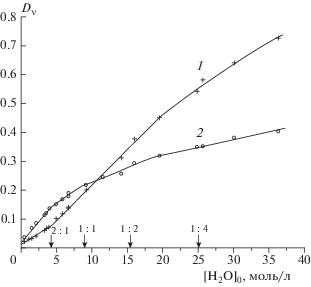
Отметим, что в спектрах исследованных растворов в диапазоне концентраций от 100%-ного содержания ДМАА до соотношения ДМАА : Н2О, равного 2 : 1, в области валентных колебаний ν(OH) молекул Н2О наблюдается одна широкая полоса с максимумом вблизи частоты 3500 см–1. Оптические плотности этой полосы, измеренные вблизи ее максимума (3540 см–1) и на низкочастотном крыле (3350 см–1)1)1), изменяются пропорционально концентрациям добавленной воды до значения [Н2О]0 = 4 моль/л. При дальнейшем разбавлении водой рост величины оптической плотности D3540 замедляется, а D3350 – ускоряется (рис. 3). Эти данные свидетельствуют о том, что при разбавлении ДМАА вплоть до значения [Н2О]0 = 4 моль/л вся вода входит в ГА состава 2 : 1. В таких гидратах оба атома водорода молекулы Н2О участвуют в образовании Н-связей с атомами кислорода карбонильных групп двух молекул ДМАА, поэтому максимум полосы ν(OH) таких молекул воды заметно смещен в область высоких частот. Нарушение линейности и дальнейший ход зависимостей на рис. 3 говорят о том, что при концентрациях [Н2О]0 > 4 моль/л в растворах кроме ГА состава 2 : 1 присутствуют также гидраты других стехиометрических составов (1 : 1, 1 : 2 либо 1 : 4). В таких гидратах только один атом водорода молекулы воды участвует в образовании сильной Н-связи с группой С=О молекулы ДМАА.
При образовании комплекса 2 : 1 оптические плотности большинства полос ДМАА существенно уменьшаются. Самые сильные изменения наблюдаются для полосы ν(С=O), а уменьшение величины D1500 (ν(NC(O))), напротив, совсем незначительно (рис. 4). Эти факты свидетельствуют о координации группы ОН молекулы воды по атому кислорода карбонильной группы ДМАА.
В разбавленных растворах при более чем четырехкратном избытке воды значения оптической плотности Dν всех полос ДМАА возрастают пропорционально увеличению концентрации ДМАА. В более концентрированных растворах такая зависимость для большинства полос ДМАА нарушается (см. рис. 2 и 4). Из этого следует, что в разбавленных растворах ДМАА образуются ГА одного состава – со стехиометрическим соотношением компонентов 1 : 4.
Анализ данных, приведенных на рис. 2–4, показал, что наиболее чувствительными к изменению состояния молекул воды, входящих в состав гидратов, являются колебания ν(ОH) и ν(С=O). Вблизи соотношения компонентов ДМАА : Н2О = 1 : 2 наблюдается излом на зависимости 2, изображенной на рис. 3, и практически достигает максимума оптическая плотность D1607 (см. рис. 4). Оба эти факта говорят о присутствии в системе ДМАА–H2O гидратных комплексов стехиометрического состава 1 : 2. Отметим, что на основании исследования водных растворов ДМАА различными методами в ряде работ ранее был сделан вывод об образовании дигидратов ДМАА ∙ 2H2O [9, 13, 15, 20].
В системе ДМАА–Н2О присутствуют также гидраты со стехиометрическим соотношением компонентов, равным 1 : 1. На это указывает наличие излома на зависимости 2 (см. рис. 3) вблизи соотношения концентраций [ДМАА] : [Н2О], равного 1 : 1, а также тот факт, что для большинства частот коэффициенты поглощения ГА 2ДМАА ∙ Н2О, ДМАА ∙ Н2О, ДМАА ∙ 2Н2О и ДМАА ∙ 4Н2О заметно различаются между собой (табл. 3). При расчете этих коэффициентов использовали значения оптической плотности Dν в спектрах растворов с фиксированным соотношением компонентов: 2 : 1, 1 : 1, 1 : 2 и 1 : 4. Для полос ДМАА вычисление проводили в расчете на одну молекулу ДМАА, входящую в состав гидрата, а для полос воды – на одну молекулу воды, входящую в состав ГА.
Таблица 3.
Коэффициенты поглощения ДМАА и его гидратов в ИК-спектрах растворов
| ν, см–1 (в ДМАА) |
ε l, л/моль ∙ 103 | |||||
|---|---|---|---|---|---|---|
| ДМАА | 2 : 1 | 1 : 1 | 1 : 2 | 1 : 4 | Н2О* | |
| 1013 | 36.46 | 31.79 | 30.55 | 28.05 | 23.80 | – |
| 1187 | 24.28 | 19.62 | 18.20 | 15.84 | 12.31 | – |
| 1265 | 16.74 | 16.30 | 15.17 | 14.84 | 13.60 | – |
| 1392 | 56.30 | 45.33 | 45.33 | 45.33 | 45.33 | – |
| 1500 | 20.3 | 21.4 | 22.0 | 22.4 | 22.4 | – |
| 1607 | 8.84 | 31.6 | 61.8 | 91.0 | 118 | 1.8 |
| 1640 | 91.2 | 75.4 | 63.9 | 47.4 | 40.0 | 3.65 |
| 1660 | 52.1 | 30.2 | 22.8 | 17.5 | 10.8 | 3.34 |
| 2928 | 13.02 | 12.02 | 10.94 | 8.73 | 4.92 | – |
| 3200 | – | 10.0 | 10.3 | 12.2 | 13.6 | 13.3 |
| 3350 | – | 18.0 | 21.3 | 22.0 | 22.4 | 18.0 |
| 3500 | – | 36.0 | 29.2 | 23.8 | 18.6 | 11.7 |
| 3540 | – | 34.0 | 23.0 | 18.0 | 13.6 | 9.2 |
Отметим, что для всех приведенных в табл. 3 частот ДМАА наблюдается изменение коэффициентов поглощения ГА состава 2 : 1 по сравнению с чистым ДМАА. Меньше всего изменяются коэффициенты поглощения для частот валентных колебаний связей CN (1265, 1500 см–1) и метильных групп, связанных с атомом азота (2928 см–1), а наиболее сильно – коэффициенты для ν(С=O) и частот, включающих колебания ацетатных групп СН3 (см. отнесение частот ДМАА в табл. 2). Изменения коэффициентов поглощения при переходе от ДМАА к смеси состава 2 : 1 обусловлены существенным изменением структуры раствора. В жидком ДМАА самоассоциация отсутствует из-за особенностей строения молекул дизамещенных амидов, между которыми не могут образовываться прочные Н-связи [9, 10].
В растворе с соотношением компонентов 2 : 1 молекулы ДМАА входят, в основном, в состав гетеротримеров 2ДМАА ∙ Н2О (см. рис. 3), содержащих водородные связи средней прочности (см. табл. 1). При этом координация молекулы воды по карбонильному атому кислорода приводит к заметному изменению коэффициентов поглощения для большинства частот молекул ДМАА.
Сравним коэффициенты поглощения гидратов различных стехиометрических составов, которые могут образовываться в водных растворах ДМАА. В ряду ГА с соотношением компонентов от 2 : 1 до 1 : 4 коэффициенты поглощения большинства колебаний, связанных с атомом азота, в том числе ν(СN), изменяются слабо. При этом наблюдается резкое изменение коэффициентов в области колебаний ν(С=O) и менее значительное – коэффициентов колебаний, связанных с ацетатной группой СН3. Колебания ν(С=O) в молекулах ДМАА и его гидратах проявляются в виде отдельных полос при 1640 и 1607 см–1 (см. рис. 1 и 4, а также работы [18, 20]), что однозначно свидетельствует об участии групп С=O в образовании гидратных комплексов. Изменение коэффициентов колебаний, связанных с ацетатной группой СН3, говорит о формировании циклических структур, в которых реализуются слабые водородные связи между атомами кислорода молекул Н2О и атомами водорода ацетатных групп СН3 (аналогичный вывод был сделан в работе [16]). Таким образом, изучение ИК-спектров водных растворов ДМАА показало, что в зависимости от доли компонентов, в них присутствуют гидратные комплексы со стехиометрическими соотношениями ДМАА : Н2О, равными 2 : 1, 1 : 1, 1 : 2, 1 : 4.
Определение состава, строения и относительной стабильности различных гидратов диметилацетамида
Для определения строения комплексов, обнаруженных методом ИК-спектроскопии, проанализируем результаты квантовохимических расчетов, представленные в табл. 1. Отметим, что молекула ДМАА содержит два оснóвных центра – атомы O и N. Согласно расчету сродство к протону карбонильного атома кислорода (221.71 ккал/моль) на 10.5 ккал/моль больше чем у атома азота. Все наиболее устойчивые в рядах изомеров гидраты не содержат связей N⋅⋅⋅H. Например, ГА составов 1 : 1, 1 : 2 и 1 : 4, в которых акцептором протона является атом азота, обладают значительно меньшей устойчивостью (на 57, 44 и 19% соответственно), чем самые прочные изомеры тех же составов.
Еще одна особенность взаимодействия молекул ДМАА и H2O состоит в том, что в нем принимают участие атомы H метильных групп. Этот вывод следует из проявлений такого взаимодействия в ИК-спектрах растворов ДМАА–H2O (см. выше) и из анализа оптимальных структур всех изученных ГА. Межмолекулярные связи O⋅⋅⋅H(CH2) являются слабыми водородными, а содержащие их фрагменты комплексов – циклическими.
Расчет показал (табл. 1), что среди гидратов ДМАА одинаковых составов более устойчивы те, в которых молекулы воды образуют связи (H2)O⋅⋅⋅H(CH2) с ацетатными, а не с амидными группами CH3, что согласуется с экспериментом. Из трех ГА состава 2 : 1 наименее прочный содержит две “амидные” H-связи, а самый стабильный – две “ацетатные” (рис. 5а). Циклический изомер ДМАА ∙ H2O, сформированный с участием ацетатной метильной группы (рис. 5б), прочнее изомера, в котором задействована амидная группа CH3. Наиболее устойчивый из ГА ДМАА ∙ 2H2O (рис. 5е) имеет “ацетатную” связь (Н2)O⋅⋅⋅H(CH2).
Охарактеризуем строение долгоживущих гидратов, присутствующих в системе ДМАА–H2O. Для этого найдем среди ГА со стехиометрическим составом, характерным для каждой из концентрационно-структурных зон, комплекс, обладающий наибольшей относительной стабильностью. В растворах с избытком ДМАА этому условию отвечает гетеротример 2ДМАА ∙ H2O, изображенный на рис. 5а.
В большинстве двойных жидких систем с известными структурами ГА в эквимолярном растворе образуются не комплексы состава 1 : 1, а циклические гетеротетрамеры с чередующимися или расположенными попарно молекулами компонентов [23–28]. В системе ДМАА–H2O (табл. 1), подобные тетрамеры менее устойчивы, чем гетеродимер ДМАА ∙ H2O (рис. 5б). По-видимому, в более прочном из ГА 2ДМАА ∙ 2H2O (с чередующимися молекулами компонентов) оба атома O(=C) дважды выступают в качестве акцепторов протона, а обе молекулы H2O дважды являются донорами протонов (рис. 5в). Такое строение приводит к заметному (≥10% [32, 33]) ослаблению связи (C=)O⋅⋅⋅H(OH) по сравнению с H-связями в циклических гетеротетрамерах, наблюдаемых в других бинарных системах [23–25], при образовании которых задействованы один протон молекулы воды и одна неподеленная пара электронов атома кислорода. В итоге, связи (C=)O⋅⋅⋅H(OH) в комплексе 2ДМАА ∙ 2H2O оказываются менее прочными, чем в гетеродимере ДМАА ∙ H2O (рис. 5б), что проявляется в длинах сравниваемых связей (табл. 1).
Самый стабильный среди ГА стехиометрического состава 1 : 1 – комплекс 4ДМАА ∙ 4H2O, состоящий из четырех гетеродимеров, молекулы воды которых объединены в оптимальный (с учетом кооперативных эффектов [34]) цикл (см. рис. 5г). Столь нетипичная для эквимолярного раствора структура гидрата обусловлена строением молекул ДМАА. Расчет показал, что после образования гетеродимера возможности межмолекулярных взаимодействий для этих молекул исчерпаны: в энергетически предпочтительных ГА стехиометрических составов 1 : 2 и 1 : 4 появляются только H-связи между молекулами воды. Структура комплекса 2ДМАА ∙ H2O в процессе дальнейшей гидратации переходит в структуру 4ДМАА ∙ 4H2O. При взаимодействии ГА 2ДМАА ∙ H2O (EH = 3.25 ккал/моль) и молекулы воды образуются два более устойчивых (EH = 3.95 ккал/моль) гидрата ДМАА ∙ H2O. Они объединяются с аналогичными ГА в существенно более прочные (4.85 ккал/моль) гетерооктамеры 4ДМАА ∙ 4H2O.
При рассмотрении ГА стехиометрического состава 1 : 2 по имеющимся в литературе данным [9, 15, 20] наиболее стабильным считают гетеротример ДМАА ∙ 2H2O, в котором обе молекулы воды образуют связи (C=)O⋅⋅⋅H с карбонильным атомом кислорода (рис. 5д). Однако расчет показал, что даже среди изомеров он не является энергетически более выгодным. Вследствие взаимного ослабления соседних H-связей, образованных атомом кислорода молекулы ДМАА, энергия образования ДМАА ∙ 2H2O (рис. 5д) на 3.15 ккал/моль меньше ΔE циклического изомера, в котором молекулы воды взаимодействуют друг с другом (рис. 5е, табл. 1). Еще бóльшую относительную прочность (5.81 ккал/моль) имеет комплекс 2ДМАА ∙ 4H2O с объединенными в цикл молекулами воды (рис. 5ж), оказавшийся самым устойчивым из гидратов данного стехиометрического состава (табл. 1). Отметим, что структуры этого гидрата и ГА 4ДМАА ∙ 4H2O могут переходить друг в друга при появлении “избыточных” молекул ДМАА или воды соответственно.
Долгоживущие ГА следующего стехиометрического состава представляют собой комплексы 2ДМАА ∙ 8H2O (рис. 5и). Они являются димерами гидратов ДМАА ∙ 4H2O (рис. 5з), и образуются за счет взаимодействия между молекулами воды. ГА 2ДМАА ∙ 8H2O получаются из комплексов 2ДМАА ∙ 4H2O (рис. 5ж). При этом сохраняется цикл (Н2О)4, на основе которого образуется достаточно “замкнутая” кубическая структура из молекул воды (в ней остаются свободными только две группы OH и четыре неподеленные пары электронов). Гетероассоциат 2ДМАА ∙ 8H2O имеет самую большую устойчивость из всех гидратов ДМАА (6.11 ккал/моль) и присутствует в этом диапазоне концентраций, что следует из линейных зависимостей на рис. 2 и 4 при [ДМАА] : [Н2О] ≤ 1 : 4. Случаи, когда в растворах с очень высокой концентрацией одного из компонентов образуются комплексы, содержащие две молекулы второго компонента, реализуются и в других бинарных системах, если такие комплексы имеют наибольшую относительную устойчивость [23–28].
В пользу того, что в растворах ДМАА–Н2О с мольными соотношениями компонентов 1 : 2 и 1 : 4 образуются гидраты удвоенных стехиометрических составов (2 : 4 и 2 : 8 соответственно), можно привести еще два аргумента. Во-первых, объединение гетеротримеров ДМАА ∙ 2H2O (рис. 5е) в комплекс 2ДМАА ∙ 4H2O приводит к значительному выигрышу в энергии (12.13 ккал/моль) и прочность каждой из возникших связей (6.07 ккал/моль) оказывается выше средней прочности H-связей в гетеротримере (5.73 ккал/моль). Аналогичная ситуация имеет место при димеризации ГА ДМАА ∙ 4H2O (рис. 5з) со средней энергией H‑связей 6.06 ккал/моль путем образования четырех H-связей по 6.27 ккал/моль. Во-вторых, так как молекула ДМАА содержит три метильные группы, практически изолирующие ее от окружения, и всего один атом O (в ГА он координирован молекулами H2O), ориентация гидратированных молекул ДМАА в растворе не может быть стохастической. Высокая способность молекул воды к кооперативным межмолекулярным взаимодействиям должна привести к появлению в растворах составов 1 : 1–1 : 4 гидрофобных и гидрофильных микрообластей. Последние могут быть образованы только объединившимися в циклы молекулами воды двух ГА ДМАА ∙ 2H2O (рис. 5е) или ДМАА ∙ 4H2O (рис. 5з).
Таким образом, методами ИК-спектроскопии и квантовой химии исследованы особенности гидратации и определены концентрационно-структурные зоны в системе ДМАА–H2O. Установлены состав, строение, энергии образования и относительные прочности присутствующих в ней гидратных комплексов. По мере разбавления ДМАА водой в растворах последовательно образуются гетероассоциаты со стехиометрическими соотношениями компонентов ДМАА : Н2О, равными 2 : 1, 1 : 1, 1 : 2, 1 : 4. Они представляют собой полициклические комплексы 2ДМАА ∙ H2O (рис. 5а), 4ДМАА ∙ 4H2O (рис. 5г), 2ДМАА ∙ 4H2O (рис. 5ж) и 2ДМАА ∙ 8H2O (рис. 5и), имеющие следующие особенности: относительная стабильность гидратов ДМАА монотонно возрастает от 3.25 до 6.11 ккал/моль по мере увеличения в них доли молекул воды; входящие в комплекс молекулы ДМАА непосредственно не связаны друг с другом.
На основании полученных результатов в водных растворах ДМАА можно выделить следующие концентрационно-структурные области: ДМАА–2 : 1 с основным структурным фрагментом 2ДМАА ∙ H2O (1); 2 : 1–1 : 1 с основными структурными фрагментами 2ДМАА ∙ H2O и 4ДМАА ∙ 4H2O (2); 1 : 1–1 : 2 с основными структурными фрагментами 4ДМАА ∙ 4H2O и 2ДМАА ∙ ∙ 4H2O (3); 1 : 2–1 : 4 с основными структурными фрагментами 2ДМАА ∙ 4H2O и 2ДМАА ∙ 8H2O (4); 1 : 4–Н2О с основным структурным фрагментом 2ДМАА ∙ 8H2O (5). В областях 1 и 5, кроме указанных ГА, присутствуют также молекулы ДМАА или Н2О соответственно. В областях 2–4 компоненты раствора практически полностью связаны в гидраты.
Работа по измерению и анализу ИК-спектров выполнена за счет субсидии, выделенной ИХФ РАН на выполнение государственного задания, тема 46.13 0082-2014-0007 “Фундаментальные закономерности гетерогенного и гомогенного катализа”, АААА-А18-118020890105-3.
Работа по изучению состава и структуры гидратов, образующихся в водных растворах диметилацетамида, методом ТФП выполнена в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований.
Список литературы
Котельникова Н.Е., Михаилиди А.М, Мартакова Ю.В. // Высокомолекуляр. соединения. Серия А. 2017. Т. 59. № 1. С. 63.
Заболоцкий В.И., Демин А.В., Демина О.А. // Электрохимия. 2011. Т. 47. № 3. С. 349.
Вулах Е.Л., Малышев А.Н. Способ получения хлорзамещенных 4,41-диаминобензанилидов: Патент 2385861. Российская Федерация // Б.И. 2010.
Laninovic V. // Высокомолекуляр. соединения. Серия А. 2005. Т. 47. № 7. С. 1196.
Yuan Z., Dan-Li X. // Desalination. 2008. V. 223. P. 438.
Николенко А.В., Вязовская О.В., Чеканова В.В. // Пробл. криобиологии и криомедицины. 2013. Т. 23. № 4. С. 297.
Костяев А.А., Мартусевич А.К. // Медицина экстремальных ситуаций. 2013. Т. 43. № 1. С. 91.
Тюрин Р.В. Дис. … канд. мед. наук. СПб. : ВМА, 1996.
Зайчиков А.М., Бушуев Ю.Г. // ЖФХ. 1995. Т. 69. № 11. С. 1942.
Лященко А.К., Лилеев А.С., Борина А.Ф. // Там же. 1998. Т. 72. № 10. С. 1863.
Zielkiewicz J. // J. Chem. Thermodyn. 2008. V. 40. P. 431.
Das D., Messaâdi A., Barhoumi Z., Ouerfelli N. // J. Solution Chem. 2012. V. 41. P. 1555.
Das D., Messaâdi A., Dhouibi N., Ouerfelli N., Hamzaoui A.H. // Phys. Chem. Liq. 2013. V. 51. № 5. P. 677.
Pal A., Singh Y.P., Singh W. // Indian J. Chem. 1994. V. 33A. P. 1083.
Kinart C.M., Kinart W.J., Bald A., Szejgis A. // Phys. Chem. Liq. 1995. V. 30. № 1. P. 151.
Zhang R., Li H., Lei Y., Han S. // J. Phys. Chem. B. 2005. V. 109. P. 7482.
Терешкевич М.О., Пожидаева Э.Ю., Гольтеузен Э.Э. // Теорет. и эксперим. химия. 1967. Т. 3. № 3. С. 349.
Takamuku T., Matsuo D., Tabata M., Yamaguchi T., Nishi N. // J. Phys. Chem. B. 2003. V. 107. P. 6070.
Papamatthaiakis D., Aroni F., Havredaki V. // J. Chem. Thermodyn. 2008. V. 40. P. 107.
Schmid E.D., Brodbek E. // Can. J. Chem. 1985. V. 63. P. 1365.
Han W.-G., Suhai S. // J. Phys. Chem. 1996. V. 100. P. 3942.
Зайчиков А.М. // Журн. структур. химии. 2006. 47. Прилож. С. 77.
Майоров В.Д., Волошенко Г.И., Кислина И.С. // Хим. физика. 2018. Т. 37. № 4. С. 3.
Тараканова Е.Г., Юхневич Г.В. // ЖСХ. 2014. Т. 55. Пр. № 2. С. S237.
Тараканова Е.Г., Волошенко Г.И., Кислина И.С., Майоров В.Д., Юхневич Г.В., Лященко А.К. // Там же. 2019. Т. 60. № 2. С. 282.
Тараканова Е.Г., Юхневич Г.В. // Там же. 2008. Т. 49. № 4. С. 707.
Тараканова Е.Г., Юхневич Г.В. // Изв. АН. Сер. хим. 2011. № 1. С. 79.
Тараканова Е.Г., Юхневич Г.В. // ЖСХ. 2012. Т. 53. № 3. С. 501.
Майоров В.Д., Кислина И.С., Тараканова Е.Г. // Хим. физика. 2017. Т. 36. № 1. С. 3.
Харрик Н. Спектроскопия внутреннего отражения. М.: Мир, 1970.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Scalmani G., Barone V., Mennucci B., Petersson G.A., Nakatsuji H., Caricato M., Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G., Sonnenberg J.L., Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T., Montgomery J.A., Peralta J.E., Ogliaro F., Bearpark M., Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N., Kobayashi R., Normand J., Raghavachari K., Rendell A., Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N., Millam J.M., Klene M., Knox J.E., Cross J.B., Bakken V., Adamo C., Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O., Austin A.J., Cammi R., Pomelli C., Ochterski J.W., Martin R.L., Morokuma K., Zakrzewski V.G., Voth G.A., Salvador P., Dannenberg J.J., Dapprich S., Daniels A.D., Farkas O., Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J. Gaussian 09. Rev. A.02. Wallingford CT: Gaussian, Inc., 2009.
Тараканова Е.Г., Цой О.Ю., Юхневич Г.В. // Журн. структур. химии. 2002. Т. 43. № 5. С. 810.
Юхневич Г.В., Тараканова Е.Г., Петров А.В. // ДАН. 1999. Т. 367. № 6. С. 784.
Yukhnevich G.V. // Spectrosc. Lett. 1997. V. 30. № 5. P. 901.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика