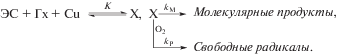Химическая физика, 2020, T. 39, № 1, стр. 19-22
Каталитическое поглощение кислорода тройной системой эпоксид стирола – гидрохинон – хлорид меди(II) в водном трет-бутаноле
Л. В. Петров 1, *, В. М. Соляников 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: plv@icp.ac.ru
Поступила в редакцию 21.12.2018
После доработки 18.01.2019
Принята к публикации 21.01.2019
Аннотация
Изучено окисление кислородом тройной системы эпоксид стирола (ЭС) – гидрохинон (Гх) – хлорид Cu(II) в растворителе трет-бутанол : вода в соотношении 4 : 1 (по объему). Выражение скорости окисления через концентрации: V = k[CuCl2]1[ЭС]0[Гх]0 при [ЭС] > [Гх] > [CuCl2], объяснено образованием тройного комплекса реагентов, предшествующего окислению. Эффективная константа скорости окисления k [c–1] = 92.5 exp(–22/RT) при 323–343 K. Величины отношений концентраций поглощенного кислорода и медного катализатора [O2]/[CuCl2] $ \gg $ 1, т.е. окисление каталитическое.
Тематика катализированного соединениями металлов окисления гидрохинона (1,4-дигидроксибензола) и его производных широко представлена в патентной и научной литературе [1]. Реакция катализированного медью окисления гидрохинона (Гх) предложена, в частности, как высокочувствительный тест на присутствие Cu(II) в растворе [2]. Поэтому основная проблема выполнения этой работы состояла в нахождении условий эксперимента, в которых окисление двойной системы (ДС) гидрохинон – соль Cu малозаметно на фоне быстрого окисления интересующей нас тройной системы (ТрС) ЭС – Гх – Cu. Такие условия были найдены: в смеси трет-бутанола и воды в объемном соотношении 4 : 1, тройная система окисляется на порядок быстрее, чем двойная ДС. Кинетика окисления упомянутой тройной системы изучена в этой работе. Система в чем-то аналогична описанной ранее тройной системе ЭС – Гх – кислота: при попытке затормозить ингибитором гидрохиноном окисление двойной системы эпоксид стирола (ЭС) – кислота обнаружено и изучено ускорение поглощения кислорода [3]. При сравнении двух тройных систем, ЭС – Гх – кислота и ЭС – Гх – CuCl2, возникают вопросы: каков механизм участия эпоксида в появлении радикальных частиц, о которых мы традиционно судим по поглощению кислорода; в чем сходство и различие механизмов действия кислоты и медной соли в этой реакции; какова роль гидрохинона?
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методика проведения и обработки опытов по поглощению кислорода на манометрической установке описана в работе [4]. Тройная система ЭС – Гх – CuCl2 оказалась удобной для изучения. Плавный изгиб кинетических кривых поглощения кислорода позволил достаточно надежно измерять начальные скорости по тангенсам углов наклона касательных к начальным участкам кинетических кривых. В работе использованы очищенный двухкратной вакуумной ректификацией в атмосфере аргона эпоксид стирола и водный бидистиллат для приготовления смесей трет-бутанол – вода. Кристаллогидрат CuCl2 ∙ 2H2O марки “ЧДА”, гидрохинон марки “reinst” фирмы “AppliChem” и трет-бутанол марки “ЧДА” использованы без какой-либо предварительной обработки.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 1 компактно представлена часть результатов предварительной работы, определившей предмет и условия последующего изучения тройной системы ЭС – Гх – CuCl2; здесь и всюду ниже CuCl2 – обозначение соли CuCl2 ∙ 2H2O, задействованной в опытах. Поясним: окисление двойных систем в опытах № 4–6 (табл. 1) испытывалось из-за реальности неконтролируемого значительного вклада окисления трех возможных двойных систем в суммарную скорость окисления изучаемой тройной системы. Данные табл. 1 (где присутствующие компоненты обозначены “+”, отсутствующие – “–”) показывают, что сумма скоростей окисления двойных систем V4 + V5 + V6 $ \ll $ V2, т.е. тройная система является совокупностью трех компонентов-синергистов. Примечательно влияние воды: в безводном трет-бутаноле окисление не идет (ср. строки 1–3 табл. 1).
Таблица 1.
Скорости окисления (V) тройных и двойных систем в водно-спиртовых растворах при [ЭС] = 0.35, [Гх] = 0.122, [CuCl2] = 7.2 ∙ 10–3 моль/л (343 K)
| Номер опыта |
Тип системы |
ЭС | Гх | Cu | H2O, об.% | V · 105, моль/л · c |
|---|---|---|---|---|---|---|
| 1 | ТрС | + | + | + | 0 | 0.0 |
| 2 | ТрС | + | + | + | 10 | 9.0 |
| 3 | ТрС | + | + | + | 20 | 15.0 |
| 4 | ДС | – | + | + | 10 | 0.5 |
| 5 | ДС | + | – | + | 10 | 0.3 |
| 6 | ДС | + | + | – | 10 | 0.0 |
Зависимость VТрС от содержания воды в водно-спиртовом растворе представлена на рис. 1 (эти и все последующие опыты по изучению концентрационных зависимостей скорости окисления выполнены при 333 K). Объяснить сложную форму кривой 1 (рис. 1) зависимости V = f([H2O]), как и резкий рост скорости с увеличением содержания воды в растворе, видимо, невозможно. Предположения на этот счет без знания механизма окисления беспредметны. Но с использованием данных, представленных на кривой 1 рис. 1, выбраны оптимальные условия определения концентрационных зависимостей скорости окисления изучаемой ТрС: 80 об.% трет-бутанола и 20 об.% H2O (растворитель БУВ – смесь трет-бутанола и воды данного состава, 333 K).
Рис. 1.
Зависимость скорости окисления тройной системы ЭС – Гх – CuCl2 при [ЭС] = 0.35, [Гх] = 0.02 моль/л от содержания: 1 – воды в смеси с трет-бутанолом, [CuCl2] = 5.6 ∙ 10–4 моль/л; 2 – кислорода в газовой смеси-окислителе, [CuCl2] = 1.12 ∙ 10–3 моль/л (перекрывающиеся точки соответствуют 3–5-кратному изменению рабочей частоты встряхивания реактора в атмосфере воздуха); растворитель – БУВ, 333 K.
Кривой 2 на рис. 1 представлена зависимость скорости окисления от содержания кислорода в газе-окислителе. Она отлична по форме от привычных зависимостей от [O2] для углеводородов, окисляющихся по радикальному (радикально-цепному) механизму через пероксидный радикал: скорость окисления таких систем перестает расти уже при содержании кислорода 5–10% в газе-окислителе. Скорость же окисления V тройной системы ЭС – Гх – Cu возрастает при увеличении [O2] во всем диапазоне концентраций кислорода, представленных кривой 2 рис. 1. Отметим, что характер зависимости не связан с протеканием реакции в диффузионном или диффузионно-кинетическом режиме, о чем свидетельствуют близкие значения скорости поглощения кислорода при разных частотах перемешивания реакционной смеси (рис. 1). Порядок реакции по кислороду, рассчитанный по характеру этой зависимости, n = Δ lg V/Δ lg [O2] = 0.67 ± 0.1.
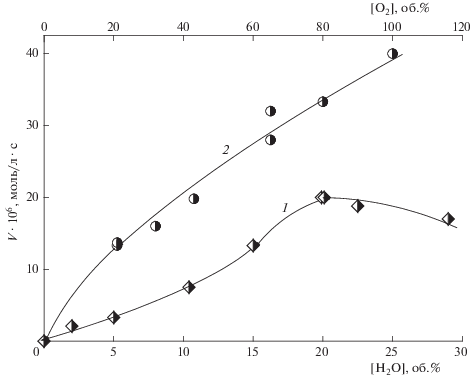
На рис. 2 приведены примеры кривых окисления при разных исходных значениях [CuCl2]. Зависимости скорости окисления ТрС от [CuCl2], [ЭС], [Гх] (кривые 1–3 соответственно) представлены на рис. 3. Скорость окисления пропорциональна концентрации соли меди (первый порядок) и не зависит от концентраций Гх и ЭС, т.е. порядки по этим двум компонентам при [ЭС], [Гх] $ \gg $ [CuCl2] нулевые и V = k[CuCl2]1[ЭС]0[Гх]0, где k [с–1] – эффективная константа скорости сложного процесса окисления тройной системы. Окисление, несомненно, носит каталитический характер. В условиях опытов (см. точки на зависимости 1 рис. 3) отношение количества поглощенного кислорода к исходной концентрации медной соли [O2]погл/[CuCl2] $ \gg $ 1, хотя и падает с увеличением [CuCl2]. При [CuCl2] = 1.7 ∙ 10–3 моль/л это отношение равно 10, при 1.12 ∙ 10–3 оно составляет 18, при 5.6 ∙ 10–4 – 28 (продолжительность опытов – 1620 c). По температурной зависимости V (табл. 2) рассчитаны величина брутто-энергии активации окисления E = (22 ± 6) кДж/моль и константа скорости k [с–1] = 92.5 exp(–22/RT). Малые величины предэкспонента и энергии активации в аррениусовском выражении k – свидетельство сложности окисления тройной системы. Энергия активации в 4 раза ниже, чем в случае кислотно-каталитического окисления ЭС в спиртовой среде [5].
Рис. 2.
Кинетические кривые поглощения кислорода тройной системой при [ЭС] = 0.35, [Гх] = 0.029 моль/л и следующих значениях [CuCl2], моль/л: 1 – 5.6 ∙ 10–4, 2 – 1.12 ∙ 10–3, 3 – 1.68 ∙ 10–3; растворитель – БУВ, 333 K.
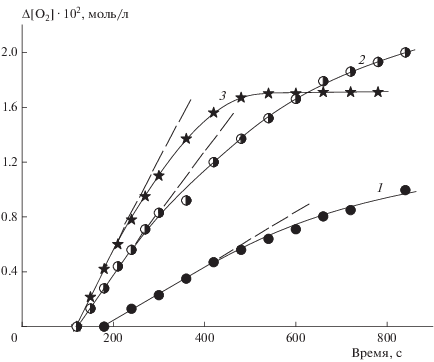
Рис. 3.
Зависимости скорости окисления тройной системы ЭС – Гх – CuCl2 в растворе БУВ при 333 K от: 1 – [CuCl2] при [ЭС] = 0.35, [Гх] = 0.029 моль/л; 2 – [ЭС] при [Гх] = 0.029, [CuCl2] = 5.6 ∙ 10–4 моль/л; 3 – [Гх] при [ЭС] = 0.35, [CuCl2] = 1.12 ∙ 10–3 моль/л.
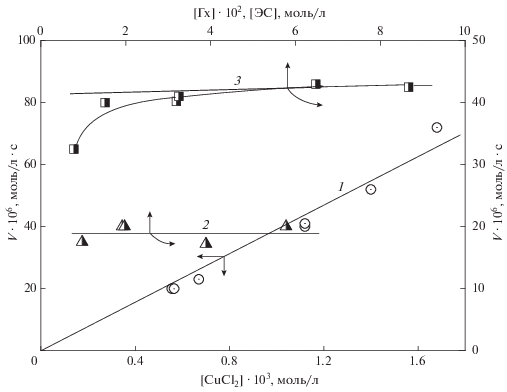
Таблица 2.
Исходные данные для расчета энергии активации окисления тройной системы ЭС – Гх – CuCl2 при [ЭС] = 0.35, [Гх] = 0.029, [CuCl2] = 1.12 ∙ 10–3 моль/л (растворитель – БУВ)
| t, °C | T, K | V · 105, моль/л · с |
|---|---|---|
| 69.5 | 342.5 | 4.81 |
| 60 | 333 | 3.90 |
| 50 | 323 | 3.00 |
О сложности реакции свидетельствуют и величины частных порядков по ЭС, Гх и CuCl2 (0, 0, 1 соответственно). В качестве рабочей гипотезы объяснения сложности кинетики, полагаем, приемлема схема образования из трех исходных реагентов комплекса X, предшественника окисления:
Здесь K – константа равновесия, kМ – константа скорости нерадикального превращения X, kР – константа скорости образования свободных радикалов по реакции комплекса X с кислородом. При [CuCl2] $ \ll $ [Гх] и [ЭС] K = [X]/[ЭС][Гх]([CuCl2] – [X]), [X] = K[ЭС][Гх][CuCl2]/(1 + K[ЭС][Гх]), при K[ЭС][Гх] > 1, [X] = [CuCl2] и в согласии со схемой скорость окисления V = kР[O2][CuCl2]1[ЭС]0[Гх]0 = = k[CuCl2]1[ЭС]0[Гх]0, где k – эффективная константа скорости радикалообразования. Природа отклонения зависимости V = f ([O2]) от линейности (рис. 1, кривая 2) неизвестна. Возможно, причина заключается в дезактивации медного катализатора продуктами окисления: чем быстрее с ростом [O2] окисление, тем заметнее снижение скорости окисления из-за дезактивации катализатора продуктами окисления. Возможно, впрочем, дезактивируют катализатор и продукты окисления, и продукты молекулярного, нерадикального превращения комплекса X.
Работа выполнена по теме государственного задания (номер государственной регистрации 01201361859).
Список литературы
Radel R.J., Sullivan J.M., Hatfield J.D. // Industrial and Engineering Chemistry Product Research and Development. 1982. V. 21. № 4. P. 566.
Рыжкова В.И., Долманова И.Ф. // ЖАХ. 1974. Т. 29. № 6. С. 1222.
Петров Л.В., Соляников В.М. // Нефтехимия. 2017. Т. 57. № 4. С. 474.
Петров Л.В., Соляников В.М. // Изв. АН. Сер. хим. 2015. № 1. С. 107.
Петров Л.В., Соляников В.М. // Нефтехимия. 1999. Т. 39. № 2. С. 107.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика