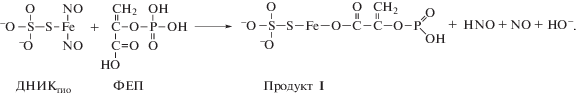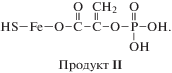Химическая физика, 2020, T. 39, № 1, стр. 39-46
Применение масс-спектрометрии для идентификации продуктов взаимодействия нитрозильных комплексов железа – доноров монооксида азота с фосфоенолпировиноградной кислотой
Е. А. Саратовских 1, *, Н. А. Санина 1, 2, В. М. Мартыненко 1, Б. Л. Психа 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: easar@icp.ac.ru
Поступила в редакцию 14.01.2019
После доработки 14.01.2019
Принята к публикации 20.02.2019
Аннотация
Предложено использование масс-спектрометрии для исследования взаимодействия донора монооксида азота (тетранитрозильного комплекса железа с тиосульфатным лигандом) с одним из основных биологических макроэргических соединений – фосфоенолпировиноградной кислотой. Применение масс-спектрометрического метода позволило проводить исследования в водной среде; получить разделение веществ и установить массы продуктов реакции; количественно связать интенсивность регистрируемых пиков и концентрации соответствующих веществ.
ВВЕДЕНИЕ
Хорошо известно, что монооксид азота (NO) является уникальным регулятором клеточного метаболизма. Молекула NO непрерывно образуется в организмах млекопитающих. Она функционирует в качестве сигнальной молекулы в разнообразных физиологических и биохимических процессах, в том числе в процессах регуляции генетического аппарата на уровне транскрипции и трансляции мРНК. Взаимодействуя с клеточными субстратами, NO играет ключевую роль в жизнедеятельности живых организмов [1]. Биологическая активность NO очень высока: эта молекула участвует в регуляции тонуса кровеносных сосудов, ингибирует агрегацию тромбоцитов и их адгезию на стенках кровеносных сосудов [2]; функционирует в центральной и вегетативной нервной системе; регулирует деятельность органов дыхания, желудочно-кишечного тракта и мочеполовой системы. Она связана с передачей сигналов нейронами, иммунными реакциями, противомикробной и противоопухолевой активностью, репродуктивными и другими функциями [3].
Интерес к комплексам железа обусловлен тем, что они обладают высокой биологической активностью [4–7] и потенциальными терапевтическими свойствами [8–10]. Очевидно, что на основе нитрозильных комплексов железа – доноров монооксида азота NO, могут быть созданы лекарственные препараты нового поколения, обладающие способностью направленной доставки NO к биологическим мишеням клетки.
В данной работе мы провели исследование нитрозильного комплекса железа с тиосульфатом натрия (ТНКЖ), имеющего химическую формулу Na2[Fe2(S2O3)2(NO)4] ∙ 4H2O. Этот комплекс является эффективным донором монооксида азота и проявляет потенциальную терапевтическую активность [9, 10]. Так, например, на моделях ишемического и реперфузионного повреждения сердца крыс линии Wistar ex vivo и in vivo показано [9], что ТНКЖ обладает вазодилатационным действием, которое проявляется в эффективном восстановлении коронарного потока и снижении систолического артериального давления. Его применение при острой ишемии сердца позволяет поддерживать метаболизм и ритм сокращений сердечной мышцы, уменьшает размер зоны поражения миокарда при инфаркте, не проявляя аритмогенного действия, способного привести к гибели экспериментальных животных.
В настоящее время доказана роль NO в индуцировании апоптоза в опухолевых клетках саркомы и меланомы [11, 12]. Установлено, в частности, что ТНКЖ проявляет противоопухолевые свойства [10]. Исследование механизмов регуляции энергетического метаболизма в клетках с целью поиска методов терапии сердечно-сосудистых заболеваний, болезней легких и крови, процессов старения представляет собой актуальную задачу современной молекулярной биологии. Важно выяснить механизм влияния комплексов железа – доноров NO на энергетический метаболизм вообще и на гликолиз в частности, поскольку доказано [13], что в онко-пораженной клетке выработка энергии происходит не в цикле Кребса, а через гликолиз.
Взаимодействие одного из основных макроэргических соединений – аденозинтрифосфорной кислоты (АТФ) с комплексом ТНКЖ мы показали в ряде работ [14–16]. Синтез АТФ происходит в процессе гликолиза на ферменте пируваткиназе из фосфоенолпировиноградной кислоты (ФЕП). Так же, как и АТФ, ФЕП является одной из основных макроэргических молекул. Она находится в начале четырех основных метаболических путей, связана с митохондриальным дыханием [17] и является мощным ингибитором ферментов гликолиза [18].
Все вышеизложенное вызывает огромный интерес к исследованию взаимодействия ТНКЖ – донора NO с одним из биологических макроэргических соединений – фосфоенолпировиноградной кислотой. Цель настоящей работы – исследование взаимодействия ФЕП и ТНКЖ масс-спектрометрическим (МС) методом и идентификация продуктов реакции.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы ФЕП чистоты 99% (Sigma, США) использовали без дополнительной очистки. Рабочие растворы (10–2 М) готовили растворением навески препарата в бидистиллированной воде. Соли: FeSO4 ∙ 7H2O и Na2S2O3 ∙ 5H2O (для синтеза металлокомплекса ТНКЖ) и NaNO2 и KI (для калибровки электрохимического сенсора) использовали без дополнительной очистки (Aldrich, США). Растворители: тетрагидрофуран, ионол, N-метилпирролидон и ацетонитрил чистоты 99.5–99.9% (Aldrich, США) и H2SO4 (марки “ХЧ”, “Химспециализация”, РФ) использовали без дополнительной очистки. Растворитель диметилсульфоксид (ДМСО) очищали по методу, изложенному в работе [19]. Комплекс ТНКЖ общей формулы Na2[Fe2(S2O3)2(NO)4] ∙ 4H2O синтезировали согласно методике, рекомендованной в работе [20]. Анион [Fe2(S2O3)2(NO)4]2– имеет биядерную центросимметричную структуру, в которой атомы железа связаны μ-атомами серы тиосульфатных групп.
Для исследования взаимодействия между ФЕП и ТНКЖ сливали эквимолярные (10–2 М) водные растворы обоих веществ. Реакцию проводили при интенсивном перемешивании и при нормальных условиях.
Для измерения количества NO, генерируемого ТНКЖ в растворах, использовали сенсорный электрод “amiNO-700” анализатора “inNO Nitric Oxide Measuring System” (Innovative Instruments, США). Количество NO фиксировали в течение 3.5 мин с шагом 0.2 с в 1%-ном водном растворе ДМСО. Калибровку электрохимического сенсора проводили на стандартном водном растворе NaNO2 (100 мкМ ∙ л–1), который добавляли в смесь водных растворов KJ (0.12 М ∙ л–1) и H2SO4 (1.0 М ∙ л–1).
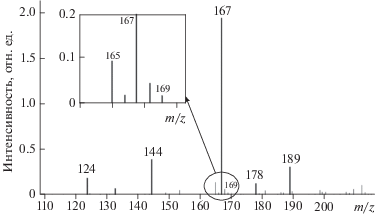
Для анализа исходных веществ и определения продуктов реакции использовали жидкостной квадрупольный хромато-масс-спектрометр (ЖХ-МС) LCMS 2020 (Shimadzu, Япония), с ионизацией в электроспрее (ESI), без разделения на колонке. Водный раствор анализируемого вещества из дозатора поступал непосредственно в ионный источник масс-анализатора. Диапазон определяемых масс – от 10 до 2000 m/z. Разрешение квадрупольного масс-анализатора (FWHM) равно 0.6. Элюэнт – ацетонитрил/вода в соотношении 50 : 50%. Объем впрыска составлял 0.1–10 мкл. Отнесение спектров проводили на основании распределения отрицательно заряженных ионов. Тип ионов, имеющих близкие массовые числа к соединениям ТНКЖ или ФЕП, определяли по изотопному распределению, как показано на вставке рис. 1.
Инфракрасные спектры регистрировали на ИК-фурье спектрометре “FT-IR ALPHA” (4000–500 см–1) фирмы “Bruker”, (Германия). Измерения выполняли в водных растворах в капле между стеклами ZnSe при 20 °С на воздухе.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Определение растворимости
Работа с биологическими системами накладывает ряд существенных ограничений. Прежде всего, поддержание нормальных условий: температуры, давления и использование водных систем с рН близким к 7.0 в качестве растворителя. В результате возникают определенные сложности в применении того или иного аналитического метода. Поэтому на предварительном этапе исследования мы проверили растворимость исходных веществ. При выборе растворителя исходили из требований к его использованию в приборах: тетрагидрофуран и N-метилпирролидон для жидкостной хроматографии; вода и ацетонитрил для МС; вода для УФ- и ИК-спектроскопии. Результаты определения растворимости ТНКЖ и ФЕП представлены в табл. 1. Как видно из табл. 1, оба исходных вещества полностью растворяются только в протонных или полярных растворителях, и прежде всего в воде. Однако в ИК-спектрах вода, взятая в качестве растворителя, закрывает часть характеристических пиков и снижает возможности применения этого метода для исследования поведения комплекса железа.
Таблица 1.
Растворимость ФЕП и ТНКЖ в различных растворителях
| Растворитель | ФЕП | ТНКЖ |
|---|---|---|
| Дистиллированная вода | полное растворение | полное растворение |
| Ацетонитрил | полное растворение | полное растворение |
| Тетрагидрофуран | не растворяется | не растворяется |
| N-метилпирролидон | частичное растворение | частичное растворение |
Исследования поведения ТНКЖ масс-спектрометрии
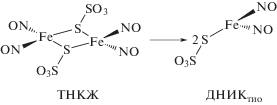
Ранее [21] мы использовали МС для определения поведения комплекса ТНКЖ в растворах (рис. 2). Установлено, что в протонных растворителях происходит образование моноядерного динитрозильного тиосульфатного комплекса железа (ДНИКтио), как показано на схеме
Рис. 2.
Масс-спектры водного раствора комплекса ТНКЖ через 4 (а), 24 (б) и 64 (в) мин после приготовления водно-метанольного (9 : 1) раствора, концентрация ТНКЖ 1 ∙ 10–4 М.
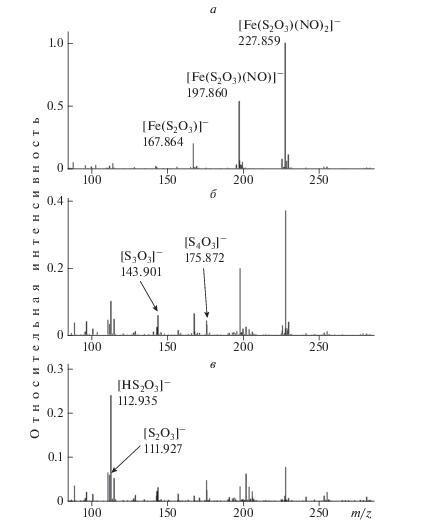
Анализ растворов анионного нитрозильного комплекса – ТНКЖ–Na, выполненный с помощью МС, приведен на рис. 2а. Показано, что спустя ∼4 мин после растворения комплекса в воде в спектре присутствуют, в основном, ионы трех типов: [Fe(S2O3)(NO)2]–, [Fe(S2O3)(NO)]– и [Fe(S2O3)]– в соотношении 1 : 0.47 : 0.16. Через 24 мин после приготовления раствора количество основных ионов [Fe(S2O3)(NO)2]– в спектре составляет 40% от первоначального (рис. 2б). При этом сохраняется соотношение между интенсивностью этого иона и интенсивностями ионов [Fe(S2O3)(NO)]– и [Fe(S2O3)]– на уровне 1 : 0.47 : 0.16. В спектре появились ионы [S3O3]– и [S4O3]–, а интенсивности ионов [S2O3]– и [НS2O3]– увеличились в 4.5 и 5.5 раз соответственно. В спектре, полученном через 64 мин после приготовления раствора, количество основных ионов [Fe(S2O3)(NO)2]– составляет около 10% от первоначального. Происходит изменение соотношения между интенсивностью этих ионов и интенсивностями ионов [Fe(S2O3)(NO)]– и [Fe(S2O3)]– до 1 : 0.5 : 0.2, как видно на рис. 2в. Интенсивности ионов [S3O3]– и [S4O3]– практически не изменились, а интенсивности ионов [S2O3]– и [НS2O3]– увеличились в 2 и 2.5 раза соответственно. Относительная интенсивность ионов [Fe2(S2O3)2(NO)4]2– составила в этих трех спектрах 7, 2 и 0% соответственно [21].
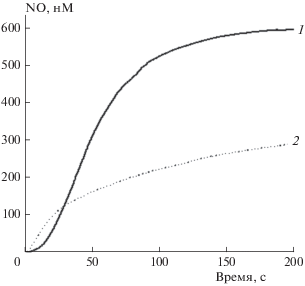
На рис. 3 приведена зависимость выделения NO комплексом ТНКЖ от времени по данным работы [21]. Как следует из рис. 3, генерация NO начинается сразу после растворения в протонных растворителях и продолжается в течение 1 ч.
Анализ состава смеси ТНКЖ и ФЕП до и после реакции
Можно ожидать, что между ФЕП и ТНКЖ протекает реакция этерификации по механизму электрофильного замещения с образованием сложного эфира согласно схеме:
На рис. 1 приведен масс-спектр одного из исходных веществ – ФЕП, на котором виден молекулярный ион с m/z = 167, который для ФЕП является основным пиком. В масс-спектре реакционной смеси присутствие этого пика сохраняется в течение всего времени наблюдения (36 мин), т.е. реакция между ФЕП и ДНИКтио протекает медленно.
Полученные результаты идентификации молекулярных ионов продуктов реакции в масс-спектре приведены на рис. 4. Анион с m/z = 318, вероятно, относится к первому продукту реакции (Продукт I). Он появляется в спектре через 2 мин после смешивания растворов, при этом ион с m/z = = 228, принадлежащий соединению ДНИКтио еще удерживающему две группы NO, также присутствует.
Рис. 4.
Масс-спектры смеси водных растворов ФЕП и ТНКЖ через 36 мин после приготовления концентрация 10–2 М.
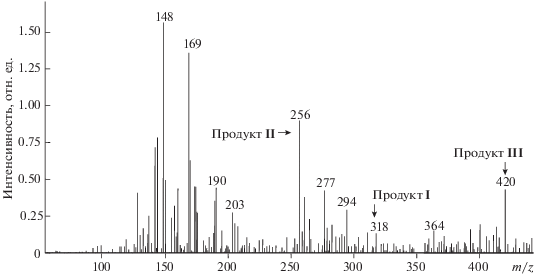
Ион с m/z = 256, по всей видимости, относится ко второму продукту реакции:
Продукт II может иметь в масс-спектре разное количество протонов. Эти ионы появляются в спектре через 2 мин после смешивания растворов исходных веществ. Интенсивности пиков этого иона увеличиваются со временем по мере протекания реакции (до 36-й мин наблюдения). Вероятно, молекулярный ион продукта II образуется из продукта I. К 36-й мин наблюдения количество продукта II почти в 2.5 раза больше, чем продукта I.
Образование продукта II может также происходить другим путем – в параллельной реакции при взаимодействии ФЕП и иона [S-Fe]–, являющегося остатком ТНКЖ. На 2-й мин после смешения растворов исходных веществ в масс-спектре наблюдается ион, имеющий m/z = 420. Возможно, что это ион третьего продукта реакции (Продукт III), в котором остаток молекулы ТНКЖ скоординирован с двумя молекулами ФЕП – [S-Fe-2ФЕП]–.
Анализ инфракрасных спектров
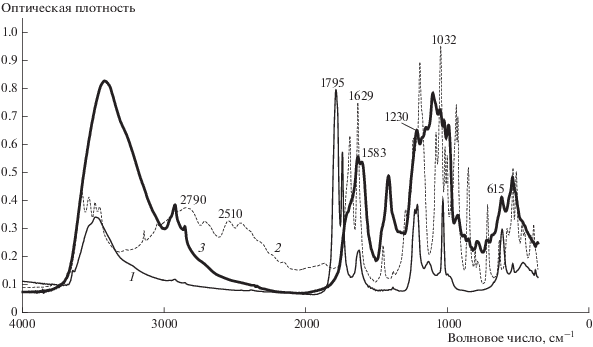
Для доказательства строения полученного соединения мы использовали ИК-спектроскопический метод. На рис. 5 представлены зарегистрированные ИК-спектры. Сильный дублет в спектре ТНКЖ (кривая 1) в области 1795 см–1 с плечом 1742 см–1 согласно данным работы [22] является характеристической полосой и принадлежит валентному колебанию ν(NO). В спектре продукта реакции (кривая 3) эти полосы полностью отсутствуют, что свидетельствует об отщеплении группы NO после растворения комплекса ТНКЖ и в процессе проведения реакции.
Еще одна характеристическая полоса колебания в спектре комплекса ТНКЖ средней интенсивности в области 1629 см–1 также, согласно данным работы [22], принадлежит угловым колебаниям связи железа, координированного с NO: ν(Fe–NO). В спектре продукта реакции (кривая 3) эта полоса смещается до 1583 см–1. При этом значительно возрастает ее интенсивность, т.е. произошло перераспределение энергии связи железа. Возможно, что вслед за отщеплением NO железо было скоординировано с другим атомом.
Сильный дублет в области 1230 см–1 в спектре ТНКЖ мы отнесли к симметричным колебаниям νs(SO2). А сильная полоса 1032 см–1, возможно, принадлежит валентным колебаниям связи сера–кислород: ν(S–O) [22–24]. Обе эти полосы сохраняются в спектре продукта (кривая 3).
Сильную полосу в спектре исходного комплекса ТНКЖ в области 615 см–1 можно отнести к валентным колебаниям связи железо–азот: ν(Fe–N). В спектре продукта I (кривая 3) эта полоса также сохраняется. Хотя возможно, что теперь эта полоса принадлежит валентному колебанию связи Fe–O–ν(Fe–О), или колебаниям группы (СОО–), скоординированными с атомом железа, например через кислород: Fe–O (δ(O–C=O) + ν(Fe–O)), как указано в работе [21].
В спектре ФЕП (кривая 2) много связанной воды, характеризующейся полосами в области 3000–3500 см–1, которая сохраняется в полученном продукте. Сильная полоса в области 2790 см–1 и сильный дублет в областях 2510 и 2490 см–1 принадлежат колебаниям карбоксильных групп ν(С–O) и ν(С–OН) и являются характеристическими в спектре ФЕП (кривая 2). В спектре продукта (кривая 3) эти полосы полностью отсутствуют. Исчезновение этих полос свидетельствует об образовании нового соединения за счет карбоксильных групп.
Сильный дублет в областях 1710 и 1629 см–1 в спектре исходной ФЕП (кривая 2) принадлежат колебаниям димерной и мономерной форм фосфорных остатков: ν(P–O). При образовании нового соединения (кривая 3) колебания димера исчезают, а мономерной формы – остаются.
Значительное количество полос в области 750–1250 см–1 в спектре исходного ФЕП (кривая 2) принадлежат валентным, деформационным, симметричным и ассиметричным колебаниям связей: P–O, P=O, P–O–С. Все они сохраняются в спектре продукта реакции (кривая 3), т.е. в образовании нового соединения остатки фосфорной кислоты не принимают участия. Таким образом, на основании анализа ИК-спектров можно говорить об образовании нового соединения за счет образования связи железа принадлежавшего ТНКЖ, с атомом (или атомами) кислорода, принадлежавшим карбоксильным группам ФЕП.
Количественные определения
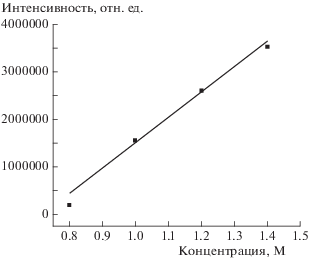
Как видно из рис. 3, в водных растворах ТНКЖ отдает монооксид азота, а в результате претерпевает серьезные изменения структуры, поэтому использование его для количественных измерений в процессе реакции проблематично. В отличие от ТНКЖ, ФЕП является молекулой устойчивой в водном растворе и пригодной для измерения изменения его концентрации во времени. Поэтому для измерения концентрации вещества в процессе реакции был выбран именно ФЕП. Были приготовлены растворы с концентрациями: 0.76 ∙ 10–2, 0.96 ∙ 10–2, 1.16 ∙ 10–2, 1.36 ∙ 10–2 М в дистиллированной воде. Измерения масс-спектров проводили при напряжении 3.5 кВ, объем вводимой пробы составлял 5 мкл. Полученная зависимость интенсивности пика основного иона ФЕП от концентрации взятого образца представлена на рис. 6. Выявленная линейность этой зависимости дает возможность количественно следить за ходом реакции, что необходимо для кинетических исследований и последующего установления механизма реакции.
Результаты проведенных исследований показали возможность применения МС для исследования биологического макроэрга – ФЕП в водных растворах. С помощью МС идентифицированы продукты взаимодействия нитрозильных комплексов железа – доноров NO с фосфоенолпировиноградной кислотой и установлены массы продуктов реакции. Использование МС дает возможность количественно следить за ходом реакции, что необходимо для кинетических измерений и установления ее механизма.
ВЫВОДЫ
На основании проведенных исследований можно утверждать, что в системе протекают следующие процессы:
1. Диссоциация ТНКЖ идет согласно схеме, описанной в работах [14–16].
2. Молекула ДНИКтио взаимодействует с молекулой ФЕП с образованием соединения [ФЕП- ДНИКтио], в результате чего появляется промежуточный продукт – молекулярный ион с массовым числом 318 m/z. Далее от этого соединения отсоединяются поочередно группы NO и, наконец, [SO3]–. Возникает продукт реакции [S–Fe–ФЕП].
3. Ион [O3S–S–Fe]–, являющийся частью ДНИКтио, и образовавшийся по мере диссоциации ТНКЖ, вступает во взаимодействие с ФЕП с образованием того же промежуточного продукта реакции [O3S–S–Fe–ФЕП], стабилизирующегося в виде [S–Fe–ФЕП].
Таким образом, в результате реакции между ФЕП и ТНКЖ образуется новое соединение за счет образования связи железо–кислород. С помощью МС установлены массы продуктов реакции. Предложена гипотетическая схема протекания реакции и дано строение образующихся продуктов реакции.
Работа выполнена по теме госзадания (номер государственной регистрации N0089-2014-0037).
Список литературы
Страйер Л. Биохимия. М.: Книга по требованию, 2013.
McCleverty J.A. // Chem. Rev. 2004. V. 104. № 2. P. 403.
Wink D.A., Mitchel J.B. // Free Radical. Biol. Med. 1998. V. 25. № 4. P. 434.
Саратовских Е.А., Кондратьева Т.А., Психа Б.Л. и др. // Изв. АН СССР. Сер. хим. 1988. № 11. С. 2501.
Саратовских Е.А., Коршунова Л.А., Рощупкина О.С., Скурлатов Ю.И. // Хим. физика. 2007. Т. 26. № 8. С. 46.
Саратовских Е.А., Глазер В.М., Костромина Н.В., Котелевцев С.В. // Экологическая генетика. 2007. Т. 5. № 3. С. 46.
Саратовских Е.А., Козлова Н.Б., Байкова И.С., Штамм Е.В. // Хим. физика. 2008. Т. 27. № 11. С. 87.
Татьяненко Л.В., Котельников А.И., Саратовских Е.А. и др. // Хим.-фармацевт. журн. 2009. Т. 43. № 8. С. 55.
Санина Н.А., Серебрякова Л.И., Шульженко В.С., Писаренко О.И., Руднева Т.Н., Алдошин С.М. Применение биядерного сера-нитрозильного комплекса железа анионного типа в качестве вазодилататорного лекарственного средства: Патент РФ 2437667 от 27.12.2011 // “Изобретения. Полезные модели”. Официальный бюллетень федеральной службы по интеллектуальной собственности. 2011. № 36.
Санина Н.А., Руднева Т.Н., Сулименков И.В. и др. // Рос. хим. журн. 2009. Т. 53. № 1. С. 164.
O`Donnell V.B., Spycher S., Azzi A. // Biochem. J. 1995. V. 310. P. 133.
Xie K., Huang S., Dong Z. et al. // Cancer Res. 1995. V. 55. P. 3123.
Warburg O.H. The Prime Cause and Prevention of Cancer. Revised lecture at the meeting of the Nobel-Laureates on June 30, 1966. Würzburg: Publ. Konrad Triltsch., 1969.
Саратовских Е.А., Психа Б.Л., Санина Н.А. // Изв. РАН. Сер. хим. 2011. Т. 60. № 6. С. 1151.
Психа Б.Л., Саратовских Е.А., Санина Н.А. // Изв. РАН. Сер. хим. 2012. № 9. С. 1810; https://doi.org/10.1007/s11172-012-0249-5
Saratovskikh E.A., Psikha B.L., Sanina N.A. Natural Science. 2013. V. 5. № 7. P. 800; https://doi.org/10.4236/ns.2013.57097
Dizengremel P., Vaultier M.-N., Le Thiec D. // New Phytologist. 2012. V. 195. P. 512.
Gallardo-Pérez J.C., Marín-Hernández A., Rodríguez-Enríquez S. // Biochim. Biophys. Acta. 2011. V. 1807. P. 755.
Armarego W.L.F., Chai Ch.L.L. Purification of Laboratory Chemicals. Amsterdam–London–N.Y.–Tokyo: Elsevier Inc., 2013.
Санина Н.А., Алдошин С.М., Руднева Т.Н. и др. // Координац. химия. 2005. Т. 31. № 5. С. 323.
Санина Н.А. Дис. … д-ра хим. наук. Черноголовка: ИПХФ РАН, 2010.
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991.
Наканиси И. Инфракрасные спектры и строение органических соединений. М.: Мир, 1965.
Свердлов Л.М., Ковнер М.А., Крайнов Е.П. Колебательные спектры многоатомных молекул. М.: Наука, 1970.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика