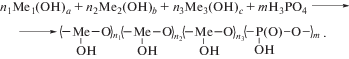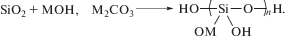Химическая физика, 2020, T. 39, № 1, стр. 75-82
Неорганические и гибридные полимеры и композиты
А. Ю. Шаулов 1, *, Л. В. Владимиров 1, А. В. Грачев 1, В. М. Лалаян 1, Е. М. Нечволодова 1, Р. А. Сакович 1, В. К. Скачкова 1, Е. В. Стегно 1, Л. А. Ткаченко 1, С. А. Патлажан 1, А. А. Берлин 1
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: ajushaulov@yandex.ru
Поступила в редакцию 08.04.2019
После доработки 17.04.2019
Принята к публикации 22.04.2019
Аннотация
Рассмотрена возможность получения и переработки негорючих материалов на основе олигомерных и полимерных оксидов и их гибридов с органическими и элементорганическими соединениями при температурах в диапазоне 20–200 °С. Синтезированы неорганические термореактопласты с широким диапазоном температур текучести: 100–700 °С. При более интенсивной термообработке возможно получение огнеупорных материалов. Изучены литьевые полимер-полимерные смеси неоргано/органических полимеров, полученных при смешении их расплавов. Определены области возможного применения армированных материалов на основе неорганических и гибридных пропиточных композиций.
В основе абсолютного большинства широко используемых неметаллических материалов лежат в основном три класса полимеров: полиуглеводороды, элементоорганические полимеры, состоящие из неорганического каркаса, обрамленного углеводородными радикалами, и неорганические высокомолекулярные соединения, не содержащие углеводородных групп. В качестве четвертого класса можно рассматривать гибридные полимеры – сополимеры углеводородов и неорганических соединений.
Каждый из этих классов полимеров обладает определенными преимуществами и недостатками. Органическим полимерам присущи низкие температуры синтеза и переработки, высокая деформативность и наряду с этим горючесть, низкая термическая устойчивость, большие времена природной ассимиляции (50–600 лет), необходимость использования органических растворителей. Следствием этого являются значительные человеческие и материальные потери, связанные с горючестью материалов, необходимость утилизации отходов изделий после их эксплуатации, экологические проблемы, возникающие при использовании органических растворителей.
Широкое применение неорганических полимеров возвратит нас к природным материалам и избавит от некоторых проблем, связанных с применением органических пластмасс. Неорганические полимеры, к которым можно отнести моноэлементные полимеры (Cn, Sin, Gen, Pn, Bn, Asn, Sbn, Bin, Ten, Sen, Sn), полиоксиды, бориды, нитриды, силициды, карбиды, фосфиды, халькогены (S, Se, Te) и их сополимеры, являются высокотермостойкими хрупкими материалами, для абсолютного большинства которых требуются высокие температуры синтеза и переработки. К неорганическим полимерам можно также отнести фторуглеродные полимеры как соединения, не содержащие углеводородных групп [1, 2].
Наибольший интерес с точки зрения условий синтеза, наличия широкого спектра практически важных свойств и возможности широкого использования вызывают полиоксиды (силикаты, фосфаты, алюминаты бораты, германаты, титанаты) и их сополимеры (кислородная керамика), составляющие до 80% земной коры. Они не подвержены окислению, негорючи, обладают высокой термической и радиационной устойчивостью, отличаются отсутствием летучих продуктов при термической деструкции и чрезвычайно низкой упругостью паров расплавов. Кроме того, полиоксиды – это неограниченные сырьевые ресурсы.
Сравнивая свойства столь различных высокомолекулярных соединений, представляется заманчивым поиск компромиссного решения – получения материалов с преимуществами обоих классов полимеров: низкими температурами синтеза и переработки в сочетании с негорючестью, термо- и радиационной устойчивостью, экологической безопасностью. Примером таких материалов могут служить неорганические термореактопласты и их сополимеры с углеводородами, обладающие температурами размягчения (Тразм) и текучести (Ттек), близкими к значениям для органических полимеров, синтез которых возможен при “органических” температурах (20–250 °С).
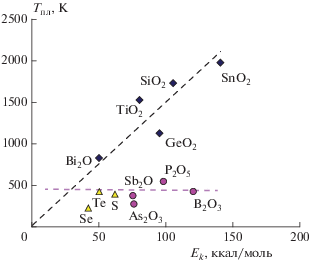
Исходя из того, что столь низкие температуры фазовых переходов не характерны для неорганических полимеров, осуществлен поиск тех типов полимеров, высокоэластическое состояние которых возможно при относительно низких температурах, близких к соответствующим значениям для органических полимеров. В качестве критерия использовали зависимость температуры плавления полимера от энергии химической связи составляющих его атомов (рис. 1). Проведенный анализ позволил выделить три типа “низкоплавких” полимеров: полиоксиды бора, полифосфаты, линейные моноэлементные полимеры – халькогены (S, Se, Te).
В качестве объектов исследования были использованы олигомерные оксиды бора, фосфора, кремния и их производные как соединения, обладающие температурами фазовых переходов, близкими к таковым для полиуглеводородов. В процессе синтеза применяли водные растворы кислот, солей, гидроксидов, оксогидроксидов и оксохлоридов различных элементов, а при формировании материалов – традиционные технологии переработки пластмасс.
Олигомерные оксиды как продукты неполного превращения обладают еще одной особенностью: они содержат значительное число химически активных гидроксильных групп, способных к образованию прочных водородных связей. Это позволяет синтезировать не только ковалентные гибридные полимеры с органическими и элементорганическими соединениями, но и супрамолекулярные поликомплексы.
Другой особенностью неорганических полимеров, практически не встречающейся в полиуглеводородах, является возможность образования планарных (2D) структур, обладающих свойствами, отличающимися от линейных и пространственно-сшитых полимеров. К таковым относятся, в частности, полиоксиды бора, состоящие из макроциклов бороксольных колец – структурных аналогов бензольного кольца.
Полиоксиды бора
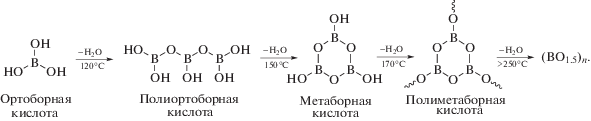
Синтез полиоксидов бора (ПОБ) осуществляется путем поликонденсации ортоборной кислоты и проходит через стадию образования $\beta $-формы метаборной кислоты – олигомера, состоящего из нескольких соединенных между собой шестичленных бороксольных циклов. Конечным продуктом поликонденсации борной кислоты является “борный ангидрид” с температурой стеклования Тg = = 305 °С [3]. Идеальная структура полимера представляет собой планарную макромолекулу, состоящую из макроциклов бороксольных колец [4]:
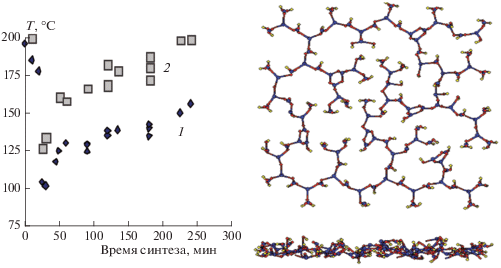
Нами изучены условия синтеза полиоксидов бора с различными температурами размягчения (Тразм) и текучести (Ттек) и рассчитаны их структуры. Полученные зависимости значений Тразм и Ттек при заданной температуре от времени реакции позволяют выбрать условия синтеза полимера с необходимыми технологическими параметрами (рис. 2).
Рис. 2.
Зависимость температуры размягчения (1) и текучести (2) ПОБ от времени синтеза (Т = 220 °С) и структура полиоксида (справа).
Металлофосфаты
Металлофосфаты представляют собой водорастворимые олигомерные продукты химического взаимодействия гидроксидов различных металлов и фосфорной кислоты (Т = 90–800 °С). Общая схема их синтеза соответствует уравнению
Алюмо- и алюмохромофосфаты являются промышленными продуктами в форме водных растворов. Химическая модификация и отверждение их проводятся с помощью оксидов и гидроксидов металлов, медленно растворяющихся в их растворах, продуктов гидролиза солей, оксохлоридов металлов [5].
Соли одновалентных металлов поликремневой кислоты (“жидкие стекла”)
Наиболее широко используются натриевые и калиевые производные этих водорастворимых олигомеров кремнезема [6]. Синтез “жидких стекол” (силикатов) проводится при взаимодействии кремнезема с гидроксидами или солями одновалентных металлов при Т = 1000–1300 °C. Мольное соотношение SiO2/M2O для натриевых и калиевых стекол составляет соответственно 2.3–3.0 и 2.8–4.0. Это соотношение определяет долю свободных гидроксильных групп полиоксида кремния, которые могут быть введены в химическое или физическое взаимодействие:
Оксихлориды металлов
Водорастворимые олигомерные комплексы оксогидроксидов металлов с хлором в качестве противоиона:
могут быть использованы для синтеза неорганических сополимеров с другими типами полиоксидов, содержащих гидроксильные группы.
Поликонденсация и модификация олигомерных оксидов
Возможность поликонденсации и модификации полиоксидов определяется остаточными гидроксильными группами, способными не только вступать в химическое взаимодействие, но и образовывать прочные водородные связи, оказывающие существенное влияние на релаксационные свойства полимеров. Наличие их и высокая полярность химических связей предопределяют и низкую гидролитическую устойчивость полиоксидов с недостаточной глубиной превращения.
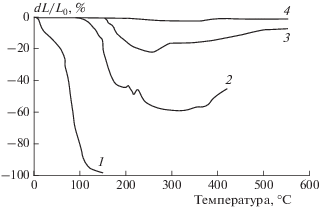
При поликонденсации и химической модификации олигомерных оксидов традиционно используются гетерогенные композиции химически активных окислов. Наряду с этим возможны также гомогенные смеси различных олигомерных оксидов и оксохлоридов, позволяющие синтезировать при относительно низких температурах (<200 °С) термопластичные и водоустойчивые полимеры с температурой текучести от 150 до 800 °С и более. Примером могут служить продукты взаимодействия алюмофосфата (АФС) с оксихлоридом алюминия (ОХА), рис. 3.
Рис. 3.
Термомеханические свойства продуктов взаимодействия АФС с оксихлоридом алюминия: 1 – АФС/30 мас.% ОХА (130 °С), 2 – АФС/30мас.% ОХА (180 °С), 3 – АФС/30 мас.% ОХА (200 °С), 4 – АФС/ 40 мас.%. ОХА (200 °С).
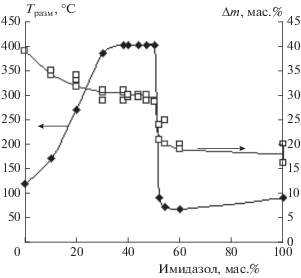
В качестве другого способа регулирования свойств полиоксидов можно использовать способность гидроксильных групп полиоксидов к образованию донорно-акцепторных связей с атомами азота аминов. На примере полиоксида бора показана возможность регулирования процесса поликонденсации гидрооксидов бора за счет блокирования групп В–ОН атомами азота имидазола [7] и п-фенилендиамина [8] (рис. 4), а следствием взаимодействия группы Р–ОН алюмофосфата с первичными аминами является образование поликомплексов с более высокими температурами размягчения.
Рис. 4.
Зависимость температуры размягчения и потери массы смесей борная кислота/имидазол от состава (Т = 220 °С, время реакции – 3 ч).
На примере алюмофосфата и девяти различных аминов с использованием квантовохимических расчетов показано, что энергия взаимодействия молекул воды со звеньями алюмофосфата существенно меньше, чем с аминами, что предопределяет возможность их вытеснения с “поверхности” молекулы алюмофосфата при суммарном энергетическом выигрыше от 9.6 ккал/моль для анилина до 27.6 ккал/моль для полиэтиленполиамина. Образование аналогичных донорно-акцепторных связей отмечено также при совместной полимеризации борной кислоты и капролактама [9].
Новый класс олигомеров
Проведенные синтезы широкого круга короткоцепных полиоксидов и возможность получения из них функциональных материалов, а также литературный анализ публикаций по синтезу низкоплавких неорганических стекол позволяют провести обобщение и рассмотреть их как новый перспективный класс олигомеров. Продукты их поликонденсации и химической модификации можно использовать не только как неорганические и гибридные блочные полимеры и связующие, но и как компоненты смесевых композиций с органическими и элементорганическими низко- и высокомолекулярными соединениями. Основными типами олигомерных полиоксидов являются боратные, фосфатные, силикатные, свинцовые, висмутовые, ванадиевые, оксифторидные и фторидные соединения, содержащие в качестве основных элементов B, P, Mg, Zn, Са, Sn, Pb, F, Bi, V, Mn. Диапазон температур размягчения олигомеров составляет 50–250 °C, и при дальнейшей термической обработке он может быть значительно увеличен.
Армированные композиты
Полученные композиции на основе олигомерных оксидов и гибридных полимер-полимерных связующих позволили провести разработку негорючих армированных композитов с использованием широкого спектра тканей на основе стеклянных, базальтовых, углеродных и целлюлозных волокон. Измерены термические и механические свойства, кислородный индекс, водостойкость композитов. Определены оптимальные соотношения связующего и наполнителя и рассмотрены возможные технологии получения композитов [10, 11]. На основе разработанных составов получены тонкостенные листовые материалы толщиной 1–3 мм с термостойкостью более 800 °С, не выделяющие при термическом воздействии продуктов деструкции, причем прочность на изгиб некоторых из них достигает значений, характерных для высокопрочных сплавов алюминия. Обозначены области применения разработанных материалов [12–14].
Полимер-полимерные смеси
Способность олигомерных оксидов к переходу в вязкотекучее состояние и их температуры размягчения и текучести, близкие к значениям для полиуглеводородов, открывают перспективу получения нового типа композитов путем смешения расплавов органических и неорганических полимеров [15–18]. Такие композиции позволяют существенно уменьшить сдвиговые усилия, необходимые при экструзионном смешении полимеров, тем самым повышая степень наполнения, достигающую 90 об.% (“модель размягчающегося наполнителя”). Такой подход также дает возможность проведения синтеза гибридных полимеров в расплавах с использованием экструдера в качестве реактора.
Изучены литьевые смеси полиоксида бора с полиэтиленом (ПЭ) [19], полипропиленом (ПП), сополимером этилена с винилацетатом (СЭВА) [20], фторуглеродными полимерами [21]. Одним из важных результатов является обнаруженная возможность смешения столь разных по природе полимеров на нано- и молекулярном уровнях (табл. 1) [22, 23]. Другим доказательством, указывающим на высокий уровень смешения компонентов, является образование прозрачных в видимой области спектра образцов смесей полиоксидов бора с ПЭ, ПП и СЭВА, а также продуктов поликонденсации борной кислоты с аминами (рис. 5).
Рис. 5.
Фотографии пластин из смесей ПП/ПОБ 57/ 43 мас.%, ПЭНП/ПОБ 47/53 мас.% (верхний образец слева), СЭВА/ПОБ 80/20 мас.% и продукта совместной полимеризации капролактама и борной кислоты 30/70 об.% (надпись расположена под пластиной, толщина пластины – 2 мм).

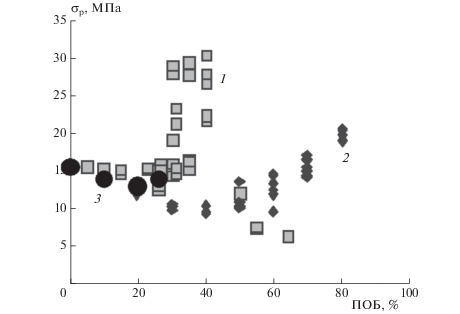
При исследовании полимер-полимерных смесей обнаружен ряд интересных особенностей. Так, в расплавах смесей ПОБ с полиэтиленом низкой плотности (ПЭНП) – алкатеном наблюдалось аномальное увеличение скорости движения расплавов при введении ПОБ, а в литьевых образцах – фибриллообразование, сопровождающееся аномальным увеличением прочности при растяжении в 2 раза (рис. 6) и модуля упругости в 15 раз, при отсутствии аналогичных изменений в смесевых композициях смесей других несмешивающихся полимеров ПЭ/полиметилметакрилат (ПММА). Полученные результаты объяснены ориентацией полиоксида в потоке расплава, связанной с его планарной структурой [24].
Рис. 6.
Зависимость прочности при растяжении σр композитов ПЭНП/ПОБ (1) ПЭНП/ПММА (2) и ПЭНП/TiO2 (3) от их состава.
Увеличение прочности гибридных композитов с ростом содержания неорганического компонента также наблюдалось в случае смесей ПОБ с СЭВА [20]. Показано, что аномальная реология смесей ПОБ с ПЭНП и бората алюминия с ПП, уменьшение вязкости расплава при введении более вязкого компонента и падение вязкости расплавов смесей ниже значений вязкости обоих компонентов также объясняются планарной структурой полиоксида бора [25].
Термостойкость полимер-полимерных смесей
Наличием химически активных гидроксильных групп полиоксидов объясняет увеличение термостойкости органических полимеров в смесевых композициях за счет их взаимодействия с гидроперекисями, неизбежно образующимися в процессе деструкции углеводородов. В работе [19] показано, что в смесевых композициях ПЭ с полиоксидами бора наблюдается повышение термоокислительной стабильности ПЭ (на 114 °С при содержании полиоксида 25 мас.%), сопровождающееся изменением направления реакций деструкции полимера. Увеличение термостойкости обнаружено и в смесях сополимера этилен/тетрафторэтилен Tefzel ETFE 207 c алюмофосфатом (на 77.9 °С при содержании фосфата 40 мас.%).
В работе [26] обнаружен эффект низкотемпературной (Т = 200 °С) карбонизации полиспиртов в композициях с ПОБ, где полиоксид выступает в качестве высокотемпературного антиоксиданта [26], как и в смесях с ПЭ, а в [19] рассмотрен механизм процесса [19]. Следует отметить, что термостойкость гибридных полимеров и композитов можно рассматривать как новую область исследований для получения негорючих материалов, которая позволит найти оптимальные композиции, сочетающие полиоксиды с традиционными антиоксидантами, применяемыми в органических полимерах. Интересен возможный эффект синергизма.
Гибридные полимеры
Высокая химическая активность гидроксильных групп полиоксидов позволяет осуществлять реакции с широким кругом органических соединений. В качестве примера использована реакция борной кислоты с олигомерной метилолполиамидной смолой. Установлено, что температура размягчения гибридного полимера превышает значение ее для термически отвержденной исходной смолы на 35 °С.
Особый интерес вызывает возможность синтеза элементорганических гибридных полимеров, позволяющих в еще большей мере, по сравнению с полимерами на основе неорганических соединений с углеводородами, уменьшить содержание углеводородных групп. Объектом исследования служила синтезированная низковязкая гибридная смола – продукт взаимодействия олигомера оксида бора и кремнийорганического олигомера Nik 892 [СН3SiO0.75(СН3О)1.5]n при мольном соотношении 1/0.37. Смола в зависимости от температуры отверждения (50–150 °С) образует прозрачные, водоустойчивые полимеры с Тразм = 300–450 °С, термостойкостью до 501 °С (потеря массы составляет 5%) и кислородным индексом КИ = 81 [27].
Гибридные поликомплексы получены при взаимодействии алюмофосфата с азотсодержащими соединениями: анилином [28], п-фенилендиамином [8], гексаметилендиамином и пентиламином [29]. Образование прочных водородных связей фосфатных групп алюмофосфата с аминами указывает на возможность получения супрамолекулярных структур – поликомплексов с более высокой температурой размягчения и влагоустойчивостью. Квантовохимические расчеты и компьютерное моделирование структуры позволили рассчитать энергию и определить “контактные точки” взаимодействия. Энергия водородных связей Р–ОН…N–, длина которых составляет 0.15–0.18 нм, лежит в диапазоне 13–17 ккал/моль.
Деформационные свойства
Фундаментальной проблемой, возникающей при использовании неорганических полиоксидов как жесткоцепных высокомолекулярных соединений, является увеличение деформационной способности. Рассматривая полиоксиды как термопласты, следует иметь в виду, что этот термин означает лишь то, что соединение способно переходить в высокоэластичное состояние, и не связан с деформацией полимера в твердом состоянии. Проблема увеличения деформации материалов на основе полиоксидов остается нерешенной.
Низкая деформация полиоксидов определяется высокой энергией внутренних взаимодействий (включающей энергию каждой связи), валентностью элементов и дипольными взаимодействиями фрагментов цепей. Это означает, что пластификации могут быть подвергнуты лишь олигомерные полиоксиды с последующей их поликонденсацией. В качестве пластификаторов полиоксидов могут быть использованы органические соединения, но при этом следует иметь в виду возможность снижения термо- и теплостойкости материала. К настоящему времени неизвестны неорганические пластификаторы полиоксидов, но решение задачи не представляется экспериментально бесперспективным.
Рассматривая корреляцию между деформационными свойствами полимера и его температурой текучести, можно предположить, что уменьшение значения Ттек должно сопровождаться ростом деформации при нагружении. Такой результат получен. Так, при введении в матрицу силиката натрия кластерного соединения (Et3NH)2[BnRn], разлагающегося в щелочной среде с образованием газообразного амина и фуллереноподобного трехмерного кластерного аниона бора [BnRn]2– (n = 10, 12, R=H, Cl), при содержании [B10H10]2–, составляющем 1.8 мас.%, Тразм уменьшается на 30 °С [30]. Очевидно, что решение проблемы связано с поиском совместимой пары полиоксид/низкомолекулярное неорганическое соединение. В связи с этой задачей интересны расчеты структуры сферических образований, которые можно рассмотреть с точки зрения возможного применения в качестве неорганических пластификаторов [31].
Горючесть полиоксидов и гибридных полимеров
Полиоксиды как окисленная форма элементов относятся к классу “НГ” и при “пожарных” температурах (800–900 °С) не выделяют летучих продуктов деструкции. Наряду с этим фторуглероды, не содержащие углеводородных групп, подвержены окислению при Т > 400 °С. Смеси с органическими полимерами при содержании полиоксида около 70 мас.% являются трудногорючими и не распространяющими пламя материалами с КИ = 80–90. Такой подход является новым при получении трудногорючих и негорючих материалов без использования антипиренов.
Работа выполнена в рамках госзадания Министерства образования и науки России (тема 45.11, 0082-2014-0009, № АААА-А17-117040610309-0).
Список литературы
Shaulov A.Yu., Berlin A.A. // Additives in Polymers. Analysis and Applications / Ed. Berlin A.A., Rogovina S.Z., Zaikov G.E. Boca Raton: CRC, 2015. P. 364; Hard ISBN 978177188128
Shaulov A.Yu. // Modern Concepts Mater. Sci. 2019. V. 1. № 1; MCMS.MS.ID.000505
Poch W. // Glastech. Ber. 1964. V. 37. № 12. P. 533.
Zachariasen W.H. // Acta Crystallogr. 1963. V. 16. Pt. 5. P. 380, 385.
Голынко-Вольфсон С.Л., Сычев М.М., Судакас Л.Г., Скобло Л.И. Химические основы технологии и применения фосфатных связок и покрытий. Л.: Химия, 1968.
Корнеев В.И., Данилов В.В. Растворимое жидкое стекло. М.: Стройиздат, 1996.
Нечволодова Е.М., Грачев А.В., Сакович Р.А., Владимиров Л.В., Шашкин Д.П., Ткаченко Л.А., Шаулов А.Ю., Берлин А.А. // Хим. физика 2017. Т. 36. № 9. С. 66.
Нечволодова Е.М., Сакович Р.А., Грачев А.В., Глаголев Н.Н., Мотякин М.В., Шаулов А.Ю., Берлин А.А. // Хим. физикa. 2017. Т. 36. № 5. С. 82.
Шаулов А.Ю., Скачкова В.К., Саламатина О.Б., Руднев С.Н., Щеголихин А.Н., Ломакин С.М., Айххофф У., Штоернагель Ш., Самойленко А.А., Берлин А.А. // Высокомолекуляр. соединения. А. 2006. Т. 48. С. 397.
Шаулов А.Ю., Лалаян В.М., Стегно Е.В., Грачев А.В., Берлин А.А. // Все матер. Энцикл. справочник. 2019. № 6 (в печати).
Лалаян В.М., Стегно Е.В., Грачев А.В., Шаулов А.Ю., Берлин А.А. // Там же. № 7 (в печати).
Шаулов А.Ю., Лалаян В.М., Грачев А.В., Нечволодова Е.М., Ткаченко Л.А. Берлин А.А. Патент РФ 117357 //Б.И. 2012. № 18.
Шаулов А.Ю., Лалаян В.М., Стегно Е.В., Грачев А.В. Патент РФ 2655139 // Офиц. бюлл. ФИПС “Изобретения. Полезные модели”. 2017. № 7.
Шаулов А.Ю., Лалаян В.М., Грачев А.В., Нечволодова Е.М., Ткаченко Л.А., Берлин А.А. Патент РФ 2493966 // Б.И. 2013. № 27.
Ray N., Sherliker F. US Patent 3,732,181. 1973.
Shaulova A.B., Shaulov A.Yu., Shalumov B.Z. // Proc. Intern. conf. “Eurogel.” Saarbruken, Germany, 1991.
Шаулова А.Б., Шаулов А.Ю., Шалумов Б.З. Патент РФ 2048488 // Б. И. 1995. № 32.
Urman K., Otaigbe J.U. // Prog. Polym. Sci. 2007. V. 32. P. 1462.
Шаулов А.Ю., Ломакин С.М., Рахимкулов А.Д., Коверзанова Е.В., Глушенко П.Б., Щеголихин А.Н., Шилкина Н.Г., Берлин А.А. // ДАН. 2004. Т. 398. № 3. С. 361.
Стегно Е.В., Лалаян В.М., Грачев А.В., Владимиров Л.В., Нелюб В.А., Шаулов А.Ю., Берлин А.А. // Все матер. Энцикл. справочник. 2018. № 5. С. 2.
Лалаян В.М., Стегно Е.В., Грачев А.В., Игнатьева Л.Н., Гончарук В.К., Шаулов А.Ю., Берлин А.А., Бузник В.М. // ДАН. 2016. Т. 468. № 6. С. 648.
Шаулов А.Ю., Алиев И.И., Люмпанова А.Ю., Зар-хина Т.С., Барашкова И.И., Вассерман А.М., Берлин А.А. // Там же. 2007. Т. 413. № 2. С. 210.
Чалых А.Е., Герасимов В.К., Алиев А.Д., Люмпанова А.Ю., Шаулов А.Ю., Берлин А.А. // Там же. 2008. Т. 423. № 2. С. 198.
Stegno E.V., Lalayan V.M., Berezkina N.G., Grachev A.V., Shaulov A.Yu., Berlin A.A., Patlazhan S.A. // Polym. Compos. 2019. V. 40. P. 916; https://doi.org/10.1002/pc.24761
Ilyin S.O., Malkin A.Y., Kulichikhin V.G., Shaulov A.Yu., Stegno E.V., Berlin A.A., Patlazhan S.A. // Rheol. Acta. 2014. V. 53. № 5–6. P. 467.
Ломакин С.М., Шаулов А.Ю., Коверзанова Е.В., Усачев С.В., Шилкина Н.Г., Берлин Ал.Ал. // Хим. физика. 2019. Т. 38. № 4. С. 1.
Лалаян В.М., Стегно Е.В., Никитин А.В., Самойленко А.А., Грачев А.В, Хазанов И.И., Шаулов А.Ю., Копылов В.М., Берлин А.А. // Высокомолекуляр. соединения. Б. 2015. Т. 57. № 1. С. 26.
Шаулов А.Ю., Нечволодова Е.М., Сакович Р.А., Владимиров Л.В., Грачев А.В., Ткаченко Л.А. // Хим. физика. 2019. Т. 31. № 1. С. 76.
Нечволодова Е.М., Сакович Р.А., Грачев А.В., Ткаченко Л.А., Шаулов А.Ю. // Хим. физика. 2020 (в печати).
Скачкова В.К., Малинина Е.А., Гоева Л.В., Грачев А.В., Авдеева В.В., Шаулов А.Ю., Берлин А.А., Кузнецов Н.Т. // Матер. XII Междунар. конф. по химии и физикохимии олигомеров. Черноголовка: ИПХФ РАН, 2017. Т. 2. С. 96.
Ивановская В.В., Ивановский А.Л. // Наноструктуры. Мат. физика и моделиров. 2009. № 1. С. 7.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика