Химическая физика, 2020, T. 39, № 10, стр. 3-8
Диссоциация фенилацетилена и его производных электронным ударом
Ю. А. Дьяков 1, *, А. А. Пузанков 2, С. О. Адамсон 1, Г. В. Голубков 1, 3, И. И. Морозов 1, О. А. Ольхов 1, В. Л. Шаповалов 1, Д. В. Шестаков 1, М. Г. Голубков 1
1 Федеральный исследовательский центр химической физики
им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Национальный Тайбэйский университет по уходу за больными и науке о здоровье
Тайбэй, Тайвань
3 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: yuri_dyakov@mail.ru
Поступила в редакцию 07.05.2020
После доработки 07.05.2020
Принята к публикации 20.05.2020
Аннотация
Фенилацетилен и его химически активный изомер пентален играют важную роль в процессах образования и разрушения полиароматических углеводородов – основных компонентов микрочастиц сажи, образующихся в процессе сгорания органического топлива и являющихся наиболее опасными для здоровья человека антропогенными аэрозольными загрязнителями атмосферы. Рассмотрены вероятные механизмы распада фенилацетилена и его изомеров при ионизации электронным ударом. Показано, что потеря электронов в процессе ионизации изменяет свойства ароматичности/антиароматичности фенилацетилена и его изомеров на противоположные.
1. ВВЕДЕНИЕ
Многочисленные исследования, проведенные в последние десятилетия, доказывают, что бурный рост числа респираторных и онкологических заболеваний, особенно в крупных городах, вызван загрязнением атмосферы микрочастицами сажи и других биологически активных соединений. При этом наиболее опасными для организма являются частицы с размером менее 2.5 мкм. Они беспрепятственно проникают через стенки капилляров легких в кровь и воздействуют на все органы и ткани человека [1, 2]. Микрочастицы сажи состоят в основном из смеси полиароматических углеводородов (ПАУ), образующихся при сжигании органического топлива. Причем чем меньше их размер, тем сильнее потенциальное воздействие на организм.
Микрочастицы сажи также интенсивно взаимодействуют с другими веществами, содержащимися в атмосфере, вызывая образование ядовитых веществ, смога, тумана и др. Это, в свою очередь, является одним из факторов, мешающих работе глобальных навигационных спутниковых систем [3, 4], и создает проблемы для пассивной спутниковой локации поверхности Земли [5].
Важнейшая стадия синтеза и разрушения ПАУ – образование пяти- и шестизвенных фрагментов ароматических молекул, являющихся либо радикалами, либо антиароматическими соединениями, свойства которых подчиняются правилу Хюккеля и число π-электронов у которых равно 4n, где n – любое натуральное число. Они химически очень активны и запускают цепочки дальнейших превращений, приводящих в конечном итоге к синтезу различных вредных для здоровья веществ. В последние годы было проведено большое количество теоретических и экспериментальных исследований, доказывающих ключевую роль данного механизма в реакциях синтеза и разрушения ненасыщенных углеводородов, в частности ПАУ [6–12].
Одним из наиболее известных веществ, ответственных за образование сажевых частиц в процессе горения органического топлива, является фенилацетилен. Он представляет собой стабильный ароматический углеводород C8H6, содержащий бензольное кольцо с ацетиленовым фрагментом вместо одного из атомов водорода. Бензольное кольцо содержит шесть π-электронов, т.е. эта молекула соответствует критерию Хюккеля для химически стабильных ароматических соединений: число π-электронов должно быть равно 4n + 2. В случае фенилацетилена n = 1. Это вещество широко используется в химической и фармацевтической промышленности. Фотохимические свойства фенилацетилена рассматривались в работе [13]. В атмосфере он в значительном количестве присутствует в сажевых микрочастицах. В промежуточных реакциях синтеза и разрушения ПАУ фенилацетилен, как правило, не участвует, но легко преобразуется в химически нестабильные и крайне активные бензоциклобутадиен и пентален [14]. Последний представляет собой типичный антиароматический углеводород с числом π-электронов, равным 8 (4n, n = 2), который участвует в большинстве промежуточных реакций образования ПАУ [7–10].
В процессе ионизации высокоэнергетическими электронами и ионами либо при сильном нагреве (горении) или облучении ПАУ ультрафиолетом фенилацетилен теряет электроны и из ароматического соединения превращается в антиароматическое. При этом наиболее химически стабильным изомером становится уже пентален, хотя в реакциях его распада ввиду специфического профиля поверхности потенциальной энергии (ППЭ) ключевую роль продолжает играть ион фенилацетилена [14]. Другими словами, реакция диссоциации разбивается на два этапа: на первом этапе происходит отрыв молекулы ацетилена с образованием фрагмента ${{{\text{C}}}_{{\text{8}}}}{\text{H}}_{{\text{6}}}^{ + }$ или его изомеров, а на втором – распад самого этого фрагмента. Процессы распада фенильного радикала, его ионов и их производных рассматривались ранее в работах по фотодиссоциации малых ароматических молекул [15–24].
В настоящей работе подробно рассмотрены реакции, протекающие с участием фенилацетилена и основных его изомеров после ионизации электронным ударом. Проведен анализ теоретически предсказанных масс-спектров их катионов и дикатионов. Указаны основные элементарные фотохимические процессы, приводящие к формированию соответствующих масс-спектров.
2. МЕТОДИКА РАСЧЕТОВ
Оптимизация геометрии поверхностей потенциальной энергии ионов и образующихся фрагментов была осуществлена методом B3LYP/6-31G*. Затем энергии в точках минимумов и максимумов были пересчитаны с помощью метода G3(MP2,CCSD) [25, 26]. Величины энергий нулевых колебаний были использованы без корректирующего коэффициента. Константы скоростей реакций и конечный выход продуктов были рассчитаны с помощью статистического метода Райса–Рамспергера–Касселя–Маркуса (РРКМ) [27] и микроканонического метода вариационного переходного состояния [28]. Квантовохимические расчеты выполнены с помощью пакета программ GAUSSIAN 09 [29]. Практическое применение метода РРКМ и метода вариационного переходного состояния для каскадной диссоциации молекул подробно описано в работах [30–35].
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
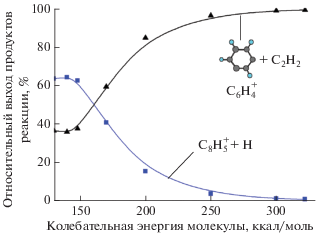
На рис. 1 показана упрощенная схема реакции диссоциации катиона фенилацетилена, на основании которой был рассчитан выход конечных продуктов. Реакции отрыва атома водорода от фенилацетилена и молекулы ацетилена от фрагмента ${{{\text{C}}}_{{\text{8}}}}{\text{H}}_{{\text{6}}}^{ + }$ на конечном этапе являются безбарьерными. Вероятность протекания этих реакций рассчитывалась по теории вариационного переходного состояния [28]. Предварительные оценки показали, что в случае, если реакция распада начитается с пенталена, практически единственным ее каналом является образование ацетилена, так как высоты энергетических барьеров между бензоциклобутадиеном и фенилацетиленом относительно велики, а безбарьерная реакция по каналу вариационного переходного состояния ВПС1 протекает достаточно быстро. Поэтому здесь мы не рассматриваем этот процесс. Кроме того, фенилацетилен является стабильным нейтральным изомером, и при его возбуждении электронным ударом или другим видом высокоэнергетического воздействия реакция распада начнется именно с него.
Рис. 1.
Упрощенная принципиальная схема реакции диссоциации катиона фенилацетилена. Представлены три основных изомера и промежуточные минимумы (интермедиаты). Стрелками обозначены переходные состояния (ПС) и вариационные (безбарьерные) переходные состояния (ВПС). Энергии (цифры на схеме) даны в ккал/мол. Курсивом указаны высоты барьеров, обычным шрифтом – энергии минимумов ППЭ. Параметр m/z на схеме есть отношение массы молекулы к ее заряду (в а. е.). В случае однократно ионизированных фрагментов z = 1. В правой части рисунка даны значения энергии для трех изомеров ${{{\text{C}}}_{8}}{\text{H}}_{5}^{ + }.$
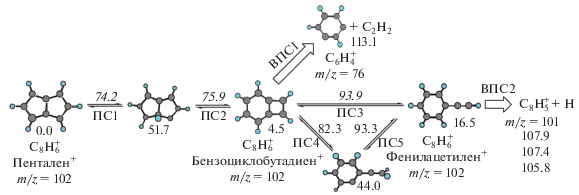
На рис. 2 показан относительный выход продуктов диссоциации катиона фенилацетилена, а на рис. 3 – масс-спектр фенилацетилена, полученный после воздействия электронным ударом и взятый из базы данных NIST Chemistry Webbook. Видно, что при низких значениях внутренней колебательной энергии молекулы основным каналом реакции является отрыв атома водорода, дающий фрагмент ${{{\text{C}}}_{{\text{8}}}}{\text{H}}_{{\text{5}}}^{ + }$ с отношением массы к заряду m/z = 101 (см. рис. 2). При высоких значениях внутренней энергии интенсивность этого канала падает и основной становится реакция образования ацетилена и фрагмента ${{{\text{C}}}_{{\text{6}}}}{\text{H}}_{{\text{4}}}^{ + }$ (m/z = 76).
Рис. 3.
Масс-спектр фенилацетилена, взятый из базы данных NIST Chemistry Webbook (https://webbook.nist.gov/chemistry).
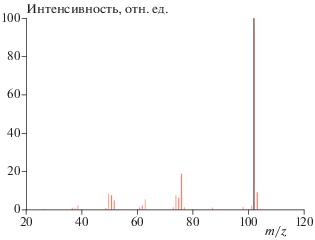
На масс-спектре (см. рис. 3) линия при m/z = 101 практически отсутствует. При этом количество нераспавшегося фенилацетилена (m/z = 102) велико. Это означает, что количество получаемой при электронном ударе внутренней энергии не превосходит 120 ккал/моль, поскольку значение энергии активации процесса диссоциации данного иона лежит в диапазоне 110–120 ккал/моль. Причем энергии, полученной при электронном ударе, едва хватает на диссоциацию исходных катионов (m/z = 102). В противном случае они распались бы все. Вероятность того, что все эти фрагменты претерпели вторичный распад (и из-за этого линия m/z = 101 отсутствует), крайне мала, поскольку хорошо известно (см., например, [6–9, 11–13]), что энергии активации реакций вторичного распада данных фрагментов имеют величину, близкую к 100 ккал/моль.
Линии при m/z = 74, 75 и 76, напротив, являются достаточно интенсивными, а следовательно, канал образования ацетилена практически единственный. Этот факт плохо согласуется с предположением, что реакция происходит на нижнем электронном уровне однократно ионизованной молекулы. Однако линия с m/z = 63 – это фрагмент ${{{\text{C}}}_{{\text{5}}}}{\text{H}}_{{\text{3}}}^{ + },$ который, согласно работе [14] и предварительным расчетам, образуется после двукратного отщепления молекулы ацетилена от исходного катиона, что требует большого избытка имеющейся внутренней энергии. Линия с m/z = 50 соответствует фрагменту ${{{\text{C}}}_{{\text{4}}}}{\text{H}}_{{\text{2}}}^{ + },$ образующемуся после изомеризации фенилацетилена в пентален с последующим распадом.
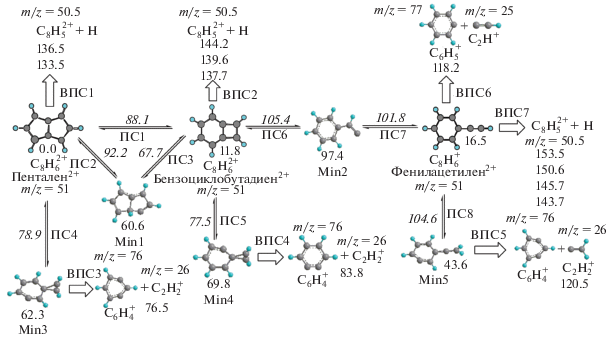
Таким образом, для корректного описания кинетики процессов, протекающих с участием фенилацетилена и его изомеров после ионизации электронным ударом, необходимо также включить в рассмотрение двукратно и трехкратно ионизованные молекулы. На рис. 4 приведена упрощенная схема диссоциации дикатионов данных соединений. Согласно эмпирическому правилу Хюккеля, потеря двух электронов (вероятнее всего, π-электронов) должна изменить свойства ароматичности или антиароматичности данных изомеров на противоположные относительно нейтральных молекул. Пентален в этом случае будет иметь 6π-электронов и станет ароматической молекулой. В то же время фенилацетилен потеряет два электрона и превратится в 4π-электронную антиароматическую систему, что видно из рис. 4. Пентален действительно становится самым энергетически стабильным соединением, тогда как энергия фенилацетилена на поверхности потенциальной энергии становится выше энергии пенталена на 16.5 ккал/моль, т.е. фенилацетилен стал проявлять антиароматические свойства. Энергетические барьеры реакций изомеризации между всеми изомерами становятся выше, чем при однократной ионизации, и сравнимы с барьерами на ППЭ нейтральных молекул [14]. При этом бензоциклобутадиен и пентален легко распадаются на фрагменты ${{{\text{C}}}_{{\text{6}}}}{\text{H}}_{{\text{4}}}^{ + }$ (m/z = 76) и ${{{\text{C}}}_{{\text{2}}}}{\text{H}}_{{\text{2}}}^{ + }$ (m/z = 26). При распаде фенилацетилена также возможно образование фрагментов ${{{\text{C}}}_{{\text{6}}}}{\text{H}}_{{\text{5}}}^{ + }$ (m/z = 75) и C2H+ (m/z = 25). Однако при рассмотрении реакций с участием дикатионов следует иметь в виду, что дважды ионизованные молекулы подвергаются внутреннему воздействию сильного электрического поля, усиливающего внутримолекулярное отталкивание. Реакции с участием дикатионов не всегда могут быть описаны равновесной статистической теорией РРКМ. Как показали предыдущие исследования двукратно и трехкратно ионизованных молекул [33–35], их распад происходит либо напрямую из высоколежащих возбужденных состояний, либо после релаксации в основное электронное состояние путем взрывообразного процесса (“кулоновского взрыва”).
Рис. 4.
Упрощенная принципиальная схема реакции диссоциации дикатиона фенилацетилена. Обозначения те же, что и для рис. 1. В случае однократно ионизированных фрагментов z = 1, при двукратной ионизации z = 2.
4. ЗАКЛЮЧЕНИЕ
Анализ ППЭ, приведенных в данной работе, и их сравнение с масс-спектром фенилацетилена, имеющимся в базе данных NIST Chemistry Webbook (см. рис. 3), позволяет утверждать, что масс-спектр фенилацетилена, полученный после воздействия электронным ударом, можно объяснить, учитывая процессы, протекающие с участием однократно, двукратно и трехкратно ионизованных молекул. Кроме того, не стоит исключать из рассмотрения прямой неравновесный распад высоковозбужденных электронных состояний [36], не описываемых теорией РРКМ и требующих дальнейшего и более детального изучения. Поэтому в данной работе при описании процессов распада дикатионной формы молекул мы не приводим количественные величины выхода продуктов реакции. Многие рассмотренные здесь процессы носят принципиально нестатистический характер и не могут быть описаны классической теорией РРКМ.
Важную роль в реакциях диссоциации однократно и двукратно ионизованных молекул фенилацетилена играют процессы изомеризации последнего в бензоциклобутадиен и пентален. В электрически нейтральной форме пентален имеет 8π-электронов (т.е. 4n, где n = 2), что, согласно эмпирическому правилу Хюккеля, делает его химически очень нестабильным антиароматическим соединением. Кольцевой фрагмент фенилацетилена имеет 6π-электронов (т.е. 4n + 2, где n = 1), поэтому он является стабильным ароматическим соединением. Бензоциклобутадиен проявляет промежуточные свойства, так как содержит одновременно и ароматическую, и антиароматическую части. При однократной, а тем более двойной ионизации потеря электронов изменяет свойства ароматичности/антиароматичности данных изомеров на противоположные. Поэтому важную роль в процессе диссоциации фенилацетилена после однократной и двойной ионизации начинают играть два других его изомера: пентален и бензоциклобутадиен. Вследствие этого реакции изомеризации между этими тремя изомерами практически полностью управляют процессами диссоциации в зависимости от величины внутренней колебательной энергии молекулы.
Если в будущем расширить круг изучаемых процессов, то в средней атмосфере следует также рассматривать реакции распада фенилацетилена за счет диссоциативной рекомбинации и фотодиссоциации [37]. При этом следует учитывать, что процессом диссоциативной рекомбинации можно управлять с помощью поля внешнего лазерного излучения [38–41].
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (регистрационный номер АААА–А19–119010990034–5).
Список литературы
Dockery D.W., Pope C.A., Xu X. et al. // New Engl. J. Med. 1993. V. 329. № 24. P. 1753.
Miller F.J., Gardner D.E., Graham J.A. et al. // J. Air Poll. Contr. Assoc. 1979. V. 29. № 6. P. 610.
Голубков Г.В., Манжелий М.И., Лушников А.А. // Хим. физика. 2014. Т. 33. № 7. С. 101.
Голубков Г.В., Манжелий М.И., Берлин А.А. и др. // Хим. физика. 2016. Т. 35. № 1. С. 5.
Голубков Г.В., Манжелий М.И., Берлин А.А. и др. // Хим. физика. 2018. Т. 37. № 7. С. 33.
Richter H., Howard J.B. // Phys. Chem. Chem. Phys. 2002. V. 4. № 11. P. 2038.
Dyakov Y.A., Ni C.K., Lin S.H. et al. // J. Phys. Chem. A. 2005. V. 109. № 39. P. 8774.
Dyakov Y.A., Ni C.K., Lin S.H. et al. // J. Chinese Chem. Soc. 2006. V. 53. № 1. P. 161.
Dyakov Y.A., Ni C.K., Lin S.H. et al. // Phys. Chem. Chem. Phys. 2006. V. 8. № 12. P. 1404.
Kislov V.V., Mebel A.M. // J. Phys. Chem. A. 2007. V. 111. № 38. P. 9532.
Ni C.K., Tseng C.M., Lin M.F. et al. // J. Phys. Chem. B. 2007. V. 111. № 44. P. 12631.
Lin M.F., Tseng C.M., Dyakov Y.A. et al. // J. Chem. Phys. 2007. V. 126. № 24. 241104.
Sorkhabi O., Qi F., Rizvi A.H. et al. // J. Amer. Chem. Soc. 2001. V. 123. № 4. P. 671.
Dyakov Y.A., Adamson S.O., Golubkov G.V. et al. // Proc. XIV Intern. Conf. Pulsed Lasers and Laser Applications. Proc. SPIE: Intern. Soc. Opt. Eng., 2019. V. 11322. 113221Q.
Dyakov Y.A., Bagchi A., Lee Y.T. et al. // J. Chem. Phys. 2010. V. 132. № 1. 014305.
Yang Y.L., Dyakov Y.A., Lee Y.T. et al. // J. Chem. Phys. 2011. V. 134. № 3. 034314.
Mebel A.M., Landera A. // J. Chem. Phys. 2012. V. 136. № 23. 234305.
Tseng C.M., Dyakov Y.A., Huang C.L. et al. // J. Chinese Chem. Soc. 2006. V. 53. № 1. P. 33.
Hsu H.C., Tsai M.T., Dyakov Y. et al. // Phys. Chem. Chem. Phys. 2011. V. 13. № 18. P. 8313.
Hsu H.C., Tsai M.T., Dyakov Y.A. et al. // Intern. Rev. Phys. Chem. 2012. V. 31. № 2. P. 201.
Zhao L., Kaiser R.I., Xu B. et al. // J. Phys. Chem. Lett. 2018. V. 9. № 10. P. 2620.
Dyakov Y.A., Mebel A.M., Lin S.H. et al. // J. Phys. Chem. A. 2007. V. 111. № 38. P. 9591.
Bagchi A., Dyakov Y.A., Ni C.K. // J. Chem. Phys. 2010. V. 133. № 24. 244309.
Dyakov Y.A., Tsai S.T., Bagchi A. et al. // J. Phys. Chem. A. 2009. V. 113. № 52. P. 14987.
Baboul A.G., Curtiss L.A., Redfern P.C. et al. // J. Chem. Phys. 1999. V. 110. № 16. P. 7650.
Curtiss L.A., Raghavachari K., Redfern P.C. et al. // Chem. Phys. Lett. 1999. V. 314. № 1–2. P. 101.
Eyring H., Lin S.H., Lin S.M. Basic Chemical Kinetics. New York: JohnWiley & Sons, 1980.
Steinfeld J.I., Francisco J.S., Hase W.L. Chemical kinetics and dynamics. Upper Saddle River: Prentice Hall, 1999.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Scalmani G., Barone V., Petersson G.A., Nakatsuji H., Li X., Caricato M., Marenich A.V., Bloino J., Janesko B.G., Gomperts R., Mennucci B., Hratchian H.P., Ortiz J.V., Izmaylov A.F., Sonnenberg J.L., Williams-Young D., Ding F., Lipparini F., Egidi F., Goings J., Peng B., Petrone A., Henderson T., Ranasinghe D., Zakrzewski V.G., Gao J., Rega N., Zheng G., Liang W., Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T., Throssell K., Montgomery J.A., Jr., Peralta J.E., Ogliaro F., Bearpark M.J., Heyd J.J., Brothers E.N., Kudin K.N., Staroverov V.N., Keith T.A., Kobayashi R., Normand J., Raghavachari K., Rendell A.P., Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Millam J.M., Klene M., Adamo C., Cammi R., Ochterski J.W., Martin R.L., Morokuma K., Farkas O., Foresman J.B., Fox D.J. Gaussian 09, Rev. A.02. Wallingford CT: Gaussian, Inc., 2009.
Sharifi M., Kong F, Chin S.L. et al. // J. Phys. Chem. A. 2007. V. 111. № 38. P. 9405.
Zyubina T.S., Dyakov Y.A., Lin S.H. et al. // J. Chem. Phys. 2005. V. 123. № 13. 134320.
Mebel A.M., Zyubina T.S., Dyakov Y.A. et al. // Intern. J. Quant. Chem. 2005. V. 102. № 5. P. 506.
Wang Q.Q., Wu D., Jin M.X. et al. // J. Chem. Phys. 2008. V. 129. № 20. 204302.
Wang Q.Q., Wu D., Jin M.X. et al. // J. Phys. Chem. C. 2009. V. 113. № 27. P. 11805.
Wang Q.Q., Dyakov Y.A., Wu D. et al. // Chem. Phys. Lett. 2013. V. 586. P. 21.
Голубков Г.В., Иванов Г.К., Голубков М.Г. // Хим. физика. 2005. Т. 24. № 9. С. 3.
Ivanov G.K., Golubkov G.V. // Z. Phys. D. 1986. V. 1. № 2. P. 199.
Голубков Г.В., Голубков М.Г., Романов А.Н. // ЖЭТФ. 2002. Т. 121. Вып. 3. С. 573.
Golubkov G.V., Golubkov M.G., Romanov A.N. et al. // Phys. Chem. Chem. Phys. 2003. V. 5. № 15. P. 3174.
Адамсон С.О., Бюнкер Р.Дж., Голубков Г.В. и др. // Хим. физика. 2009. Т. 28. № 4. С. 26.
Голубков Г.В., Голубков М.Г., Бюнкер Р.Дж. // ЖЭТФ. 2011. Т. 139. Вып. 2. С. 221.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика