Химическая физика, 2020, T. 39, № 10, стр. 40-46
Особенноси гидратации дихлоруксусной кислоты
Г. В. Карпов 1, Е. С. Васильев 1, Н. Д. Волков 1, И. И. Морозов 1, *, С. В. Савилов 2, О. А. Ольхов 1, В. Л. Шаповалов 1, Д. В. Шестаков 1
1 Федеральный исследовательский центр химической физики
им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: igormrzv@gmail.com
Поступила в редакцию 07.05.2020
После доработки 18.05.2020
Принята к публикации 20.05.2020
Аннотация
Методом электрораспыления водных растворов дихлоруксусной кислоты в вакуумную камеру масс-спектрографа установлена структура гидратированных ионов дихлоруксусной кислоты. При концентрации кислоты 0.01 моль/л количество гидратированных ионов монотонно уменьшается с увеличением степени их гидратации. Полученный масс-спектр дает информацию о распределении гидратированных ионов в растворе, что делает масс-спектрографический метод электорораспыления растворов электролитов в вакууме применимым для определения состава растворов электролитов в исследованиях окружающей среды.
1. ВВЕДЕНИЕ
Источниками галогенсодержащих соединений в окружающей среде могут быть как антропогенные, так и природные процессы [1]. Дихлоруксусная кислота (ДХК) является токсичным веществом, негативно воздействующим на окружающую среду [2]. Эта кислота и ее эфиры используют в качестве интермедиатов в органических синтезах. На ее основе получают глиоксиловую кислоту, диалкокси- и диарилоксикислоты, а также сульфамиды. Она находит применение в анализе лавсана и в качестве дезинфицирующего препарата вместо формалина. Эфиры ДХК находят применение в производстве антибиотиков, дихлорацетамида, для защиты сельскохозяйственных культур, а также в производстве красителей полимерных материалов [3]. Ее эфиры с глицерином и гликолем являются пластификаторами производных целлюлозы. Дихлоруксусная кислота находит применение в качестве полупродукта в органическом синтезе. Ее производные используются в производстве косметических и лекарственных средств [4].
В хлорированной воде было обнаружено большое количество ДХК [5]. Последствия проникновения ДХК в организм человека пока полностью не изучены, но есть предположения о ее негативном воздействии с возможными долгосрочными последствиями [6–8]. К тому же в настоящее время имеются недостаточно полные данные о предельно допустимых концентрациях изучаемых веществ в атмосферном воздухе, в водах хозяйственно-питьевого назначения, а также в воде рыбохозяйственных водоемов, что дает основание сомневаться в их достоверности [9]. Дихлоруксусная кислота обладает высокой антивирусной и противогрибковой активностью, ее соли (дихлорацетаты натрия и калия) в настоящий момент интенсивно изучаются в качестве экспериментальных противоопухолевых средств [9].
Дихлоруксусная кислота входит в перечень веществ, загрязняющих атмосферный воздух [10]. В природные воды хлоруксусные кислоты (ХК) попадают как из атмосферы, так и из почвы [11]. Производство дихлоруксусной кислоты очень сложное, и, как правило, она образуется в качестве побочного продукта в результате образования монохлор- и трихлоруксусных кислот. Наиболее распространенные способы производства ДХК – это реакция хлоральгидрата с СаСО3 и NaCN с последующим подкислением, хлорирование уксусной и монохлоруксусной кислот и гидролиз дихлорацетилхлорида [4].
Дихлоруксусная кислота образуется в атмосфере в результате химических реакций с участием хлорорганических соединений, которые широко используются в производстве [12]. Одним из источников получения ДХК служат химические процессы с участием атомарного хлора. Известно, что средняя концентрация атомов хлора в атмосфере составляет 3.7 ⋅ 104 молекула/см3 [13]. Атомы хлора могут вступать в реакцию с органическими веществами на поверхности частиц, присутствующих в атмосфере, приводя к образованию монохлоруксусной (МХК), дихлоруксусной и трихлоруксусной (ТХК) кислот. Эти кислоты – продукты атмосферной деградации 1,1,1-трихлорэтана (максимальное время жизни – 4.8 лет) и тетрахлорэтилена (максимальное время жизни – 6 мес.) [14], – широко используются в производстве.
Одним из важных процессов образования ХК является поглощение хлораля каплями облаков, где происходит их окисление до МХК, ДХК и ТХК [12]. Помимо ХК при окислении хлораля образуются и другие продукты, такие как хлороформ, формальдегид и углекислый газ.
Время жизни МХК и ДХК в окружающей среде в сравнении с другими галогенуксусными кислотами
Галогенуксусные кислоты, как правило, накапливаются в природных водах [5, 15, 16]. Период полувыведения дихлоруксусной кислоты (в водной среде при температуре 288 К) составляет 68 лет. Информации о поведении ДХК в водной среде недостаточно, особенно с учетом ее устойчивости в состоянии водного раствора. Это побудило заняться исследованием данного вопроса. Для этого необходимо было выбрать наиболее информативный, доступный и удобный метод анализа веществ.
В настоящей работе с использованием метода электрораспыления водных растворов дихлоруксусной кислоты в вакуумную камеру масс-спектрографа исследована структура ее гидратированных ионов [17].
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
При растворении в воде ДХК диссоциирует на анионы кислотного остатка и ионы водорода:
Затем следует гидратация ионов:
Для исследования водного раствора ДХК был использован масс-спектрографический метод электрораспыления растворов электролитов в вакууме (ЭРРЭВ).
Идея метода
Анализируемый раствор подается непрерывно в высоковакуумную область масс-спектрографа через металлический капилляр. На капилляр подан высокий электрический потенциал для электрораспыления раствора на выходном конце капилляра. Электрораспыление возникает при определенной величине потока раствора. При этом в вакууме появляются однозарядные ионы, эмитированные из раствора, которые затем направляются на масс-спектральный анализ [18].
В работе для регистрации масс-спектров используется масс-спектрограф, а не масс-спектрометр, по той причине, что эмиссия ионов при электрораспылении происходит нерегулярными импульсами и для накопления сигнала и одновременной регистрации всего масс-спектра необходимо использовать фотопластинку. Для выполнения этих требований идеально подходит масс-спектрограф.
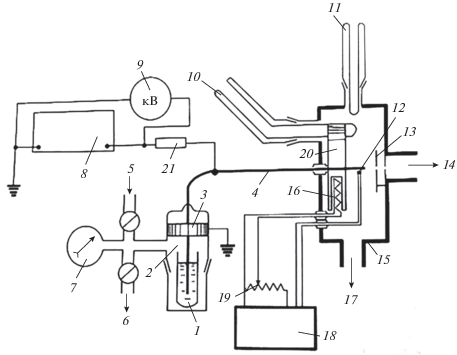
На рис. 1 представлена схема ввода раствора электролита в методе ЭРРЭв. В ампулу 1 с раствором электролита погружают капилляр 4, выходной конец которого находится в высоковакуумной камере масс-спектрографа 15. Величина потока раствора регулируется с помощью системы, которая изменяет величину атмосферного давления над раствором 2. На капилляр подан высокий электрический потенциал (несколько кВ). При определенной величине потока (порядка 10–5–10–4 г/с) происходит электрораспыление раствора в вакууме, и в газовой фазе появляются ионы, эмитированные из раствора. Пары́ растворителя из высоковакуумной области масс-спектрографа вымораживают при температуре жидкого азота специальной съемной ловушкой 11, которая по окончании работы освобождается от вымороженных паров. Вымораживание паров растворителя необходимо для поддержания высокого вакуума в масс-спектрографе. Знак заряда эмитированных ионов совпадает со знаком высокого потенциала, поданного на капилляр. Меняя знак этого потенциала, можно осуществлять эмиссию из раствора электролита как отрицательных, так и положительных ионов. Далее происходит обычный масс-спектрографический анализ эмитированных ионов [19, 20]. Эмиссия ионов при электрораспылении происходит при определенной скорости подачи раствора в канал капилляра в момент, когда поверхность раствора попадает в область “провисания” электрического поля, создаваемого высоким потенциалом, и на этой поверхности образуется заряженный слой. Эмиссия ионов осуществляется двумя способами: 1) полевым испарением и 2) электрораспылением.
Рис. 1.
Схема экспериментальной установки ввода раствора электролита в методе ЭРРЭВ: 1 – ампула с раствором ДХК; 2 – система скорости подачи раствора; 3 – заземление; 4 – апилляр; 5 – напуск воздуха; 6 – откачка; 7 – вакуумметр; 8 – генератор высокого напряжения; 9 – киловольтметр; 10 – холодильник; 11 – ловушка с жидким азотом; 12 – термопара; 13 – заземленный электрод; 14 – в масс-спектрограф; 15 – высоковакуумная камера; 16 – нагреватель; 17 – к диффузионному насосу; 18 – регулятор температуры; 19 – регулировка тока нагревателя; 20 – блок нагрева раствора; 21 ‑ сопротивление, препятствующее образованию разряда.
На поверхности мениска раствора на срезе капилляра под действием электрического поля образуются жидкие “иголочки”. Эмиссия обоих видов происходит из вершин множества таких жидких “иголочек”, вытягивающихся в направлении электрического поля из заряженного слоя на поверхности раствора на выходном конце капилляра. Полевое испарение не разрушает кончика жидкой “иголочки”, и поэтому эмиссия ионов в этом случае довольно устойчива и может происходить достаточно долго.
Полевое испарение ионов из раствора происходит из верхушки жидкой “иголочки” в результате того, что здесь возникает сильное электрическое поле, способное создать силу, достаточную для “вырывания” иона из раствора. При полевом испарении ионы, попавшие в газовую фазу, – это ионы с поверхности раствора. В противоположность полевому испарению при электрораспылении кончик “иголочки” периодически разрушается (взрывается) и восстанавливается вновь. При этом в газовой фазе появляются ионы, извлеченные из объемной части раствора. В этом случае верхушка “иголочки” подвергается действию двух сил – силы F1 поверхностного натяжения, которая старается сохранить целостность “иголочки”, и силы F2 расталкивания зарядов q, находящихся на макушке “иголочки”, а также зарядов Q, находящихся ниже границы разрыва. Когда “иголочка” вытягивается, поверхностное натяжение уменьшается, в результате чего сила F1 уменьшается, а сила F2 увеличивается, и в определенный момент, когда сила расталкивания зарядов F2 становится больше F1, верхушка “иголочки” разрывается.
Масс-спектральные линии ионов одной и той же массы, соответствующие разным способам эмиссии, не полностью налагаются друг на друга, и суммарная линия всегда имеет несимметричный вид в отличие от симметричной формы линий ионов, эмитированных только одним из способов. При двух видах эмиссии форма линий представляет собой дуплет. Информацию о состоянии ионов в объеме раствора несут ионы, эмитированные путем электрораспыления. Ионы, образовавшиеся в результате полевого испарения, несут информацию только о составе поверхностного заряженного слоя, который не соответствует объемной концентрации электролита хотя бы потому, что из-за испарения растворителя (воды) концентрация электролита значительно превышает его объемную концентрацию [20].
Условия эксперимента и исходные реактивы
Раствор дихлоруксусной кислоты (Sigma-Aldrich, 99%-ной чистоты) в дистиллированной воде приготавливали при температуре 293 К с добавлением для нейтрализации раствора щелочи КОН (Sigma-Aldrich). Условия проведения экспериментов представлены ниже:
| концентрация водного раствора ДХК – | 0.01 моль/л |
| потенциал, поданный на капилляр, кВ – | –10.0 |
| напряжение U, В – | ±507 |
| ток магнита, А – | 1.9 |
| температура раствора ДХК, К – | 303 |
| динамический диапазон регистрируемых ионов – | 200 |
| точность определения интенсивностей масс-спектральных линий, % – | 10–15 |
Попытки получить масс-спектры чистых кислот успеха не имели, потому что при обычно используемых концентрациях электролита порядка 0.01 моль/л концентрации ионов водорода и кислотного остатка были малы. Если же использовать более высокие концентрации кислот, то раствор начинает заметно реагировать с материалом напускного капилляра, а это может привести к засорению канала капилляра. Поэтому работа проводилась с растворами кислот, полностью нейтрализованных щелочью КОН (pH = 7). Такой прием не только защищал напускной капилляр от засорения, но и увеличивал концентрацию кислотных остатков (до величины концентрации кислоты в исходном растворе), способствуя этим увеличению чувствительности метода ЭРРЭВ. Таким образом, анализ раствора кислот заменяли анализом раствора их кислотных остатков с той же концентрацией.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Эксперименты с нейтрализованными кислотами показали, что их масс-спектры зависят от условий в зоне эмиссии ионов из раствора. Эти условия (в частности, температура) не всегда точно воспроизводятся, что является причиной небольших расхождений в получающихся масс-спектрах.
Были зарегистрированы и обработаны масс-спектры водных растворов ДХК с концентрацией 0.01 моль/л. Эти масс-спектры представлены в табл. 1, где курсивом и жирным выделены гидратные серии. Из полного масс-спектра выбраны пики, характеризующиеся наличием ионов кислотного остатка (HCl2C–СОО)–, гидратированного n молекулами воды. Кроме ионов кислотного остатка (HCl2C–COO)– и членов его гидратной серии (Н2О)n(HCl2C–COO)– (n = 1, 2, 3…) в масс-спектре присутствуют пики, соответствующие отдельным ионам хлора (изотопы 35Cl и 37Cl), образующимся в результате их отрыва от кислотного остатка в ходе электрораспыления:
Таблица 1.
Масс-спектр гидратированных ионов дихлоруксусной кислоты (СНСl2COO–)(H2O)n (концентрация водного раствора ДХК – 0.01 моль/л)
| Масса иона | Интенсивность ионного тока, усл. ед. | Структура ионов |
|---|---|---|
| 35 | 95 | 35Cl−, (ОН−)(Н2О) |
| 37 53 |
37.3 | 37Cl− |
| 17 | (ОН−)(Н2О)2, (35Cl−)(Н2О) | |
| 55 71 |
8.7 | (37Cl−)(Н2О) |
| 15.6 | (ОН−)(Н2О)3, (35Cl−)(Н2О)2 | |
| 73 83 |
6.4 | (37Cl−)(Н2О)2 |
| 53 | (H35Cl2C−) | |
| 85 | 46 | (H35Cl37ClC−) |
| 87 | 5.4 | (H37Cl2C−) |
| 89 | 14.3 | (ОН−)(Н2О)4 |
| 91 | 6.7 | (37Cl−)(Н2О)3 |
| 107 | 6.3 | (ОН−)(Н2О)5 |
| 109 | 4.3 | (37Cl−)(Н2О)4 |
| 111 | 1.7 | (H35Cl2C-СО−) |
| 125 | 3.15 | (ОН−)(Н2О)6 |
| 127 | 100 | (H35Cl2C–СОО−) |
| 129 | 68 | (H35Cl37ClC–СОО−) |
| 131 | 9.6 | (H37Cl2C–СОО−) |
| 145 | 78.7 | (H35Cl2C–СОО−)(Н2О) |
| 147 | 50.2 | (H35Cl37ClC–СОО−)(Н2О) |
| 149 | 5.5 | (H37Cl2C–СОО−)(Н2О) |
| 163 | 58.7 | (H35Cl2C–СОО−)(Н2О)2 |
| 165 | 41.6 | (H35Cl37ClC–СОО−)(Н2О)2 |
| 167 | 4.2 | (H37Cl2C–СОО−)(Н2О)2 |
| 181 | 32 | (H35Cl2C–СОО−)(Н2О)3 |
| 183 | 15.3 | (H35Cl37ClC–СОО−)(Н2О)3 |
| 185 | 3.7 | (H37Cl2C–СОО−)(Н2О)3 |
| 199 | 12 | (H35Cl2C–СОО−)(Н2О)4 |
| 201 | 8 | (H35Cl37ClC–СОО−)(Н2О)4 |
| 217 | 7.3 | (H35Cl2C–СОО−)(Н2О)5 |
| 219 | 4 | (H35Cl37ClC–СОО−)(Н2О)5 |
Линии, которые периодически повторяются в масс-спектре, соответствуют гидратным сериям ионов, массы которых различаются на величину массы молекулы воды. Остальные линии спектра соответствуют ионам, образованным в газовой фазе, так как они одиночны и не имеют гидратных серий. Их образование происходит в газовой фазе, где концентрация молекул воды несравнимо меньше их концентрации в растворе, и поэтому у этих ионов не происходит образования гидратного “хвоста”. Так, например, массы 83, 85 и 87 соответствуют ионам, которые образовались в процессе эмиссии при развале иона кислотного остатка уже в газовой фазе.
В масс-спектре присутствуют линии, соответствующие ионам хлора и кислотного остатка (HCl2CCOO)–. Ионы хлора образуют серии с изотопами 35Cl (m/z = 35, 53, 71) и 37Cl (m/z = 37, 55, 73), а ионы кислотного остатка – серии с изотопами 35Cl (m/z = 127, 145, 163, 181, 199, 217) и 37Cl (m/z = 131, 149, 167, 185) и серии, содержащие оба изотопа (m/z – 129, 147, 163, 165, 183, 201, 219). Численные величины интенсивностей линий масс-спектра представлены в табл. 1 (концентрация МХК в исходном растворе равна 0.01 моль/л).
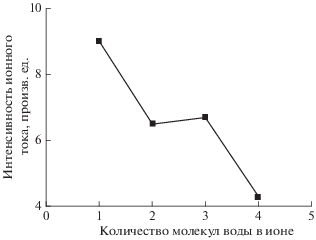
Распределение ионов кислотного остатка в зависимости от количества молекул воды в гидратных оболочках представлено на рис. 2. Можно видеть, что по мере увеличения количеств молекул воды в ионе их общее количество уменьшается. Полученное распределение показывает, что в водных растворах электролитов присутствуют наборы ионов с разной степенью гидратации. В данном случае при концентрации электролита 0.01 моль/л количество гидратированных ионов монотонно уменьшается с увеличением степени их гидратации. Видимо, ионы в растворе ДХК конкурируют друг с другом за молекулы воды. Условно можно выделить ионы с молекулами воды, близко окружающими ион и образующими первую гидратную оболочку иона, и ионы с молекулами воды первой и частично второй гидратных оболочек. Молекулы воды в первой гидратной оболочке прочно связаны с ионом, а во второй гидратной оболочке они связаны с ионом слабее, и поэтому могут отрываться в процессе электрораспыления.
Рис. 2.
Распределение ионов кислотного остатка дихлоруксусной кислоты по степени гидратации: ◼ – кислотный остаток с изотопом 35Cl, ▲ – кислотный остаток с изотопами 35Cl и 37Cl, ⚫ – кислотный остаток с изотопом 35Cl. Концентрация ДХК – 0.01 моль/л.
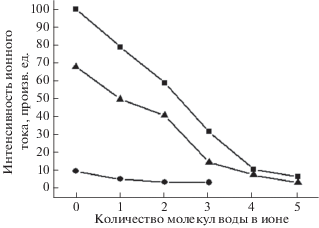
На рис. 3 приведена зависимость распределения образующихся ионов гидратной серии изотопа 37Cl от степени их гидратации. Зависимость распределения интенсивности ионного тока от числа молекул воды в ионе показывает такое же поведение, что и для случая ионов с кислотным остатком. Это говорит о том, что ионы гидратной серии изотопа 37Cl образовались в газовой фазе при распаде ионов с кислотным остатком.
4. ЗАКЛЮЧЕНИЕ
Методом электрораспыления водных растворов дихлоруксусной кислоты в вакуумную камеру масс-спектрографа получен масс-спектр отрицательных ионов водного раствора дихлоруксусной кислоты. Масс-спектр включает в себя серии, состоящие из гидратированных нераспавшихся ионов кислотного остатка и продуктов распада – гидратированных ионов изотопов хлора. Из анализа масс-спектра была установлена структура гидратированных ионов кислотных остатков дихлоруксусной кислоты. Кислотные свойства ДХК были нейтрализованы необходимым количеством гидроксида калия.
Распределение ионов по степени гидратации зависит от концентрации кислоты в исходном растворе. При концентрации кислоты 0.01 моль/л количество гидратированных ионов монотонно уменьшаются с увеличением степени их гидратации. Полученный масс-спектр дает информацию о распределении гидратированных ионов в растворе, что дает возможность применить масс-спектрографический метод ЭРРЭВ для определения состава водных растворов электролитов в исследованиях окружающей среды.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (регистрационный номер АААА-А20-120021390044-2) и поддержана грантом Российского фонда фундаментальных исследований № 19-05-50076 – Микромир.
Список литературы
Laturnus F., Fahimi I., Gryndler M. et al. // Environ. Sci. Poll. Res. 2005. V. 12. № 4. P. 233.
Weissflog L., Krueger G., Elansky N. et al. // Chemosphere. 2006. V. 65. № 6. P. 975.
Фрид М.Р., Трегер Ю.А. Винилхлорид: химия и технология. М.: Калвис, 2008.
Справочник химика / Под ред. Никольского Б.П. Л.: Химия, 1971.
Clemens M., Scholer H.F. // Fresenius J. Anal. Chem. 1992. V. 344. № 1. P. 47.
De Angelo A.B., Daniel F.B., Most B.M. et al. // J. Toxicol. Environ. Health. 1997. V. 52. № 5. P. 425.
Тертышная Ю.В., Карпова С.Г., Попов А.А. // Хим. физика. 2017. Т. 36. № 6. С. 84.
Штамм Е.В., Скурлатов Ю.И., Рощин А.В. и др. // Хим. физика. 2019. Т. 38. № 11. С. 16.
Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Изд. 7 / Под ред. Лазарева Н.В., Левиной Э.Н. Т. 2. Л.: Химия, 1976.
Перечень и коды веществ, загрязняющих атмосферный воздух. СПб.: Изд-во АО НИИ Атмосфера, 2015.
Peters R.J.B. // J. Environ. Monitor. 2003. V. 5. № 2. P. 275.
Wenger J.C., Calvé S., Sidebottom H.W. et al. // Environ. Sci. Technol. 2004. V. 38. № 3. P. 831.
Sidebottom H., Franklin J. // Pure Appl. Chem. 1996. V. 68. № 9. P. 1757.
Lifongo L.L., Bowden D.J., Brimblecombe P. // Intern. J. Phys. Sci. 2010. V. 5. № 6. P. 738.
Reimann S., Grob K., Frank H. // Environ. Sci. Technol. 1996. V. 30. № 7. P. 2340.
Скурлатов Ю.И., Вичутинская Е.В., Зайцева Н.И. и др. // Хим. физика. 2017. Т. 36. № 7. С. 42.
Карпов Г.В., Виноградова О.А., Васильев Е.С. и др. // Хим. физика. 2018. Т. 37. № 7. С. 26.
Karpov G.V., Morozov I.I., Vasiliev E.S. et al. // Chem. Phys. Lett. 2013. V. 586. P. 40.
Карпов Г.В. // Электрохимия. 2010. Т. 46. № 1. С. 100.
Karpov G.V., Vasiliev E.S., Morozov I.I. et al. // Intern. J. Chem. Kinet. 2016. V. 48. № 8. P. 442.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика