Химическая физика, 2020, T. 39, № 10, стр. 29-34
Кинетика гетерогенной реакции сероводорода с оксидом йода в диапазоне температур 273–368 K
И. К. Ларин 1, А. И. Спасский 1, Е. М. Трофимова 1, *
1 Институт энергетических проблем химической физики им. В.Л. Тальрозе Федерального исследовательского центра химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: eltrofimova@yandex.ru
Поступила в редакцию 11.07.2019
После доработки 25.10.2019
Принята к публикации 20.11.2019
Аннотация
Методом резонансной флуоресценции атомов йода была изучена реакция радикала IO c сероводородом в диапазоне температур 273–368 K. Зависимость константы скорости данной реакции от температуры описывается выражением kII(T) = (1.6 ± 0.3) ⋅ 10–14exp(1035/T) см3 ⋅ молекула–1 ⋅ с–1. Было доказано, что взаимодействие этих веществ протекает в основном на стенке реактора. Обсуждена возможность взаимодействия этих веществ в морской и прибрежной зонах.
ВВЕДЕНИЕ
Антропогенными источниками сероводорода – токсичного вещества для живых организмов, разрушающего промышленное оборудование, – являются нефтеперерабатывающие заводы, гниение свалок, канализационные стоки, навозохранилища и многие другие объекты человеческой деятельности. В природе сероводород образуется за счет анаэробного разложения биомассы морей и океанов, а также при восстановлении донных сульфатных отложений анаэробными бактериями [1–3]. Эти процессы особенно интенсивно протекают в Черном море, что приводит к возможности выброса сероводорода в атмосферу [4, 5].
Оксид йода (IO) также преимущественно поступает в атмосферу в непосредственной близости от морей и океанов [6]. Исходным веществом для его образования служит йодистый метан, также являющийся продуктом разложения биомассы, содержащейся в их акватории. В результате в атмосферу поступает ∼1.5 Мт CH3I в год [7]. При фотолизе этого соединения образуются атомы йода, при окислении которых образуется IO. Еще одним процессом, приводящим к образованию атомов йода (а следовательно, и оксида йода) в морской атмосфере, является гетерогенная реакция CH3I с атомами хлора, исследованная нами в лабораторных условиях [8], которая в природе может протекать на поверхности аэрозолей морских солей. Атомы хлора образуются при фотолизе молекулярного хлора, поступающего в атмосферу за счет реакции тропосферного озона и ClNO3 с аэрозолями морской соли [9, 10].
В результате описанных выше процессов в морской атмосфере могут возникать значительные концентрации оксида йода, превышающие 108 молекула/см3 [11], в то время как концентрация в ней основного “чистильщика атмосферы” – радикала OH в дневное время достигает максимальной концентрации, составляющей 9 ⋅ 106 молекула/см3 [12]. Таким образом, оксид йода в атмосфере морей и океанов, а также в прибрежных зонах может конкурировать с радикалом OH в процессе окисления сероводорода.
Реакции IO с рядом соединений серы были исследованы нами ранее при температуре 343 K [13]. Данная работа посвящена измерению константы скорости реакции оксида йода с сероводородом (H2S) в интервале температур от 273 до 368 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
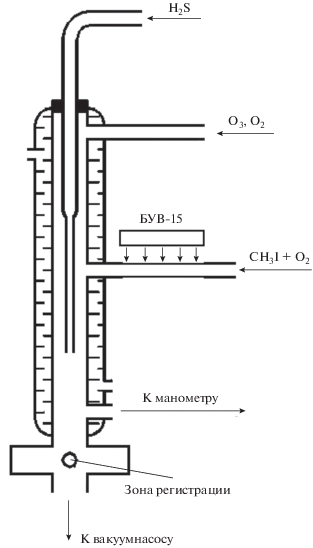
Опыты проводились в реакторе, изображенном на рис. 1. Реактор имел водяную рубашку, присоединенную к термостату, что позволяло изменять его температуру в диапазоне 273–368 K и поддерживать ее с точностью в 0.5 K. Температура в термостате контролировалась при помощи ртутного термометра. Перед опытами поверхность реактора обрабатывали жидким фторопластом марки Ф-32Л. Затем реактор выдерживали в течение нескольких часов в специальной печи при температуре 160°C. Такая обработка поверхности реактора позволяла снизить величину константы скорости гетерогенной гибели поступающих в реактор атомов йода и образующихся в реакторе радикалов IO до 10 с–1.
Через источник атомов йода, присоединенный к боковой поверхности реактора, пропускали смесь гелия с газообразным йодистым метилом, который под действием света бактерицидной кварцевой ртутной лампы низкого давления БУВ-15 с λ = = 253.7 нм образовывал атомы йода в состояниях 2P1/2 и 2P3/2. Дезактивация атомов йода из состояния 2P1/2 в основное состояние 2P3/2 происходила как в самом источнике на молекулах CH3I, так и в реакторе на молекулах кислорода.
Для регистрации атомов йода по их резонансной флуоресценции применялась резонансная лампа, изготовленная из кварца и излучающая резонансную линию атомов йода с α = 178.3 нм. Коротковолновая граница пропускания кварцевых окон лампы находится при α = 160 нм. Вакуумное уплотнение достигалось с помощью прокладок из индия. Через лампу прокачивалась смесь гелия с молекулярным йодом в соотношении ~10 000/1. Для возбуждения разряда в лампе использовали СВЧ-резонатор Бройда.
Регистрацию переизлученных атомами йода квантов осуществляли с помощью счетчика Гейгера, работающего в диапазоне 160–185 нм. Счетчик заполнялся смесью окиси азота и аргона (10 Торр NO и 230 Торр Ar). В стеклянный отросток, припаянный к корпусу счетчика, помещалась капля диэтилферроцена. Пары диэтилферроцена находились в равновесии с каплей. Длинноволновая граница счетчика определялась потенциалом ионизации диэтилферроцена, равным 6.3 эВ [14], и составляла ~185 нм. Мы уже упоминали, что коротковолновая граница пропускания кварцевых окон счетчика находится при α = 160 нм. Таким образом, счетчик выполнял одновременно функцию монохроматора, выделяя спектральный участок от ~160 до ~185 нм.
Накопление сигналов осуществлялось с помощью частотомера Ч3-63/1. При отношении сигнал/шум, равном единице, и времени накопления импульсов ~100 с чувствительность регистрации атомов йода составляла ~108 молекула/см3.
Радикалы IO получали в реакции атомов йода с озоном. Величины константы скорости этой реакции в диапазоне температур от 273 до 370 K приведены в работе [15]. Ее значения в этом диапазоне изменялись от 1.03 ⋅ 10–12 до 2.2 ⋅ 10–12 см3 ⋅ молекула–1 ⋅ с–1.
Озон получали в озонаторе “Озон-2”, изготовленном в ИХФ РАН, через который проходил поток кислорода. Из озонатора смесь озона и кислорода попадала в стеклянную ячейку с кварцевыми окнами, помещенную в спектрофотометр “Spectromom-204”, который регистрировал оптическую плотность на длине волны α = 253.7 нм. Давление в ячейке регулировалось вентилем, что позволяло изменять давление в оптической ячейке, не меняя массовый поток газов. Это давало возможность выбирать интервал оптической плотности, удобный для измерения концентрации озона. Затем смесь O2 + O3 вводилась в реактор. Концентрацию озона вычисляли по изменению оптической плотности на длине волны 253.7:
(1)
${\text{[}}{{{\text{O}}}_{{\text{3}}}}{\text{]}} = \frac{{Q{\text{(}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}}}{{{{Q}_{{{\text{общ}}}}}}}\Sigma {\text{[}}{{{\text{C}}}_{i}}],$(2)
$\begin{gathered} Q{\text{(}}{{{\text{O}}}_{{\text{3}}}}{\text{)}} = Q{\text{(}}{{{\text{O}}}_{{\text{2}}}} + {\text{He)}}\frac{{{\text{2}}{\text{.3}}{{D}_{{{\text{10}}}}}}}{{\sigma {{L}_{{\text{к}}}}{{P}_{{\text{к}}}}{\text{(3}}{\text{.25}} \cdot {\text{1}}{{{\text{0}}}^{{16}}})}}, \\ [{\text{с}}{{{\text{м}}}^{{\text{3}}}} \cdot {\text{Торр}} \cdot {{{\text{с}}}^{{ - {\text{1}}}}}]; \\ \end{gathered} $Поток О2 и О3 между ячейкой и реактором контактировал только со стеклом и кранами, изготовленными из тефлона, на которых озон каталитически не разрушался. Концентрацией озона в реакторе управляли, изменяя напряжение на озонаторе при сохранении параметров потока.
Газы-разбавители и CH3I поступали в реактор через регуляторы расходов, позволяющие поддерживать постоянный расход газа с точностью 2–3% в течение 10–15 ч. Массовые потоки реагентов и газов-носителей измеряли методом истечения из калиброванного объема в единицу времени. За изменением давления следили по образцовому манометру. Во всех опытах использовали гелий и кислород марки “ВЧ”, CH3I марки “ЧДА”. Сероводород получали в реакции Na2S c серной кислотой и очищали многократной низкотемпературной перегонкой.
В начале эксперимента в реактор вводились атомы йода в смеси с гелием, образовавшиеся при фотолизе CH3I, и записывался сигнал резонансной флуоресценции (РФ) атомов йода (J0). Предварительно снималась зависимость сигнала РФ атомов йода от концентрации атомарного йода в реакторе. Процедура градуировки подробно описана в работе [13]. Затем через боковой вход в реактор подавался озон, который реагировал с атомами йода. В результате этой реакции атомы йода превращались в радикалы IO:
Вследствие этого сигнал РФ атомов йода уменьшался до своих фоновых значений. Затем через тонкую трубку, герметично соединенную с реактором через тефлоновое уплотнение, на расстоянии 3 см от зоны регистрации в реактор поступал H2S, что приводило к появлению сигнала РФ атомов йода (J):
(II)
${\text{IO}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}} \to {\text{I}} + {{{\text{H}}}_{{\text{2}}}}{\text{SO}}.$Опыты проводили при величине сигнала РФ, не превышающей 1000 импульсов за 10 с. Это в соответствии со сделанной перед опытами градуировкой означало, что концентрация атомов йода не превышала 1011 молекула /см3. Так как стационарная концентрация IO равняется разнице между начальной и стационарной концентрациями атомов йода, то она всегда была меньше, чем 1011 молекула/см3. Это позволило избежать реакции радикалов IO друг с другом, приводящей к дополнительному источнику атомов йода [17]. Специальная обработка поверхности реактора приводила к тому, что константы скорости гибели активных центров на поверхности реактора не превышали величины в 10 с–1. Поэтому стадию обрыва цепи в схеме реакции можно было не учитывать.
Цепной процесс в реакторе включал следующие стадии:
(I)
${\text{I}} + {{{\text{O}}}_{{\text{3}}}}\xrightarrow{{{{k}_{{\text{I}}}}}}{\text{IO}} + {{{\text{O}}}_{{\text{2}}}},$(II)
$\begin{gathered} {\text{IO}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}}~\xrightarrow{{k_{{{\text{Ii}}}}^{{{\text{гом}}}}}}{\text{I}} + {{{\text{H}}}_{{\text{2}}}}{\text{SO}}, \\ {\text{IO}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}}~\xrightarrow{{k_{{{\text{II}}}}^{{{\text{гет}}}}}}{\text{I}} + {{{\text{H}}}_{{\text{2}}}}{\text{SO}}, \\ \end{gathered} $Атомы йода, образующиеся в гетерогенной реакции (II), поступали в газовую фазу, где и регистрировались методом РФ.
Скорость генерации атомов йода описывается следующим выражением:
(3)
$W = k_{{{\text{II}}}}^{{{\text{гом}}}}[{\text{IO}}][{{{\text{H}}}_{{\text{2}}}}{\text{S}}] + {{k}_{{{\text{эф}}}}}\left[ {{\text{IO}}} \right],$где
(4)
${{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} {{{k}_{{{\text{эф}}}}}}}} \right. \kern-0em} {{{k}_{{{\text{эф}}}}}}} = \left( {{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} {k_{{{\text{II}}}}^{{{\text{гет}}}}}}} \right. \kern-0em} {k_{{{\text{II}}}}^{{{\text{гет}}}}}}} \right)\left[ {{{{\text{H}}}_{{\text{2}}}}{\text{S}}} \right] + {{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} {{{k}_{{{\text{диф}}}}}}}} \right. \kern-0em} {{{k}_{{{\text{диф}}}}}}},$$k_{{{\text{II}}}}^{{{\text{гет}}}}$[H2S] – константа скорости реакции в кинетической области, kдиф = 3.66D/R2 [18], D – коэффициент диффузии радикалов IO, R – радиус реактора. Коэффициент D можно найти по уравнению D = = D0$\left( {{{760} \mathord{\left/ {\vphantom {{760} P}} \right. \kern-0em} P}} \right),$ где D0 – коэффициент диффузии радикалов IO при давлении 760 Торр, P – давление в реакторе.
Стационарная концентрация атомарного йода определяется из следующего выражения:
(5)
${{k}_{{\text{I}}}}{{\left[ {\text{I}} \right]}_{{{\text{ст}}}}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right] = k_{{{\text{II}}}}^{{{\text{гом}}}}{{\left[ {{\text{IO}}} \right]}_{{{\text{ст}}}}}[{{{\text{H}}}_{{\text{2}}}}{\text{S}}] + {{k}_{{{\text{эф}}}}}[{\text{IO}}],$Учитывая, что [I]0 = [I]ст + [IO]ст, из выражений (4) и (5) получаем следующее соотношение:
(6)
$\begin{gathered} \frac{{{{{[{\text{I}}]}}_{0}}}}{{{{{[{\text{I}}]}}_{{{\text{ст}}}}}}} = \\ = \frac{{[{\text{O3}}]}}{{[{{{\text{H}}}_{2}}{\text{S}}]}}\frac{{{{k}_{{\text{I}}}}}}{{k_{{{\text{II }}}}^{{{\text{гом}}}} + k_{{{\text{II}}}}^{{{\text{гет}}}}{{{{k}_{{{\text{диф}}}}}} \mathord{\left/ {\vphantom {{{{k}_{{{\text{диф}}}}}} {\left( {k_{{{\text{II}}}}^{{{\text{гет}}}}{\text{[}}{{{\text{H}}}_{2}}{\text{S]}} + {{k}_{{{\text{диф}}}}}} \right)}}} \right. \kern-0em} {\left( {k_{{{\text{II}}}}^{{{\text{гет}}}}{\text{[}}{{{\text{H}}}_{2}}{\text{S]}} + {{k}_{{{\text{диф}}}}}} \right)}}}} + 1. \\ \end{gathered} $При малых концентрациях H2S и достаточно больших значениях kдиф (что достигается уменьшением давления в реакционном сосуде), когда ${{{{k}_{{{\text{диф}}}}}} \mathord{\left/ {\vphantom {{{{k}_{{{\text{диф}}}}}} {k_{{{\text{II}}}}^{{{\text{гет}}}}[{{{\text{H}}}_{2}}{\text{S}}] + {{k}_{{{\text{диф}}}}}}}} \right. \kern-0em} {k_{{{\text{II}}}}^{{{\text{гет}}}}[{{{\text{H}}}_{2}}{\text{S}}] + {{k}_{{{\text{диф}}}}}}} \approx 1,$ выражение (6) приобретает следующий вид:
(7)
$\frac{{{{{[{\text{I}}]}}_{0}}}}{{{{{[{\text{I}}]}}_{{{\text{ст}}}}}}} = \frac{{[{\text{O3}}]}}{{[{{{\text{H}}}_{2}}{\text{S}}]}}\frac{{{{k}_{{\text{I}}}}}}{{k_{{{\text{II }}}}^{{{\text{гом}}}} + k_{{{\text{II}}}}^{{{\text{гет}}}}}} + 1.$Так как [I0]/[I]ст = J0/Jст, то (7) переходит в следующее выражение:
(8)
$\frac{{{{J}_{0}}}}{{{{J}_{{{\text{ст}}}}}}} = \frac{{[{\text{O3}}]}}{{[{{{\text{H}}}_{2}}{\text{S}}]}}\frac{{{{k}_{{\text{I}}}}}}{{k_{{{\text{II }}}}^{{{\text{гом}}}} + k_{{{\text{II}}}}^{{{\text{гет}}}}}} + 1.$Построив график зависимости J0/Jст от [O3]/[H2S], можно определить сумму kII = $k_{{{\text{II}}}}^{{{\text{гет}}}} + k_{{{\text{II}}}}^{{{\text{гом}}}}.$
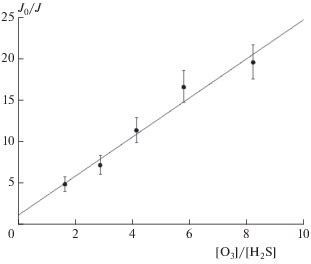
Такой график, полученный при [H2S] = (5 ± ± 0.2) ∙ 1013 молекула/см3, T = 298 K и давлении в реакторе (1.3 ± 0.1) Торр, представлен на рис. 2. Из наклона прямой на графике была определена сумма гетерогенной и гетерогенной констант скорости реакции (II): kII = (5.5 ± 0.6) ∙ 10–13 см3 ⋅ ⋅ молекула–1 ⋅ с–1. При расчете kII значение константы скорости kI, входящей в формулу (8), было взято из работы [15].
Рис. 2.
График зависимости J0/Jст от [O3]/[H2S] при [H2S] = 5 ∙ 1013 молекула/см3, T = 298 K, давлении в реакторе 1.3 Торр.
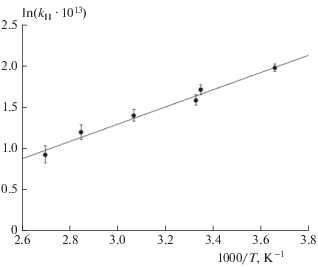
Аналогичные опыты были проведены при температурах в реакторе 273, 303, 325, 350 и 368 K. График зависимости ln(kII ⋅ 1013) от 1000/T представлен на рис. 3. Из этого графика получено следующее выражение для константы скорости данной реакции:
Используя значение kII = $k_{{{\text{II}}}}^{{{\text{гет}}}} + k_{{{\text{II}}}}^{{{\text{гом}}}},$ определенное при малых концентрациях реагента H2S, можно построить теоретическую зависимость [I]0/[I]ст от [O3]/[H2S] при разной доле гетерогенной составляющей константы скорости реакции (II), которая будет иметь вид
(9)
$\begin{gathered} \frac{{{{{[{\text{I}}]}}_{0}}}}{{{{{[{\text{I}}]}}_{{{\text{ст}}}}}}} = \frac{{{\text{[}}{{{\text{O}}}_{{\text{3}}}}{\text{] }}}}{{[{{{\text{H}}}_{{\text{2}}}}{\text{S}}]}} \times \\ \times \,\,\frac{{{{k}_{1}}}}{{(1 - \alpha ){{k}_{{{\text{II}}}}} + \alpha {{k}_{{{\text{II}}}}}{{{{k}_{{{\text{диф}}}}}} \mathord{\left/ {\vphantom {{{{k}_{{{\text{диф}}}}}} {\left( {\alpha {{k}_{{{\text{II}}}}}[{{{\text{H}}}_{2}}{\text{S}}] + {{k}_{{{\text{диф}}}}}} \right)}}} \right. \kern-0em} {\left( {\alpha {{k}_{{{\text{II}}}}}[{{{\text{H}}}_{2}}{\text{S}}] + {{k}_{{{\text{диф}}}}}} \right)}}}} + 1, \\ \end{gathered} $где α = ${{k_{{{\text{II}}}}^{{{\text{гет}}}}} \mathord{\left/ {\vphantom {{k_{{{\text{II}}}}^{{{\text{гет}}}}} {\left( {k_{{{\text{II}}}}^{{{\text{гет}}}} + k_{{{\text{II}}}}^{{{\text{гом}}}}} \right)}}} \right. \kern-0em} {\left( {k_{{{\text{II}}}}^{{{\text{гет}}}} + k_{{{\text{II}}}}^{{{\text{гом}}}}} \right)}}.$
Результаты расчета при температуре 298 K и давлении в реакторе (3.5 ± 0.1) Торр приведены на рис. 4. Значение коэффициента диффузии радикала IO в кислороде при давлении 760 Торр, необходимые для расчета kдиф, было взят из работы [19].
Рис. 4.
Теоретическая зависимость J0/Jст от [O3]/[H2S], полученная при следующих значениях α: 0 (1), 0.5 (2), 0.7 (3), 1 (4). Экспериментальные данные при T = 298 K, [O3] = 7.8 ⋅ 1014 молекула/см3 и давлении в реакторе, равном 3.5 Торра, представлены кружками.
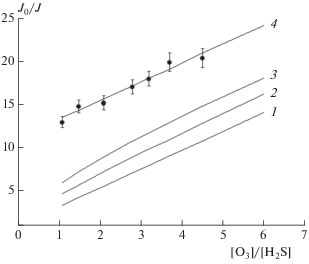
Для сравнения теоретических расчетов с экспериментальными данными были проведены опыты при температуре 298 K и давлении в реакторе 3.5 Торр. Концентрации озона в этих опытах была равной 7.8 ⋅ 1014 молекула/см3, а концентрации сероводорода изменялась от 1.7 ⋅ ⋅ 1014 до 7 ⋅ 1014 молекула/см3. Полученные экспериментальные данные представлены на рис. 4.
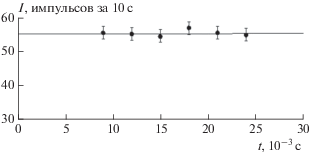
В специальных опытах было проверено, происходит ли выгорание сероводорода в реакции с озоном. На рис. 5 представлена зависимость сигнала резонансной флуоресценции атомов йода от времени контакта сероводорода с озоном. Данные получены при температуре 298 K, концентрации H2S (1.1 ± 0.1) ⋅ 1015 молекула/см3 и концентрации озона (0.9 ± 0.2) ⋅ 1015 молекула/см3. Видно, что сигнал РФ не зависит от времени контакта сероводорода с озоном, т.е. выгорания H2S не происходит.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные нами экспериментальные данные указывают на то, что реакция сероводорода с оксидом йода протекает на стенке реактора. При этом скорость гетерогенной реакции (II) прямо пропорциональна концентрации H2S, а константа скорости этой реакции имеет размерность, типичную для бимолекулярной реакции. Такой результат мы наблюдали во многих изученных нами реакциях с участием соединений, содержащих атомы йода [20, 21].
Наблюдали такую зависимость константы скорости гетерогенной реакции от концентрации реагентов и другие авторы. В работе [22] изучалась гетерогенная реакция хлористого натрия с озоном. Авторы приводят следующее значение константы скорости данной реакции: k ~ 10–18 см3 ⋅ с–1 которое получено из экспериментальных кривых, описываемых выражением (1/[NaCl])d[Cl]/dt = = k[O3], т.е. размерность константы скорости также соответствует бимолекулярной реакции.
Реакция радикалов IO с H2S изучалась в работе [23]. Значение константы скорости этой реакций в работе не приводится, но авторы предположили, что реакция происходит с отрывом атома Н от сероводорода, однако никаких следов HOI в инфракрасных спектрах не было обнаружено.
В наших экспериментах в гетерогенной реакции (II) образуется атом йода, который, реагируя с озоном, вновь образует радикал IO (реакция (I)). В атмосфере данная реакция может иметь очень большую длину цепи из-за отсутствия процессов обрыва, так как соединения, содержащие атом йода, нестабильны в основном за счет фотохимических процессов [24]. Не исключено, что в природных условиях гетерогенная реакция (II) может происходить на поверхности аэрозолей морских солей. Тогда радикал IO может вносить существенный вклад в окисление сероводорода, так как его концентрация в морских регионах, как это следует из данных работ [11, 12], существенно превышает концентрацию радикалов OH.
Отметим, что именно гетерогенные реакции в атмосфере вызывают в настоящее время большой интерес у исследователей процессов, происходящих как в тропосфере, так и в стратосфере. Именно с гетерогенными процессами связано образование озоновых дыр над Антарктидой [25], а также появление весеннего дефицита озона в северном полушарии [26]. Идущие с гораздо большими скоростями гетерогенные реакции на поверхности твердых и жидких компонентов атмосферы еще недостаточно хорошо изучены, но их вклад в химию атмосферы активно обсуждается.
В континентальных областях радикал IO, по-видимому, не может конкурировать с радикалом OH в процессе окисления сероводорода, если эта реакция происходит в газовой фазе. Наши экспериментальные данные, представленные на рис. 4, располагаются вокруг теоретической кривой, для которой α = 1. Так как α = ${{k_{{{\text{II}}}}^{{{\text{гет}}}}} \mathord{\left/ {\vphantom {{k_{{{\text{II}}}}^{{{\text{гет}}}}} {\left( {k_{{{\text{II}}}}^{{{\text{гет}}}} + k_{{{\text{II}}}}^{{{\text{гом}}}}} \right)}}} \right. \kern-0em} {\left( {k_{{{\text{II}}}}^{{{\text{гет}}}} + k_{{{\text{II}}}}^{{{\text{гом}}}}} \right)}},$ то это означает, что $k_{{{\text{II}}}}^{{{\text{гом}}}} \ll k_{{{\text{II}}}}^{{{\text{гет}}}},$ т.е. значение $k_{{{\text{II}}}}^{{{\text{гом}}}} \ll {\text{5}}.{\text{5}} \cdot {\text{1}}{{0}^{{ - {\text{13}}}}}$ см3 ⋅ молекула–1 ⋅ с–1 при T = 298 K, в то время как константа скорости реакции радикала OH с сероводородом при этой температуре составляет величину, равную 5.48 ⋅ 10–12 см3 ⋅ молекула–1 ⋅ с–1 [27]. Кроме того, в этих областях концентрация радикала IO не превышает концентрацию радикала OH [28].
Однако, быстрые гетерогенные реакции могут протекать не только на поверхности частиц аэрозолей морских солей, но и на твердых частицах, выброшенных в атмосферу при извержении вулканов и пыльных бурях, а также на поверхности частиц снега и аэрозолей серной кислоты [29, 30].
ВЫВОДЫ
1. Методом РФ атомов йода измерена константа скорости реакции сероводорода с радикалом IO (реакция (II)) в диапазоне температур 273–368 K.
2. Для выяснения гомогенного или гетерогенного характера реакции (II) при температуре 298 K была построена теоретическая зависимость [I]0/[I]ст от [O3]/[H2S] при разной доле гетерогенной составляющей константы скорости этой реакции.
3. На основании сравнения теоретической зависимости с экспериментальными данными сделан вывод, что реакция (II) протекает в основном на стенке реактора.
4. Предположено, что в морских и прибрежных зонах реакция (II), протекая на поверхности частиц аэрозолей морских солей, может конкурировать с реакцией сероводорода с радикалом OH. Ранее мы отмечали, что концентрация радикала IO в этих зонах значительно превышает концентрацию радикала OH.
Список литературы
Hansen M.H., Ingvorsen K., Jorgensen B.B. // Limn. and Oceanog. 1978. V. 5. P. 68.
Jorgensen B.B. // Ibid. 1977. V. 22. P. 814.
Kump L.R., Pavlov A., Arthur M.A. // Geology. 2005. V. 33. P. 397.
Богуславский С.Г., Еремеев В.Н., Жоров В.А., Новоселов А.А. // Мор. гидрофиз. журн. 1986. № 6. С. 52.
Якушев Е.В., Беседин Д.Е., Лукашев Ю.Ф., Часовников В.К. // Океанология. 2001. Т. 41. С. 686.
Carpenter L.J. // Chem. Rev. 2003. V. 103. P. 4953.
Barrie L.A., Bottenheim J.W., Hart W.R. // J. Geophys. Res. 1994. V. 99. P. 25313.
Ларин И.К., Спасский А.И., Туркин Л.Е., Трофимова Е.М. // Кинетика и катализ. 2010. Т. 51. С. 369.
Keene W.C., Pszenny A.A.P., Jacob D.J. et al. // Global Biogeochem. Cycles. 1990. V. 4. P. 407.
Finglasson-Pitts B.J., Ezell M.J., Pitts J.N., Jr. // Nature. 1989. V. 337. P. 241.
Huang R.J., Seitz K., Neary T. et al. // Geophys. Res. Let. V. 37. L. 03803.
Vaughan S., Ingham T., Whalley L.K. et al. // Atmos. Chem. Phys. 2012. V. 12. P. 2149.
Ларин И.К., Мессинева Н.А., Спасский А.И., Трофимова Е.М., Туркин Л.Е. // Кинетика и катализ. 2000. Т. 41. С. 485.
Кикоин И.К. Таблицы физических величин. М.: Атомиздат, 1976. С. 200.
Atkinson R., Baulch D.L., Cox R.A. et al. // Atmos. Chem. Phys. 2007. V. 7. P. 981.
Александров Э.Л., Израэль Ю.А., Кароль И.Л., Хргиан А.Х. Озонный щит Земли и его изменения. СПб.: Гидрометеоиздат, 1992. С. 36.
Vipond A., Canosa-Mas C.E., Flugge M.L. et al. // Phys. Chem. Chem. Phys. 2002. V. 4. P. 3648.
Vinogradov P.S., Borisenko D.M., Hansel A. et al. // Intern. J. Mass Spectrom. 2005. V. 243. P. 127.
Fuller E.M., Ensue K., Giddins J.Q. // J. Phys. Chem. 1969. V. 73. P. 367.
Ларин И.К., Мессинева Н.А., Невожай Д.В., Спасский А.И., Трофимова Е.М. // Кинетика и катализ. 2000. V. 41. P. 313.
Ларин И.К., Спасский А.И., Трофимова Е.М., Прончева Н.Г. // Кинетика и катализ. 2014. Т. 55. С. 301.
Behnke W, Zetsch C. // J. Aerosol Sci. 1989. V. 20. P. 1167.
Barnes J., Bastian V., Becker K.H. Physico-Chemical Behaviour of Atmospheric Pollutants / Eds. Restelli G., Angeletto G. Dordrecht: Kleuwer Academic Publishers, 1990. P. 166.
Solomon S., Garcia R.P., Ravishankara A.R. // J. Geophys. Res. 1994. V. 99. P. 20491.
Carpenter L.J., Wevill D.J., Palmer C.J., Michels J. // Mar. Chem. 2007. V. 103. P. 227.
Barrie L.A., Bottenheim J.W., Schnell R.C., Crutzen P.J., Rasmussen R.A. // Nature. 1988. V. 334. P. 138.
Wang H.T., Zhu D.S., Wang W.P., Mu Z., Chin Y.J. // Sci. Bull. 2010. V. 55. P. 2951.
Bosch H.C., Camy-Peyret M., Chipperfield P. et al. // J. Geophys. Res. 2003. V. 108. P. 4455.
Solomon S. // Rev. Geophys. 1999. V. 37. P. 275.
Gilfedder B.S., Petri M., Biester H. // Atmos. Chem. Phys. 2007. V. 7. P. 2661.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика