Химическая физика, 2020, T. 39, № 11, стр. 48-51
Сорбционное изменение электрического сопротивления изоляции лакоткани при воздействии микроскопического гриба Aspergillus niger
И. Г. Калинина 1, *, В. Б. Иванов 1, С. А. Семенов 1, В. В. Казарин 1, О. А. Жданова 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
* E-mail: i_kalinina1950@mail.ru
Поступила в редакцию 27.09.2019
После доработки 04.12.2019
Принята к публикации 20.01.2020
Аннотация
Установлено, что обратимое снижение электрического сопротивления изоляции лакоткани при воздействии микроскопического гриба Aspergillus niger обусловлено возрастанием электропроводности материала в результате сорбции в его объеме продуцируемых микроорганизмом электропроводящих веществ. Предложены кинетические модели снижения электрического сопротивления изоляции в условиях роста на ней микроскопического гриба. Модели могут быть использованы для разработки методики определения стойкости изоляционных материалов к воздействию микробиологического фактора.
ВВЕДЕНИЕ
Изменение свойств полимеров при контакте с микроскопическими грибами обычно связывают с воздействием специфических жидких сред, состоящих из химических веществ, продуцируемых микроорганизмами в процессе метаболизма (органические кислоты, ферменты, соли и др.) [1–3]. Воздействие грибов, так же как и традиционных агрессивных сред, может обуславливаться различными физическими и химическими процессами [4]. В работе [5] нами показано, что снижение электрического сопротивления изоляции (R) пластифицированного поливинилхлорида (ПВХ-пластиката) в условиях роста на его поверхности микроскопического гриба Aspergillus niger (A. niger) обусловлено возрастанием электропроводности материала вследствие адсорбции на нем токопроводящих веществ (метаболитов), выделяемых микроорганизмом в процессе жизнедеятельности. При таком характере воздействия значимый эффект снижения величины R наблюдался только при проведения замеров контролируемого параметра без удаления биомассы, а значит, и адсорбционно-активных метаболитов с поверхности материала. Для очищенных образцов влияния микроорганизма на величину R не обнаруживается. Среднее значение электрического сопротивления изоляции таких образцов близко к исходному (определенному до проведения испытаний). Вместе с тем отмечено что воздействие микроскопического гриба способствовало повышению дисперсии величины R, т.е. снижало стабильность диэлектрических свойств ПВХ-пластиката. Установлено, что изменение этой статистической характеристики носит обратимый характер. Дисперсии величин R исходных образцов и образцов после воздействия микроорганизма, последующей очистки и кондиционирования различаются незначительно.
Такие обратимые изменения, наблюдаемые после удаления биомассы, позволяют предположить, что они связаны прежде всего с пластифицирующим действием токопроводящих метаболитов, диффундировавших в объем материала. Цели работы – подтверждение этой гипотезы и выявление кинетических закономерностей такого сорбционного воздействия метаболитов A. niger на диэлектрические свойства изоляционного материала.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследовали двухслойную композиционную полимерную изоляцию провода БПВЛ (токопроводящая жила медная, состоящая из более чем 100 мягких луженых проволок). В экспериментах использовали образцы провода сечением 10 мм2 и длиной 400 мм. Наружный слой изоляции – лакотканевая оплетка, внутренний слой – ПВХ-пластикат марки И-40-13 (ГОСТ 5960-72). Лакотканевая оплетка представляет собой хлопчатобумажную нитяную основу, пропитанную этилцеллюлозным лаком ЭЦ-959 (ТУ-6-10-691-74). Согласно используемой методике измерения электрического сопротивления изоляции провода БПВЛ [5], эффект от воздействия микроорганизма будет определятся, прежде всего, изменением диэлектрических свойств наружного изоляционного слоя – лакотканевой оплетки, на которой происходит рост гриба. При этом, как показали предварительные эксперименты, стандартное водопоглощение лакоткани (2%) на порядок превосходит эту характеристику для ПВХ-пластиката (0.2%). В связи с этим, предположительно, количество перенесенных в объем лакоткани метаболитов должно существенно превышать имеющее место для ПВХ, и, следовательно, он может играть значимую роль в изменении диэлектрических свойств.
В качестве тест-микроорганизма применяли микроскопический гриб A. niger (штамм ВКМF-2039), являющийся одним из наиболее распространенных и активных биодеструкторов полимерных материалов. Испытания проведены по методике, учитывающей основные требования государственного стандарта по определению стойкости материалов и изделий к воздействию плесневых грибов [6]. Образцы, предварительно очищенные 30%-ным этиловым спиртом от внешних загрязнений, инокулировали водной суспензией спор гриба и выдерживали в условиях, оптимальных для его развития (температура – (29 ± 2) °С, относительная влажность более – 90%). Параллельно, в таких же условиях, что и в случае зараженных A. niger образцов, испытывали контрольные (не зараженные грибом) образцы.
Периодически снимали часть образцов с испытаний, очищали их и определяли сопротивление изоляции R (Ом). Измерения проводили сразу после очистки, а затем – после сушки образцов. Поверхность провода очищали сначала смоченной раствором этилового спирта, а затем сухой мягкой хлопчатобумажной тканью. Сушку осуществляли при выдержке в условиях лаборатории в течение 72 ч. Более продолжительная сушка не приводит к изменению величины R. Согласно [6], микроскопический гриб для испытаний выращивали на агаризованной среде Чапека–Докса при температуре (29 ± 2) °С в течение 14 сут. Для заражения образцов использовали водную суспензию, содержащую ~(1–2) ⋅ 106 спор в 1 мл. Концентрацию спор определяли микроскопическим методом с помощью оптического микроскопа, снабженного счетной камерой Горяева. На поверхность образцов суспензию наносили капельным методом (~0.2 мл суспензии на 1 см2 поверхности). После заражения образцы выдерживали до высыхания капель (~60 мин) и помещали в камеру, где поддерживали температуру (29 ± 2) °С и относительную влажность более 95%. Продолжительность испытаний – 25 сут. По данным работы [7] в этот период величина биомассы А. niger на лакоткани достигает своего максимального значения.
В течение всего срока испытаний периодически измеряли величину R (Ом) образцов. Измерения проводили тераомметром Е6-13А. В качестве измерительного электрода использовали латунный хомут шириной 70 мм с толщиной стенок 0.5 мм и диаметром 8.8 мм, что на 1.2 мм меньше наружного диаметра провода, в результате чего обеспечивается плотное прилегание к нему электрода. К закрепленному хомуту присоединяли щуп (наконечник “земля”) измерительного прибора. Второй щуп прибора присоединяли к оголенной жиле тестируемого образца провода. Измерения проводили при постоянном напряжении 1000 В на 60-той секунде после приложения напряжения. Выполнялось трехкратное измерение значений сопротивления изоляции при определенном расстоянии между обрезом последней изоляции у оголенной жилы и закрепленным на ней латунным хомутом, подсоединенным к прибору. Замеры осуществляли в двух-трех точках по всей длине образца посредством передвижения латунного электрода. Определяли математическое ожидание, и полученные значения сопротивления изоляции образца пересчитывали на 1 пог. м длины провода (далее все значения электросопротивления изоляции приведены в пересчете на 1 м провода). Для одного определения величины R испытывали не менее пяти образцов. Разброс экспериментальных результатов не превышал 15%. Его характеризовали отношением среднего квадратичного отклонения к математическому ожиданию. Обработку экспериментальных данных, включая их аппроксимацию математическими моделями, проводили при помощи программы STATISTICA 6.1. Величина сопротивления изоляции провода до испытаний (исходная) составляет R0= 1.26 ⋅ 1010 Ом. По техническим условиям удельное сопротивление должно быть не менее 1.0 ⋅ 107 Ом. Следовательно, используемые в экспериментах провода работоспособны и удовлетворяют предъявляемым к ним требованиям.
При анализе результатов использовали полученную нами в работе [7] экспериментальную кинетическую кривую роста величины биомассы гриба A. niger (штамм ВКМ F-2039) на лакотканевой оплетке проводов. Условия культивирования гриба на материале в работе [7] и в данном исследовании были одинаковыми.
На рис. 1 представлены кинетические кривые изменения электрического сопротивления изоляции (R), измеренного сразу после очистки образцов от биомассы A. niger, и сопротивления соответствующих контрольных образцов (Rк), а также кинетическая кривая роста биомассы (m) гриба на лакотканевой оплетке провода, аппроксимированная логистическим уравнением [7]. Кинетические зависимости величин R и Rк представлены в виде соединенных средних значений электрического сопротивления изоляции с доверительным интервалом, определенным при уровне значимости α = 0.05.
Рис. 1.
Кинетические кривые изменения электрического сопротивления изоляции (R) лакотканевой оплетки провода при культивировании на образцах микроскопического гриба и сопротивления соответствующих контрольных образцов (Rк), а также кинетическая кривая роста на ней биомассы (m) A. niger (измерения величин R и Rк проводились сразу после очистки образцов, без их сушки).
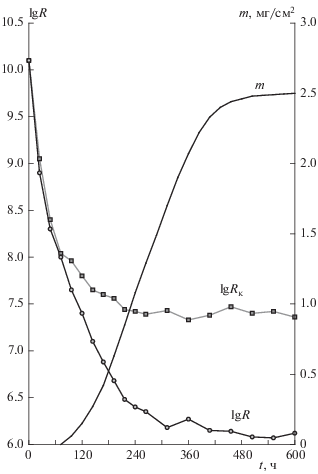
Установлено, что при используемом режиме выполнения замеров снижение R очищенной лакотканевой оплетки происходит в течение всего времени ее контакта с микроорганизмом. При этом эффект от воздействия гриба на диэлектрическую характеристику электроизоляции обнаруживается только после определенного времени (t1) инкубирования образцов, равного ~80 ч, что близко к продолжительности фазы адаптации микроорганизма к материалу (т.е. фазы, когда рост биомассы гриба еще не обнаруживается). В период времени (t–t1) экспериментальные зависимости R (t) для зараженных грибными клетками и контрольных образцов совпадают. Установлено также, что сушка очищенных, подвергавшихся воздействию гриба и контрольных образцов приводит к восстановлению величин их электрического сопротивления до исходного, наблюдаемого до испытаний значения.
Полученные результаты могут быть объяснены на основании сорбционной гипотезы. Так, в начальный период испытаний, когда эффект воздействия микроорганизма еще не обнаруживается, снижение R связано, по-видимому, с поглощением (сорбцией) материалом атмосферной влаги [8, 9].
Рост биомассы, как известно, сопровождается появлением и увеличением концентрации метаболитов, в том числе токопроводящих [10, 11]. Следствием этого, согласно развиваемым представлениям, является диффузионный процесс, приводящий к постепенному их накоплению в объеме и пластификации лакоткани, что, начиная с момента времени t1, и приводит к возрастанию ее токопроводности и, соответственно, снижению электрического сопротивления (в сравнении с наблюдаемым в контрольном опыте). Такое снижение R продолжается непрерывно в течение всего времени накопления метаболитов, т.е. роста колонии микроорганизма на лакотканевой оплетке. Восстановление диэлектрических свойств лакоткани до исходного уровня после сушки образцов связано, по-видимому, с десорбцией метаболитов (или воды, в случае контрольных образцов) из материала, происходящей при отсутствии межу ними химического взаимодействия.
Общеизвестно, что перенос жидких сред в материале описывается диффузионными уравнениями Фика. Известные решения этих дифференциальных уравнений [12–14] использовались нами для подтверждения гипотезы о сорбционном характере изменений диэлектрических свойств лакоткани под воздействием метаболитов развивающегося на ней микроскопического гриба и получения аналитической модели кинетики этого процесса.
Принимали, что изменение электрического сопротивления изоляции прямопропорционально средней концентрации метаболитов микроорганизма в материале (Cм):
где R0 и R – электрическое сопротивление изоляции в момент начала ее контакта со средой (с метаболитами микроорганизма) и в момент времени t соответственно; βR – коэффициент пропорциональности.Используя упрощенные решения уравнения Фика [9, 10], описывающие изменение концентрации вещества в объеме тела в зависимости от времени, и переходя с помощью выражения (1) от концентрации метаболитов к величине R, для малых времен воздействия среды (метаболитов микроорганизма), т.е. на начальной стадии процесса ее диффузии в материал, получим
(2)
$\frac{{{{R}_{0}} - R}}{{{{R}_{0}} - {{R}_{\infty }}}} = \frac{2}{r}{{\left( {\frac{{{{D}_{{ef}}}t}}{\pi }} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$Для больших времен воздействия среды (метаболитов), т.е. на завершающей стадии процесса диффузии,
(3)
$\frac{{R - {{R}_{\infty }}}}{{{{R}_{0}} - {{R}_{\infty }}}} = \frac{8}{{{{\pi }^{2}}}}\exp \left( { - \frac{\pi }{{4{{r}^{2}}}}{{D}_{{ef}}}t} \right).$С помощью программы STATISTICA 6.1 проведена кусочно-линейная аппроксимация экспериментальных данных в координатных плоскостях линеаризованных выражений (2) и (3). Расчеты показали, что экспериментальные данные на начальном и завершающем участках кривой зависимости R = φ(t) при t > t1 успешно аппроксимируются моделями выражениями (2) и (3). Соответствие кинетических моделей, описываемых выражениями (2) и (3), экспериментальным данным соответственно на начальном и завершающем участках кинетической кривой изменения R характеризуются высокой степенью достоверности. Величины индексов корреляции составляют 0.94 и 0.96 соответственно. При этом эффективные коэффициенты диффузии Def, вычисленные (для начального и завершающего участков кинетической кривой) по уравнениям (2) и (3), различаются незначительно: их значения равны соответственно 0.38 ⋅ 10–12 м2/с и 0.41 ⋅ 10–12 м2/с. Это является важным признаком применимости диффузионных законов Фика для описания исследуемого процесса [9, 10], что подтверждает сорбционно-диффузионный механизм влияния метаболитов гриба на диэлектрические свойства лакоткани.
ЗАКЛЮЧЕНИЕ
Установлено, что снижение электрического сопротивления изоляции лакоткани при воздействии микроскопического гриба Aspergillus пiger может носить обратимый характер. Изменение этой диэлектрической характеристики обусловлено пластификацией материала в результате сорбции в его объеме продуцируемых микроорганизмом электропроводящих веществ.
Предложены кинетические модели снижения величины электрического сопротивления изоляции лакоткани при росте на ней микроскопического гриба, основанные на представлениях о переносе жидких сред в материалах и диффузионных уравнениях Фика. Модели могут быть использованы для разработки методики определения стойкости изоляционных материалов к воздействию микробиологического фактора.
Работа выполнена в рамках финансирования госзадания ФИЦ ХФ им. Н.Н. Семёнова РАН № ГЗ-0082-2019-0008 (АААА-А20-120030590042-8).
Список литературы
Сахно О.Н., Селиванов О.Г., Чухланов В.Ю. Биологическая устойчивость полимерных материалов / Под общ. ред. проф. Трифоновой Т.А. Владимир: Владим. гос. ун-тет им. А.Г. и Н.Г. Столетовых, 2014.
Webb J.S., van der Mei H.C., Nixon M., Eastwood I.M., Handley P.S. // Appl. Environ. Microbiol. 1999. P. 3575.
Semenov S.A., Gumargalieva K.Z., Zaikov G.E. Biodegradation and Durability of Materials under the Effect of Microorganisms. Utrecht, Boston: VSP, 2003.
Иванов В.Б., Солина Е.В., Староверова О.В. и др. // Хим. физика. 2017. Т. 36. №11. С. 72.
Калинина И.Г., Гумаргалиева К.З., Семенов С.А., Казарин В.В., Жданова О.А. // Хим. физика. 2019. Т. 38. №3. С. 70.
ГОСТ 9.048-89. ЕСЗКС. Изделия технические. Методы лабораторных испытаний на стойкость к воздействию плесневых грибов; http//www.gostexpert.ru/gost/gost-9.048-89/
Семенов С.А., Гумаргалиева К.З., Заиков Г.Е. // Горение, деструкция и стабилизация полимеров. СПб.: Изд-во НОТ, 2008. С. 100.
Рихтера М., Бартакова Б. Тропикализация электрооборудования. М.–Л.: Госэнергоиздат, 1962.
Электрические свойства полимеров / Под ред. Сажина Б.И. Л.: Химия, 1986.
Калинина И.Г., Гумаргалиева К.З., Семенов С.А. // Хим. физика. 2017. Т. 36. № 3. С. 54.
Калинина И.Г., Гумаргалиева К.З., Семенов С.А., Казарин В.В. // Хим. физика. 2018. Т. 37. № 2. С. 78.
Баррер Р. Диффузия в твердых телах. Пер. с англ. / Под ред. Тазулахова Б.Д. М.: Изд-во иностр. лит., 1948.
Степанов Р.Д., Шленский О.Ф. Расчет на прочность конструкций из пластмасс, работающих в жидких средах. М.: Машиностроение, 1981.
Кулиш Е.И., Туктарова И.Ф., Чернова В.В., Захаров В.П., Колесов С.В. // Хим. физика. 2015. Т. 34. № 4. С. 35.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


