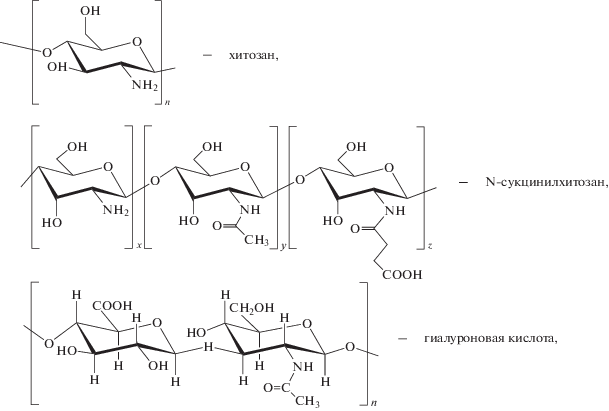
Химическая физика, 2020, T. 39, № 11, стр. 73-79
Ферментативная устойчивость наночастиц интерполиэлектролитных комплексов хитозана
С. В. Колесов 1, Л. А. Бадыкова 1, Р. Х. Мударисова 1, *
1 Уфимский институт химии Уфимского Федерального исследовательского центра
Российской академии наук
Уфа, Россия
* E-mail: mudarisova@anrb.ru
Поступила в редакцию 25.10.2019
После доработки 29.11.2019
Принята к публикации 20.12.2019
Аннотация
Рассмотрена динамика изменения размеров микрочастиц полиэлектролитных комплексов на основе гидрохлорида хитозана и полианионов – натриевой соли N-сукцинилхитозана и гиалуроновой кислоты под действием ферментного препарата гиалуронидазы. Показано, что микрочастицы полиэлектролитных комплексов подвергаются ферментативному разрушению, следствием чего является уменьшение размера частиц до 16–70 нм за время от 2 до 10 мин в зависимости от вида полимерной пары. Предположено, что процесс ферментативного разрушения микрочастиц полиэлектролитного комплекса протекает за счет ферментативного отщепления лиофилизирующих фрагментов цепей и выделения гидрофобного ядра наночастиц, составленного из плотно упакованных лестничных последовательностей пар звеньев электростатически комплементарных полиэлектролитов, связанных солевыми связями. Последующие гидрофобные взаимодействия этих частиц приводят к быстрому формированию осадков стехиометрических полиэлектролитных комплексов.
ВВЕДЕНИЕ
В последние годы опубликован ряд обзоров, в которых рассмотрены полиэлектролитные комплексы (ПЭК) хитозана с анионными полисахаридами, а также возможность использования подобных композиций в медицине, фармации, пищевой промышленности и т.д. [1–3]. Один из существенных моментов биомедицинского направления применения таких комплексов связан с биодеградируемостью составляющих их компонентов – полимеров биогенного происхождения. Строение и свойства ПЭК хитозана зависят от природы и структуры сополиэлектролитов (молекулярных масс, плотности заряда и распределения ионогенных групп вдоль полимерной цепи), а также от условий формирования ПЭК (рН и ионной силы раствора, температуры, концентрации и соотношения полимеров). Варьируя тип сополиэлектролита и условия проведения полиэлектролитной реакции, можно получить полимерные материалы в виде геля, пленок, мембран, пористых структур, жидкокристаллических дисперсий, а также нано- и микрочастиц [4–10]. Именно наночастицы дисперсий, самопроизвольно образующиеся в совместном растворе комплементарных по заряду полиэлектролитов (ПЭ) по механизму электростатического взаимодействия противоположно заряженных ионогенных групп с образованием солевых интерполиэлектролитных комплексов, привлекают особое внимание среди многих видов полимерных нано- и микрочастиц вследствие простоты процесса их получения. Использование нано- и микрочастиц в качестве носителей лекарственных соединений может способствовать преодолению тканевых барьеров, уменьшению побочных эффектов от введения лекарственных соединений (токсичности, аллергенности), повышению эффективности последних за счет пролонгирования действия и, главное, адресного переноса их в клетки.
Материалы на основе полимеров природного происхождения, предназначенные для временного функционирования в организме, должны обладать контролируемым сроком деградации, а продукты их распада должны быть нетоксичными и легко выводиться из организма. Биосовместимые и биодеградируемые полимеры, такие как
этому в полной мере отвечают. В многочисленных работах показано, что эти биополимеры подвергаются распаду под действием целого ряда неспецифических ферментов, в том числе ферментов живого организма (пепсина, трипсина, коллагеназы, гиалуронидазы, лизоцима) [11–13]. Процесс ферментативной деградации фиксируется по изменению различных характеристик материала в зависимости от его вида. В случае растворов полисахаридов определяются, как правило, изменения степени полимеризации или связанные с ней показатели вязкости [14, 15]. В работах [16, 17] процесс ферментативной деструкции хитозана изучался по накоплению восстанавливающих сахаров. В случае полисахаридных пленок, волокон и объемных материалов (имплантов или матриксов) чаще всего фиксируется потеря массы или изменение качества поверхности материала [18, 19]. В случае полимерных нано- и микрочастиц на основе биополимеров представляется целесообразным фиксировать процесс биодеградации непосредственно по изменению размеров частиц. Размер частиц непосредственно определяет их перенос и распределение в организме, а разрушение частиц есть фактор, способствующий выделению введенных в них биологически активных соединений.
Известно, что вид материала (например, раствор, гель, пленка) определяет особенности процесса ферментативной деструкции, поскольку с топохимической точки зрения существует принципиальная разница между доступностью для взаимодействия с ферментом звеньев индивидуальных макромолекул полимера в растворе и их доступностью в объемном образце [14, 20]. Так как микрочастицы на основе ПЭК хитозана представляют большой интерес в качестве депо для доставки биологически активных соединений в органы и ткани живого организма, изучение их поведения в ферментосодержащей среде, моделирующей в определенной степени среду живого организма, является важной и актуальной задачей.
Цели настоящей работы – оценка ферментативной устойчивости микрочастиц ПЭК на основе поликатиона – гидрохлорида хитозана (ГХТЗ) и некоторых полианионов – натриевой соли N-сукцинилхитозана (СХТЗ) и гиалуроновой кислоты (ГК) в водной дисперсии под действием ферментного препарата гиалуронидазы и выяснение закономерностей и особенностей этого процесса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Коммерческие образцы полисахаридов: хитозан ТУ 9289-067-00473124-03 (ММ = 70 кДа, степень дезацетилирования – 87%) и водорастворимая натриевая соль N-сукцинилхитозана ТУ 9284-027-11734126 (ММ = 207 кДа, степень замещения – 62%) производства ЗАО “Биопрогресс” (г. Щелково, Россия), гиалуроновая кислота (ММ = 43 кДа) (Leko Style, Санкт-Петербург), использовали без дополнительной очистки. В качестве ферментного препарата использовали гиалуронидазу в виде фармакопейного препарата “Лидаза” производства ФГУП НПО Микроген Минздрава России.
Гидрохлорид хитозана получали в виде пленки из солянокислого раствора хитозана (2 г хитозана в 50 мл 1%-ного раствора соляной кислоты) путем высушивания на воздухе и далее под вакуумом до постоянной массы. Мольное соотношение соляная кислота : хитозан при этом составляет 1 : 07.
Образцы ХТЗ с ММ = 30 кДа и N-сукцинилхитозана с ММ = 67 кДа получали методом окислительного расщепления высокомолекулярных полимеров перекисью водорода в водном растворе по методике, описанной в работе [21]. Полагали, что содержание ацетамидных, амино- и N-сукцинильных групп при окислительном расщеплении макроцепей по закону случая не изменялось.
Степень деацетилирования (СД) хитозана оценивали кислотно-основным титрованием с потенциометрическим определением точек эквивалентности на кулонометрическом титраторе ТК100-В по формуле [22]
Молекулярную массу (MZ) деструктированных полимеров определяли методом седиментационного равновесия (ультрацентрифуга МОМ-3080) и рассчитывали согласно формуле
Водные дисперсии ПЭК получали путем титрования водного раствора полианиона водным раствором гидрохлорида хитозана при интенсивном перемешивании (500 об/мин) при комнатной температуре с интервалом между введением порций в 5 мин. Фазовое поведение систем оценивали визуально по появлению опалесценции смеси растворов ПЭ и по образованию осадка комплекса. Размеры частиц опалесцирующих систем ПЭК определяли методом лазерного рассеяния на приборе Sald 7101 (Shimadzu). Длина волны полупроводникового лазера – 375 нм. Рабочий диапазон измерения диаметров частиц: 10 нм – 300 мкм. Измерения проводились в специальных кварцевых кюветах Sald-BC с механическим вертикальным перемешиванием при комнатной температуре. Для сравнительной характеристики частиц по размеру были взяты медианные размеры частиц, соответствующие точке на дифференциальной кривой распределения, слева и справа от которой находится по 50% площади под кривой распределения. Ошибка измерения составляет 1%. За время устойчивости систем принимали время до момента образования визуально наблюдаемого осадка ПЭК.
В образующихся системах мольное соотношение компонентов z, начиная с которого происходит формирование частиц ПЭК, определяли как отношение молярной концентрации ионогенных звеньев ГХТЗ, рассчитанное с учетом степени деацетилирования, к молярной концентрации ионогенных групп полианиона (ПА): z = [ГХТЗ]/[ПА]. Для СХТЗ концентрация ионогенных звеньев рассчитана с учетом степени деацетилирования и степени модификации по аминогруппам.
Дисперсные системы характеризовали также массовым содержанием суммы полимеров, ω, мас.%. Массовую концентрацию ГХТЗ и ПА в растворе находили по отношению массы растворенного вещества к общей массе раствора с учетом влажности полисахаридов. Влажность полисахаридов составляла 4–5%.
Для проведения ферментативной деструкции ферментный препарат, предварительно растворенный в небольшом количестве дистиллированной воды, вводили в водную дисперсию микрочастиц ПЭК. С целью оценки динамики изменения размеров частиц через определенные промежутки времени отбирали пробы из объема реакционной системы и определяли текущие размеры частиц.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Выбор объектов исследования обусловлен следующими соображениями. Гиалуронидаза является специфическим ферментом, расщепляющим ГК. В то же время в работе [15] показано, что этот фермент успешно гидролизует хитозан и СХТЗ в растворе. Оптимум активности гиалуронидазы проявляется в интервале рН = 5.5–7.0. Также все компоненты, включая соли ГХТЗ и СХТЗ, хорошо растворимы в нейтральной водной среде. В растворах с рН = 6.5–7.0 исходный хитозан, имеющий рК = 6.2–6.5 в зависимости от молекулярной массы [23], практически не растворяется из-за недостаточно высокого содержания заряженных групп. В то же время образцы хитозана в виде гидрохлоридных солей хорошо растворяются в воде и не образуют осадков при длительном хранении [24]. Водные смеси ГХТЗ–СХТЗ имеют рН = 6.5–7.0, а смеси ГХТЗ–ГК – рН = 6.9. Соли, ГХТЗ и СХТЗ, являются сильными полиэлектролитами и в нейтральных водных растворах находятся в полностью ионизированной форме.
При сливании растворов ГХТЗ с полианионами в определенных мольных соотношениях образуются дисперсные системы микрочастиц ПЭК, что обнаруживается по появлению устойчивой опалесценции смеси. Как показано в работе [25], размер частиц и устойчивость систем в отношении образования седиментационно нестабильных дисперсий зависят от соотношения молекулярных масс ПЭ, величины z и концентрации полимерного раствора. В качестве исходных выбраны системы, параметры которых обеспечивали получение дисперсий с размерами частиц в нанометровом диапазоне и устойчивостью в отношении образования осадка в течение времени, необходимого для проведения эксперимента по ферментативной деструкции. В работе [26] показано, что ферментативная деструкция ХТЗ в растворе, оцениваемая по уменьшению характеристической вязкости, описывается кинетическими кривыми, выходящими на некоторое ее постоянное значение уже в течение 24–120 ч.
Размеры частиц исходных комплексов и динамика изменения их размеров во времени приведены в табл. 1 и на рис. 1. Во всех дисперсных системах в присутствии фермента происходит деструкция цепей полисахаридов, формирующих частицы ПЭК, результатом чего является уменьшение размеров частиц со временем. При этом для конкретных видов ПЭК проявляются особенности процесса ферментативной деструкции.
Таблица 1.
Характеристики исходных дисперсных систем ПЭК полисахаридов
| Состав ПЭК | z | ω, мас.% | Начальный размер частиц D, нм | Время до образования осадка, ч |
|---|---|---|---|---|
| ХТЗ(70)–СХТЗ(67) | 0.20 | 0.10 | 201 | 120 |
| ХТЗ(30)–СХТЗ(207) | 0.40 | 0.94 | 340 | >360 |
| ХТЗ(70)–ГК | 0.70 | 0.07 | 209 | 360 |
Рис. 1.
Относительное изменение размеров частиц ПЭК полисахаридов во времени: 1 – ГХТЗ(30)–СХТЗ(207), 2 – ГХТЗ(70)-ГК, 3 – ГХТЗ(70)–СХТЗ(67).
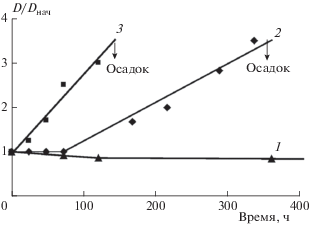
При сливании растворов гидрохлорида хитозана с ММ = 70 кДа (ГХТЗ(70)) и ГК образуется относительно устойчивая (до 360 ч) дисперсная система с начальным размером частиц 209 нм (табл. 2). При введении в раствор ферментного препарата процесс деструкции начинается достаточно быстро и в течение 15 мин размер частиц уменьшается до 18 нм и далее не изменяется по крайней мере в течение нескольких часов. Однако примерно через 20 ч размер частиц в дисперсной системе увеличивается до 200 нм, что свидетельствует о развивающихся в системе процессах структурообразования. В течение 40 ч размер частиц увеличивается до 450 нм, через 70 ч – до 500 нм. Через 190 ч в системе образуется осадок.
Таблица 2.
Изменение размера частиц D, дисперсных систем ПЭК полисахаридов в процессе ферментативной деструкции в моменты времени 0, 2, 5…90 мин
| ПЭК | Сф, мас. % | D, нм | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 0 | 2 | 5 | 10 | 15 | 30 | 60 | 90 | ||
| ХТЗ(70)–ГК | 0.060 | 209 | 36 | 27 | 19 | 18 | 18 | 18 | 18 |
| ХТЗ(70)–СХТЗ(67) | 0.055 | 201 | 124 | 85 | 73 | 130 | осадок | ||
| ХТЗ(30)–СХТЗ(207) | 0.054 | 340 | 210 | 163 | 17 | 17 | осадок | ||
Для ПЭК ГХТЗ(70) и СХТЗ с ММ = 67 кДА (СХТЗ(67)) процесс деструкции также начинается очень быстро. Для пары полимеров с сопоставимыми значениями молекулярных масс уже через 10 мин размер частиц уменьшается почти в 3 раза (табл. 2). Однако через 15 мин, несмотря на присутствие фермента, наблюдалось увеличение размера частиц, а через 30 мин в системе отмечено появление осадка ПЭК. После интенсивного перемешивания осадочной суспензии в течение 5 ч размер частиц составил 769 нм, а на следующий день при определении в тех же условиях – 784 нм. Для пары полимеров, сильно различающихся по молекулярным массам, за 10 мин деструкции уменьшение размера частиц оказалось еще более значительным – в 20 раз, а через 20–30 мин в системе появился осадок ПЭК.
Таким образом, неожиданным результатом оказалось то, что в процессе ферментативной деструкции параллельно с процессом уменьшения размеров частиц идут процессы, приводящие к их укрупнению и, в конечном счете, к более быстрому, чем в отсутствие фермента, образованию осадков ПЭК. Примечательно, что добавление новой порции фермента не приводило к продолжению деструкции. Например, в случае ферментолизованного ПЭК ГХТЗ(70)–ГК с размером частиц 443 нм после добавления новой порции лидазы размер частиц через 40 мин стал равен 470 нм. Повторное добавление через 24 ч лидазы к дисперсии ПЭК ГХТЗ(70)–СХТЗ(67) также не вызвало значительной деструкции частиц.
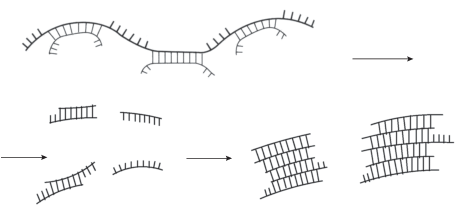
Объяснение наблюдаемых закономерностей можно дать, исходя из представлений о структуре ПЭК как о полимерах лестничного строения. Последовательности пар звеньев, связанных солевыми связями, чередуются в полимерах с дефектами, состоящими из разобщенных гидрофильных звеньев ПЭ [26]. Согласно полученным результатам схему ферментативной деструкции ПЭК можно представить так, как показано на рис. 2.
Из-за стерического несоответствия между электростатически комплементарными цепями ПЭ около 20% звеньев в ПЭК находятся в дефектах в виде свободных концов цепей и петель [27]. Допустим, что под действием фермента разрываются по закону случая как гликозидные связи в лестничных последовательностях, доступные на поверхности частиц ПЭК, так и гликозидные связи свободных звеньев, входящих в состав дефектов цепей и составляющих гидрофильную оболочку частиц ПЭК. В первом случае разрыв цепей на структуре ПЭК сказаться никак не должен, так как не изменяет длину последовательностей солевых связей и не приводит к появлению в системе новых компонентов. Во втором случае деструкция приводит к появлению в растворе дополнительных фрагментов цепей свободных ПЭ, вероятнее всего, небольшой молекулярной массы. Следует учитывать также деструкцию ПЭ, находящихся в избытке, с образованием более низкомолекулярных продуктов.
Для пары сильных ПЭ ГХТЗ(30)–СХТЗ(207), сильно различающихся по степеням полимеризации (Р) и отвечающих условию РПА$ \gg $ РПК, частицы ПЭК в избытке полианиона относительно устойчивы в течение длительного периода, вероятно, вследствие наличия большого количества лиофилизирующих дефектов. Фермент, “обрезая” эти дефекты, способствует выделению гидрофобных частиц с составом, близким к стехиометрическому. Такие частицы склонны к процессу агрегации и появлению осадка вследствие гидрофобных взаимодействий.
Пара ГХТЗ(70)–СХТЗ(67) с сопоставимыми молекулярными массами характеризуется невысокой устойчивостью дисперсной системы, обусловленной только наличием гидрофильных звеньев дефектов. При появлении коротких цепочек ГХТЗ при ферментативной деструкции дефектов они (цепочки), вероятно, быстро вовлекаются в образование стехиометрического ПЭК с избытком ПА с образованием гидрофобных частиц и их последующей быстрой агрегацией с образованием осадка.
Появление в результате ферментативной деструкции дополнительного количества низкомолекулярных свободных цепей ГХТЗ повлечет за собой образование комплекса за счет избытка полианиона. Кроме того, следует иметь в виду, что такие слабые полианионы, как ГК, при значениях рН = 6.5–6.9 содержат часть неионизированных карбоксильных групп и включаются в состав нерастворимых частиц ПЭК в некотором избытке [28], участвуя в образовании водородных связей и гидрофобных взаимодействиях.
ЗАКЛЮЧЕНИЕ
Таким образом, на примере водных коллоидных дисперсий наночастиц ПЭК на основе биоразлагаемых полисахаридов – солей ГХТЗ и N-сукцинилхитозана, гиалуроновой кислоты показано, что эти частицы подвергаются ферментативному разрушению под действием гиалуронидазы, результатом чего является достаточно быстрое уменьшение их размера. Последнее обстоятельство, вероятно, связано с отщеплением под действием фермента свободных лиофилизирующих фрагментов цепей и выделением таким образом гидрофобного ядра наночастиц, составленного из плотно упакованных лестничных последовательностей пар звеньев электростатически комплементарных полиэлектролитов, связанных солевыми связями. Агрегация деструктированных частиц за счет гидрофобных взаимодействий приводит к последующему росту размеров частиц вплоть до потери ими седиментационной устойчивости и выпадения осадков, причем более быстрому, чем в случае недеструктированных дисперсий наночастиц ПЭК.
Анализы выполнены на оборудовании ЦКП “Химия” УфИХ УФИЦ РАН.
Статья подготовлена в рамках выполнения программы ФНИ государственных академий на 2019–2021 гг. Госзадание № АААА-А17-117011910026-3.
Список литературы
Izumrudov V.A. // Polym. Sci. A. 2012. V. 54. № 7. P. 513.
Краюхина М.А., Самойлова Н.А., Ямсков И.А. // Успехи химии. 2008. Т. 77. № 9. С. 799; https://doi.org/10.1070/RC2008v077n09ABEH003750
Iliva A.V., Varlamov V.P. // Appl. Biochem. and Microbiol. 2005. V. 41. № 1. P. 5.
Petrova V.A., Orekhov A.S., Chernyakov D.D. et al. // Crystallogr. Rep. 2016. V. 61. № 6. P. 945.
Sabitha P., Vijaya Ratna J. and Ravindra Reddy K. // Intern. J. Chem. Technol. Res. 2010. V. 2. № 1. P. 88.
Мусабаева Б.Х., Мурзагулова К.Б., Ким М.Е., Изумрудов В.А., Арипжанова З.Ж. // Фармация и фармакология. 2017. Т. 5. № 2. С. 164.
Devi M.G., Dutta S., Al Hinai A.T., Feroz S. // Korean J. Chem. Engin. 2015. V. 32. № 1. P. 118.
Черняков Д.Д., Петрова В.А., Баклагина Ю.Г., Гофман И.В., Скорик Ю.А. // Изв. Уфимск. науч. центра РАН. 2016. № 3-1. С. 99.
Гурина М.С., Вильданова Р.Р., Бадыкова Л.А., Власова Н.М., Колесов С.В. // ЖПХ. 2017. V. 90. № 2. P. 197; https://doi.org/10.1134/S1070427217020100
Rafiee A., Alimohammadian M.H., Taraneh G. et al. // Asian Pacific J. Tropical Disease. 2014. V. 4. № 5. P. 372.
Zhang H., Du Y., Yu. X., Mitsutomi M., Aiba S. // Carbohydr. Res. 1999. V. 320. P. 257.
Хитин и хитозан: получение, свойства и применение / Под ред. Скрябина К.Г., Вихоревой Г.А., Варламова В.П. М.: Наука, 2002.
Кулиш Е.И., Туктарова И.Ф., Чернова В.В., Захаров В.П., Колесов С.В. // Хим. физика. 2015. Т. 34. № 4. С.35.
Чернова В.В., Шуршина А.С., Кулиш Е.И. // Хим. физика. 2018. Т. 37. № 6. С. 83.
Чернова В.В., Туктарова И.Ф., Кулиш Е.И. // Хим. физика. 2017. Т. 36. № 4. С. 75.
Кулиш Е.И., Чернова В.В., Хуснутдинова А.Р., Володина В.П., Колесов С.В. // ЖПХ. 2012. Т. 85. № 1. С. 163; https://doi.org/10.1134/S1070427212010314
Луньков А.П., Шагдарова Б.Ц., Ильина А.В. // Изв. Уфимск. научн. центра РАН. 2016. № 3-1. С. 56.
Коновалова М.В., Курек Д.В., Дуриев Е.А., Литвинец С.Г., Варламов В.П. // Там же. С. 42.
Tomihata K., Ikada Y. // Biomaterials. 1997. V. 18. P. 567.
Tuktarova I.F., Chernova V.V., Lazdin R.Y. Kulish E.I. // Prot. Metal and Phys. Chem. Surf. 2016. V. 52. № 2. P. 297.
Купреев Н.И., Быковский Д.В., Кузнецов В.А., Ваел Шехта Матвалли Э.Е. Способ получения низкомолекулярного хитозана. Патент RU 2417088 С1 // Б.И. 2011. № 12.
Кучина Ю.А., Долгопятова Н.В., Новиков В.Ю., Сагайдачный В.А., Морозов Н.Н. // Вестн. МГТУ. 2012. Т. 15. № 1. С. 107.
Tharanathan R.N., Kittur F.S. // Crit. Rev. Food Sci. Nutr. 2003. V. 43. P. 61.
Хайруллин Р.З., Куликов С.Н., Тихонов В.Е. и др. // Вестн. Казан. технол. ун-та. 2010. № 7. С. 148.
Kolesov S.V., Gurina M.S., Mudarisova R.Kh. // Polym. Sci. A. 2019. V. 61. № 3. P. 195.
Зезин А.Б., Кабанов В.А. // Успехи химии. 1982. Т. 51. № 9. С. 1447; https://doi.org/10.1070/RC1982v051n09ABEH002921
Zezin A.V., Rogacheva V.B., Komarova V.S., Razvodovskii Ye.F. // Polym. Sci. USSA. 1975. V. 17. № 12. P. 3032.
Zezin A.B., Lutsenko V.V., Izumrudov V.A., Kabanov V.A. // Ibid. 1974. V. 16. № 3. P. 694.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика