Химическая физика, 2020, T. 39, № 11, стр. 7-15
Динамическая адсорбция ионов аммония из водных растворов сильнокислотными катионитами
И. В. Кумпаненко 1, *, М. В. Дюбанов 1, Н. А. Иванова 1, Н. Ю. Ковалева 1, Е. Г. Раевская 1, А. В. Рощин 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
* E-mail: ivkumpan@chph.ras.ru
Поступила в редакцию 22.07.2019
После доработки 22.07.2019
Принята к публикации 20.09.2019
Аннотация
Выполнен анализ проскоковых кривых колоночной динамической адсорбции ионов аммония катионитами из воды. Экспериментальные данные были взяты из опубликованных научных источников (катионит 650C) либо получены авторами из собственного эксперимента (катионит КУ 2-8чс). В ходе математической обработки обычные проскоковые зависимости C/C0 от t, где t – текущее время, C и C0 – соответственно проскоковая и исходная концентрации загрязняющего вещества в воде, преобразовывались в зависимости ln(C0/C – 1) от t, которые являются линейными функциями в рамках моделей Бохарта–Адамса, Томаса или BDST. Обнаружено, что в рассмотренных в статье случаях для катионитов 650C и КУ 2-8чс эти зависимости нелинейные. Предложен метод анализа такого рода данных, основанный на разложении этих зависимостей в степенной ряд. Коэффициенты разложения были использованы для определения констант скорости адсорбции k и динамической обменной емкости адсорбентов qm.
1. ВВЕДЕНИЕ
Концентрация ионов аммония в поверхностных и грунтовых водах, а также в питьевой воде в последнее время постоянно растет. Точечными источниками загрязнения аммонием могут быть системы отвода муниципальных и промышленных сточных вод, в частности протечки в канализационных трубопроводах и фитингах, в местах очистки сточных вод, в пунктах содержания животных [1–3], а к неточечным источникам можно отнести сельскохозяйственные стоки в местах применения аммонийных удобрений, атмосферные осадки, организацию землепользования вблизи рек и водоемов [1, 4, 5] и т.п.
В зависимости от значений pH и температуры среды в поверхностных водоемах аммоний $\left( {{\text{NH}}_{{\text{4}}}^{ + }} \right)$ и аммиак (NH3) легко превращаются друг в друга [6]. Неионизированный аммиак гораздо токсичнее аммония, в особенности для водных организмов [7], так как он является нейтральной молекулой, которая легко диффундирует через эпителиальные мембраны. Он может нанести вред жаберным эпителиям, способствовать удушению, стимулируя расщепление глюкозы, подавляя цикл Кребса и приводя к прогрессирующему ацидозу, который уменьшает кислородную емкость крови, разрушает кровеносные сосуды, нарушает функции печени и почек [8].
Таким образом, несмотря на слабую токсичность ионов аммония для человека, их попадание в природную водную среду из-за непостоянства ее температуры и кислотности крайне нежелательно. Согласно действующим в РФ нормативам предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения, ПДК ионов аммония в пересчете на азот составляет 0.4 мг/дм3 (приказ Минсельхоза России от 13.12.2016 г. № 552).
В настоящее время разработано множество биологических и физико-химических методов и технологий удаления ионов аммония из водной среды. Физико-химические методы включают в себя адсорбцию и ионный обмен, аэрацию, хлорирование, химическое осаждение, обратный осмос, микроволновое облучение, окисление в сверхкритических условиях [9–17].
Некоторые из перечисленных технологий имеют недостатки, к которым можно отнести высокую стоимость, низкую скорость удаления ионов аммония, существенную зависимость от pH среды и температуры, чувствительность к введению новых загрязнителей. По сравнению с другими методами адсорбция и ионный обмен обладают рядом предпочтительных характеристик: они демонстрируют значительное сродство к ионам аммония, высокую эффективность, низкую стоимость, простоту применения, экологическую безопасность [17–19]. Благодаря этим преимуществам технология водоочистки с помощью ионообменных смол является конкурентоспособной и используется как в домохозяйствах, так и на крупных водоочистных станциях.
Настоящая статья посвящена исследованию очистки воды от ионов аммония методом динамической адсорбции на ионообменных смолах. В частности, на основе данных литературных источников и эксперимента, проведенного авторами, описана математическая обработка выходных кривых адсорбции ионов аммония для колонки, заполненной сильнокислотными ионитами.
2. ДИНАМИЧЕСКАЯ АДСОРБЦИЯ ИОНОВ АММОНИЯ НА СИЛЬНОКИСЛОТНОМ КАТИОНИТЕ DOWEX-MONOSPHERE-650C
В этом разделе мы представим анализ экспериментальных данных из работы [20] по динамической адсорбции ионов аммония на сильнокислотных ионитах. В указанной работе исследовалась адсорбция ионов аммония на катионите Na+-типа PK228 производства Samyang Co. Ltd. и катионите H+-типа Dowex Monosphere 650C производства Dow Chemical Co. как в статическом, так и в динамическом режимах. Поскольку методом динамической колоночной адсорбции исследовался в основном катионит 650C, для которого были получены зависимости вида выходных кривых от массы ионита в колонке, исходной концентрации ионов аммония в растворе и скорости потока раствора, мы сосредоточили свое внимание именно на результатах экспериментальных исследований адсорбции ионов аммония на этом катионите. В ходе обработки экспериментальных данных нам понадобятся характеристики сорбента 650C, представленные производителем: объемная плотность ρ = 0.8009 г/мл и адсорбционная емкость a = 1.90 мэк/мл.
Математическая обработка экспериментальных данных, взятых из [20] и представленных ниже в данном разделе, а также результатов наших собственных экспериментов, описанных в следующем разделе, проводилась аналогично тому, как это было выполнено в наших предыдущих работах [21, 22]. Отметим также, что возможно математическое моделирование динамической адсорбции с помощью пакета программ VBA-EXCEL [23].
Экспериментальные данные по динамической адсорбции имеют вид выходных кривых зависимостей концентрации C (мг/мл) адсорбтива на выходе из колонки от времени t (мин). В научной литературе вместо C(t) чаще используется отношение C(t)/C0, где C0 (мг/мл) – исходная концентрация адсорбтива на входе в колонку. Иногда выходные кривые имеют вид функциональной зависимости C(t)/C0 от текущего объема V (л) прошедшей через нее жидкости. Именно в таком виде представлены экспериментальные данные по динамической адсорбции ионов аммония на катионитах в статье [20]. Эти данные были нами пересчитаны в зависимости, где в качестве аргумента используется время.
Форма выходных кривых для большинства существующих простых моделей адсорбции (Бохарта–Адамса, BDST, Юна–Нельсона и Томаса [21]) является S-образной логистической и описывается формулой
где для модели Томаса и k (мл · мг–1 · мин–1) – константа скорости адсорбции, qm (мг/г) – динамическая обменная емкость (ДОЕ) адсорбента (максимальная возможная концентрация загрязняющего вещества в адсорбенте в динамическом режиме), M (г) – масса адсорбента в колонке, Q (мл/мин) – объемная скорость потока очищаемого раствора.Преобразовав выражение (1), получим
Из (3) видно, что зависимость ln(C0/C – 1) от t для логистической функции вида (1) представлена прямой линией, проходящей через точку a0, соответствующую отсечке на оси ординат при t = 0 с угловым коэффициентом a1. Определив значения a0 и a1 в процессе аппроксимации экспериментальной зависимости ln(C0/C – 1) от t теоретической (3), можно рассчитать величины k и qm, воспользовавшись выражениями (2) и приняв во внимание, что значения M, Q и C0, относящиеся к условиям эксперимента, известны.
Отметим, что иногда при экспериментальных исследованиях наблюдается отклонение зависимости ln(C0/C – 1) от t от линейного вида. Некоторыми исследователями [24, 25] по аналогии с теоретическим анализом роста народонаселения было предложено в этом случае использовать ее обобщенную версию в виде степенного ряда [26–28]:
Сравнивая (3) и (4), получим, что b0 = a0 и b1 = = −a1, откуда следует, что формулы (2) можно представить в виде
Выражение (1) для выходной кривой в обобщенной версии примет вид
(5)
$\frac{C}{{{{C}_{0}}}} = {{\left[ {1 + \exp \left( {\sum\limits_{i = 0}^N {{{b}_{i}}{{t}^{i}}} } \right)} \right]}^{{ - 1}}}.$Обратимся к математической обработке экспериментальных данных, представленных в статье [20]. Имея в виду формулы (1) и (3), мы провели численный пересчет экспериментальных зависимостей C(t)/C0 от V, представленных в [20] на рис. 10 и 11 , в зависимости ln(C0/C − 1) от t. В процессе пересчета предполагалось, что объемная скорость потока очищаемого водного раствора Q = 9.36 л/ч = = 156 мл/мин. Величина Q = 9.36 л/ч взята из подписи к рис. 9 в [20]. Учитывая скорость потока, получаем t(мин) = V(л) ⋅ 1000/156.
Пересчитанные экспериментальные зависимости ln(C0/C − 1) от t показаны на рис. 1 и 2 в виде точек ⚪, ◻ и △. Каждая из представленных на рис. 1 и 2 экспериментальных кривых была аппроксимирована многочленом (4) подходящей степени. В большинстве случаев удовлетворительная подгонка теоретической кривой к экспериментальной наблюдалась, когда правая часть выражения (4) представляла собой квадратный трехчлен (N = 2).
Рис. 1.
Зависимости ln(C0/C – 1) от времени t для процесса динамической очистки воды от ионов аммония на катионите 650C. Точки – экспериментальные данные для различных исходных концентраций C0 (мг/мл) ионов аммония в воде: ⚪ – 0.0005, ◻ – 0.001, △ – 0.002; M = 0.5 г, Q = 156 мл/мин. Сплошные линии 1–3 рассчитаны соответственно для экспериментальных точек ⚪, △, ◻ по формуле (4) при N = 2 с величинами параметров b0, b1, b2, представленными в табл. 1. Точечная линия 2 ' рассчитана для экспериментальной кривой 2 по формуле (4) при N = 3 с величинами параметров b0, b1, b2, b3, представленными в табл. 1.
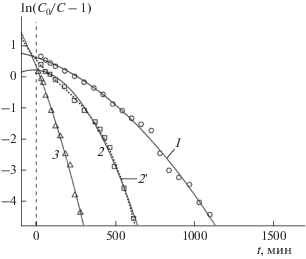
Рис. 2.
То же, что и на рис. 1, при M = 1.0 г, Q = = 156 мл/мин. Точечная линия 1 ' рассчитана для экспериментальной кривой 1 по формуле (4) при N = 3 с величинами параметров b0, b1, b2, b3, представленными в табл. 1. Остальные обозначения те же, что и на рис. 1.
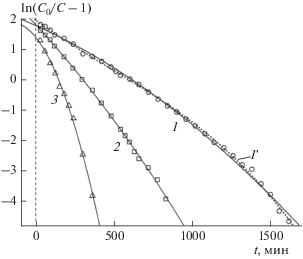
Соответствующие теоретические кривые изображены на рис. 1, 2 сплошными линиями 1–3. Для двух кривых, 2 ' на рис. 1 и 1' на рис. 2, аппроксимация с помощью квадратного трехчлена оказалась не столь успешной: их пришлось аппроксимировать кубическим многочленом (N = 3). Полученные в ходе аппроксимации величины параметров многочленов b0, b1, b2, b3 приведены в табл. 1.
Таблица 1.
Параметры b0, b1, b2, b3уравнения (4), аппроксимирующего кривые рис. 1 и 2, а также рассчитанные значения константы скорости адсорбции k и ДОЕ qm для катионита 650C
| Номер кривой | M, г | C0, мг/мл | b0 | b1 | b2 | b3 | k*, мл/(мг · мин) | qm**, мг/г |
|---|---|---|---|---|---|---|---|---|
| 1 | 0.5 | 0.0005 | 0.61683 | –0.00168 | –2.75E – 06 | 0 | 3.36 | 57.27707 |
| 2 | 0.5 | 0.001 | 0.20929 | –3.86E-04 | –1.16E – 05 | 0 | 0.386304 | 169.0339 |
| 2' | 0.5 | 0.001 | 0.53907 | –0.00637 | 1.10E – 05 | –2.32E – 08 | 6.37 | 26.40343 |
| 3 | 0.5 | 0.002 | 0.32343 | –0.01284 | –1.40E – 05 | 0 | 6.42 | 15.71809 |
| 1 | 1.0 | 0.0005 | 1.76195 | –0.00231 | –9.38E – 07 | 0 | 4.62 | 59.49442 |
| 2' | 1.0 | 0.0005 | 1.93754 | –0.00372 | 1.30E – 06 | –9.25E – 10 | 7.44 | 40.62584 |
| 2 | 1.0 | 0.001 | 1.78596 | –0.00553 | –1.50E – 06 | 0 | 5.53 | 50.38151 |
| 3 | 1.0 | 0.002 | 1.37254 | –0.00648 | –2.13E – 05 | 0 | 3.24 | 66.08526 |
Учитывая, что b0 = a0 и b1 = −a1, с помощью формул (2') были рассчитаны значения констант скорости адсорбции k и ДОЕ qm, которые также приведены в табл. 1. Очевидно, что значения k и qm не должны зависеть от массы M адсорбента в колонке или исходной концентрации адсорбтива C0. Однако сравнение величин k и qm в табл. 1 показывает их значительный разброс: k = 3.24–7.44 мл/(мг ⋅ мин), qm = 15.71809–66.08526 мг/г.
Значения M для кривых 2 (M = 0.5 г) и 1 (M = = 1.0 г) мы здесь не учитываем из-за неудовлетворительной аппроксимации экспериментальных данных теоретической кривой, определяемой выражением (4), для N = 2. Для учтенных значений k и qm под табл. 1 приведены средние значения констант скорости адсорбции $\bar {k}$ и ДАЕ ${{\bar {q}}_{m}},$ а также среднеквадратичные отклонения σk, σq и коэффициенты вариации (КВ) ${{{{\sigma }_{k}}} \mathord{\left/ {\vphantom {{{{\sigma }_{k}}} {\bar {k}}}} \right. \kern-0em} {\bar {k}}}$, ${{{{\sigma }_{q}}} \mathord{\left/ {\vphantom {{{{\sigma }_{q}}} {{{{\bar {q}}}_{m}}}}} \right. \kern-0em} {{{{\bar {q}}}_{m}}}}$ определяемых величин от их средних значений, которые достигают нескольких десятков процентов.
Как мы отмечали выше, производитель катионита 650C определяет следующие его характеристики: объемная плотность ρ = 0.8009 г/мл и адсорбционная емкость a = 1.90 мэк/мл. Отсюда следует, что для ионов аммония ДОЕ в единицах мг/г равно qm = ${{a{\text{ММ}}\left( {{\text{NH}}_{{\text{4}}}^{ + }} \right)} \mathord{\left/ {\vphantom {{a{\text{ММ}}\left( {{\text{NH}}_{{\text{4}}}^{ + }} \right)} \rho }} \right. \kern-0em} \rho }$ = 1.90 ⋅ 18/0.8009 = = 42.7 мг/г, где ${\text{ММ}}\left( {{\text{NH}}_{{\text{4}}}^{ + }} \right)$ – молекулярная масса ионов аммония. Таким образом, величина qm, рассчитанная по данным производителя, находится в интервале разброса величин qm из табл. 1.
Хотя экспериментальные зависимости аппроксимировались уравнением (4) для N = 2 или 3, а не (3), при расчете параметров k и qm мы воспользовались выражениями (2) или (2'), выведенными для линейной зависимости ln(C0/C – 1) от t. Возможность такого подхода объясняется тем обстоятельством, что (см. табл. 1)
(6)
$\left| {{{b}_{{\text{2}}}}} \right|,\left| {{{b}_{{\text{3}}}}} \right| \ll \left| {{{b}_{0}}} \right|,\left| {{{b}_{{\text{1}}}}} \right|.$Вместе с тем условие (6) указывает на то, что имеют силу выражения (2) или (2') и, следовательно, кривые для различных величин C0 должны пересекаться в одной точке ${{a}_{0}} = {{k{{q}_{m}}M} \mathord{\left/ {\vphantom {{k{{q}_{m}}M} Q}} \right. \kern-0em} Q},$ расположенной на оси ординат. Внимательный анализ рис. 1 и 2 показывает, что это не так. Кривые не пересекают ось ординат в одной точке. Более того, сами кривые также не пересекаются в единой точке.
В статье [20] наблюдаемый факт такого поведения кривых объясняется так называемой начальной “протечкой”, которая возникает в ходе динамической колоночной очистки воды. Причиной такой протечки может быть, например, недостаточное время контакта между раствором и смолой, что есть следствие высокой скорости потока и малой толщины неподвижного слоя сорбента. В свою очередь, именно непредсказуемым поведением кривых, не поддающимся описанию формулами (2) или (2'), объясняется большой разброс значений рассчитанных параметров k и qm. В ходе постановки эксперимента, описанного в следующем разделе, мы постарались свести к минимуму начальную протечку.
3. ДИНАМИЧЕСКАЯ АДСОРБЦИЯ ИОНОВ АММОНИЯ НА СИЛЬНОКИСЛОТНОМ КАТИОНИТЕ КУ 2-8чс
В качестве адсорбента ионов аммония в наших экспериментах мы выбрали ионообменную КУ 2-8чс смолу отечественного производства в форме H+ [29], являющуюся сильнокислотным катионитом, так же как и ионит 650C, рассмотренный в предыдущем разделе. В нашей предыдущей работе [30] и работе наших коллег [31] было показано, что катионит КУ 2-8 и его модификации ионами Cu2+, Ca2+, Mg2+ обладают достаточно высокой сорбционной емкостью по отношению к аммиаку, поэтому следует ожидать высокой эффективности КУ 2-8чс при динамической адсорбции ионов аммония.
При постановке эксперимента основное внимание было сосредоточено на поиске условий его проведения, исключающих упомянутую выше начальную протечку очищаемого раствора, следствием которой является наблюдаемый факт непересечения представленных на рис. 1 и 2 кривых, описываемых уравнением (4), в единой точке, расположенной на оси ординат. Этот факт, как уже отмечалось, приводит к большому разбросу измеряемых величин k и qm.
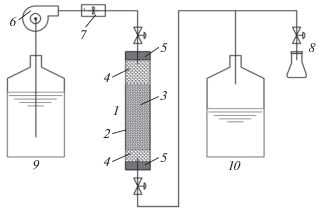
Исследования проводились на установке, схема которой показана на рис. 3. Основной элемент установки – колонка 1 представляет собой трубку 2, изготовленную из молибденового стекла, с внутренним диаметром 1 см и длиной ~10 см. В торцах трубки (колонки) находятся силиконовые уплотнения 5, сквозь которые пропущены трубопроводы. В колонку засыпался адсорбент (катионит КУ 2-8чс) массой M, образующий неподвижный слой 3, положение которого внутри колонки фиксировалось вкладышами 4 из стекловаты. Емкости с исходным раствором NH4Cl (9) – источником ионов аммония и для слива использованного раствора (10) должны иметь достаточно большой объем (в некоторых опытах осуществлялся долив/слив раствора). Требуемая скорость потока раствора задавалась перистальтическим насосом 6, а величина скорости определялась датчиком 7 потока жидкости. Необходимая для построения выходных кривых проскоковая концентрация ионов аммония определялась для проб раствора, взятых с помощью соответствующего ответвления 8. Измерение концентрации ионов аммония проводилось фотометрическим методом с использованием реактива Несслера [32].
Рис. 3.
Схема установки для исследования динамической адсорбции ионов аммония на катионите КУ 2-8чс: 1 – колонка, 2 – трубка из молибденового стекла, 3 – адсорбент (катионит КУ 2-8чс), 4 – вкладыши из стекловаты, 5 – силиконовые уплотнения, 6 – перистальтический насос, 7 – измеритель скорости потока, 8 – ответвление для отбора проб раствора, 9 – емкость с исходным раствором, 10 – емкость для слива использованного раствора.
Для того чтобы снизить вероятность начальной протечки очищаемого раствора, мы уменьшили скорость его потока по сравнению с опытами, описанными в предыдущем разделе, в 2.6 раза: все эксперименты проводились при объемной скорости потока Q = 60 мл/мин. Все условия экспериментов приведены в табл. 2.
Таблица 2.
Условия экспериментов по измерению выходных кривых динамической адсорбции ионов аммония катионитом КУ 2-8чс
| Название параметра | Параметр | Единицы измерения | Значение |
|---|---|---|---|
| Масса катионита | M | г | 2.24; 3.0 |
| Скорость потока | Q | мл/мин | 60 |
| Исходная концентрация ЗВ в воде | C0 | мг/мл | 0.0003; 0.000975; 0.00165; 0.002325; 0.003 |
Работы, описанные в данном разделе, выполнялись поэтапно в следующей последовательности:
1) измерение зависимостей проскоковых концентраций от времени;
2) построение экспериментальных выходных кривых зависимостей C/C0 от t по точкам;
3) пересчет экспериментальных зависимостей C/C0 от t в зависимости ln(C0/C – 1) от t;
4) построение графиков зависимостей ln(C0/C – – 1) от t;
5) аппроксимация этих графиков формулой (4) с определением параметров bi;
6) расчет констант скорости адсорбции k и ДОЕ qm;
7) построение теоретических выходных кривых с помощью формулы (5) и зависимостей ln(C0/C – 1) от t с помощью формулы (4) с использованием параметров bi, определенных в процессе аппроксимации. Ниже этапы выполнения работ будут соответствовать данной последовательности.
Условия проведения экспериментов, значения параметров аппроксимирующих кривых и рассчитанных с их помощью величин k и qm, а также коэффициенты детерминации R2 представлены в табл. 3. Под табл. 3 приведены рассчитанные средние значения констант скорости адсорбции $\bar {k}$ и ДОЕ ${{\bar {q}}_{m}},$ а также среднеквадратичные отклонения σk и σq и КВ ${{{{\sigma }_{k}}} \mathord{\left/ {\vphantom {{{{\sigma }_{k}}} {\bar {k}}}} \right. \kern-0em} {\bar {k}}},$ ${{{{\sigma }_{q}}} \mathord{\left/ {\vphantom {{{{\sigma }_{q}}} {{{{\bar {q}}}_{m}}}}} \right. \kern-0em} {{{{\bar {q}}}_{m}}}}$ определяемых величин от их средних значений.
Таблица 3.
Условия проведения экспериментов по динамической адсорбции ионов аммония катионитом КУ 2-8чс и значения параметров аппроксимирующих кривых и рассчитанных с их помощью величин констант скорости адсорбции k и ДОЕ qm
| M, г | C0, мг/мл | b0 | b1 | b2 | k*, мл/(мг ⋅ мин) | qm**, мг/г | R2 |
|---|---|---|---|---|---|---|---|
| 2.24 | 0.0003 | 5.360 | –0.00196 | –1.12E – 06 | 6.533 | 21.98 | 0.99996 |
| 0.000975 | 5.366 | –0.00645 | –1.61E – 06 | 6.615 | 21.73 | 0.99997 | |
| 0.00165 | 5.358 | –0.01064 | –2.31E – 06 | 6.448 | 22.25 | 0.99989 | |
| 0.002325 | 5.370 | –0.01513 | –2.34E – 06 | 6.508 | 22.11 | 0.99988 | |
| 0.003 | 5.433 | –0.01957 | –3.18E – 06 | 6.523 | 22.31 | 0.99983 | |
| 3.0 | 0.0003 | 7.448 | –0.00231 | –1E – 06 | 7.7 | 19.34 | 0.99983 |
| 0.000975 | 7.065 | –0.00618 | –1.2E – 06 | 6.338 | 22.29 | 0.99981 | |
| 0.00165 | 7.136 | –0.01108 | –7.98E – 07 | 6.715 | 21.25 | 0.99988 | |
| 0.002325 | 7.101 | –0.01486 | –1.38E – 06 | 6.391 | 22.22 | 0.99962 | |
| 0.003 | 7.221 | –0.02003 | 1.45E – 08 | 6.677 | 21.63 | 0.99982 |
В ходе экспериментов сначала были измерены зависимости проскоковых концентраций от времени. Полученные выходные кривые для исходных концентраций C0, перечисленных в табл. 3, а также для неподвижных слоев с массами 2.24 и 3.0 г, представлены на рис. 4 и 5.
Рис. 4.
Выходные кривые динамической адсорбции ионов аммония на катионите КУ 2-8чс при M = 2.24 г. Начальная концентрация ионов аммония C0 (мг/мл): 1 – 0.0003, 2 – 0.000975, 3 – 0.00165, 4 – 0.002325, 5 – 0.003.
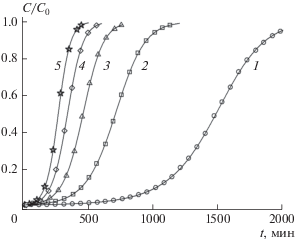
Рис. 5.
Выходные кривые динамической адсорбции ионов аммония на катионите КУ 2-8чс при M = 3.0 г. Обозначения те же, что и для рис. 4.
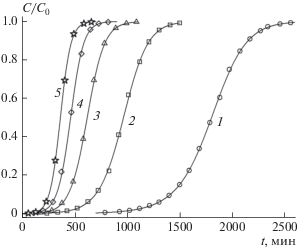
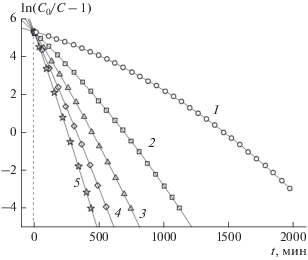
Рис. 6 .
Зависимости ln(C0/C – 1) от времени t для процесса динамической очистки воды от ионов аммония на катионите КУ 2-8чс. Точки – экспериментальные данные для различных исходных концентраций C0 (мг/мл) ионов аммония в воде: ⚪ – 0.0003, ◻ – 0.000975, △ – 0.00165, ◇ – 0.002325, ☆ – 0.003; M = 2.24 г, Q = 60 мл/мин. Сплошные линии 1–5 рассчитаны по формуле (4) с величинами параметров b0, b1, b2, представленными в табл. 3.
Экспериментальные зависимости C/C0 от t были пересчитаны в зависимости ln(C0/C – 1) от t, чьи графики были построены и представлены в виде точек на рис. 6 и 7 .
Рис. 7.
То же, что и на рис. 6 , при M = 3.0 г, Q = = 60 мл/мин. Остальные обозначения те же, что и для рис. 6 .
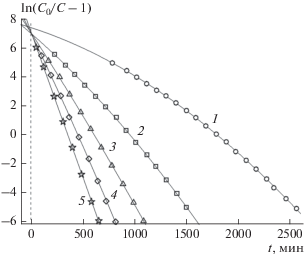
Пересчитанные экспериментальные кривые, обозначенные на рис. 6, 7 различными геометрическими фигурами, были аппроксимированы полиномом (4) с подходящей степенью N = 2. Коэффициенты соответствующих аппроксимирующих парабол bi представлены в табл. 3. С использованием этих коэффициентов с помощью формул (2') были рассчитаны константы скорости адсорбции k и ДОЕ qm, которые также представлены в табл. 3. С использованием коэффициентов bi с помощью формул (5) и (4) были рассчитаны теоретические выходные кривые и зависимости ln(C0/C – 1) от t, показанные сплошными линиями на рис. 4, 5 и рис. 6, 7 соответственно.
Первичный анализ хода кривых, приведенных на рис. 6, 7 , показывает, что все они пересекаются практически в одной точке, расположенной на оси ординат (t = 0). На рис. 6 значение координаты точки a0 на оси ординат для всех кривых находится в интервале 5.358–5.433, на рис. 7 – в интервале 7.065–7.448. Небольшое исключение составляет кривая 1 на рис. 7, которая пересекает ось ординат на некотором удалении от точки пересечения остальных кривых. Это связано с тем, что экспериментальные точки располагаются сравнительно далеко (t = 787 мин) от оси ординат, что неадекватно влияет на расположение теоретической кривой в области значений аргумента t = 0 мин.
Сопоставление хода кривых, показанных на рис. 1, 2 и рис. 6, 7 , в области t = 0 и разброса рассчитанных величин констант скорости адсорбции k и ДОЕ qm, представленных в табл. 1 и 3, однозначно указывает на то, что наглядным показателем отсутствия начальной протечки раствора, которая приводит к такому разбросу и, следовательно, к некорректному определению важнейших характеристик адсорбента и процесса адсорбции, является факт пересечения кривых зависимостей ln(C0/C – 1) от t при различных значениях C0 в единой точке, расположенной на оси ординат. Важными количественными характеристиками разброса рассчитанных величин являются коэффициенты вариации. Их значения наряду со средними значениями величин и среднеквадратичными отклонениями приведены под табл. 1 и 3. Как видно, КВ констант скорости адсорбции k и ДОЕ qm, определенные для динамической адсорбции на катионите 650C, на порядок выше аналогичных величин для адсорбции на катионите КУ 2-8чс. Величины коэффициентов детерминации, приведенные в табл. 3, (R2 > 0.999), указывают на высокое качество аппроксимации экспериментальных зависимостей ln(C0/C – 1) от t параболами полинома (4) при N = 2.
Другими словами, точность определения значений k = 5.393 мл · мг–1 · мин–1 и qm = 42.749 мг/г для динамической адсорбции на катионите 650C невысока (КВ равны 32.1% и 44.58% соответственно), в то время как точность определения значений k = 6.645 мл мг–1 мин–1 и qm = 21.71 мг/г для динамической адсорбции на катионите КУ 2-8чс вполне разумна (КВ равны 5.86% и 4.15% соответственно).
Полученное для КУ 2-8чс значение qm = = 21.71 мг/г близко к величине qm = 1600 г экв/м3 = = 23.4 мг/г для этого катионита, указанной в ГОСТ 20298-74 [29]. При расчетах предполагалось, что объемная плотность катионита КУ 2-8чс ρ = = 1.23 г/см3.
Таким образом, уменьшив скорость потока очищаемого раствора через неподвижный слой сорбента КУ 2-8чс в наших экспериментах (Q = = 60 мл/мин) в 2.6 раза по сравнению со скоростью потока в экспериментах, описанных в статье [20] (Q = 156 мл/мин), мы снизили вероятность начальной протечки раствора и тем самым повысили достоверность определения характеристик адсорбента и процесса адсорбции.
ЗАКЛЮЧЕНИЕ
Статья посвящена математической обработке выходных кривых динамической адсорбции ионов аммония в колонке, заполненной сильнокислотными ионитами. Экспериментальные данные взяты из литературного источника, а также получены в ходе экспериментов, проведенных авторами настоящей статьи. В процессе расчетов обычные для выходных кривых зависимости C/C0 от t преобразовывались в зависимости ln(C0/C – 1) от t, которые в соответствии с моделями Бохарта–Адамса, BDST или Томаса [21] описываются прямыми линиями. Вместе с тем во многих случаях при экспериментальных исследованиях наблюдается отклонение зависимости ln(C0/C – 1) от t от линейного вида. Именно такое отклонение наблюдалось и в рассмотренных в работе [20], и в проведенных и описанных авторами настоящей статьи экспериментах.
В статье детально изложен метод математической обработки такого рода экспериментальных данных. Продемонстрирована возможность определения ряда важнейших характеристик процесса адсорбции и самого адсорбента.
Установлено, что из-за слишком большой скорости потока очищаемой жидкости или малой толщины неподвижного слоя сорбента в системе может возникнуть начальная протечка раствора вследствие недостаточного времени контакта между раствором загрязняющих веществ и адсорбентом. Наличие протечек проявляется в большом разбросе определяемых в ходе математической обработки параметров процесса. Количественным показателем такого разброса служит коэффициент вариации.
Определены константы скорости адсорбции k и ДОЕ адсорбентов qm для процессов динамической адсорбции ионов аммония на сильнокислотных катионитах 650C (экспериментальные данные взяты из работы [20]) и КУ 2-8чс (экспериментальные данные авторов). Получено: для 650C k = 5.393 мл · мг–1 · мин–1(КВ = 32.1%) и qm = = 42.749 мг/г (КВ = 44.58%); для КУ 2-8чс k = = 6.645 мл · мг–1 · мин–1 (КВ = 5.86%) и qm = 21.71 мг/г (КВ = 4.15%). Судя по значениям КВ, разброс величин k и qm для катионита 650C слишком большой, чтобы считать их достоверными. Напротив, значения КВ для катионита КУ 2-8чс достаточно реальны, вследствие чего можно предположить, что нам удалось определить величины k и qm для процесса динамической адсорбции с участием этого адсорбента с удовлетворительной степенью достоверности.
Работа выполнена в рамках Программы фундаментальных исследований ИХФ РАН № 46.15. Номер темы ФАНО 0082-2014-0005. Номер государственной регистрации ЦИТИС: АААА-А17-117091220076-4.
Список литературы
Camargo J.A., Alonso A. // Environ. Intern. 2006. V. 32. P. 831.
Carlson J.C., Anderson J.C., Low J.E. et al. // Sci. Total Environ. 2013. V. 445–446. P. 64.
Jansen J.C., Spliid H., Hansen T.L. et al. // Waste Management. 2004. V. 24. P. 541.
Nolan B.T., Hitt K.J. // Environ. Sci. Technol. 2006. V. 40. P. 7834.
Zhu M., Zhu G., Li W. et al. // Environ. Pollut. 2013. V. 173. P. 216.
Nollet L.M.L., Gelder L.S.P. Handbook of water analysis. London, N.Y.: CRC Press Inc., 2013.
Batley G.E., Simpson S.L. // Marine Pollution Bulletin. 2009. V. 58. P. 1472.
Augspurger T., Keller A.E., Black M.C. et al. // Environ. Toxicol. Chem. 2003. V. 22. P. 2569.
Bermejo M.D., Cantero F., Cocero M.J. // Chem. Eng. J. 2008. V. 137. P. 542.
Bernet N., Delgenes N., Akunna J.C. et al. // Water Res. 2000. V. 34. № 2. P. 611.
Bodalo A., Gomez J.-L., Gomez E. et al. // Desalination. 2005. V. 184. P. 149.
Booker N.A., Cooney E.L., Priestley A.J. // Water Sci. Technol. 1996. V. 34. № 6. P. 17.
Guštin S., Marinšek-Logar R. // Process. Saf. Environ. Prot. 2011. V. 89. P. 61.
Huang H., Huang L., Zhang Q. et al. // Chemosphere. 2015. V. 136. P. 289.
Lin L., Chen J., Xu Z. et al. // J. Hazard. Mater. 2009. V. 168. P. 862.
Siegrist H. // Water Sci. Technol. 1996. V. 34. № 1–2. P. 399.
Turan M. // Low-Dimensional and Nanostructured Materials and Devices Eds. Unlu H. et al. Cham, Heidelberg, N.-Y., Dordrecht, London: Springer Intern. Pub. Switzerland, 2016. P. 477; https://doi.org/10.1007/978-3-319-25340-4_19
Uğurlu M., Karaoğlu M.H. // Microporous Mesoporous Mater. 2011. V. 139. P. 173.
Widiastuti N., Wu H., Ang H.M., Zhang D. // Desalination. 2011. V. 277. P. 15.
Yoon T., Noh B., Moon B. // Korean J. Chem. Eng. 2000. V. 17. № 6. P. 652.
Кумпаненко И.В., Иванова Н.А., Дюбанов М.В. и др. // Хим. физика. 2019. Т. 38. № 3. С. 52.
Кумпаненко И.В., Иванова Н.А., Дюбанов М. В. И др. // Хим. физика. 2019. Т. 38. № 6. С. 59.
Травин С.О., Громов О.Б. // Хим. безопасность. 2018. Т. 2. № 1. С. 67; https://doi.org/10.25514/CHS.2018.1.12882
Lin S.H., Wang C.S., Chang C.H. // Ind. Eng. Chem. Res. 2002. V. 41. P. 4116.
Xu Z., Cai J.-G., Pan B.-C. // J. Zhejiang Univ. Sci. A (Appl Phys & Eng). 2013. V. 14. № 3. P. 155.
Pearl R., Reed L.J. // Proc. Nat. Acad. Sci. 1920. V. 6. № 6. P. 275.
Lloyd P. J. // Population Studies. 1967. V. 21. № 2. P. 99.
Pearl R., Reed L.J. // Proc. Nat. Acad. Sci. 1922. V. 8. № 12. P. 365.
ГОСТ 20298-74. Смолы ионообменные. Катиониты. Технические условия. М.: Изд-во стандартов, 1991.
Кумпаненко И.В., Ефременко Е.Н., Лейкин Ю.А. и др. // Хим. и биологич. безопасность. 2010. № 5–6. С. 20.
Лейкин Ю.А., Мясоедов Б.Ф., Лосев В.В., Кириллов Е.А. // Хим. физика. 2007. Т. 26. № 10. С. 18.
Федеральный природоохранный нормативный документ 14.1:2:3.1-95. Методика измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера. М.: ФГБУ “ФЦАО”, 2017.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


