Химическая физика, 2020, T. 39, № 11, стр. 52-57
Морфология и антибактериальные свойства композитов на основе полилактида и комплекса марганца(III) с тетрафенилпорфирином
Ю. В. Тертышная 1, *, А. В. Лобанов 2, А. В. Хватов 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
* E-mail: moraxella@bk.ru
Поступила в редакцию 21.10.2019
После доработки 19.11.2019
Принята к публикации 20.11.2019
Аннотация
Получены пленочные образцы композиционного материала на основе полилактида (ПЛА) и комплекса марганца(III) с тетрафенилпорфирином с содержанием 0.1–2 мас.%. Методом спектрофотометрии показано, что этот комплекс распределен в матрице ПЛА в виде микровключений. Определено, что введение металлокомплекса порфирина изменяет температуру стеклования и плавления полилактида на 1–2 °С и увеличивает степень кристалличности на 4–5%. Установлено, что температура, соответствующая максимуму пика деструкции композитов, на 2–7 °С ниже по сравнению с чистым ПЛА. Показан антибактериальный эффект полученных композитов в отношении бактерий Staphylococcus aureus, Salmonella typhimurium и Escherichia coli.
ВВЕДЕНИЕ
Получение композитов на основе полимеров и биологически активных соединений является активно развивающейся областью супрамолекулярной химии и направлено на синтез частиц различных размеров, формы и химического состава с улучшенными или новыми свойствами по сравнению с мономолекулярными аналогами [1]. Комплексы марганца – это катализаторы автоокисления ряда биогенных восстановителей и их аналогов, например аскорбиновой кислоты, убихинона и цистеина. В этом процессе происходит промежуточное образование активных форм кислорода – супероксид анион-радикала, пероксидного и гидроксильного радикалов, пероксида водорода. Комплексы переходных металлов эффективно генерируют активные формы кислорода и свободные радикалы [2–5], цитостатическая и другая биологическая активность которых хорошо известна [6]. Такие радикальные и ион-радикальные частицы вызывают окислительные деструктивные реакции, в том числе расщепление нуклеиновых кислот.
Металлокомплексы порфиринов представляются перспективными еще и потому, что, с одной стороны, в них удается стабилизировать степень окисления +3 для большинства катионов переходных металлов, а с другой – сами по себе порфириновые макроциклы в меньшей степени, по сравнению с фталоцианиновыми макроциклами, склонны к агрегации по причине их сравнительно меньшей гидрофобности. Авторы работы [7] исследовали возможность применения комплексов железа с тетрафенилпорфирином (FeClTФП) и его полимерной формы в качестве противоопухолевых средств. Полимерная матрица представляла собой сополимер молочной и гликолевой кислот. Определено, что полимерные частицы, содержащие FeClTФП, проявляют высокую цитотоксическую активность.
В работе [8] изучали структурные особенности нетканого волокна из поли-3-гидроксибутирата (ПГБ) и порфиринового комплекса цинка. Показано, что при введении комплекса цинка с тетрафенилпорфирином (ZnClTФП) в количестве до 5 мас.% степень кристалличности ПГБ увеличивается.
В настоящей работе объектом исследования служили композиты биоразлагаемого полимера – полилактида (ПЛА) с различной концентрацией металлокомплекса порфиринового ряда – Mn(III)Cl-тетрафенилпорфирина (MnClТФП). Полилактид – широко известный термопластичный полиэфир, получаемый из возобновляемого растительного сырья [9, 10]. Он легко подвергается гидролизу, при этом не нуждается в присутствии ферментов, чтобы катализировать процесс [11–13], а также обладает уникальными свойствами: биосовместимостью и способностью к разрушению в окружающей среде без образования токсичных веществ [14, 15]. Полилактид применяется в упаковочной и косметической промышленности, также он прочно вышел на рынок биосовместимых медицинских изделий [16–19]. Однако в настоящее время композиционные материалы на основе ПЛА и металлокомплексов порфирина изучены недостаточно.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение образцов
L-Полилактид марки 4032D компании Nature Works (США) с молекулярной массой 1.9 ⋅ 105 и плотностью 1.24 г/см3 был выбран для получения пленочных композиционных материалов на основе ПЛА и комплекса марганца(III) с тетрафенилпорфирином с содержанием 0.1–2 мас.%. Концентрация ПЛА в растворе хлороформа составляла 5 мас.%. Конечные растворы ПЛА и MnClТФП наливали в чашки Петри и оставляли при Т = (22 ± 2) °С на 48 ч, затем помещали в сушильный шкаф при Т = (35 ± 2) °С и выдерживали еще 3 ч.
Дифференциальная сканирующая калориметрия (ДСК)
Теплофизические характеристики исследуемых образцов определяли на приборе DSC 204 F1 (Netzsch, Германия). Скорость сканирования составляла 10 град/мин, навеску варьировали в пределах 5–6 мг, калибровку осуществляли по индию с температурой плавления Тпл = 156.6 °С. Точность измерения Тпл равна 0.1 °С.
Величину степени кристалличности αкр рассчитывали по формуле
(1)
${{\alpha }_{{{\text{кр}}}}}\left( \% \right) = {{{\text{1}}00\Delta {{Н}_{{{\text{пл}}}}}} \mathord{\left/ {\vphantom {{{\text{1}}00\Delta {{Н}_{{{\text{пл}}}}}} {\Delta Н_{{{\text{пл}}}}^{*}}}} \right. \kern-0em} {\Delta Н_{{{\text{пл}}}}^{*}}},$Термогравиаметрический анализ (ТГА)
Термогравиаметрический анализ образцов на воздухе проводили на термоаналитических весах TG 209 F1 (Netzsch, Германия) при скорости нагрева 20 град/мин. Кривые деривативной термогравиметрии (ДГТ) получали путем определения первой производной от ТГ-кривых.
Электронная спектроскопия
Электронные абсорбционные спектры полученных композитов различного состава регистрировали с помощью спектрофотометра DR/4000V (HACH-Lange, США) в диапазоне длин волн λ = = 320–800 нм. Для регистрации спектра был взят образец пленочного полимерного композита размером 2 × 2 см2 и закреплен в кюветном отделении спектрофотометра в плоскости, перпендикулярной направлению светового потока.
Бактериальный тест
Биоцидную (антибактериальную) активность определяли методом диффузии в агар, содержащий тест-культуру, по замеру диаметра зон задержки роста бактерий. В опытах с материалами с различным содержанием металлокомплекса использовали тест-культуры Staphylococcus aureus Р209 (золотистый стафилококк), Salmonella typhimurium (сальмонеллу) и Escherichia coli 1257 (кишечную палочку). Тест-культуры микроорганизмов пересевали на скошенный мясо-пептонный агар и инкубировали в течение 17–18 ч при 37 °С. Затем в физиологическом растворе готовили суспензию каждого микроорганизма и устанавливали концентрацию микробных клеток (м.к) по стандарту мутности: 104 м.к/мл. В стерильные чашки Петри помещали образцы полимерного материала (контрольные и опытные) размером 10 × 10 мм2. По поверхности испытуемого материала распределяли 1 мл суспензии тест-культуры и выдерживали при комнатной температуре в течение 30 мин. Затем в чашку наливали 9 мл стерильного физиологического раствора и выдерживали в течение 10–15 мин для элюирования тест-культуры с пленочных образцов. По истечении экспозиции материал из чашек в количестве 100 мкл высевали на поверхность мясо-пептонного агара, разлитого предварительно в чашки Петри. Посевы инкубировали в течение 14–48 ч при 37 °С. В качестве контрольных служили образцы полимерного материала, не содержащего металлокомплекс порфирина. Параллельно проводили высев используемых в опыте суспензий тест-культур для контроля концентрации жизнеспособных микроорганизмов. Затем производили подсчет выросших на поверхности агара колоний жизнеспособных микроорганизмов. Анализ выполняли в шести параллельных опытах (уровень статистической значимости p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что термические методы анализа позволяют определить температуры фазовых переходов исследуемых полимеров, а также рассчитать их теплоту плавления и степень кристалличности, изучить процесс термического распада полимеров и их композиций. Ниже приведены результаты исследований, полученные методом ДСК и ТГА.
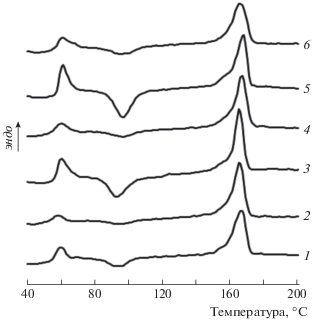
В табл. 1 представлены теплофизические характеристики образцов, а на рис. 1 – их термограммы плавления, полученные методом ДСК. Можно видеть, что различное содержание ТФП в композициях изменяет Тпл и Тс ПЛА на 1–2 °С. Степень кристалличности при этом возрастает: так, наличие 1.5–2.0 мас.% MnClТФП увеличивает степень кристалличности матрицы полилактида на 4–5% по сравнению с чистым ПЛА. Известно, что в небольших количествах низкомолекулярные добавки могут выступать в роли пластификатора, увеличивать сегментарную подвижность полимера и тем самым облегчать процесс кристаллизации, что может приводить к увеличению степени кристалличности полимерной матрицы [21]. Вероятно, в исследуемых композициях наблюдается подобный эффект, и значения степени кристалличности ПЛА повышаются. Можно также предположить наличие гетерогенного зародышеобразования, когда комплекс MnClТФП выступает в роли агента нуклеации, но в этом случае, как правило, повышение степени кристалличности более значимо, а также требуется тщательное изучение процесса изотермической кристаллизации [22].
Таблица 1.
Теплофизические характеристики композиций ПЛА–MnClТФП различных составов
| Содержание MnClТФП, мас.% | Тс, °С | Тпл, °С | ∆Нпл, Дж/г | αкр, % |
|---|---|---|---|---|
| 0 | 60 | 167 | 38.2 | 41 |
| 0.1 | 58 | 165 | 39.1 | 42 |
| 0.5 | 60 | 165 | 39.1 | 42 |
| 1.0 | 60 | 167 | 41.9 | 45 |
| 1.5 | 61 | 168 | 42.8 | 46 |
| 2.0 | 60 | 166 | 41.9 | 45 |
Рис. 1.
Термограммы плавления образцов ПЛА (1) и ПЛА–MnClТФП с содержанием MnClТФП 0.1 (2), 0.5 (3), 1.0 (4), 1.5 (5) и 2.0 мас.% (6).
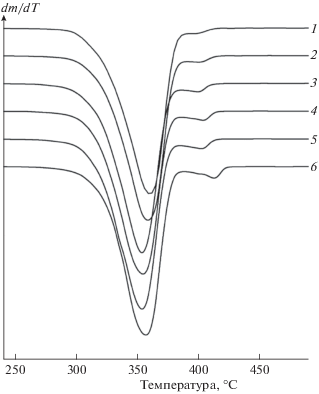
На рис. 2 и 3 приведены термограммы ТГА и ДТГ, соответственно, исходя из которых можно заключить, что присутствие MnClТФП не влияет на закономерности термодеструкции матрицы ПЛА, а только смещает пик температурного максимума термического распада в область более низких температур. Так, при содержании комплекса MnClТФП в количестве 0.5 мас.% и более, температура деструкции снижается на 5–7 °С.
Рис. 2.
Зависимость потери массы от температуры для образцов ПЛА (1) и ПЛА–MnClТФП с содержанием MnClТФП 0.1 (2), 0.5 (3), 1.0 (4), 1.5 (5) и 2.0 мас.% (6).
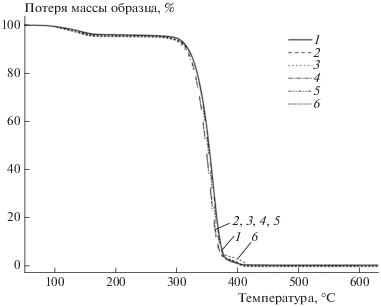
Рис. 3.
Кривые ДТГ для образцов ПЛА (1) и ПЛА–MnClТФП с содержанием MnClТФП 0.1 (2), 0.5 (3), 1.0 (4), 1.5 (5) и 2.0 мас.% (6).
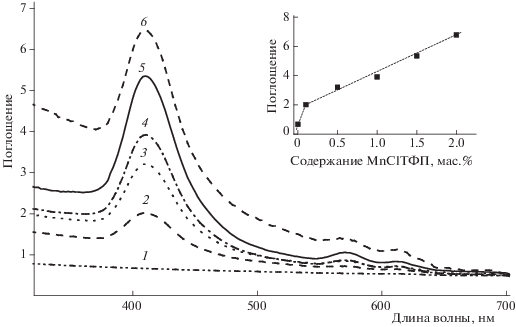
Для изучения морфологических особенностей композитов ПЛА–MnClТФП был использован метод спектрофотометрии. На рис. 4 представлены электронные спектры композитов, характеризующиеся поглощением в видимой области 470–480 нм, относящимся к полосе Соре порфирина. Уширенная форма данной полосы позволяет сделать вывод о существовании в композите областей локального концентрирования металлокомплекса. Этот вывод подтверждает отклонение от закона Бугера–Ламберта–Бера, т.е. от прямо пропорциональной зависимости между поглощением раствора и его концентрацией (см. вставку на рис. 4). В то же время образования молекулярных агрегатов, имеющих собственные полосы поглощения, не наблюдается, т.е. тетрафенилпорфирин распределен в матрице ПЛА в виде микровключений. Подобный эффект авторы работы [23] наблюдали при исследовании композитов полилактида с железосодержащим комплексом тетрафенилпорфирина. Данный факт существен с точки зрения практического использования пленочных композиционных материалов на основе порфиринов для биомедицины, поскольку каталитической активностью в образовании реакционноспособных радикальных форм кислорода обладают комплексы переходных металлов в мономолекулярной форме, тогда как агрегаты порфиринов малоактивны [24].
Рис. 4.
Электронные спектры поглощения образцов ПЛА (1) и ПЛА–MnClТФП с содержанием MnClТФП 0.1 (2), 0.5 (3), 1.0 (4), 1.5 (5) и 2.0 мас.% (6). На вставке – зависимость поглощения от содержания MnClТФП в образцах ПЛА.
Антибактериальную активность полученных образцов ПЛА–MnClТФП исследовали с помощью тест-культур различных микроорганизмов. Кишечная палочка – представитель нормальной микрофлоры кишечника человека, но некоторые ее штаммы способны в определенных условиях вызывать заболевания желудочно-кишечного тракта. Стафилококки распространены в почве, воздухе и являются представителями нормальной микрофлоры человека. Патогенные и условно-патогенные стафилококки обычно колонизируют носовые ходы и брюшную полость. При повреждениях кожи и слизистых оболочек стафилококки проникают в глубь организма и способны поражать практически любые ткани и органы. Бактерия Salmonella typhimurium способна вызвать острое инфекционное заболевание.
Результаты бактериологического исследования приведены в табл. 2. Согласно проведенному эксперименту антибактериальный эффект сильнее проявляется в композициях с содержанием MnClТФП 1.5 и 2.0 мас.%. Следует отметить, что антибактериальный эффект MnClТФП также был обнаружен в работе [25] при введении металлокомплекса порфирина в матрицу нетканого волокнистого материала поли-3-гидроксибутирата, что подтверждает целесообразность создания биомедицинских материалов на основе биоразлагаемых полимеров и металлокомплексов порфиринов, активных в отношении условно-патогенных и патогенных микроорганизмов.
Таблица 2.
Жизнеспособность культур микроорганизмов на полимерном материале ПЛА–MnClТФП
| Наименование тест-культуры | Количество жизнеспособных микроорганизмов, КОЕ/мл | ||
|---|---|---|---|
| исходная тест-культура | опытный образец | контрольный образец | |
| Содержание MnClТФП равно 0.5 мас.% | |||
| S. aureus р 209 | 2.1 ⋅ 104 | 1.8 ⋅ 103 | 7.4 ⋅ 103 |
| E. coli 1257 | 1.8 ⋅ 104 | <1 ⋅ 102 | 9.1 ⋅ 103 |
| S. typhimurium | 2.2 ⋅ 104 | 1.3 ⋅ 103 | 6.2 ⋅ 103 |
| 1.5 мас.% | |||
| S. aureus р 209 | 2.0 ⋅ 104 | 1.6 ⋅ 103 | 7.1 ⋅ 103 |
| E. coli 1257 | 1.8 ⋅ 104 | <1 ⋅ 102 | 8.8 ⋅ 103 |
| S. typhimurium | 2.0 ⋅ 104 | 1.0 ⋅ 103 | 6.4 ⋅ 103 |
| 2.0 мас.% | |||
| S. aureus р 209 | 2.0 ⋅ 104 | 1.3 ⋅ 103 | 7.2 ⋅ 103 |
| E. coli 1257 | 1.8 ⋅ 104 | <1 ⋅ 102 | 8.3 ⋅ 103 |
| S. typhimurium | 2.2 ⋅ 104 | 1.0 ⋅ 103 | 6.1 ⋅ 103 |
ВЫВОДЫ
1. В работе показано, что присутствие в композициях MnClТФП в количестве 1.5–2.0 мас.% приводит к увеличению степени кристалличности ПЛА на 4–5%.
2. Определено, что температура максимума пика деструкции композитов ПЛА–MnClТФП на 2–7 °С ниже по сравнению с чистым ПЛА.
3. Методом спектрофотометрии показано, что MnClТФП распределен в матрице ПЛА в виде фазовых включений.
4. Тест на биоцидную активность подтвердил антибактериальные свойства полученных композитов, антибактериальный эффект у которых усиливается с увеличением содержания тетрафенилпорфирина. Эти данные указывают на прикладную значимость полученных результатов.
Работа выполнена с использованием приборов Центра коллективного пользования (ЦКП ИБХФ РАН) “Новые материалы и технологии”.
Работа выполнена согласно госзаданию № 1201253305 по теме 44.3 “Полимерное материаловедение: кинетика и механизмы химических и физических процессов в полимерах, композитах и биологических системах”.
Список литературы
Губарев Ю.А., Лебедева Н.Ш., Голубев С.Н. и др. // Макрогетероциклы. 2013. Т. 6. № 1. С. 106; https://doi.org/10.6060/mhc120986g
Batinic-Haberle I., Rajic Z., Tovmasyan A. et al. // Free Radical Biol. Med. 2011. V. 51. № 5. 1035.
Лобанов А.В., Голубева Е.Н., Зубанова Е.М., Мельников М.Я. // Химия высоких энергий. 2009. Т. 43. № 5. С. 438.
Голубева Е.Н., Лобанов А.В., Кокорин А.И. // Хим. физика. 2009. Т. 28. № 4. С. 9.
Лобанов А.В., Громова Г.А., Горбунова Ю.Г., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2014. Т. 50. № 5. С. 465; https://doi.org/10.7868/S0044185614050106
Aust S.D., Morehouse L.A., Thomas C.E. // Free Radicals in Biol. Med. 1985. V. 1. P. 3.
Faustova M.R., Nikolskaya E.D., Zhunina O.A. et al. // Rus. Chem. Bulletin. 2018. V. 67. № 2. P. 359.
Карпова С.Г., Ольхов А.А., Тюбаева П.М. et al. // Хим. физика. 2019. Т. 38. № 3. С. 37; https://doi.org/10.1134/S0207401X19030038
Nampoothiri K.M., Nair N.R., John R.P. // Bioresour. Technol. 2010. V. 101. P. 8493.
Steinbuechel A. // Biomaterials / Ed. Byron D.B. Basingstoke: Macmillan, 1996. P. 221.
Тертышная Ю.В., Карпова С.Г., Попов А.А. // Хим. физика. 2017. Т. 36. № 6. С. 84; https://doi.org/10.7868/S0207401X17060140
Luo Y.-B., Wang X.-L., Wang Y.-Z. // Polym. Degrad. Stab. 2012. V. 97. P. 721; https://doi.org/10.1016/j.polymdegradstab.2012.02.011
Тертышная Ю.В., Попов А.А. // Все материалы. Энциклопедический справочник. 2019. № 9. С. 42–48; https://doi.org/10.31044/1994-6260-2019-0-9-42-47
Vink E.T.H., Rábago K.R., Glassner D.A., Gruber P.R. // Polym. Degrad. Stab. 2003. V. 80. P. 403.
Bogaert J.C., Coszac P.P. // Macromol. Sympos. 2000. V. 154. P. 287.
Ortiz R., Moreno-Flores S., Quintana I. et al. // Mater. Sci. Eng. 2014. V. 37. P. 241.
Caffee H.H., Hardt N.S., La Torre G. // Plast. Reconstr. Surg. 1995. V. 95. № 7. P. 1145.
Pankaj S.K., Bueno-Ferrer C., Misra N.N., Miloszvljevic V. et al. // Trend Food Sci. Technol. 2014. V. 35. P. 5.
Coskun S., Korkusuz F., Hasirci V. // J. Biomat. Sci. Polymer. 2005. V. 16. P. 1485.
Lim L-T., Auras R., Rubino M. // Progress Poly. Sci. 2008. V. 33. P. 820.
Кулезнев В.Н., Шершнев В.А. Химия и физика полимеров. СПб.: Изд-во “Лань”, 2014.
Wunderlich B. Macromolecular physics. V. 2. Crystal nucleation, growth, annealing. N.Y.: Acad.press. 1976.
Тертышная Ю.В., Хватов А.В., Лобанов А.В. // Хим. физика. 2017. Т. 36. № 9. С. 53; https://doi.org/10.7868/S0207401X1709014X
Dolotova O., Yuzhakova O., Solovyova L. et al. // J. Porphyrins Phthalocyanines. 2013. V. 17. P. 881.
Лобанов А.В., Ольхов А.А., Попов А.А. // Хим. безопасность. 2018. Т. 2. № 2. С. 78; https://doi.org/10.25514/CHS.2018.2.14104
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


