Химическая физика, 2020, T. 39, № 12, стр. 70-73
Влияние рН среды на клетки Paramecium caudatum при воздействии низкотемпературной плазмы атмосферного давления
И. Г. Калинина 1, *, О. В. Карпухина 1, 2, В. А. Рябый 3, В. П. Савинов 2, В. Г. Якунин 2, А. Н. Иноземцев 2, В. Б. Иванов 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Московский авиационный институт (национальный исследовательский университет)
Москва, Россия
* E-mail: i_kalinina1950@mail.ru
Поступила в редакцию 19.03.2020
После доработки 03.05.2020
Принята к публикации 20.05.2020
Аннотация
Показано, что при воздействии низкотемпературной плазмы атмосферного давления на одноклеточную культуру Paramecium caudatum в результате изменения внешних условий (ионного состава раствора) меняется характер движения и уменьшается количество жизнеспособных клеток. Жизнеспособность клеток Paramecium caudatum зависит от времени воздействия плазмы и коррелирует с изменением рН среды. Проанализированы обнаруженные в работе кинетические особенности процессов: пост-эффект воздействия плазмы, ступенчатый характер гибели клеток.
ВВЕДЕНИЕ
Задача защиты материалов от биоповреждений, включая повреждения микроскопическими грибами, бактериями и другими микроорганизмами, продолжает оставаться актуальной. Будучи составной частью окружающей среды, биодеструкторы в силу специфики своей жизнедеятельности способны быстро адаптироваться к самым различным материалам и постоянно изменяющимся условиям, а также к средствам защиты. Воздействуя на материалы, они вызывают изменение структурных и функциональных характеристик изделий вплоть до их разрушения [1]. Анализ кинетики микробиологического повреждения материалов включает последовательное рассмотрение отдельных этапов, каждый из которых протекает по определенному кинетическому закону [2–4].
Известен ряд способов защиты материалов от воздействия микроорганизмов: применение фунгицидов, биоцидов, синтез биостойких полимеров, модификация состава и структуры материалов [5]. В настоящее время основное внимание исследователей сосредоточено на разработке экологически безопасных методов решения этой проблемы. Поэтому, в частности, все более актуальным становится изучение влияния низкотемпературной плазмы атмосферного давления (НТПАД) на живые организмы. Воздействие НТПАД является одним из эффективных, но одновременно и экологически безвредных способов борьбы с микроорганизмами. Перспективность этого направления, включая и возможность полного подавления жизнедеятельности многих патогенных организмов [6] продемонстрирована в ряде работ [7, 8]. Однако механизмы действия плазмы остаются дискуссионными.
Кроме воздействия на микрофлору, находящуюся на поверхности изделий, НТПАД в определенных условиях способна модифицировать поверхность полимерных материалов и изделий. Положительным результатом в этом случае может стать получение новых биосовместимых материалов, обладающих уникальными свойствами [9].
Основные цели данной работы – кинетический анализ воздействия НТПАД на клетки Paramecium caudatum и оценка влияния изменения под действием плазмы окружающей среды на жизнеспособность микроорганизмов. В качестве тест-объекта использовали непатогенный одноклеточный организм Раramecium caudatum, универсальный характер реакций которого на внешние воздействия делает возможным его применение для стандартных биохимических исследований жизнеспособности и метаболических изменений клеток не только при действии химических веществ, но и физических факторов (электромагнитных полей различной частоты и интенсивности, а также разных типов излучений).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культуру клеток Раramecium caudatum инкубировали в стандартных условиях на среде Лозина–Лозинского при температуре (23 ± 2) °С и рН водной среды (6.5–7.0). При проведении исследований Раramecium caudatum отбирались в логарифмической фазе роста, так как именно в этот период клетки обладают наибольшей чувствительностью к внешним воздействиям.
Источником плазмы был электродуговой плазматрон постоянного тока нового типа с высоким ресурсом работы и сверхчистой плазменной струей, практически свободной от частиц металла электродов [10]. Основными конструктивными узлами плазматрона являются стержневой катод и сопловой анод. Для защиты катода от окисления в зазор между катодом и анодом подается инертный газ (аргон), в атмосфере которого возбуждается дуговой разряд. Конструкция медного анода обеспечивает распределенный характер анодной привязки дуги за счет подачи в газовый канал анода технологического газа, в качестве которого использовали воздух. Воздух поступает в круговую щель, двигаясь к оси плазматрона в радиальном направлении. В зоне его смешения с аргоном возникает вихревая зона, в которой и образуется фиксирующая длину дуги распределенная анодная привязка, окружающая с внешней стороны сопловой канал анода. Данная особенность приводит к резкому уменьшению плотности тока на аноде и снижению скорости его эрозии, а следовательно, и к практически полному исключению переноса частиц металла в изучаемые системы.
Пробирки с клетками помещали под плазменную струю. Расстояние от точки выхода струи плазмы до поверхности среды с клетками составило 15 см. Время воздействия плазмы варьировали от 0.5 до 5 мин. Контролем служили необлученные (т.е. интактные) клетки из флакона с маточной культурой.
Подсчет общего количества клеток в 1 мл среды до и после воздействия плазмы осуществляли через 1 мин, 2, 4 и 24 ч под микроскопом МБС-10 (увеличение 7 × 10) с видеорегистрацией при помощи камеры Levenhuk C 130 NG. На всех этапах эксперимента проводили контроль температуры и рН среды (pH-метр Kelilong PH-221). Кроме того, рН среды измеряли в каждой пробе через 1, 3, и 5 мин; 0.5, 1, 2 и 4 ч.
Измерения проводились в трех повторах. Среднее значение и стандартную ошибку определяли с использованием функций, включенных в программный пакет Еxcel 2010. Сравнение количественных данных проводили с помощью критерия Стьюдента. При распределении признака, отличающегося от нормального, применяли непараметрические методы (критерии Вилкоксона и Манна–Уитни). Уровень значимости был принят равным 0.05. Статистический анализ проводили с использованием пакета программ Statistica 6.0
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При резкой смене условий: перепадах температуры и ионного состава раствора, характер движения клеткок Paramecium caudatum (в нормальном состоянии постоянно активно плавающие во всем объеме среды) начинает меняться. В наших опытах во всех пробах температура среды вне зависимости от времени воздействия низкотемпературной плазмы фиксировалась на уровне, благоприятном для нормальной жизнедеятельности клеток Paramecium caudatum (24–28 °С). Однако в пробах, находившихся под струей плазмы в течение 3 или 5 мин, с первых секунд последующего наблюдения большинство особей отличались резкими, крутящимися, беспорядочными движениями и со временем (в течение 30 мин) замедляли их до полной остановки.
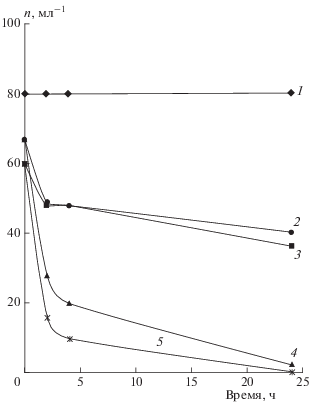
Двигательная активность Paramecium caudatum во многом формируется на основе работы ионных каналов: встроенных в мембрану органов движения – ресничек, и является характеристикой, отражающей функциональное состояние клетки. В результате снижения мембранного потенциала клетки двигаются медленнее или вращаются на месте вокруг одного конца. В ходе опытов было установлено, что действие плазменной струи приводит к уменьшению количества жизнеспособных клеток, при этом выраженность негативного влияния плазмы зависит от времени ее воздействия. Количество жизнеспособных клеток, определяемое сразу после прекращения действия плазмы, относительно слабо зависит от времени воздействия, но при дальнейшем наблюдении скорость гибели клеток возрастает при увеличении дозы облучения. Таким образом, наблюдается ярко выраженный эффект последействия: клетки продолжают погибать после прекращения воздействия даже при небольших временах обработки плазмой (рис. 1). Отметим также, что кинетические кривые имеют выраженный “ступенчатый” характер: на начальных стадиях после прекращения воздействия плазмы гибель происходит существенно быстрее, чем на более поздних стадиях (так называемая кинетическая остановка процесса).
Рис. 1.
Кинетические кривые изменения числа клеток Paramecium caudatum в 1 мл раствора при разных временах плазменной обработки: 1 – интактные клетки (без обработки), 2 – 0.5 мин, 3 – 1 мин, 4 – 3 мин, 5 – 5 мин.
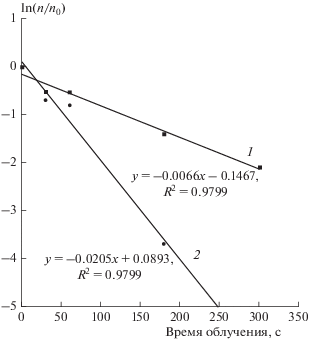
Наиболее наглядной формой количественного анализа результатов экспериментов является зависимость выживаемости от дозы воздействия. Как показано на рис. 2 на примере зависимости доли выживших клеток n/n0 через 4 (прямая 1) или 24 ч (прямая 2) от времени t воздействия плазмы, в полулогарифмических координатах ln(n/n0) – t, где n – число выживших, а n0 – первоначальное число клеток, наблюдаются удовлетворительные линейные зависимости (коэффициент корреляции R2 ~ 0.978). Следовательно, процесс описывается кинетическим уравнением реакции первого порядка. Наклоны кривых, соответствующие константам скорости процессов, составляют 6.6 ⋅ 10–3 (1) и 20.5 ⋅ ⋅ 10–3 с–1 (2). Через 24 ч в пробирках, находившихся под потоком частиц плазмы в течение 3 и 5 мин, выживаемость клеток оказалась <3% и 0% соответственно (рис. 1, кривые 4 и 5). Более точный физический смысл имеет только константа скорости, определяемая по выживаемости клеток через 24 ч, так как только к этому времени количество жизнеспособных клеток достигает близкого к стационарному значения (рис. 1), и именно количество погибших через 24 ч клеток лучше характеризует те физико-химические изменения, которые вызвало воздействие плазмы.
Рис. 2.
Полулогарифмическая анаморфоза зависимости доли выживших клеток Paramecium caudatum от времени воздействия НТПАД через 4 ч (1) и через сутки (2) после прекращения воздействия.
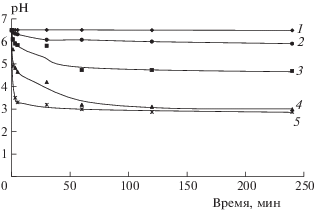
Отметим, что плазма в данных условиях непосредственно на клетки влияет мало, так как подавляющее большинство их находится далеко от поверхности питательной среды. Однако действие плазмы, по-видимому, вызывает изменения среды, которые приводят к существенному снижению жизнеспособности клеток, и эти изменения тем более значимы, чем больше время, прошедшее после воздействия плазмы.
Одним из таких потенциально значимых факторов может быть изменение ионного состава раствора. В соответствии с этой гипотезой обнаружено, что после воздействия НТПАД, генерируемой плазматроном, во всех пробах наблюдалось снижение уровня рН (рис. 3), что согласуется с результатами других исследователей [11]. Наиболее значимое уменьшение рН (на 2–3.5 значения от исходного уровня ~6.5) отмечено в пробах после облучения в течение 3 и 5 мин. Ранее было установлено, что при уменьшении рН при добавлении кислот до значений <4.5 наблюдаются существенные нарушения двигательной активности клеток и появляются атипичные клетки [12]. Как следует из полученных результатов (рис. 3), в пробах, находившихся под воздействием плазмы в течение 3 и 5 мин, через два часа значения рН становятся критически низкими, что приводит к резкому снижению жизнеспособных особей Paramecium caudatum (рис. 1).
Рис. 3.
Изменения pH среды с клетками Paramecium caudatum после воздействия НТПАД: 1 – интактные клетки (без воздействия), 2 – 0.5 мин, 3 – 1 мин, 4 – 3 мин, 5 – 5 мин.
Значения рН < 4, фиксируемые при длительном воздействии плазмы, свидетельствуют об образовании значительных количеств сильных кислот. Эти кислоты возникают при взаимодействии с водой ионов и радикалов ${\text{N}}{{{\text{O}}}^{\centerdot }}$ и ${\text{N}}_{2}^{\centerdot }$, регистрируемых в плазме методом эмиссионной спектроскопии, а также окислов азота, образующихся в струе плазмы. Этим, по-видимому, и обусловлено влияние плазменного воздействия на жизнедеятельность клеток Paramecium caudatum.
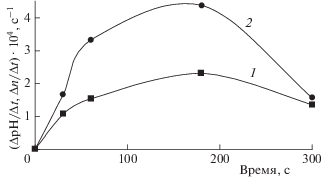
Об определяющем влиянии рН среды свидетельствует показанный на рис. 4 симбатный характер зависимостей констант скоростей изменения числа выживших клеток Paramecium caudatum в 1 мл раствора (кривая 1) и рН раствора (кривая 2) от времени воздействия плазмы. Дополнительный вклад может вносить пероксид водорода, образующийся при воздействии радикалов ${\text{O}}{{{\text{H}}}^{\centerdot }}$, также регистрируемых в струе плазмы, и другие окислители, возникающие в результате окислительно-восстановительных процессов, индуцированных ионами плазмы.
ВЫВОДЫ
1. Обнаружено, что обработка низкотемпературной плазмой атмосферного давления клеток Paramecium caudatum приводит к существенному снижению их жизнеспособности даже при относительно небольших временах воздействия и в отсутствие непосредственного контакта плазмы с микроорганизмами.
2. Симбатный характер изменения рН среды и снижения жизнеспособности клеток свидетельствует о том, что именно образование под действием плазмы сильных кислот есть основной фактор, определяющий снижение жизнеспособности микроорганизмов.
3. Выраженные эффекты последействия, когда и уменьшение числа жизнеспособных клеток, и изменение рН продолжаются в течение значительного времени после завершения воздействия плазмы, являются дополнительными аргументами в пользу вывода об определяющем влиянии кислотности на жизнеспособность микроорганизмов при плазменной обработке.
4. Это позволяет использовать измерение рН среды в качестве дополнительного экспресс-метода для оценки потенциальной эффективности воздействия плазмы на микроорганизмы.
Работа выполнена в рамках финансирования госзадания ФИЦ ХФ им. Н.Н. Семёнова РАН № ГЗ-0082-2019-0008 (АААА-А20-120030590042-8) и ГЗ МГУ им. Ломоносова (АААА-А16-116021660055-1).
Список литературы
Semenov S.A., Gumargalieva K.Z., Zaikov G.E. // Biodegradation and Durability of Materials under the Effect of Microorganisms. New Concepts in Polymer Science. Utrecht, Boston: VSP, 2003.
Калинина И.Г., Гумаргалиева К.З., Казарин В.В., Семенов С.А. // Хим. физика. 2017. Т. 36. № 3. С. 54.
Калинина И.Г., Гумаргалиева К.З., Семенов С.А., Казарин В.В. // Хим. физика. 2018. Т. 37. № 2. С. 78.
Калинина И.Г., Гумаргалиева К.З., Семенов С.А., Казарин В.В., Жданова О.А. // Хим. физика. 2019. Т. 38. № 3. С. 70.
Хохлов С.С., Ходос И.Н., Дьячкова Л.Г., Куткин А.В., Григорьев В.С., Рощин А.В. // Хим. физика. 2019. Т. 38. № 11. С. 34
Savinov V.P., Yakunin V.G., Karpukhina O.V. et al. // J. Phys.: Conf. Ser. 2019. V. 1348. P. 012007.
Laroussi M. // IEEE Trans. Plasma Sci. 2015. V. 43. № 3. P. 703.
Graves D.B. // Phys. Plasma. 2014. V. 21. P. 080901.
Vasiljeva T.M. // Fine Chem. Technol. 2015. V. 10. № 2. P. 5.
Рябый В.А., Савинов В.П., Якунин В.Г. и др. // Мед. техника. 2017. № 3. С. 3.
Figueira, F.R., Doria A.C.O.C., Khouri S. et al. // Plasma Med. 2018. V. 8. № 3. P. 237.
Карпухина О.В., Гумаргалиева К.З., Иноземцев А.Н. и др. // Вестн. КТУ. 2015. Т. 18. № 10. С. 9.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика