Химическая физика, 2020, T. 39, № 12, стр. 3-9
Процессы уф-фотолиза смеси C2H2F2Br2 с кислородом
И. К. Ларин 1, Т. И. Белякова 1, Н. А. Мессинева 1, **, А. И. Спасский 1, Е. М. Трофимова 1, *
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
** E-mail: nat-messineva@yandex.ru
* E-mail: eltrofimova@yandex.ru
Поступила в редакцию 18.09.2019
После доработки 08.04.2020
Принята к публикации 20.05.2020
Аннотация
Фотолиз C2H2F2Br2 в смеси с кислородом изучался при T = 298 K и различных временах облучения смеси ртутной лампой с максимумом излучения при λ = 253.7 нм. Спектры поглощения записывались в диапазоне длин волн 200–900 нм на спектрофотометре Specord M-40. Кинетические закономерности фотолиза изучали по расходованию исходного хладона и накоплению молекулярного брома. Были определены сечения поглощения хладона C2H2F2Br2 в области длин волн 230–258 нм. Предложен механизм фотолиза C2H2F2Br2 в смеси с кислородом. Определено сечение диссоциации C2H2F2Br2 на длине волны 253.7 нм, а также отношение константы скорости реакции радикала C2H2F2Br, образующегося при фотолизе, с молекулярным бромом к константе скорости реакции этого радикала с молекулярным кислородом.
ВВЕДЕНИЕ
Углеводороды, содержащие в своем составе атомы брома (хладоны), по степени их опасности для озонового слоя Земли можно разделить на две группы. В состав первой группы, кроме атомов брома, входят также атомы фтора и хлора, но он не содержит атомов водорода.
Длина цепей бромного цикла разрушения озона в нижней стратосфере бромсодержащими хладонами в десятки раз превышает длину цепей с участием атомов хлора. Это объясняется тем, что образующиеся при временнóм обрыве цепи в бромном цикле резервуары HOBr, BrONO2 и HBr гораздо менее устойчивы, чем резервуары HOCl, BrOClO2 и HCl, образующиеся при временнóм обрыве цепи в хлорном цикле. В результате паузы в цепном процессе, связанные с образованием молекул-резервуаров и их распадом, в бромном цикле занимают гораздо меньше времени, чем в хлорном, что и приводит к большей длине цепи в бромном цикле по сравнению с хлорным [1–4].
Из-за более слабой связи атома брома с остальной молекулой по сравнению с атомом хлора основной распад бромсодержащих хладонов происходит на высотах около 20 км, т.е. там, где плотность озона близка к максимальной. Эти факторы представляют большую опасность для озонового слоя от углеводородов, содержащих атомы брома [5, 6].
Ранее мы изучили фотолиз трех представителей хладонов, относящихся к первой группе [7–9]. Мы перечислим их в порядке убывания озоноразрушающего потенциала (ОРП): CF3Br (halon 1301, ОРП = = 12), C2F4Br2 (halon 2402, ОРП = 8) и CF2СlBr (halon 1211, ОРП = 6) [10]. Эти хладоны обладают большим сечением поглощения в инфракрасной области вблизи максимума теплового излучения Земли, где оптическое поглощение атмосферы малó. Тем самым они способствуют глобальному потеплению (парниковый эффект). Потенциал глобального потепления для CF3Br составляет 7030, для C2F4Br2 он равен 1860, а для CF2ClBr – 1620 [10]. Константы скорости реакций этих молекул с “чистильщиком тропосферы” радикалом OH не превышают значения, равного 1.5 · 10–16 см3 ⋅ молекула–1 ⋅ с–1 [11].
Перечисленные выше хладоны ранее широко применялись в различных сферах деятельности человека, но особенно эффективными они оказались при тушении пожаров, взаимодействуя с разветвляющим агентом реакции горения, атомом водорода, и тем самым ингибируя цепную реакцию горения [12, 13]. Однако из-за опасности этих хладонов для озонового слоя и климата Земли они были запрещены к применению [14], поэтому для пожаротушения стали использовать вторую группу хладонов, которые содержали в своем составе атомы водорода. Ранее мы изучили фотолиз трех таких хладонов: CH3Br, CHF2Br и C2HF4Br [15]. Константы скорости реакций этих молекул с радикалом OH на два порядка выше, чем в случае хладонов, не содержащих атомы водорода. Поэтому эти молекулы не достигают тех высот, где они могут разрушать молекулы озона [16–18].
В данной работе мы исследовали еще один хладон, содержащий атомы водорода – C2H2F2Br2, величина ОРП которого находится в интервале 0.7–1.5 [10], а константа скорости его реакции с радикалом OH при температуре 298 K составляет 2.46 ⋅ 10–14 см3 ⋅ молекула–1 ⋅ с–1 [19]. Этот хладон был для нас интересен тем, что в опубликованных фотохимических данных, используемых для моделирования процессов в стратосфере [20], сведения о сечениях поглощения этого хладона отсутствуют. Кроме того, этот хладон, так же как и C2F4Br2, фотолиз которого мы изучили ранее [21], содержит два атома брома, и было важно установить величину его квантового выхода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Составление смесей фреона С2H2F2Br2 с O2 проводили в вакуумной установке из молибденового стекла с запорными вентилями из стеклянных и тефлоновых деталей. Вакуумная смазка не применялась. Кислород марки “ч” хранили в стеклянной колбе, а жидкий C2H2F2Br2 – в ампулах, изолированных от света. Хладон очищали от примесей путем многократной низкотемпературной перегонки. Давления измеряли вакуумметрами и манометром “Сапфир”, который калибровался по давлению паров воды при температуре 273 K. Давление в диапазоне 0–30 Торр измеряли с точностью ~0.1 Торр, а в диапазоне 30–760 Торр – с точностью до 1 Торр.
Оптическая установка состояла из кварцевой кюветы диаметром 4 см и длиной 10 см и ртутной лампы низкого давления мощностью 8 Вт, служившей источником излучения с длиной волны λ = 253.7 нм. Более 92% излучения используемой нами лампы приходилось на эту длину волны. Перед началом облучения лампу включали и прогревали в течение 20 мин. Для записи спектров абсорбции исследуемых веществ в ультрафиолетовой и видимой областях использовали спектрофотометр М-40. Для выяснения спектрального состава излучения был снят спектр лампы в диапазоне волн 200–900 нм. Кинетику фотолиза C2H2F2Br2 изучали путем измерения оптической плотности исследуемой смеси при различных временах облучения в области поглощения хладона и при длине волны 416 нм, соответствующей максимуму поглощения молекулярного брома.
Для определения интенсивности лампы (I) при данных условиях облучения были проведены опыты с HBr, который широко используется как актинометр в диапазоне длин волн 180–280 нм, так как квантовый выход его фотолиза (φ) при облучении светом с λ = 253.7 нм и по атомам водорода, и по атомам брома равен единице. Интенсивность лампы оказалась равной (1.9 ± 0.2) ⋅ 1015 квант/см2 ⋅ с.
Перед началом измерений оптическая кювета откачивалась до давления 3 ⋅ 10–3 Торр и многократно промывалась гелием. Затем снимался спектр откачанной кюветы, и после этого – спектр кюветы, заполненной исследуемой смесью веществ. Смесь облучалась в течение определенных промежутков времени, и после облучения записывались спектры содержимого кюветы в диапазоне длин волн 200–900 нм. Изменение оптической плотности смеси в области поглощения хладона при λ = 416 нм (что соответствует максимуму поглощения молекулярного брома) в зависимости от времени облучения позволяло изучать кинетику расходования хладона и накопления молекулярного брома.
Перед проведением кинетических опытов был снят спектр поглощения C2H2F2Br2 при четырех парциальных давлениях (12, 21, 24 и 30 Торр) и температуре 298 K в диапазоне длин 230–258 нм. Оптическая плотность D(λ), определяемая из показаний спектрофотометра, связана, в соответствии с законом Ламберта–Бэра, с концентрацией присутствующего в оптической кювете хладона C2H2F2Br2 следующим соотношением:
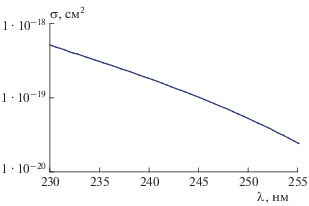
где n – концентрация вещества, молекула ⋅ см–3; σ(λ) – сечение поглощения хладона на соответствующей длине волны, см2; l – длина кюветы, см.Усредненные значения сечений поглощения C2H2F2Br2 в диапазоне длин волн 230–258 нм представлены на рис. 1. Значение сечения поглощения на длине волны 253.7 нм составило (3.1 ± ± 0.2) ⋅ 10–20 см2.
Рис. 1.
Усредненное значение сечений поглощения хладона C2H2F2Br2 в области длин волн 230–258 нм, полученное из экспериментальных данных при четырех значениях давления хладона: 12, 21, 24 и 30 Торр.
При температуре 298 K, давлении C2H2F2Br2, равном 9 Торр, и давлении кислорода 150 Торр, был получен график зависимости парциального давления хладона и парциального давления молекулярного брома от времени облучения смеси. Данные представлены на рис. 2.
Рис. 2.
Зависимость парциальных давлений хладона (▲) и молекулярного брома (⚫) от времени облучения смеси. Исходное давление C2H2F2Br2 составляло 9 Торр, давление кислорода – 150 Торр.
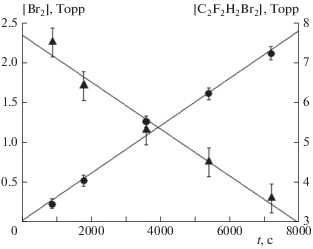
Парциальное давление C2H2F2Br2 рассчитывалось при λ = 230 нм. При этом вкладом поглощения от присутствующего в кювете кислорода пренебрегалось. Хотя парциальное давление кислорода в наших опытах более чем в 15 раз превышало давление хладона, сечение поглощения C2H2F2Br2 на указанной длине волны более чем на 5 порядков превышает сечение поглощения молекулярного кислорода, согласно нашим измерениям и данным работ [22–25]. Как видно из рис. 2, для того, чтобы при достаточно большом парциальном давлении кислорода (≥150 Торр) образовалась одна молекула молекулярного брома, должна быть истрачена не одна, а две молекулы C2H2F2Br2.
Для объяснения этих экспериментальных данных мы предложили следующую схему фотолиза C2H2F2Br2 на длине волны 253.7 нм:
(0)
${{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{2}} + h\nu \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{{\centerdot \,*}}} + {\text{B}}{{{\text{r}}}^{\centerdot }},$(I)
${{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{{\centerdot \,*~}}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{2}} + {\text{B}}{{{\text{r}}}^{\centerdot }},$(II)
${{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{{\centerdot \,*}}} + {{{\text{O}}}_{2}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{\centerdot }} + {{{\text{O}}}_{2}},$(III)
${{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{\centerdot }} + {\text{B}}{{{\text{r}}}_{{\text{2}}}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{2}} + {\text{B}}{{{\text{r}}}^{\centerdot }},$(IV)
${{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{\centerdot }} + {{{\text{O}}}_{2}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{BrO}}_{2}^{\centerdot },$(VI)
${{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{\centerdot }} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{\centerdot }} \to {{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}{{{\text{F}}}_{{\text{4}}}}{\text{B}}{{{\text{r}}}_{{\text{2}}}}.$Отметим, что энергию возбужденного радикала ${{{\text{C}}}_{2}}{{{\text{H}}}_{2}}{{{\text{F}}}_{2}}{\text{B}}{{{\text{r}}}^{{\centerdot \,*}}}$, образовавшегося в стадии (0), можно оценить только приблизительно, так как неизвестна прочность связи C–Br в молекуле C2H2F2Br2. В книге [26] приведены прочности связей C–Br в ккал/моль для следующих молекул: C2H5Br – 70, C2H3F2Br – 68.6 и C2ClF3Br2 – 60. Эти данные позволяют считать, что прочность связи C–Br несколько уменьшается при замене атомов H на атомы галогенов в молекуле бромсодержащего углеводорода. Этот же эффект наблюдался и в работе [27]. Поэтому можно предположить, что прочность связи C–Br в молекуле C2H2F2Br2 приблизительно равна 65 ккал/моль. Если учесть, что в процессе принимают участие фотоны (λ = = 253.7 нм) с энергией 112.7 ккал/моль, то становится очевидным, что после разрыва первой связи C–Br и образования одного атома брома на возбуждение радикала C2H2F2Br• остается не более 48 ккал/моль, и дальнейший распад этого радикала, по-видимому, невозможен. Однако, в принципе, возможна реакция (I), когда при образовании двойной связи C=C высвобождается дополнительная энергия, необходимая для образования еще одного атома брома. Если давление кислорода превышает 1 Торр, то выполняется условие k4[O2] $ \gg $ k6[C2H2F2Br•], и реакцию (VI) можно не учитывать.
Для предложенной схемы фотолиза можно записать следующую систему дифференциальных уравнений:
(2)
$\begin{gathered} {{d\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{2}}} \right]{\text{ }}} \mathord{\left/ {\vphantom {{d\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{2}}} \right]{\text{ }}} {dt}}} \right. \kern-0em} {dt}} = \\ = - {{k}_{0}}\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{2}}} \right] + {{k}_{{{\text{III}}}}}\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{\centerdot }}} \right]\left[ {{\text{B}}{{{\text{r}}}_{2}}} \right], \\ \end{gathered} $(3)
$\begin{gathered} {{d\left[ {{{C}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{\centerdot }}} \right]} \mathord{\left/ {\vphantom {{d\left[ {{{C}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{\centerdot }}} \right]} {dt}}} \right. \kern-0em} {dt}} = {{k}_{{{\text{II}}}}}\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{{\centerdot \,*}}}} \right]\left[ {{{{\text{O}}}_{{\text{2}}}}} \right] - \\ - \,\,{{k}_{{{\text{III}}}}}\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{\centerdot }}} \right]\left[ {{\text{B}}{{{\text{r}}}_{2}}} \right] - {{k}_{{{\text{IV}}}}}\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{\centerdot }}} \right]\left[ {{{{\text{O}}}_{{\text{2}}}}} \right], \\ \end{gathered} $(4)
$\begin{gathered} {{d\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{{\centerdot \,*}}}} \right]} \mathord{\left/ {\vphantom {{d\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{{\centerdot \,*}}}} \right]} {dt}}} \right. \kern-0em} {dt}} = {{k}_{0}}\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{2}}} \right] - \\ - \,\,{{k}_{{\text{I}}}}\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{{\centerdot \,*}}}} \right] - {{k}_{{{\text{II}}}}}\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}^{{\centerdot \,*}}}} \right]\left[ {{{{\text{O}}}_{{\text{2}}}}} \right]. \\ \end{gathered} $Метод полустационарных концентраций, разработанный академиком Н.Н. Семёновым [28], позволяет получить следующее выражение для скорости расходования хладона:
(5)
$\begin{gathered} {{d\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right]} \mathord{\left/ {\vphantom {{d\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right]} {dt}}} \right. \kern-0em} {dt}} = \\ = {{\sigma }_{{\text{д}}}}I\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right]{{\alpha {{k}_{{{\text{IV}}}}}\left[ {{{{\text{O}}}_{{\text{2}}}}} \right]} \mathord{\left/ {\vphantom {{\alpha {{k}_{{{\text{IV}}}}}\left[ {{{{\text{O}}}_{{\text{2}}}}} \right]} {\left( {{{k}_{{{\text{IV}}}}}\left[ {{{{\text{O}}}_{{\text{2}}}}} \right] + {{k}_{{{\text{III}}}}}\left[ {{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right]} \right)}}} \right. \kern-0em} {\left( {{{k}_{{{\text{IV}}}}}\left[ {{{{\text{O}}}_{{\text{2}}}}} \right] + {{k}_{{{\text{III}}}}}\left[ {{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right]} \right)}}, \\ \end{gathered} $где
(6)
$\begin{gathered} \alpha = {{{{k}_{{{\text{II}}}}}\left[ {{{{\text{O}}}_{{\text{2}}}}} \right]} \mathord{\left/ {\vphantom {{{{k}_{{{\text{II}}}}}\left[ {{{{\text{O}}}_{{\text{2}}}}} \right]} {\left( {{{k}_{{\text{I}}}} + {{k}_{{{\text{II}}}}}\left[ {{{{\text{O}}}_{{\text{2}}}}} \right]} \right)}}} \right. \kern-0em} {\left( {{{k}_{{\text{I}}}} + {{k}_{{{\text{II}}}}}\left[ {{{{\text{O}}}_{{\text{2}}}}} \right]} \right)}}, \\ {{\sigma }_{{\text{д}}}}--{\text{сечение}}\,\,{\text{диссоциации}}. \\ \end{gathered} $В условиях, когда kIV[O2] $ \gg $ kIII[Br2] и kII[O2] $ \gg $ kI, выражение (5) приобретает следующий вид:
(7)
${{d\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right]} \mathord{\left/ {\vphantom {{d\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right]} {dt}}} \right. \kern-0em} {dt}} = {{\sigma }_{{\text{д}}}}I\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right].$С учетом того, что для образования одной молекулы брома требуется подвергнуть фотолизу две молекулы C2H2F2Br2 (рис. 2), выражение для скорости образования молекулярного брома в условиях, когда kIV[O2] $ \gg $ kIII[Br2] и kII[O2] $ \gg $ kI, можно записать следующим образом:
(8)
$W_{{{\text{B}}{{{\text{r}}}_{{\text{2}}}}}}^{'} = {{d\left[ {{\text{B}}{{{\text{r}}}_{2}}} \right]} \mathord{\left/ {\vphantom {{d\left[ {{\text{B}}{{{\text{r}}}_{2}}} \right]} {dt}}} \right. \kern-0em} {dt}} = \left( {{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}} \right){{\sigma }_{{\text{д}}}}I\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{2}}} \right].$Из выражения (8) следует, что сечение диссоциации C2H2F2Br2, σД, можно определить по изменению оптической плотности смеси в области 416 нм (максимум поглощения Br2) в процессе облучения. К сожалению, в область поглощения C2H2F2Br2 может попадать поглощение радикалов, образовавшихся в процессе фотолиза и в реакции (IV), и тем самым концентрация C2H2F2Br2 в процессе фотолиза может быть измерена неточно.
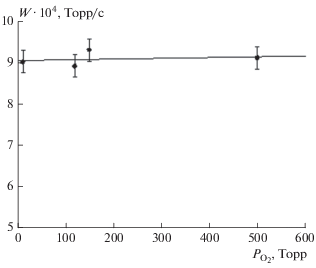
Чтобы проверить, что при достаточно больших давлениях кислорода и в условиях, когда еще не образовалось достаточно большое количество молекулярного брома, скорость накопления молекулярного брома не зависит от парциального давления кислорода, был проведен фотолиз смеси 30 Торр C2H2F2Br2 с кислородом в диапазоне давления последнего от 12 до 500 Торр. Данные, представленные на рис. 3, подтверждают, что в соответствии с выражением (8) скорость фотолиза в этих условиях не зависит от парциального давления кислорода.
Рис. 3.
Зависимость скорости накопления молекулярного брома от давления кислорода при давлении C2H2F2Br2, равном 30 Торр.
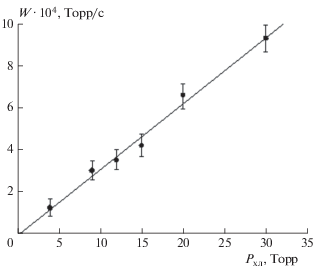
На рис. 4 представлена зависимость скорости образования молекулярного брома от парциального давления C2H2F2Br2 при давлении кислорода, равном 150 Торр. Видно, что она определяется выражением (8). По тангенсу угла наклона прямой на рис. 4 определено значение сечения диссоциации C2H2F2Br2, σД, на длине волны 253.7 нм, которое составило (3.3 ± 0.15) ∙ 10–20 см2.
Рис. 4.
Зависимость скорости накопления молекулярного брома от давления C2H2F2Br2 при давлении кислорода 150 Торр.
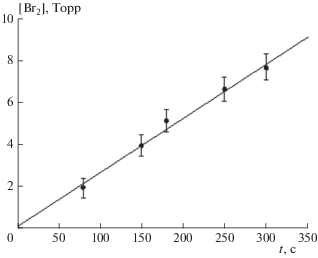
На рис. 5 представлена зависимость парциального давления молекулярного брома от времени облучения при исходном давлении хладона 16 Торр и давлении кислорода 500 Торр. Линейная зависимость сохранялась в течение всего периода облучения в соответствии с выражением (8). Рассчитанное по тангенсу угла наклона прямой на рис. 5 значение σД оказалось равным (3.0 ± 0.3) ∙ 10–20 см2.
Рис. 5.
Зависимость парциального давления молекулярного брома от времени облучения при давлении C2H2F2Br2, равном 16 Торр, и давлении кислорода в 500 Торр.
При облучении смеси 12 Торр кислорода и 30 Торр хладона линейная зависимость парциального давления молекулярного брома от времени облучения сохранялась только до момента времени облучения, соответствующего 10500 с, после чего наблюдалось уменьшение скорости образования молекулярного брома. Мы объясняем этот факт тем, что молекулярного брома образовывалось уже достаточно для того, чтобы реакция (III) вступала в конкуренцию с реакцией (IV).
При этом для описания экспериментальных данных следует использовать выражение
(9)
${{W}_{{{\text{B}}{{{\text{r}}}_{2}}}}} = {{d\left[ {{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right]} \mathord{\left/ {\vphantom {{d\left[ {{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right]} {dt}}} \right. \kern-0em} {dt}} = \left( {{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}} \right){{\sigma }_{{\text{д}}}}I\left[ {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{F}}}_{{\text{2}}}}{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right]{{{{k}_{{{\text{IV}}}}}\left[ {{{{\text{O}}}_{{\text{2}}}}} \right]} \mathord{\left/ {\vphantom {{{{k}_{{{\text{IV}}}}}\left[ {{{{\text{O}}}_{{\text{2}}}}} \right]} {({{k}_{{{\text{IV}}}}}\left[ {{{{\text{O}}}_{{\text{2}}}}} \right] + {{k}_{{{\text{III}}}}}\left[ {{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right])}}} \right. \kern-0em} {({{k}_{{{\text{IV}}}}}\left[ {{{{\text{O}}}_{{\text{2}}}}} \right] + {{k}_{{{\text{III}}}}}\left[ {{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right])}}.$После несложных преобразований выражение (9) приобретает следующий вид:
(10)
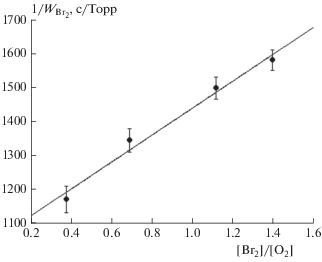
${1 \mathord{\left/ {\vphantom {1 {{{W}_{{{\text{B}}{{{\text{r}}}_{2}}}}}}}} \right. \kern-0em} {{{W}_{{{\text{B}}{{{\text{r}}}_{2}}}}}}} = {1 \mathord{\left/ {\vphantom {1 {W_{{{\text{B}}{{{\text{r}}}_{{\text{2}}}}}}^{'}}}} \right. \kern-0em} {W_{{{\text{B}}{{{\text{r}}}_{{\text{2}}}}}}^{'}}}\left( {1 + {{{{k}_{{{\text{III}}}}}\left[ {{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right]} \mathord{\left/ {\vphantom {{{{k}_{{{\text{III}}}}}\left[ {{\text{B}}{{{\text{r}}}_{{\text{2}}}}} \right]} {{{k}_{{{\text{IV}}}}}\left[ {{{{\text{O}}}_{2}}} \right]}}} \right. \kern-0em} {{{k}_{{{\text{IV}}}}}\left[ {{{{\text{O}}}_{2}}} \right]}}} \right).$График зависимости ${1 \mathord{\left/ {\vphantom {1 {{{W}_{{{\text{B}}{{{\text{r}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{W}_{{{\text{B}}{{{\text{r}}}_{{\text{2}}}}}}}}}$ от [Br2]/[O2] представлен на рис. 6. Сечение на оси ординат этого графика представляет собой обратную величину скорости накопления Br2 в условиях, когда выполняется выражение (8). Это позволило, используя данное выражение, вычислить сечение диссоциации C2H2F2Br2 (σД), которое оказалось равным (3.4 ± 0.25) ∙ 10–20 см2. Усредненное значение σд по результатам наших экспериментов оказалось равным (3.2 ± 0.2) ∙ 10–20 см2. Из тангенса угла наклона прямой на рис. 6 было также определено отношение констант скорости kIII/kIV, которое составило величину 0.38.
Рис. 6.
Зависимость ${1 \mathord{\left/ {\vphantom {1 {{{W}_{{{\text{B}}{{{\text{r}}}_{{\text{2}}}}{\text{\;}}}}}}}} \right. \kern-0em} {{{W}_{{{\text{B}}{{{\text{r}}}_{{\text{2}}}}{\text{\;}}}}}}}$ от [Br2]/[O2], полученная при давлении кислорода, равном 12 Торр, и давлении C2H2F2Br2 в 30 Торр.
Отметим, что почти такое же большое (2.37 · · 10–20 см2) значение сечения поглощения для хладонов этанового ряда на длине волны 253.7 нм наблюдается только еще у хладона C2F4Br2, также содержащего два атома брома [29]. У хладонов, содержащих один атом брома, сечения поглощения в основном значительно ниже: CF3CH2Br – 0.65 ∙ 10–20 см2, CF3CHFBr – 0.226 ∙ 10–20 см2 [30], CF3CF2Br – 0.135 ∙ 10–20 см2 [31].
Квантовый выход фотолиза, φ, определяется из отношения сечения диссоциации σд на соответствующей длине волны к сечению поглощения σ на той же длине волны. Используя определенные нами значения этих величин, мы получили величину квантового выхода фотолиза C2H2F2Br2 на длине волны 253.7 нм: φ = 1.03 ± 0.1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Данные, представленные на рис. 2, свидетельствуют о том, что в условиях, когда фотолиз C2H2F2Br2 осуществляется в присутствии достаточно большого парциального давления кислорода, в результате поглощения кванта света из одной молекулы хладона образуется только один атом брома. Проследнее обстоятельство говорит о том, что кислород эффективно дезактивирует возбужденный радикал ${{{\text{C}}}_{2}}{{{\text{H}}}_{2}}{{{\text{F}}}_{2}}{\text{B}}{{{\text{r}}}^{{\centerdot \,*}}}$, образующийся в реакции (0). В свою очередь, это означает, что константа скорости реакции (I), которая могла бы привести к возникновению еще одного атома брома, пренебрежимо мала по сравнению с эффективной константой скорости реакции (II). То, что множитель α в выражении (6) с достаточной точностью равен единице, подтверждается отсутствием зависимости скорости образования брома от давления кислорода в широком диапазоне давлений последнего (рис. 3). Исключение составляют лишь опыты, представленные на рис. 6, в которых концентрация образовавшегося брома при больших временах облучения становится сравнимой с концентрацией кислорода. При этом возникает зависимость скорости фотолиза от отношения [Br2]/[O2] в соответствии с выражением (10).
Во всех приведенных выше опытах квантовый выход φ фотолиза C2H2F2Br2 с хорошей точностью был равен единице в соответствии с представленной нами схемой фотолиза и наблюдаемыми кинетическими закономерностями. Отметим, что при изучении нами фотолиза C2F4Br2 на длине волны 253.7 нм [21] квантовый выход φ также оказался равным 1.1 ± 0.12.
Полученная нами в работе [21] величина φ отличалась от данных работы [32], в которой были получены значения φ = 1.9 ± 0.1, 1.9 ± 0.1 и 1.4 ± 0.1 для длин волн 193, 233 и 266 нм соответственно. Экстраполяция этих данных на длину волны 253.7 нм дает величину φ = 1.6. Различие величин квантовых выходов, полученных авторами работы [32] и нами в работе [21], мы объяснили тем, что так же, как и фотолиз C2H2F2Br2 в данной работе, фотолиз C2F4Br2 в работе [21] проводился при больших давлениях кислорода. При этих условиях дезактивация радикала ${{{\text{C}}}_{2}}{{{\text{F}}}_{4}}{\text{B}}{{{\text{r}}}^{{\centerdot \,*}}}$ на молекулах кислорода преобладает над реакцией распада этого радикала с образованием атома брома и C2F4.
Что касается перспективы применения хладона C2H2F2Br2 для тушения пожаров, то, несмотря на приведенное выше сравнительно низкое значение его ОРП, два обстоятельства могут помешать этому.
Во-первых, этот хладон обладает высокой горючестью, и требуется использовать специальные добавки для ее снижения.
Во-вторых, если процессы пиролиза хладона включают те же стадии, что и процессы, происходящие при фотолизе, то можно обратить внимание на следующее обстоятельство. Определенное нами при фотолизе C2H2F2Br2 отношение kIII/kIV, равное 0.38, является значительно более низким, чем для изученного нами ранее хладона CHF2Br, для которого это отношение составляет 4.8 [14]. Хладон CHF2Br также имеет низкое значение ОРП и уже предложен для применения в пожаротушении [12]. Напомним, что реакция (III) является процессом регенерации исходного хладона, а конкурирующая с этим процессом реакция (IV) превращает радикал C2H2F2Br• в неактивную форму. Поэтому, если бы хладон C2H2F2Br2 применялся для ингибирования процесса горения, то его расход был бы значительно выше, чем расход CHF2Br, и в результате образовывалось бы больше токсичных продуктов пиролиза.
ВЫВОДЫ
1. На спектрофотометре Specord M-40 записаны спектры поглощения хладона C2H2F2Br2 в области длин волн 230–258 нм при четырех значениях давления хладона (12, 21, 24 и 30 Торр) и рассчитаны его сечения поглощения в данной области спектра. Анализ существующей литературы дает основание считать, что эти спектры получены впервые.
2. Предложена схема фотолиза C2H2F2Br2 в присутствии кислорода.
3. Показано, что в широком диапазоне давлений кислорода в результате поглощения кванта света на длине волны 253.7 нм из одной молекулы хладона образуется только один атом брома. Этот факт согласуется с предложенной схемой фотолиза.
4. Обсуждена возможность применения C2H2F2Br2 как средства тушения пожаров. Приведены доводы, указывающие на то, что этот хладон не имеет преимуществ по сравнению с уже применяющимся в пожаротушении хладоном CHF2Br.
Список литературы
Ларин И.К. Химическая физика озонового слоя. М.: ГЕОС, 2013. С. 86.
Ларин И.К. // Хим. физика. 2019. Т. 38. № 10. С. 65.
Ларин И.К. // Хим. физика. 2019. Т. 38. № 5. С. 81.
Ларин И.К. // Хим. физика. 2018. Т. 37. № 11. С. 88.
Daniel J.S., Solomon S., Albritton D.L. // J. Geophys. Res. 1995. V. 100. P. 1271.
Daniel J.S., Solomon S., Portman R.W., Garcia R.R. // Ibid. 1999. V. 104. P. 23871.
Ларин И.К., Белякова Т.И., Мессинева Н.А., Спасский А.И., Трофимова Е.М. // Кинетика и катализ. 2011. Т. 52. С. 1.
Ларин И.К., Белякова Т.И., Мессинева Н.А., Спасский А.И., Трофимова Е.М. // Кинетика и катализ. 2017. Т. 58. С. 115.
Белякова Т.И., Ларин И.К., Мессинева Н.А., Спасский А.И., Трофимова Е.М. // Хим. физика. 2018. Т. 37. С. 78.
Halocarbons: Ozone Depletion and Global Warming Overview. NASA, 2006.
Burkholder J.B., Wilson R.R., Gierczak T. et al. // J. Geophys. Res. 1991. V. 96. P. 5025.
Noto T., Babushok V., Hamins A., Tsang W. // Combust. and Flame. 1998. V. 112. P. 147.
Cynthia A. de Wit. // Chemosphere. 2002. V. 46. P. 583.
Montreal Protocol on Substances that Deplete the Ozone Layer, United Nations Environment Programme (UNEP): Assessment Report of the Halons Technical Options Committee, 2006.
Ларин И.К., Белякова Т.И., Мессинева Н.А., Спасский А.И., Трофимова Е.М. // Кинетика и катализ. 2014. Т. 55. № 5. С. 549.
Hsu K.-J., DeMore W.B. // Geophys. Res. Lett. 1994. V. 21.P. 805.
Hsu K.-J., DeMore W.B. // J. Phys. Chem. 1995. V. 99. P. 1235.
Orkin V.L., Khamaganov V.G. // J. Atmos. Chem. 1993. V. 16. P. 169.
Chiorboli C., Piazza R., Tosato M.L., Carassiti V. // Coord. Chem. Rev. 1993.V. 125. P. 241.
Sander S.P., Kurilo L.M., Orkin V.L. et al. Chemical Kinetics and Photochemical Data for Use in Stratospheric Modeling. Evaluation № 15. Pasadena. CA: California Institute of Technology, 2006.
Ларин И.К., Белякова Т.И., Мессинева Н.А., Спасский А.И., Трофимова Е.М. // Кинетика и катализ. 2011. Т. 52. № 4. С.1.
Hudson R.D. // Can. J. Chem. 1974. V. 52. P. 1465.
Johnsto H.S., Paige M., Yao F. // J. Geophys. Res. 1984. V. 89. P. 661.
Cheung A.S.C., Yoshino K., Parkinson W.H., Freeman D.E. // Geophys. Res. Lett. 1984. V. 11. P. 580.
Cheung A.S.C., Yoshino K., Parkinson W.H., Guberman S.L., Freeman D.E. // Planet. Space Sci. 1986. V. 34. P. 1007.
Yu-Ran Luom.Handbook of Bond Dissociation Energies in Organic Compounds. CRC Press, 2002. P. 158.
Szwarc M., Sehon A.H. // J. Chem. Phys. 1951. V. 19. P. 656.
Семёнов Н.Н. Цепные реакции. М.: Наука, 1986.
Gillotay D., Simon P.C., Dierickx L. // Aeronomica Acta. 1988. V. A335. P. 1.
Orkin V.L., Kasimovskaya E.E. // J. Atmos. Chem. 1995. V. 21. P. 1.
Pence W., Baughum S., Leone S. // J. Phys. Chem. 1981. V. 85. P. 3844.
Zou P., McGivern W.S., Sokhabi O., Suits A.G., North S.W. // J. Chem. Phys. 2000. V. 113. P. 7149.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


