Химическая физика, 2020, T. 39, № 12, стр. 29-36
Редуцирование детального кинетического механизма для эффективного моделирования задержек воспламенения смесей метана и ацетилена с кислородом
А. М. Тереза 1, *, Г. Л. Агафонов 1, А. С. Бетев 1, С. П. Медведев 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
* E-mail: tereza@chph.ras.ru
Поступила в редакцию 18.05.2020
После доработки 18.05.2020
Принята к публикации 22.06.2020
Аннотация
Проведено численное моделирование задержек воспламенения τ для стехиометрических смесей С2Н2/О2 и СН4/О2 с использованием различных детальных кинетических механизмов (ДКМ), представленных в литературе. Сравнение расчетов τ с использованием различных механизмов ДКМ позволило выбрать для процедуры редуцирования оптимальный из них. Численное моделирование проводилось в диапазонах температуры 800 < T < 2100 K и давления 0.02 < P < 1.1 МПа. Редуцирование числа компонент ДКМ осуществлялось методом проб и ошибок по анализу отклика задержки воспламенения. Разработанный автоматический программный модуль позволил уменьшить число компонент для С2Н2/О2 более чем в два раза, а для СН4/О2 – в три раза. Сопоставление расчетов задержек воспламенения по редуцированным кинетическим механизмам показало хорошее согласие с представленными в литературе экспериментальными данными для смесей С2Н2/О2 и СН4/О2, различающихся по степени разбавления аргоном.
ВВЕДЕНИЕ
Изучение воспламенения, горения и детонации в газовых смесях обусловлено широким распространением этих процессов в различных технологических, промышленных, энергетических установках, а также в двигательных системах. Проведение масштабных экспериментов сопряжено с огромными материальными затратами, поэтому на многих этапах исследований активно применяется численное моделирование [1]. Данная расчетная процедура позволяет выявить определяющие особенности протекания различных физико-химических процессов и удачно прогнозировать экспериментальные исследования. В ряде случаев с помощью численного моделирования удается прогнозировать оптимальные условия проведения экспериментов [2]. Особенно это важно для изучения сложных пограничных процессов, когда наблюдаются переходы очагового воспламенения в распространение пламени, а затем уже – горения в детонацию [3‒6].
Благодаря быстрому развитию возможностей вычислительной техники и совершенствованию математического аппарата для численного моделирования с высокой точностью динамики газа появляется возможность более глубокого анализа и понимания процессов воспламенения, горения и детонации. Это приводит к значительному увеличению размеров детального кинетического механизма (ДКМ) по количеству компонент и реакций. В работах [7, 8] представлена динамика увеличения ДКМ за последние 30 лет. На основании ее анализа делается вывод о том, что наблюдается резкое увеличение не только числа реакций и компонент, составляющих различные ДКМ, но и количество самих ДКМ, разрабатываемых различными научными группами. В итоге ДКМ содержат сотни компонент и несколько тысяч элементарных реакций. Причин такого структурного увеличения наполняемости ДКМ и роста количества самих ДКМ – три. Первая связана с тем, что появляются новые данные об элементарных химических реакциях. Большинство этих количественных данных в настоящее время получаются с помощью квантовомеханических расчетов [9, 10]. Вторая причина обусловлена методикой конструирования ДКМ, когда блоки новых реакций добавляются к уже существующим ДКМ [11, 12], тем самым расширяя последние. Третья относится к вопросам мониторинга процессов горения и пиролиза, когда развитие методик регистрации позволяет получать более точную кинетическую информацию о концентрациях все большего числа атомов, радикалов и молекул, включая электронно-возбужденные состояния некоторых из них [13‒15]. Мониторинг в совокупности с численным моделированием горения дает возможность значительно улучшить энергоэффективность и экологическую безопасность сжигания различных углеводородных топлив.
Значительное расширение ДКМ по числу компонент и реакций приводит к проблеме их прямого использования в газодинамических расчетах с учетом химической кинетики, обременяя расчеты увеличением времени счета и накоплением вычислительных ошибок [16‒18]. В этой связи приходится проводить оптимизацию ДКМ с целью уменьшения количества компонент и реакций, получая в итоге редуцированный кинетический механизм (РКМ) [7, 8, 18, 19] и/или глобальный кинетический механизм [20, 21]. Методики редуцирования ДКМ в основном сводятся к уменьшению числа реакций [16‒18]. В то же время ранг матрицы Якоби определяется количеством компонент в ДКМ [1]. Если расчет скоростей реакций сводится к арифметическим действиям с матрицами, то интегрирование проводится по количеству компонент. В этой связи разумно понижать количество компонент, а вместе с ними и реакций, в которых они участвуют. В настоящее время математический аппарат редуцирования по числу реакций достаточно хорошо представлен различными методами, описанными в работах [16‒18]. Однако методик редуцирования числа компонент в литературе представлено значительно меньше. В основном они сводятся к трем методам.
1. Первым из них является метод квазистационарных состояний [17]. Этим методом в работе [22] было проведено редуцирование ДКМ, состоящего из 28 компонент и 114 реакций, до РКМ, содержащего 25 реакций и 15 компонент для стехиометрической смеси С2Н2/О2 в диапазонах температуры 900 < T < 2000 K и давления 0.01 < T < 5 МПа. Данный метод требует от исследователя хорошего знания химической кинетики конкретного процесса горения или пиролиза. Он удачно применяется в тех случаях, когда число компонент в ДКМ незначительное.
2. Для ДКМ, в которых число компонент может измеряться сотнями, применяется метод проб и ошибок (trial-and-error method) по анализу отклика к заданному физическому параметру [1, 16, 18].
3. В последнее время наибольшее распространение получили различные варианты метода анализа графа прямых связей (DRG), основанного на определении влияния отдельных компонент на группу компонент, определяющих поведение параметров химических превращений [18, 19, 23, 24].
Во всех трех методах важным является выбор физикохимических параметров, по которым проводится редуцирование, и тех интервалов времени, в которых проводится анализ системы обыкновенных дифференциальных уравнений (ОДУ), определяющих химическую кинетику. Как следствие, редуцирование по методу DRG становится отдельной научно-исследовательской задачей, что делает этот процесс трудноосуществимым в автоматическом режиме [18, 24].
В настоящей работе апробирована методика автоматического редуцирования числа компонент и реакций ДКМ по задержке воспламенения τ для стехиометрических смесей ацетилена и метана с кислородом. Выбор объектов исследования обусловлен необходимостью продемонстрировать универсальность предлагаемого подхода. Ацетилен обладает самыми высокими энергетическим потенциалом и детонационной способностью среди других углеводородов, в то время как метан является его антиподом [25‒28].
МЕТОДИКА РЕДУЦИРОВАНИЯ ДКМ
Сложности расчетов с использованием ДКМ напрямую связаны с решением прямой кинетической задачи, описываемой системой ОДУ, которая в общем случае является нелинейной [18, 29, 30]. Данная система ОДУ определена законом действующих масс, согласно которому изменение во времени концентрации i-го компонента Xi равно
(1)
$\frac{{d[{{{\text{X}}}_{i}}]}}{{dt}} = \mathop \sum \limits_j^{N_{R}^{i}} R_{j}^{ + } - \mathop \sum \limits_j^{N_{R}^{i}} R_{J}^{ - },$(2)
$R_{j}^{ + } = {{k}_{j}}\prod\limits_{l = 1}^\nu {\left[ {{{{\text{X}}}_{l}}} \right]} {\kern 1pt} ,$(3)
$R_{j}^{ - } = {{k}_{j}}\prod\limits_{l = 1}^{\nu - \xi } {\left[ {{{{\text{X}}}_{{jl}}}} \right]} {\kern 1pt} {{[{{{\text{X}}}_{i}}]}^{\xi }}\,;$(4)
${{C}_{p}}\frac{{dT}}{{dt}} = \sum\limits_{j = 1}^{{{N}_{R}}} {{{\Delta }_{r}}H_{j}^{0}{{R}_{j}}} - ~\frac{{\chi S}}{V}\left( {T - {{T}_{0}}} \right),$Система ОДУ (1) в совокупности с уравнением (4) принадлежит к классу так называемых “жестких” систем, которые характеризуются большим разбросом собственных значений матрицы Якоби [29], определяемой функцией Ψ. Последнее приводит к измельчению шага интегрирования и в итоге – к накоплению вычислительной ошибки и увеличению времени счета [1, 18].
Для уменьшения числа компонент в данной работе использовался метод проб и ошибок, а для уменьшения числа реакций – методика оценки вклада каждой реакции в изменение для каждого Xi правой части системы (1). Такой подход является вариантом анализа скоростей образования (rate-of-production analysis) [18]. На каждом шаге интегрирования, согласно (2) и (3), определялись вклады $R_{j}^{ + }$ и $R_{j}^{ - }$ в скорость образования, $\sum\nolimits_j^{N_{R}^{i}} {R_{j}^{ + }} ,$ и расходования, $\sum\nolimits_j^{N_{R}^{i}} {R_{j}^{ - }} ,$ i‑той компоненты по всем реакциям, участвующим в этих процессах. Далее по критериям [31]
(5)
$\frac{{R_{j}^{ + }}}{{\sum\limits_j^{N_{R}^{i}} {R_{j}^{ + }} }} \leqslant \varepsilon ,\,\,\,\,\frac{{R_{j}^{ - }}}{{\sum\limits_j^{N_{R}^{i}} {R_{j}^{ - }} }} \leqslant \varepsilon $Процедура редуцирования состояла в следующем. Строилась сетка значений Тl и Рl с фиксированным количеством точек l, покрывающих весь диапазон значений температуры и давления. По значениям этой сетки проводился расчет τ(Tl, Pl) для ДКМ. Затем путем последовательного исключения каждого i-го компонента определялось значение τ‒i(Tl, Pl), которое сравнивалось с τ(Tl, Pl) по критерию
(7)
${\text{abs}}\left( {\frac{{{{\tau }_{{ - i}}}\left( {{{T}_{l}},{{P}_{l}}} \right) - \tau \left( {{{T}_{l}},{{P}_{l}}} \right){\text{\;}}}}{{\tau \left( {{{T}_{l}},{{P}_{l}}} \right)}}} \right) < \delta ,$В соответствии с критериями (5)‒(7) была написана программа на языке FORTRAN 77, соединенная с программным модулем CHEMKIN III [32]. Все вычисления в данной работе проводились в предположении V = const. Процедура редуцирования осуществлялась в диапазонах температуры 1000 < T < 2100 К для смеси 21.43% C2H2 + 53.575% O2 в аргоне (φ = 1) и 1300 < T < 2000 К для смеси 10% CH4 + 20% O2 в аргоне (φ = 1). Для смеси C2H2/O2 расчеты проводились для трех давлений: 0.02, 0.1 и 1.1 МПа. Для смеси CH4/O2 значение давления составило 0.65 МПа.
АНАЛИЗ РАСЧЕТОВ ПО РАЗЛИЧНЫМ ДКМ
Прежде чем приступить к редуцированию, мы провели обзор ДКМ, представленных в литературе. Их сравнение осуществлялось на основе описания температурной зависимости задержки воспламенения τ. Выбор τ в качестве параметра обусловлен его высокими обобщенными характеристиками для анализа процесса самовоспламенения углеводородов [25]. Поскольку программный модуль CHEMKIN III требует использования термодинамических параметров для всех содержащихся в ДКМ компонент в формате NASA [33], то численное моделирование проводилось только с представленными в литературе ДКМ [11, 12, 34‒39], содержащими соответствующие термодинамические файлы данных. Под задержкой самовоспламенения горючих смесей в расчетах принималось значение τ, соответствующее максимальному росту давления [25].
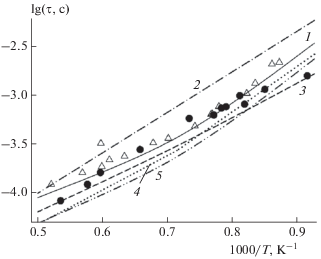
На рис. 1 представлены значения τ, полученные с использованием ДКМ из работ [11, 35‒39]. Из этого рисунка видно, что при Р = 0.02 и 0.1 МПа ДКМ из [11, 36, 38] предсказывают близкие значения τ на всем диапазоне температур, и только при Р = 1.1 МПа ДКМ из работы [36] предсказывает большее значение τ при T < 1200 K. В то же время значения τ, рассчитанные по ДКМ из [35], дают самые короткие, а по ДКМ из [37] – наболее длинные задержки воспламенения при всех значениях Р и Т. Значение τ из [39] меньше величин τ из работ [11, 36, 38], но демонстрирует аналогичную с ними температурную зависимость при всех трех значениях Р. Как показывает рис. 1, для Р = 0.02 и 0.1 МПа зависимость τ(Т) практически не изменяется для ДКМ из [11, 36, 38, 39], в то время как для ДКМ из [37] наблюдается меньшая зависимость τ(Т) при температуре выше 1400 К. При Р = 1.1 МПа уже для ДКМ из [11, 36, 38, 39] проявляется такое же уменьшение τ(Т), что и для ДКМ из [37]. В то же время значения τ, рассчитанные по ДКМ из [35], при всех трех значениях Р имеют одинаковую зависимость от температуры, слабо уменьшающуюся с ростом Т. Такое поведение τ(Т) приводит к тому, что если при T = = 2100 К значения τ уменьшаются с ростом Р, то при T = 1000 К для всех упомянутых ДКМ, кроме ДКМ из [35], наблюдается либо слабая, либо обратная зависимость τ(Р). Подобные изменения зависимостей τ(Р) от температуры, рассчитанные по ДКМ из работ [11, 36‒39], были получены в работе [22] для смесей ацетилена с кислородом в том же диапазоне температуры при давлениях от 0.01 до 5 МПа. Следует отметить, что с понижением температуры и ростом давления растет и расхождение значений τ, рассчитанных по разным ДКМ (рис. 1).
Рис. 1.
Рассчитанные температурные зависимости задержки воспламенения для смеси 21.43% C2H2 + 53.575% O2 в аргоне при Р = 0.02 МПа (сплошные линии): 1 – [38], 2 – [37], 3 – [35], 4 – [36], 5 – [11], 6 – [39]; при Р = 0.1 МПа (точечные линии): 7 – [38], 8 – [37], 9 – [35], 10 – [36], 11 – [11], 12 – [39]; при Р = 1.1 МПа (штриховые линии): 13 – [38], 14 – [37], 15 – [35], 16 – [36], 17 – [11], 18 – [39].
В целом, рис. 1 показывает, что расчеты в рамках различных ДКМ дают различающиеся результаты: как по характеру, так и в абсолютных значениях температурной зависимости задержки воспламенения τ для смеси ацетилена с кислородом. При этом различия в абсолютных значениях τ могут превышать один порядок величины для разных ДКМ. Выбор ДКМ, предназначенного для редуцирования, был основан на следующих соображениях. Согласно рис. 1, ДКМ из [11, 36, 38, 39] показывают аналогичные зависимости τ(Т) и τ(Р) в промежутке между крайними значениями τ, рассчитанными по ДКМ из [35, 37]. Расчеты значений τ по ДКМ из [11, 38] предсказывают близкие результаты для всех трех давлений во всем температурном диапазоне. Из этих двух механизмов для редуцирования был выбран ДКМ из [38], содержащий 57 компонент и 405 реакций.
РЕДУЦИРОВАНИЕ ДКМ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Редуцирование ДКМ из [38] для смеси C2H2−O2−Ar с использованием сетки из девяти точек при давлениях 0.02, 0.1 и 1.1 МПа и температурах 1000, 1500 и 2100 К осуществлялось при значении δ = 20% и свелось к РКМ(25;124), состоящему из 25 компонент и 124 реакций. Сопоставление результатов расчетов задержек воспламенения ДКМ из [38] и РКМ(25;124) представлено в табл. 1, где значения τ демонстрируют хорошее совпадение расчетов по ДКМ [38] и РКМ(25;124) на всей сетке значений Т и Р.
Таблица 1.
Сопоставление рассчитанных значений τ для смеси 21.43% C2H2 + 53.575% O2 в аргоне с использованием ДКМ из работ [12] и РКМ(25;124)
| P, MПa | τ, с | |||||||
|---|---|---|---|---|---|---|---|---|
| T = 1000 K | T = 1200 K | T = 1500 K | T = 2100 K | |||||
| ДКМ | РКМ | ДКМ | РКМ | ДКМ | РКМ | ДКМ | РКМ | |
| 0.02 | 3.28E–4 | 3.25E–4 | 9.08E–5 | 9.07E–5 | 3.06E–5 | 3.06E–5 | 9.22E–6 | 9.53E–6 |
| 0.1 | 1.14E–4 | 1.11E–4 | 2.25E–5 | 2.24E–5 | 6.32E–6 | 6.33E–6 | 1.88E–6 | 1.91E–6 |
| 1.1 | 2.43E–4 | 2.19E–4 | 7.58E–6 | 7.29E–6 | 7.91E–7 | 7.88E–7 | 1.75E–7 | 1.78E–7 |
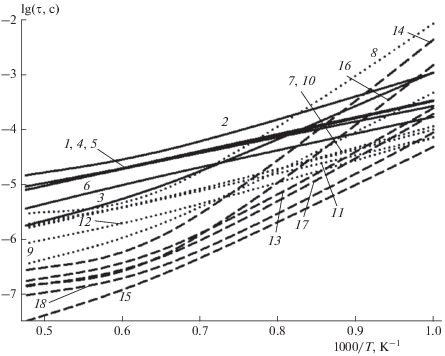
Расчеты τ, полученные с помощью РКМ(25;124), сопоставлялись с экспериментальными данными, представленными в работах [40‒43] (рис. 2 и 3). Рисунок 2 демонстрирует хорошее соответствие описания температурной зависимости задержки воспламенения τ, рассчитанной по РКМ(25;124), экспериментальным данным из работ [40, 41]. Здесь же представлены и результаты расчетов τ, проведенные с помощью ДКМ из работ [11, 12, 34, 39]. Хотя на рис. 2 представлены задержки воспламенения для сильно разбавленной аргоном смеси C2H2/O2, тем не менее видно, что расчет по ДКМ из [11] близок к расчетам по РКМ(25;124), как и в случае условий для рис. 1. Близки к ним и расчеты по ДКМ из работ [12, 39]. Расчет по ДКМ из [34] показал большее значение τ во всем температурном диапазоне.
Рис. 3.
Температурная зависимость задержки воспламенения стехиометрических смесей C2H2/O2/Ar: ▲, ⚪ – экспериментальные данные из [42] для смеси 8.6% C2H2 + 21.4% O2 в аргоне при Р ~ 0.4 Мпа, ◻ ‒ экспериментальные данные из [43] для смеси 7.8% C2H2 + 19.4% O2 в аргоне при Р ~ 0.65 МПа. Линии 1–4 – расчеты для условий, приведенных в [42], по РКМ(25;124) и из работ [11], [39], [12] соответственно.
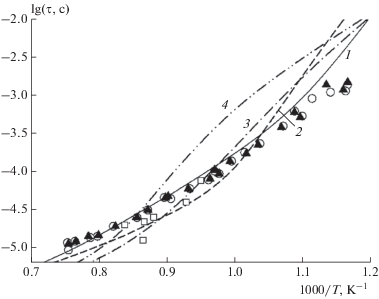
На рис. 3 представлено сравнение рассчитанных по РКМ(25;124) и ДКМ из работ [11, 12, 39] и экспериментально наблюдаемых температурных зависимостей задержки воспламенения стехиометрических смесей C2H2/O2/Ar по данным из работ [42, 43]. Поскольку при близких составах смесей и величинах давления значения τ, полученные в работах [42] и [43], хорошо согласуются между собой, расчеты проводились для условий, приведенных в [42]. Как и в случае рис. 2, видно, что РКМ(25;124) достаточно хорошо описывает экспериментальные результаты во всем температурном диапазоне. Детальные КМ из работ [11, 39] также показали хорошее описание температурной зависимости τ при T > 970 K. В то же время с понижением температуры эти ДКМ дали несколько большее значение τ, чем в [42]. Детальный КМ из [12] дает хорошее описание этой зависимости только при T > 1100 К. С понижением температуры значение τ по ДКМ из [12] увеличивается и становится в три раза больше, чем в [42].
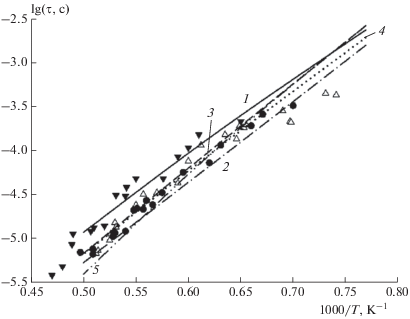
Апробация методики редуцирования ДКМ из работы [38] применительно к смеси 10% CH4 + + 20% O2, разбавленной аргоном, была осуществлена с δ = 30% при Р = 0.65 МПа в температурном диапазоне 1300 < T < 2000 K. Использовались три значения температуры: 1300, 1600 и 2000 К. В результате был получен РКМ(16; 60), состоящий из 16 компонент и 60 реакций. Таблица 2 демонстрирует хорошее соответствие расчетов по РКМ(16; 60) и ДКМ из [38]. Видно, что для смеси CH4/O2/Ar наибольшее расхождение расчетов по РКМ и исходному ДКМ из [38] наблюдается при Т = 2000 К. Сравнение расчетов по РКМ(16;60) и ДКМ из работ [11, 12, 34, 39] представлено на рис. 4 при описании экспериментально наблюдаемых значений τ из [31]. Расчеты проводились для φ = 1, поскольку в [31] было показано, что изменение φ от 0.33 до 3 в указаном диапазоне температуры слабо влияет на задержку воспламенения, изменяя ее приблизительно в 2 раза (рис. 4). Такая слабая зависимость τ(Т) от φ позволяет применительно к углеводородовоздушным смесям проводить редуцирование ДКМ при φ = 1. Из рис. 4 видно, что расчеты задержек воспламенения τ по РКМ(16; 60) и ДКМ из работ [11, 12, 34, 39] достаточно хорошо согласуются с данными из [31].
Таблица 2.
Сопоставление рассчитанных значений τ для смеси 10% CH4 + 20% O2 в аргоне при Р = 0.65 МПа с использованием ДКМ из работы [12] и РКМ(16;60)
| τ, с | |||||
|---|---|---|---|---|---|
| T = 1300 K | T = 1600 K | T = 2000 K | |||
| ДКМ | РКМ | ДКМ | РКМ | ДКМ | РКМ |
| 2.28E–3 | 2.40E–3 | 1.42E–4 | 1.57E–4 | 9.60E–6 | 1.20E–5 |
Рис. 4.
Температурная зависимость задержки воспламенения смесей метана в аргоне при Р ~ 0.65 МПа по данным работы [31]: △ – 10% CH4 + 20% O2 (φ = 1), ⚫ – 24% СН4 + 16% О2 (φ = 3), ▼ − 3.4% СН4 + 20.4% О2 (φ = 0.33). Линии 1–5 – расчеты для φ = 1 по РКМ(16;60) и из работ [34], [11], [39], [12] соответственно.
Варьируя величину δ, можно изменять степень редуцирования. Так, при изменении значения δ с 20% на 10% для смеси С2Н2/О2 ДКМ из работы [38] свелся к РКМ, состоящему из 37 компонент и 235 реакций. Прямой зависимости между количеством компонент и величиной δ не существует, поскольку каждый компонент вносит с блоком своих реакций вклад в формирование значения τ(Р, Т) не только по абсолютной величине Δτ, но и по знаку +/‒. Аналогичным влиянием обладают и группы взаимосвязанных компонентов, что демонстрируют различные методы DRG [18]. Однако общая тенденция уменьшения числа компонент с увеличением δ наблюдается.
В представленной работе редуцирование ДКМ осуществлялось по параметру τ, что было обусловлено моделированием процесса самовоспламенения ацетилена и метана в смесях с кислородом. В других задачах в качестве параметров редуцирования могут выступать иные характеристики процессов физико-химических превращений. Такими параметрами (η) могут служить нормальная скорость распространения пламени, профили концентраций исходных реагентов, продуктов горения и пиролиза, суммарное тепловыделение [25]. В случае моделирования излучения и ионизации в реагирующих смесях целесообразно принимать в качестве η как сами электронно-возбужденные состояния частиц и зондовые токи, так и концентрации атомов, радикалов и молекул, определяющие эти процессы [13‒15, 40, 44]. Предложенный метод редуцирования ДКМ можно применять и в условиях, когда нарушается термодинамическое равновесие, например для сверхзвуковых течений, где требуется учет влияния неравновесной колебательной и химической кинетики и необходимо оценивать ее влияние на параметры потока [45]. Для этого нужно дополнить систему ОДУ (1) соответствующими уравнениями поуровневой кинетики [45‒47]. Аналогичным образом можно расширить область применения предложенного метода редуцирования ДКМ для гетерогенных физико-химических процессов с учетом каталитических реакций [19, 30, 48].
ЗАКЛЮЧЕНИЕ
Проведенное численное моделирование стехиометрической смеси С2Н2/О2 в широких диапазонах температуры и давления позволило выбрать из представленных в литературе оптимальный ДКМ для дальнейшего его редуцирования. Определив τ в качестве основного характеристического параметра процесса самовоспламенения углеводородных топлив, с помощью метода проб и ошибок удалось эффективно средуцировать исходный ДКМ применительно к смесям С2Н2/О2 и СН4/О. Разработанный программный модуль позволил в автоматическом режиме по параметру δ(τ) получить РКМ для каждой из исследуемых смесей углеводородов. Апробация полученных РКМ по представленным в литературе экспериментальным данным показала их хорошую валидацию по описанию задержек воспламенения. Развитие методики редуцирования числа компонент ДКМ требует разработки сложного математического аппарата для поиска минимумов функционала по уравнениям (1) и (4) в автоматическом режиме. Успех решения проблемы редуцирования ДКМ во многом будет определяться выбором параметра η и балансом точности описания процесса с определением значения δ. Представленная работа показала, что и без исследования функции Ψ можно эффективно проводить редуцирование ДКМ.
Работа выполнена в рамках Программы фундаментальных исследований Российской академии наук на 2013–2020 гг. по теме ФИЦ ХФ РАН № 49.23 (номер государственной регистрации ЦИТИС: АААА-А18-118031590088-8).
Список литературы
Frenklach M. Combustion Chemistry / Ed. Gardi-ner W.C., Jr. New York: Springer, 1984.
Фролов С.М., Дубровский А.В., Иванов В.С. // Хим. физика. 2013. Т. 32. № 2. С. 56.
Liberman M. A., Kiverin A. D., Ivanov M. F. // Phys. Rev. E. 2012. V. 85. P. 056312.
Иванов М.Ф., Киверин А.Д, Клумов Б.А., Фортов В.Е. // УФН. 2014. Т. 184. № 3. С. 247.
Медведев С.П., Поленов А.Н., Хомик С.В., Гельфанд Б.Е. // Хим. физика. 2010. Т. 29. № 1. С. 58.
Betelin V.B., Kushnirenko A.G., Smirnov N.N. et al. // Acta Astronautica. 2018. V. 144. P. 363.
Lu T., Law C.K. // Prog. Energy Comb. Sci. 2009. V. 35. P. 192.
Wu Yu. Dissertation … Ph. D. Storrs: Connecticut University, 2019.
Szabo A., Ostlund N.S. Modern quantum chemistry: Introduction to advanced electronic structure theory. NY: Dover publications, 1996.
Jensen F. Introduction to computational chemistry. 3rd ed. Hoboken, NJ: John Wiley & Sons. 2017.
Zhou C.-W., Li Y., Burke U. et al. // Combust. and Flame. 2018. V. 197. P. 423.
Ranzi E., Frassoldati A., Grana R. et al. // Progress Energy Combust. Sci. 2012. V. 38. P. 468.
Kathrotia T. Dissertation … Dr.-Ing. Heidelberg, Germany: Ruprecht-Karls University, 2011.
Kopp M.M., Brower M., Mathieu O. et al. // Appl. Phys. B. 2012. V. 107. P. 529.
Bozkurt M. Dissertation … Dr.‒Ing. Duisburg, Germany: Duisburg–Essen University, 2013.
Reduced kinetic mechanisms for applications in combustion systems / Eds. Peters N., Rogg B. Berlin–Heidelberg: Springer-Verlag, 1993.
Lissianski V.V., Zamansky V.M., Gardiner W.C., Jr. Gas-phase combustion chemistry. Ed. Gardiner W.C., Jr. New York: Springer, 2000. P. 1.
Turanyi T., Tomlin A.S. Analysis of kinetic reaction mechanisms. Heidelberg: Springer, 2014.
Ломоносов В.И., Синев М.Ю. // Кинетика и катализ. 2020. № 6. С. 873.
Басевич В.Я., Беляев А.А., Фролов С.М. // Хим. физика. 1998. Т. 17. № 10. С. 71.
Andersen J., Rasmussen Ch.L., Giselsson T., Glarborg P. // Energy and Fuels. 2009. V. 23. № 3. P. 1379.
Varatharajan B., Williams F. A. // Combust. and Flame. 2001. V. 125. P. 624.
Jaravel Th., Wu H., Ihme M. // Ibid. 2019. V. 200. P. 192.
Chang Ya., Jia M., Niu B., Dong X., Wang P. // Ibid. 2020. V. 212. P. 355.
Заманский В.М., Борисов А.А. // Итоги науки и техники. Сер. “Кинетика и катализ”. М.: ВИНИТИ, 1989. С. 160.
Leschevich V. V., Martynenko V.V., Penyazkov O.G., Sevrouk K.L., Shabunya S.I. // Shock Waves. 2016. V. 26. P. 657.
Тереза А.М., Андержанов Э.К. // Хим. физика. 2019. Т. 38. № 8. С. 1.
Krivosheyev P., Penyazkov O., Sakalou A. // Combust. and Flame. 2020. V. 216. P. 146.
Калиткин Н.Н. Численные методы. М.: Наука, 1978.
Коледина К.Ф. Дис. … д-ра физ.-мат наук. Уфа: УФИЦ РАН, 2020.
Тереза А.М., Северин Е.С., Слуцкий В.Г. // Хим. физика. 2003. Т. 22. № 6. С. 30.
Kee R.J., Rupley F.M., Meeks E., Miller J.A. CHEMKIN III: Tech. Rep. № SAND96-8216. Livermore CA: Sandia National Laboratories, 1996.
Burcat A. Report № TAE-867. Tel-Aviv: Technion-Israel Institute of Technology. 2001; http://garfield.chem.elte.hu/Burcat/burcat.html
Smith G.P., Golden D.M., Frenklach M. et al. GRI-Mech 3.0. 1999; www.me.berkeley.edu/gri_mech/
Battin-Leclerc F., Warth V., Bounaceur R. et al. // Proc. Combust. Inst. 2014. V. 35. P. 349; https://hal.archivesouvertes.fr/hal-0772058/file/Supplemental_data_2.txt
Fernandez-Galisteo D., Sanchez A.L., Linan A., Williams F.A. // Combust. Theory and Modelling. 2009. V. 3. № 4. P. 74; http://web.eng.ucsd.edu/mae/groups/combustion/ mechanism.html
Tao Y., Smith G.P., Wang H. // Combust. and Flame. 2018. V. 195. P. 18; http://nanoenergy.stanford.edu/ffcm1
Tereza A.M., Medvedev S.P., Smirnov V.N. // Acta Astronautica. 2019. V. 163. P. 18; http://old.chph.ras.ru/lab_0114.html
Slavinskaya N., Mirzayeva A., Whitside R. et al. // Combust. and Flame. 2019. V. 210. P. 25.
Rickard M.J.A., Hall J.M., Petersen E.L. // Proc. Combust. Inst. 2005. V. 30. P. 1915.
Smirnov V.N., Tereza A.M., Vlasov P.A., Zhiltsova I.V. // Proc. Sympos. Intern. Shock Waves. V. 31. Nagoya, Japan: Springer, 2019. P. 159; https://doi.org/10.1007/978-3-319-91020-8_17
Baranyshyn Y.A., Krivosheyev P.N., Penyazkov O.G., Sevrouk K.L. // Shock Waves. 2020. V. 30. P. 305; https://doi.org/10.1007/s00193-020-00937-0
Тереза А.М., Слуцкий В.Г., Северин Е.С. // Хим. физика. 2009. Т. 28. № 2. С. 45.
Vlasov P.A., Zhiltsova I.V., Smirnov V.N. et al. // Combust. Sci. and Technol. 2018. V. 190. № 1. P. 57.
Kustova E.V., Nagnibeda E.A., Alexandrova T.Yu. et al. // Chem. Phys. 2002. V. 276. № 2. P. 139.
Скребков О.В., Каркач С.П., Иванова А.Н., Костенко С.С. // Кинетика и катализ. 2009. Т. 50. № 4. С. 483.
Kunova O.V., Nagnibeda E.A. // Chem. Phys. 2014. V. 441. P. 66.
Koledina K.F., Koledin S.N., Karpenko A.P. et al. // J. Math. Chem. 2019. V. 57. № 2. P. 484.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика