Химическая физика, 2020, T. 39, № 2, стр. 85-92
Влияние акцептора электронов на скорость деградации углеводородных загрязнений грунтов бактериями рода Rhodococcus в анаэробных условиях
С. Н. Гайдамака 1, *, М. А. Гладченко 1, В. П. Мурыгина 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: S.Gaidamaka@gmail.com
Поступила в редакцию 12.04.2019
После доработки 12.04.2019
Принята к публикации 22.04.2019
Аннотация
Исследовано влияние концентрации кислородного акцептора в виде нитратсодержащей соли на скорость и механизм деградации углеводородов (УВ) в реальных образцах грунтов, извлеченных из скважин глубиной от 1 до 5 м с территорий, отведенных под будущую городскую застройку, под действием штаммов бактерий, относящихся к роду Rhodococcus (R. ruber Ac-1513 Д и R. erythropolis Ac-1514 Д). Исходные образцы грунтов, содержащие до 9.8% УВ, способны в анаэробных условиях, в отсутствие кислородного акцептора, под действием метанобразующих аборигенных микроорганизмов продуцировать биогаз в течение 59 лет. При этом содержание пожароопасного метана в газовой продукции составляет от 8 до 36%, что делает недопустимой жилищную застройку на подобных территориях без проведения очистных мероприятий. Для ускорения процессов деградации УВ нефтеокисляющими бактериями в неспецифических для них бескислородных условиях предложено применять акцептор электронов – нитрат кальция. Установлен механизм деградации УВ в присутствии Ca(NO3)2 через процесс денитрификации. Показано обратно пропорциональное влияние нитрата кальция в трех исследованных концентрациях: 1.25, 2.5 и 5.0%, на процессы денитрификации и анаэробной деградации УВ, что связано с ингибированием процесса денитрификации высокими концентрациями Ca(NO3)2. В присутствии минимальной концентрации нитрата кальция, составляющей 1.25%, анаэробная деградация УВ в грунте в теплое и холодное время года протекает с максимальной скоростью деградации k = 1.27 и 0.32 год–1 соответственно. Объемное содержание основного непожароопасного продукта реакции – углекислого газа в газовой смеси будет составлять 99%. Таким образом, полное разложение УВ и фаза газогенерации завершатся в течение 1 года, что в 59 раз быстрее по сравнению с процессами, протекающими в отсутствие кислородного акцептора.
ВВЕДЕНИЕ
К наиболее распространенным пожароопасным загрязнениям территорий относятся техногенные разливы горюче-смазочных материалов. Особенно это опасно для территорий бывших полигонов захоронения твердых бытовых отходов, где насыпные грунты способны генерировать не только токсичный, но и взрывоопасный биогаз. Поэтому для осуществления жилищной застройки в таком случае требуется одновременное снижение газогенерации и концентрации углеводородов (УВ) в грунтах. Наиболее безопасным способом ликвидации нефтяных загрязнений является биологическое обезвреживание, главным образом аэробное. Однако на глубине нахождения подобных насыпных грунтов образуются анаэробные условия, что затрудняет действие аэробных углеводородокисляющих микроорганизмов, входящих в состав подавляющего большинства разрешенных для применения в природе коммерческих бактериальных препаратов-нефтедеструкторов.
В литературе описывается возможность биоремедиации аэробными бактериями Rhodococcus erythropolis T902.1 загрязненных нефтепродуктами тяжелых глинистых почв в условиях ограниченной диффузии кислорода [1]. При этом известно, что многие аэробные бактерии в зависимости от изменения условий окружающей среды способны в процессе потребления субстрата переключаться от использования свободного кислорода как конечного акцептора электронов к связанному – в виде нитратов, нитритов, углекислоты и т.д. [2]. Так, например, в работе [3] по изучению биодеградации 4-хлорфенола метаногенным консорциумом микроорганизмов была показана способность аэробных бактерий рода Rhodococcus phenolicus, обнаруженных в анаэробном консорциуме, к удалению токсиканта в строгих анаэробных условиях. В литературе у аэробных нефтеокисляющих бактерий рода Rhodococcus был отмечен универсальный метаболизм, обеспечивающий их жизнедеятельность в несвойственных им условиях: в отсутствие свободного кислорода, но в присутствии различных акцепторов электронов [4–8].
Известно [2], что в аэробных процессах конечным акцептором электрона или иона водорода является кислород. В анаэробных процессах таким акцептором может стать окисленное соединение типа нитрата. На основании этого нами был предложен механизм деградации УВ бактериями рода Rhodococcus в анаэробных условиях в грунтах, содержащих также и анаэробную аборигенную микрофлору, в присутствии кислородных акцепторов электронов типа нитратов и нитритов:
(1)
$\begin{gathered} {\text{УВ}} + {\text{NO}}_{3}^{ - }\xrightarrow{{\text{I}}}{\text{УВ}} + {\text{NO}}_{2}^{ - } + {{{\text{N}}}_{{\text{2}}}}{\text{О}}\xrightarrow{{{\text{II}}}} \\ \to {{{\text{N}}}_{2}} + {\text{C}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Процесс деградации УВ предположительно протекает в две стадии. На стадии I нитраты конвертируются в нитриты, реакцию денитрификации и денитритации осуществляют факультативные анаэробы, обладающие специфической активностью и содержащиеся в почвах и грунтах (уравнение (1)). А на стадии II образующийся нитрит в виде акцептора электронов вступает в реакцию конверсии УВ бактерии рода Rhodococcus (уравнение (1)), способность которых потреблять нитрогруппы в бескислородном процессе утилизации 2,4,6-тринитротолуола бактериями Rhodococcus erythropolis была ранее экспериментально показана [9].
Стадия образования нитрита из нитрата может осуществляться как в присутствии неорганического донора электронов, например сульфида, который присутствует в нефтяных загрязнениях:
(2)
${\text{NO}}_{3}^{ - } + 0.25{\text{H}}{{{\text{S}}}^{ - }} \to {\text{NO}}_{2}^{ - } + 0.25{\text{SO}}_{4}^{{2 - }} + 0.25{{{\text{H}}}^{ + }},$так и органического донора электронов, например органических загрязнений, которые присутствуют в газогенерирующих грунтах [10]:
(3)
$\begin{gathered} {\text{NO}}_{3}^{ - } + 0.25{\text{C}}{{{\text{H}}}_{3}}{\text{CO}}{{{\text{O}}}^{ - }} \to {\text{NO}}_{2}^{ - } + \\ + \,\,0.5{\text{HCO}}_{3}^{ - } + 0.25{{{\text{H}}}^{ + }}. \\ \end{gathered} $В настоящей работе исследовалось влияние различных доз акцептора электронов в виде нитратсодержащей соли на скорость деградации УВ бактериями рода Rhodococcus. Биологическая газогенерация относится к типу процессов, скорость которых падает по мере снижения концентрации субстрата – УВ, и описывается кинетическим уравнением первого порядка [11, 12]. Поэтому для описания кинетики разложения УВ использовали уравнения, описывающие необратимую одностадийную реакцию первого порядка:
(5)
$k = {{{\text{ln}}\left( {{C \mathord{\left/ {\vphantom {C {{{C}_{0}}}}} \right. \kern-0em} {{{C}_{0}}}}} \right)} \mathord{\left/ {\vphantom {{{\text{ln}}\left( {{C \mathord{\left/ {\vphantom {C {{{C}_{0}}}}} \right. \kern-0em} {{{C}_{0}}}}} \right)} t}} \right. \kern-0em} t},$где С0 – начальная концентрация ОВ, г/кг (по сухому весу (с.в)); С – текущая (конечная) концентрация ОВ, г/кг (с.в); t – время разложения ОВ, сут; k – скорость реакции, сут–1.
Поскольку процесс деградации УВ описывается кинетическим уравнением первого порядка (уравнения (4) и (5)), период полураспада (в сутках) определяется согласно уравнению [13]
(6)
${{t}_{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}} = {{{\text{ln}}2} \mathord{\left/ {\vphantom {{{\text{ln}}2} k}} \right. \kern-0em} k} = {{0.693} \mathord{\left/ {\vphantom {{0.693} k}} \right. \kern-0em} k},$где k – константа скорости распада УВ, сут–1.
Для оценки скорости газогенерации, протекающей в условиях естественного залегания (8–10 °С) газогенерирующих грунтов (ГГ), использовали температурную поправку в соответствии с правилом Вант-Гоффа [14], согласно которой при повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два-четыре раза согласно уравнению
(7)
${{q}_{2}} = {{q}_{1}}{{y}^{{{{\Delta t} \mathord{\left/ {\vphantom {{\Delta t} {10}}} \right. \kern-0em} {10}}}}},$где q2 – скорость газогенерации, установленная в процессе моделирования при t = 30 °С; q1 – скорость газогенерации, протекающей в условиях массива ГГ на площадке проектируемого строительства при t = 8–10 °С; y – температурный эмпирический коэффициент скорости, характеризующий ускорение реакции при подъеме t на 10 °С, равный двум. Следовательно, интенсивность газообразования при деградации УВ в грунтах в естественных условиях будет практически в 4 раза (yΔt/10 = 22) ниже, чем в модельных экспериментах при температуре 28 °С.
В настоящей работе исследовалось влияние концентрации кислородного акцептора в виде нитратсодержащей соли на скорость и механизм деградации углеводородов в реальных образцах грунтов, извлеченных из скважин насыпных грунтов с территорий под будущую застройку, под действием штаммов бактерий, относящихся к роду Rhodococcus.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты и материалы исследования
Объектами исследования были 10 проб ГГ, отобранных в процессе бурения трех скважин, расположенных на участке под строительство. Вскрытый скважинами массив грунта был представлен песчано-глинистыми отложениями, цвет которых менялся от серо-черного во влажном состоянии до коричневатого и оранжевого – в сухом. Во всех пробах грунта ощущался стойкий запах нефтепродуктов.
Для проведения моделирования процесса анаэробной деградации УВ использовали биопрепарат-нефтедеструктор “Родер”, состоящий из двух штаммов бактерий, относящихся к роду Rhodococcus (R. ruber Ac-1513Д и R. erythropolis Ac-1514Д) и выделенных из почв, загрязненных нефтью [15]. Согласно инструкции биопрепарат активно работает в диапазоне рН 5.8–7.8, при этом температурный диапазон действия в почве или воде составляет 8–32 °С.
В исследовании в качестве акцептора электронов применяли нитрат кальция (Химмед, Россия), что позволило не только осуществлять анаэробную деградацию УВ аэробными бактериями рода Rhodococcus, но и способствовало раскислению и обессоливанию почв. В то же время нитрат кальция является биогенным ресурсом для микроорганизмов [4].
Методы исследования
Анализ проб ГГ. Влажность определяли стандартным гравиметрическим методом [16]. Значение рН проб ГГ определяли агрохимическим методом [17]. Содержание органического вещества (ОВ) в пробах определяли, выдерживая сухую навеску в муфельной печи при температуре 600 °С до постоянного веса [18]. Для определения содержания минеральных веществ из массы сухой навески вычитали массу ОВ. В пробах количественно определяли концентрацию нитратной формы азота (акцептора электронов) с хромотроповой кислотой спектрофотометрическим методом при длине волны 410 нм [19], используя спектрофотометр Shimadzu UV-1202 (Япония), и далее пересчитывали на массовую концентрацию Ca(NO3)2.
Микробиологический анализ. Общую численность микроорганизмов в биопрепарате “Родер” находили методом предельных десятикратных разведений, используя тест-пластины Petrifilm 6406 (компания 3М, США) для определения количества аэробных микроорганизмов [17].
Базовая анаэробная ферментация ГГ, загрязненных УВ нефти
Для оценки скорости деградации УВ нефти в толще грунта на глубине от 1 до 5 м и расчета времени полураспада УВ в условиях естественного залегания был проведен эксперимент по базовой анаэробной ферментации ГГ, загрязненных УВ, при 28 °C. Описание подобных экспериментов приведено в работе [20]. Отличия от приведенной методики состояли в том, что в анаэробные реакторы вносили обводненные (50 мл проточной воды) пробы сырых грунтов массой 50 г и плотностью 2.06 г/мл.
Анализ содержания накопленных газов в реакторе проводили с использованием метода газовой хроматографии (ЛХМ 8 МД – модель 3 с катарометром), подробно описанного в работе [21].
Объем газов (Q, мл), образующихся в реакторе с исследуемыми образцами ГГ, рассчитывали по формуле
(8)
$Q = \left\{ {\left( {{С \mathord{\left/ {\vphantom {С {100}}} \right. \kern-0em} {100}}{{Р}_{{{\text{общ}}}}}{{T}_{0}}{{V}_{{{\text{г}}{\text{.ф}}}}}} \right)/\left( {{{Т}_{1}}{{Р}_{0}}} \right)} \right\}{\text{ }}\cdot{\text{ }}1000,$где С – содержание газов в газовой фазе, %; Vг.ф – объем газовой фазы в реакторе, л; Т0 – температура при нормальных условиях (273 К); Т1 – рабочая температура в реакторе, К; Р0 – давление при нормальных условиях (1 атм); Робщ – общее давление в реакторе, атм.
Массу газов (М, г), образующихся в реакторе с исследуемыми образцами ГГ, рассчитывали по формуле
(9)
$М = \left( {{Q \mathord{\left/ {\vphantom {Q {{{V}_{m}}}}} \right. \kern-0em} {{{V}_{m}}}}} \right){{M}_{r}},$где Q – объем газов, л; Vm – объем 1 моля газа при нормальных условиях (22.4 л/моль); Mr – молекулярный вес газа, г/моль. Массу биогаза находили суммированием масс всех выделившихся газов (водорода, метана и углекислого газа).
Анаэробная ферментация ГГ с помощью аэробных углеводородокисляющих микроорганизмов
В связи с тем, что основным субстратом метаногенерации были нефтепродукты, содержание которых варьировалось от 8 до 9%, грунты с трех точек по глубине отбора (от 1 до 5 м) обрабатывали водным раствором углеводородокисляющих клеток препарата “Родер” (109 КОЕ/мл) в соотношении 1 : 1 в анаэробных реакторах периодического действия. Моделирование процесса биологической анаэробной ферментации проб ГГ приведено выше. Исследовали влияние акцептора электронов Ca(NO3)2 на скорость деградации и время полураспада УВ в трех различных концентрациях нитрата кальция: 1.25, 2.5 и 5.0%. В качестве источника аммонийного азота в каждый из трех биореакторов вносили 0.3% NH4NO3. Газовое пространство реакторов замещали аргоном для создания анаэробных условий. Процесс деструкции УВ проводили в двух повторностях при термостатировании реакторов с образцами проб грунтов при 28 °C в течение 9–10 сут.
Исследования проводили при измерении давления и состава газовой продукции в динамике. Также контролировали динамику исчерпания акцептора электронов – нитратов. Все измерения проводили, как описано выше, в базовом эксперименте.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеристика состава ГГ
Анализ состава загрязнения грунтов на примере трех скважин показал, что все 10 проб содержат УВ в концентрации от 2.3 до 9.8% по сухому весу грунта (с.в.г), а также от 3.3 до 4.8% ОВ. Влажность проб грунтов варьирует в диапазоне от 11 до 16%. Значения рН проб грунтов оптимальны для бактерий и аборигенных микроорганизмов и находятся в диапазоне значений от нейтральных до слабощелочных. Для моделирования процесса газообразования в анаэробных условиях была отобрана усредненная проба, состоящая из проб, извлеченных из всех трех скважин с разных глубин с максимальными значениями УВ. Следует также отметить, что в соответствии с ГОСТ 25100–2011 содержание органических загрязнений в грунтах под жилищное строительство не должно превышать значения в 0.03 кг/кг с.в.г (3%), при котором они переходят в состояние инертных минеральных отложений (табл. 1).
Таблица 1.
Исходные характеристики ГГ
| № скважины | Глубина отбора проб, м |
рН | Влажность, % | УВ, г/кг с.в.г |
ОВ, г/кг с.в.г |
|---|---|---|---|---|---|
| № 1 | 1.00–1.90 | 8.99 ± 0.12 | 14.8 ± 0.1 | 79 ± 8 | 39 ± 3 |
| 3.80–4.00 | 8.18 ± 0.22 | 15.3 ± 0.2 | 24 ± 1 | 34 ± 1 | |
| 5.80–6.00 | 7.91 ± 0.06 | 13.2 ± 0.1 | 30 ± 2 | 32 ± 1 | |
| № 2 | 2.00–3.00 | 7.30 ± 0.13 | 15.7 ± 0.2 | 91 ± 5 | 45 ± 3 |
| 3.90–4.00 | 7.35 ± 0.08 | 11.4 ± 0.1 | 25 ± 6 | 32 ± 1 | |
| 5.90–6.00 | 7.54 ± 0.07 | 13.0 ± 0.1 | 24 ± 3 | 33 ± 2 | |
| № 3 | 4.00–5.00 | 7.63 ± 0.01 | 15.7 ± 0.1 | 98 ± 5 | 48 ± 4 |
| 5.00–5.60 | 7.72 ± 0.05 | 13.4 ± 0.1 | 70 ± 6 | 40 ± 4 | |
| 7.00–8.00 | 7.79 ± 0.03 | 13.6 ± 1.0 | 23 ± 6 | 33 ± 3 | |
| 8.00–9.00 | 8.14 ± 0.11 | 16.4 ± 0.1 | 24 ± 2 | 34 ± 1 |
Базовая анаэробная ферментация ГГ
С целью получения данных, характеризующих стабильную фазу течения процесса газогенерации, а также для оценки скорости деградации УВ и расчета времени полураспада УВ в условиях естественного залегания грунтов испытания проводили в течение 21 сут. Лабораторное моделирование базового процесса анаэробной ферментации трех образцов ГГ в присутствии аборигенной микрофлоры показало, что во всех трех биореакторах в отсутствие кислородного акцептора в процессе эксперимента наблюдалась слабая газогенерация (табл. 2). За 21 сут анаэробной ферментации средняя эффективность деградации УВ в трех биореакторах составила не более 0.27%. Состав биогаза менялся с изменением глубины отбора проб – увеличивалось выделение метана (табл. 2). Очевидно, на глубине 4–5 м концентрация аборигенных анаэробных микроорганизмов выше по сравнению с приповерхностным слоем на глубине 1.0–1.9 м. Как видно из представленных данных эксперимента (табл. 2), скорость деградации (k) и время полураспада УВ (t1/2) составили в среднем 0.05 год–1 и 14.8 года соответственно.
Таблица 2.
Образование биогаза и расчет кинетических параметров процесса деградации УВ при моделировании базового процесса анаэробной ферментации (28 °С)
| № биореактора | Глубина отбора проб, м |
УВ, г/кг с.в.г |
Образование биогаза на 21 сут, мл | k, год-1 | t1/2, год | ||
|---|---|---|---|---|---|---|---|
| Н2 | СН4 | СО2 | |||||
| 1 | 1.00–1.90 | 79 ± 8 | 0.2 ± 0.0 | 0.3 ± 0.1 | 4.1 ± 0.2 | 0.053 | 14.1 |
| 2 | 2.00–3.00 | 91 ± 5 | 0.2 ± 0.0 | 1.0 ± 0.1 | 4.3 ± 0.1 | 0.049 | 14.9 |
| 3 | 4.00–5.00 | 98 ± 4 | 0.2 ± 0.0 | 2.3 ± 0.1 | 3.9 ± 0.2 | 0.047 | 15.4 |
В результате было установлено, что распад УВ в грунте в условиях естественного залегания (~8–10 °С) с учетом температурной поправки будет протекать в 4 раза медленнее: со средней константой скорости реакции k = 0.0125 год–1 (табл. 3). Основная фаза газогенерации (образование биогаза) завершится в течение 59 лет. При этом объемное содержание метана в газовой продукции будет составлять от 8 до 36% в зависимости от глубины – чем глубже, тем выше концентрация метана в биогазе (табл. 3), что, вероятно, обусловлено распределением аборигенных групп микроорганизмов по высоте скважины. Очевидно, что на глубине скважины 5 м превалируют метаногенные аборигены. Полученные результаты свидетельствуют о том, что строительство домов и сооружений на исследуемой территории без проведения очистных мероприятий по деградации УВ недопустимо.
Таблица 3.
Состав биогаза и расчет кинетических параметров процесса деградации УВ в условиях естественного залегания при 8–10 °С (базовый процесс анаэробной ферментации)
| № биореактора | Глубина отбора проб, м |
УВ, г/кг с.в.г | Состав биогаза на 21 сут, % | k, год-1 | t1/2, год | ||
|---|---|---|---|---|---|---|---|
| Н2 | СН4 | СО2 | |||||
| 1 | 1.00–1.90 | 79 ± 8 | 3.5 ± 1.1 | 6.7 ± 2.3 | 89.8 ± 3.4 | 0.0132 | 56.3 |
| 2 | 2.00–3.00 | 91 ± 5 | 2.9 ± 0.8 | 18.0 ± 1.1 | 79.0 ± 1.9 | 0.0122 | 59.6 |
| 3 | 4.00–5.00 | 98 ± 4 | 2.5 ± 0.7 | 35.8 ± 0.2 | 61.7 ± 0.5 | 0.0118 | 61.4 |
Анаэробная ферментация ГГ с помощью аэробных углеводородокисляющих микроорганизмов
В связи с тем, что в анаэробных процессах акцептором является окисленное соединение типа нитрата, были проведены химические исследования по влиянию нитрата кальция на процесс деградации УВ нефтеокисляющими бактериями в неспецифических для них бескислородных условиях.
Процесс химического обезвреживания заключался в обработке образцов объединенного грунта, взятого с глубин от 1 до 5 м, биопрепаратом-нефтедеструктором “Родер” в присутствии акцептора электронов в трех различных концентрациях: 1.25, 2.5 и 5.0%. Было предположено, что механизм деградации УВ в присутствии кислородного акцептора осуществляется через процесс денитрификации. Этот процесс восстановления нитрата в грунтах с содержанием от 1.0 до 2.8% ОВ протекает постадийно (уравнение (8)), и “свидетелями” процессов денитрификации и денитритации являются газообразные оксиды и молекулярный азот:
(8)
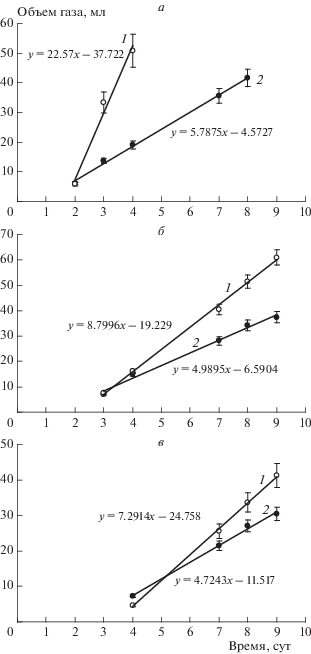
${\text{NO}}_{3}^{ - } \to {\text{NO}}_{2}^{ - } \to {\text{NО}} \to {{{\text{N}}}_{{\text{2}}}}{\text{О}} \to {{{\text{N}}}_{2}}.$Результаты, представленные на рис. 1, показывают накопление в газовой фазе закиси и свободного азота, а также влияние концентрации акцептора на скорость процесса денитрификации. При концентрациях Ca(NO3)2 в среде 1.25, 2.5 и 5.0% наблюдали лаг-периоды продолжительностью в 1, 2 и 3 сут, соответственно, вызванные адаптацией местных денитрификаторов к субстрату (рис. 1). Максимальная по продолжительности фаза адаптации (3 сут) наблюдалась в биореакторе с концентрацией акцептора, равной 5.0%. Вероятно, высокая концентрация нитрата кальция способна частично ингибировать или замедлять скорость денитрификации (рис. 1в). В то же время более низкая концентрация акцептора в среде, равная 1.25%, позволила через сутки наблюдать не только высокую скорость конверсии нитрата в закись азота, а также конверсию последнего в молекулярный азот, но и деградацию УВ, оцененную по накоплению углекислого газа – продукта действия углеводородокисляющих микроорганизмов (рис. 1а). В результате анаэробной конверсии нитрата кальция и УВ по прямолинейному экспоненциальному участку кривой были рассчитаны скорости процессов денитрификации и деградации УВ в миллилитрах образуемых газов – закиси азота и углекислого газа – “свидетелей” протекающих процессов (рис. 2). Полученные кинетические уравнения первого порядка (рис. 2) описывают максимальную скорость денитрификации с применением акцептора электронов в концентрации 1.25%. По мере увеличения концентрации акцептора скорость денитрификации резко падает в 2.6 и 3.1 раза (см. рис. 2б и 2в соответственно), что свидетельствует об ингибировании процесса нитратом кальция. Однако при этом не наблюдали высокого ингибирующего эффекта на основной процесс деградации УВ. Скорость деградации УВ была обратно пропорциональна вносимой концентрации кислородного акцептора. Максимальную скорость деградации УВ наблюдали в биореакторе с минимальной концентрацией нитрата кальция, равной 1.25%. По мере роста концентрации акцептора скорость деградации УВ снижалась незначительно (рис. 2).
Рис. 1.
Влияние концентрации акцептора Ca(NO3)2 (а – 1.25%, б – 2.5%, в – 5.0%) на образование газов N2O (1), CO2 (2), N2 (3), CH4 (4) в процессе анаэробной деградации УВ углеводородокисляющими микроорганизмами.
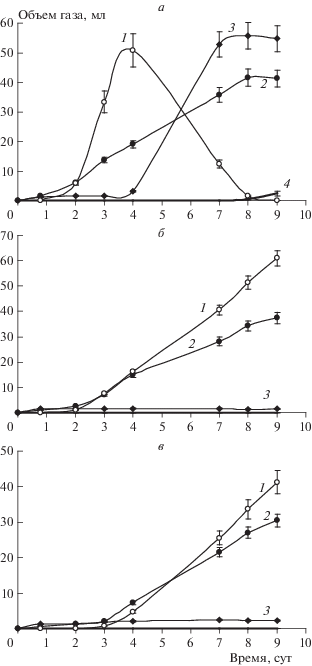
Рис. 2.
Влияние концентрации акцептора Ca(NO3)2 (а – 1.25%, б – 2.5%, в – 5.0%) на скорость накопления N2O – “свидетеля” денитрификации (1) и CO2 – “свидетеля” деградации УВ (2).
Следует также отметить, что по мере израсходования акцепторов электронов в виде нитратов, нитритов и закиси азота возможно развитие конкурирующих процессов, таких как метаногенез. Так, на девятые сутки эксперимента в первом биореакторе (1.25% Ca(NO3)2) наблюдали появление в газовой фазе метана (рис. 1а) и сульфатредукцию – визуальное почернение жидкой среды реактора, вызванное жизнедеятельностью сульфатредуцирующих бактерий. Активизация аборигенной анаэробной микрофлоры стала возможна в связи с появлением более специфических субстратов – продуктов полураспада УВ, например жирных кислот и т.п. В биореакторах с концентрацией Ca(NO3)2 2.5 и 5.0% подобных эффектов не наблюдалось в связи с более низкой скоростью образования закиси азота, по сравнению с концентрацией Ca(NO3) в биореакторе, равной 1.25%. Вероятно, не были израсходованы все акцепторы электронов, что подтверждается отсутствием конверсии закиси азота в молекулярный азот (рис. 1б и 1в).
Как видно из представленных данных (рис. 3), после адаптации микробного сообщества и при достаточной концентрации акцептора электронов время полураспада УВ (t1/2) составило в среднем 0.69 года. Согласно данным, представленным на рис. 3 и в табл. 4, скорость деградации УВ максимальна при концентрации акцептора электронов 1.25%. Анаэробная деградация УВ в грунте в присутствии оптимальной дозы Ca(NO3)2, равной 1.25%, в теплое и холодное время года с учетом температурной поправки будет протекать с максимальной скоростью реакции k = 1.27 и 0.32 год–1 соответственно (табл. 4). Объемное содержание основного непожароопасного углекислого газа в газовой продукции будет составлять 99%. Таким образом, полное разложение УВ и фаза газогенерации завершатся в течение 1 года, что в 59 раз быстрее по сравнению с процессами, протекающими в отсутствие кислородного акцептора.
Рис. 3.
Влияние концентрации акцептора Ca(NO3)2 (1 – 1.25%, 2 – 2.5%, 3 – 5.0%) на время полураспада УВ в процессе анаэробной деградации.
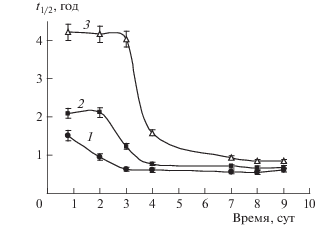
Таблица 4.
Рассчитанные значения константы скорости анаэробного разложения УВ в экспериментальных условиях (~28 °С) и в условиях естественного залегания (~8–10 °С) в процессе анаэробной ферментации в присутствии акцептора электронов
| Концентрация Ca(NO3)2, % | k, год–1 | t1/2, год | ||
|---|---|---|---|---|
| т.в.г | х.в.г | т.в.г | х.в.г | |
| 1.25 | 1.27 | 0.32 | 0.54 | 2.16 |
| 2.5 | 1.01 | 0.25 | 0.69 | 2.76 |
| 5.0 | 0.82 | 0.21 | 0.84 | 3.36 |
Полученные результаты позволят понять процесс деградации углеводородов нефтеокисляющими аэробными бактериями в неспецифических для них анаэробных условиях.
ВЫВОДЫ
1. Установлено, что грунты, извлеченные из скважин с территорий под будущую жилищную застройку, содержат до 9.8% УВ и способны в анаэробных условиях в отсутствие кислородного акцептора в течение 59 лет продуцировать биогаз с содержанием метана в газовой продукции от 8 до 36%. Жилищная застройка на подобной территории без проведения очистных мероприятий недопустима.
2. Обнаружена обратно пропорциональная зависимость концентраций нитрата кальция (1.25, 2.5 и 5.0%) от скорости процессов денитрификации и анаэробной деградации УВ. Это связано с ингибированием процесса денитрификации высокими концентрациями Ca(NO3)2.
3. Установлено, что в присутствии оптимальной дозы Ca(NO3)2, равной 1.25%, анаэробная деградация УВ в грунте в теплое и холодное время года, будет протекать с максимальной скоростью реакции k = 1.27 и 0.32 год–1 соответственно. Полное разложение УВ и фаза газогенерации завершатся в течение 1 года, что в 59 раз быстрее по сравнению с процессами, протекающими в отсутствие кислородного акцептора.
Список литературы
Masy T., Demaneche S., Tromme O. et al. // Soil Biol. and Biochem. 2016. V. 99. P. 66; https://doi.org/10.1016/j.soilbio.2016.04.016
Хенце М. Очистка сточных вод. Пер. с англ. / Под ред. Калюжного С.В. М.: Мир, 2004.
Gupta P., Sreekrishnan T.R., Shaikh Z.A. // J. Environ. Chem. Eng. 2018. V. 6. P. 2643; https://doi.org/10.1016/j.jece.2018.04.010
Murygina V.P., Gaydamaka S.N., Gladchenko M.A. et al. // Intern. Biodeterior. Biodegrad. 2016. V. 114 P. 150; https://doi.org/10.1016/j.ibiod.2016.06.009
Grishchenkov V.G., Townsend R.T., McDonald T.J. et al. // Process Biochem. 2000. V. 35. P. 889.
LaRivere D.J., Autenrieth R.L., Bonner J.S. // Water Res. 2003. V. 37. P. 3307.
LaRivere D.J., Benjamin H.C., Autenrieth R.L. et al. // Proc. 6th Intern. in Situ and On-site Bioremediation Sympos. Paris: Cazaubon, 2001. P. 25; https://doi.org/10.3917/lcp.061.0025
Tolpeshta I.I., Trofimov S.Ya, Erkenova M.I. et al. // Euras. Soil Sci. 2015. V. 48. № 3. P. 314.
Serrano-Gonzalez M.Y., Chandra R., Castillo-Zacarias C. et al. // Defence Technol. 2018. V. 14. P. 151; https://doi.org/10.1016/j.dt.2018.01.004
Трухина А.И., Гладченко М.А., Калюжный С.В. // Биотехнология. 2010. № 5. С. 68.
Christensen T., Cossu R., Stegmann R. Sanitary Landfilling: Process, Technology and Environmental Impact. Hamburg: Academic Press, 1989.
Бокштейн Б.С., Менделев М.И. Краткий курс физической химии. Уч. пособие. Изд. 2-е, исправл. М.: “ЧеРо”, 2001.
Лапова Т.В., Курзина И.А., Лямина Г.В., Вайтулевич Е.А. Физическая химия. Химическая кинетика и равновесие. Электрохимия. Уч. пособие. Томск: Изд-во Томск. гос. архит.-строит. ун-та, 2009. С. 104.
Акинфиев Н.Н., Епифанова С.С. Исследования в учебном практикуме по химии (термодинамика) Уч.-практич. пособие. М.: РГГРУ, 2008.
Албулов А.И., Самуйленко А.Я., М.А. Фролова и др. // Изв. Самарского науч. центра РАН. 2013. Т. 15. № 3. С. 1545.
Воробьева Л.А. Химический анализ почв. М.: Изд. МГУ, 1998.
Гладченко М.А., Гайдамака С.Н., Мурыгина В.П. и др. // Хим. физика. 2015. Т. 34. № 6. С. 30.
Гладченко М.А., Рогозин А.Д., Черенков П.Г. и др. // Хим. физика. 2016. Т. 35. № 6. С. 78.
Trukhina A.I., Gladchenko M.A., Kalyuzhnyi S.V. // Appl. Biochem. and Microbiol. 2011. V. 47. № 9. P. 841.
Гладченко М.А., Гайдамака С.Н., Мурыгина В.П. и др. // Хим. физика. 2017. Т. 36. № 7. С. 25.
Гладченко М.А., Ковалев Д.А., Ковалев А.А. и др. // Прикл. биохимия и микробиол. 2017. Т. 53. № 2. С. 225.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


