Химическая физика, 2020, T. 39, № 2, стр. 30-36
Кинетика образования газообразных продуктов при γ-радиолизе смесей, моделирующих жидкие радиоактивные отходы
У. А. Кулиева 1, *, М. А. Курбанов 1
1 Институт радиационных проблем Национальной академии наук Азербайджана
Баку, Азербайджанская Республика
* E-mail: ulviyegulieva13@gmail.com
Поступила в редакцию 29.11.2018
После доработки 18.03.2019
Принята к публикации 20.03.2019
Аннотация
Исследована кинетика образования газообразных продуктов, изменение показателей кислотности (рН) и химического потребления кислорода (ХПК) при γ-радиолизе водных растворов смесей муравьиной, щавелевой и азотной кислоты – как модельной системы для изучения радиолитических превращений кислотных компонентов жидких радиоактивных отходов. Установлено, что с ростом поглощенной дозы гамма-излучения кислотность и величина ХПК снижаются из-за уменьшения концентрации органических кислот в смеси. В качестве газообразных продуктов идентифицированы CO2 и H2, концентрации которых увеличиваются нелинейно с увеличением поглощенной дозы. Рассчитаны радиационно-химические выходы H2 и CO2. На основе экспериментальных и литературных данных о составе жидких продуктов радиолиза водных растворов исследованных кислот проведен расчет кинетики образования газообразных продуктов с помощью программы KINET (версия 1.2.5).
ВВЕДЕНИЕ
Водные растворы низкомолекулярных органических и неорганических кислот составляют основу жидких радиоактивных отходов (ЖРО) и отходов некоторых химических производств. Исследование радиационно-химических процессов, протекающих под действием излучения радионуклидов в ЖРО и при радиационно-химической очистке сточных вод различного происхождения, представляет интерес для оценки безопасности работы с ЖРО и оптимизации параметров радиационно-химической очистки. В процессе ядерно-энергетического цикла образуются различные типы жидких радиоактивных отходов [1]. В состав ЖРО входят более 200 различных продуктов радиоактивного распада [2]. Например, согласно данным из [3], для среднеактивных отходов наиболее значимыми источниками излучения являются изотопы 90Sr, 137Cs, 106Ru и 239Pu с содержанием 1 ∙ 10–2, 9 ∙ 10–2, 8 ∙ 10–2 и 3 ∙ 10–7 Ки/л соответственно. Несмотря на то, что в составе ЖРО имеются изотопы, которые излучают α- и β-частицы, основной вклад в радиационно-химические процессы в ЖРО вносит γ-излучение. В данной работе проводили экспериментальное изучение и кинетическое моделирование образования газообразных продуктов радиолиза смесей, моделирующих ЖРО, на основе муравьиной, щавелевой и азотной кислот в водных растворах под действием γ-излучения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использованы водные растворы муравьиной, щавелевой и азотной кислот с концентрациями 5 ∙ 10–3 M, 4.75 ∙ 10–3 M, 0.25 ∙ 10–3 M–2.5 ∙ 10–3 M. Использованы: азотная кислота с чистотой 69% (“ВДН Prolabo”, France), муравьиная кислота с чистотой 98–100% (Шосткинский завод химреактивов, Украина), щавелевая кислота с чистотой 99% (Pharmacon Biomedicinal, Китай). Состав смесей и концентрации кислот выбраны произвольно, как представляющие только часть компонентов ЖРО.
Аэрированные водные растворы указанных смесей подвергали воздействию γ-излучения от изотопа 60Со в стеклянных ампулах, при комнатной температуре, в статических условиях. Мощность поглощения дозы, определенная методом ферросульфатной дозиметрии, составляла 0.16 Гр/с. Химическое потребление кислорода (ХПК) определяли по стандартной методике титриметрическим методом [4]. Концентрацию газообразных продуктов радиолиза измеряли: в случае водорода – на хроматографе Газохром-3101 (колонка – активированный уголь АГ-3, газ-носитель – воздух), а углекислого газа – на хроматографе Agilent 7890A (США); значения pH растворов кислот и их смесей измеряли на приборе PHS-25 (Wincon Co., Китай). Расчет кинетических параметров соответствующих процессов проводили по программе KINET (версия 1.2.5).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В данной работе экспериментально изучены общие показатели процесса радиолиза – кислотность (рН), характеризующую общее содержание органических и неорганических кислот и химическое потребление кислорода (ХПК), характеризующее концентрации только органических кислот.
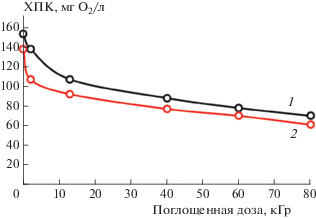
На рис. 1 представлены кинетические кривые показателя изменения ХПК в зависимости от поглощенной дозы при облучении водных растворов смесей кислот для разных концентраций азотной кислоты. Как видно из рис. 1, показатель ХПК убывает с ростом поглощенной дозы, причем при более высокой относительной концентрации азотной кислоты (кривая 2) это убывание становится меньше, т.е. присутствие азотной кислоты в растворах приводит к снижению скорости превращения органических кислот.
Рис. 1.
Кинетика изменения показателя ХПК смеси НСООН (5 ∙ 10–3 M) + НООС-СООН (4.75 ∙ 10–3 M) + + HNO3 (0.25 ∙ 10–3 M) (1) и смеси НСООН (5 ∙ 10–3 M) + + НООС-СООН (2.5 ∙ 10–3 M) + HNO3 (2.5 ∙ 10–3 M) (2) в зависимости от поглощенной дозы; мощность дозы J = 0.16 Гр/с.
Молекулы кислот имеют высокую реакционную способность по отношению к гидратированным электронам, первичным частицам радиолиза воды. Кроме того, в исследованных системах присутствует адсорбированный кислород, концентрация которого составляет ~2.7 ∙ 10–4 М, что меньше концентрации кислот в смеси НСООН, (СООН)2 и HNO3. Константы скорости реакции гидратированного электрона с кислородом и молекулами кислот равны 2 ∙ 1010, 1.4 ∙ 108, 2.5 ∙ 1010 и 9.7 ∙ 1010 л/моль ∙ с для молекул О2, НСООН, (СООН)2 и HNO3 соответственно. Оценка соотношений скоростей реакций в условиях эксперимента указывает на преобладание скорости захвата электронов молекулами HNO3:
Атомы водорода обладают относительно низкими константами скорости реакции с молекулами кислот НСООН, (СООН)2 и HNO3, которые равны соответственно 4.4 ∙ 105, 1.6 ∙ 104, 4.4 ∙ 106 л/моль ∙ с, поэтому они в условиях экспериментов в основном захватываются молекулами кислорода (k = 2 ∙ ∙ 1010 л/моль ∙ с). ОН-радикалы реагируют с молекулами муравьиной кислоты (k = 1.4 ∙ 108 л/моль ∙ с) и относительно слабо реагируют с молекулами других кислот (СООН)2 и HNO3 (k ~ 106–107 л/моль ∙ с). Оценка соотношений скоростей соответствующих реакций в условиях экспериментов приведена ниже:
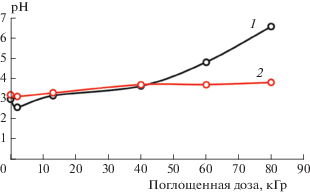
Эти оценки показывают, что уменьшение скорости превращения органических кислот в присутствии молекул HNO3 в основном связано акцептированием гидратированных электронов молекулами HNO3. На рис. 2 представлены кинетические кривые зависимости показателя рН от поглощенной дозы в процессе радиолиза водных растворов смесей органических кислот HCOOH и (COOH)2 в присутствии азотной кислоты двух разных концентраций. Как видно из рис. 2, рН растворов растет с увеличением поглощенной дозы. С ростом концентрации азотной кислоты от 0.25 ∙ 10–3 до 2.5 ∙ 10–3 M наблюдается слабое уменьшение показателя рН, что указывает на уменьшение скорости превращения органических кислот в присутствии HNO3. При малых дозах поглощенного излучения (на начальном участке) наблюдается небольшое падение величины рН, которое связано с расходованием кислорода. При этих дозах облученный раствор становится более деаэрированным при радиолизе водных растворов щавелевой кислоты, как указано в работе [5].
Рис. 2.
Кинетика изменения показателя кислотности pH водных растворов смеси НСООН (5 ∙ 10–3 M) + + НООС-СООН (4.75 ∙ 10–3 M) + HNO3 (0.25 ∙ 10–3 M) (1) и смеси НСООН (5 ∙ 10–3 M) + НООС–СООН (2.5 ∙ 10–3 M) + HNO3 (2.5 ∙ 10–3 M) (2) в зависимости от поглощенной дозы; мощность дозы J = 0.16 Гр/с.
Радиолизу водных растворов муравьиной, щавелевой и азотной кислот посвящен ряд работ [6–10]. Установлено, что конечными газообразными продуктами радиолиза водных растворов вышеуказанных органических кислот являются Н2 и СО2. В качестве жидких продуктов были идентифицированы кислоты и альдегиды. Предполагалось также образование глиоксиловой (GA), гидрокситартроновой (HA) и дигидроксивинной (DA) кислот.
Радиолиз водных растворов смесей кислот HCOOH и (COOH)2 изучен нами ранее в работах [11–13], в которых экспериментально определены и рассчитаны по кинетической модели процессы образования Н2, СО2 и кислотность раствора при разных поглощенных дозах. На основе экспериментальных и литературных данных о процессах радиолитических превращений исследованных кислот был проведен расчет кинетики образования газообразных продуктов по программе KINET (версия 1.2.5.).
Стадии кинетической схемы радиолиза воды в присутствии исследуемых кислот включают:
• элементарные реакции радиолиза воды; при рН в диапазоне 1–4 pадиационно-химические выходы продуктов радиолиза воды составляют (молекула/100 эВ): Н+ (3.45), ОН– (0.4), $e_{{aq}}^{ - }$ (3.05), H (0.6), H2 (0.425), OH (2.9), H2O2 (0.8) соответственно [14, 15];
• скорость генерации Ki (Н2О) = GJ ∙ 10–2, где G – радиационно-химические выходы соответствующих частиц, J – мощность поглощенной дозы, Ki – эффективная константа скорости образования i-й частицы;
• использованы имеющиеся в литературе элементарные реакции при радиолизе водных растворов кислот, включающие реакции рекомбинации образующихся радикалов и их реакции с молекулами компонентов смеси;
• рассмотрены процессы электролитической диссоциации щавелевой, муравьиной и азотной кислот с константами диссоциации: KI = 5.4 ∙ 10–2, KII = 5.4 ∙ 10–5 для щавелевой, K = 1.8 ∙ 10–4 для муравьиной, K = 5.1 ∙ 10–4 для азотной кислоты [16].
Реакции, использованные для составления кинетической модели радиолиза исследуемых водных растворов, приведены в табл. 1 [6–10, 17].
Таблица 1.
Формально-кинетическая схема радиолитического разложения смесей кислот НСООН + НООС–СООН + HNO3 в водном растворе [6–10]
| Реакции* | K, л/моль ∙ с |
|---|---|
| H3O+ + e = H2O + H | 2.3 · 10 |
| H + OH = H2O | 7 · 109 |
| OH + H2 = H + H2O | 3.74 · 107 |
| OH + OH = H2O2 | 5.3 · 109 |
| OH + HO2 = O2 + H2O | 7.1 · 109 |
| OH + H2O2 = HO2 + H2O | 4.06 · 107 |
| OH + ${\text{HO}}_{2}^{--}$ = HO2 + OH– | 5 · 109 |
| OH + ${\text{O}}_{2}^{--}$ = O2 + OH– | 9.96 · 109 |
| OH + e = OH– | 3 · 1010 |
| H + O2 = HO2 | 2 · 1010 |
| H + ${\text{O}}_{2}^{--}$ = ${\text{HO}}_{2}^{--}$ | 2 · 1010 |
| H + HO2 = H2O2 | 2 · 1010 |
| H + H = H2 | 7.7 · 109 |
| H + H2O2 = OH + H2O | 3.44 · 107 |
| e + O2 = ${\text{O}}_{2}^{--}$ | 1.94 · 1010 |
| e + ${\text{O}}_{2}^{--}$ = ${\text{HO}}_{2}^{--}$ + OН– | 1.3 · 1010 |
| e + HO2 = ${\text{HO}}_{2}^{--}$ | 2 · 1010 |
| e + H = H2 + OН– | 2.5 · 1010 |
| e + H2O2 = OH + OН– | 1.14 · 1010 |
| e + e = H2 + OН–+ OН– | 5.6 · 109 |
| HO2 + ${\text{O}}_{2}^{--}$ = O2 + ${\text{HO}}_{2}^{--}$ | 9.5 · 107 |
| HO2 + HO2 = O2 + H2O2 | 8.1 · 105 |
| HO2 + H2O2 = O2 + OH + H2O | 3.7 ∙ 100 |
| HO2 = H3O+ + ${\text{O}}_{2}^{--}$ | 7 · 105 |
| H3O+ + ${\text{O}}_{2}^{--}$ = HO2 | 4.5 · 1010 |
| H2O2 = H3O+ + ${\text{HO}}_{2}^{--}$ | 3.56 · 10-2 |
| H3O+ + ${\text{HO}}_{2}^{--}$ = H2O2 | 2 · 101 |
| H3O+ + OH– = H2O | 1.4 · 1011 |
| H2O = H3O+ + OН– | 2.52 · 105 |
| H + OН– = e + H2O | 1.8 · 107 |
| ${\text{O}}_{2}^{--}$ + ${\text{O}}_{2}^{--}$ = O2 + ${\text{HO}}_{2}^{--}$ + OН– | 3 · 10-1 |
| ${\text{O}}_{2}^{--}$ + H2O2 = O2 + OН–+ OH | 1.6 · 1010 |
| HCOOH = H3O+ + HCOO– | 1.8 · 106 |
| H3O+ + HCOO– = HCOOH | 1 · 1010 |
| COOH = COO– радикал + H3O+ | 4 · 108 |
| COO– радикал + H3O+ = COOH | 1 · 1010 |
| OH + HCOOH = H2O + COOH | 1.4 · 108 |
| HCOO– + OH = H2O + COO– радикал | 2.6 · 109 |
| COO– радикал + COO– радикал = –OOCCOO– | 1 · 108 |
| e + HCOOH = H + HCOO– | 1.4 · 108 |
| H + HCOOH = H2 + COOH | 4.4 · 105 |
| O2 + COOH = HO2 + CO2 | 2 · 109 |
| H2O2 + COOH = OH + H2O + CO2 | 5 · 104 |
| COOH + COOH = (СООН)2 | 4 · 108 |
| COOH + COOH = HCOOH + CO2 | 5 · 108 |
| (СООН)2 = HOOCCOO– + H3O+ | 5.6 · 108 |
| HOOCCOO– + H3O+ = (СООН)2 | 1 · 1010 |
| HOOCCOO– = –OOCCOO–+ H3O+ | 5.4 · 105 |
| –OOCCOO– + H3O+= HOOCCOO– | 1 · 1010 |
| (СООН)2 + OH = CO2 + COO– радикал + H3O+ | 1.4 · 106 |
| HOOCCOO– + OH = CO2 + COO–радикал | 1.9 · 107 |
| –OOCCOO– + OH = CO2 + COO– радикал + OH– | 9.7 · 105 |
| e + (СООН)2 = H2O2CCOOH + OH– | 2.5 · 1010 |
| HOOCCOO– + e = H2O2CCOOH + OH– + OH– | 3.2 · 109 |
| –OOCCOO– + e = H2O2CCOOH + OH– + OH– + OH– | 4.8 · 107 |
| HOOCCOO– + H = H2O2CCOOH + OH– | 1.6 · 104 |
| H + (СООН)2 = H2O2CCOOH | 3 · 106 |
| –OOCCOO– + H = H2O2CCOOH + OH– + OH– | 1 · 104 |
| H2O2CCOOH + H2O2CCOOH = GA + (СООН)2 | 1 · 108 |
| H2O2CCOOH + O2 = (СООН)2 + HO2 | 1 · 105 |
| H2O2CCOOH + H2O2CCOOH = DA | 1 · 108 |
| H2O2CCOOH + H2O2CCOOH = (СООН)2+ HCOOH + HCOOH | 1 · 109 |
| H2O2CCOOH + COOH = HA | 1 · 109 |
| H2O2 + H2O2CCOOH = OH + H2O + (СООН)2 | 1 · 105 |
| GA + OH = CO2 + CO2 + CO2 + H2O | 1 · 107 |
| HA + OH = CO2 + CO2 + CO2 + H2O | 5 · 107 |
| DA + OH = CO2 + CO2 + CO2 + H2O | 1 · 107 |
| HNO3 + OH = NO3 + H2O | 8.8 · 10 |
| NO3 + H2O = HNO3 + OH | 3 · 102 |
| N${\text{О}}_{3}^{ - }$ + e = N${\text{О}}_{3}^{{2 - }}$ | 9.7 · 1010 |
| N${\text{О}}_{3}^{{2 - }}$ + H3O+ = NO2 + OH– | 4.5 · 1010 |
| H + N${\text{О}}_{3}^{ - }$ = NO2 + OH– | 4.4 · 106 |
| NO3 + NO2 = N2O5 | 1 · 109 |
| NO2 + NO2 = N2O4 | 4.7 · 108 |
| N2O4 = NO2 + NO2 | 6.8 · 103 |
| N2O4 + H2O = HNO3 + HNO2 | 1.8 · 1010 |
| OH + NO2 = HOONO | 5 · 108 |
| NO3 + NO3 = N2O6 | 4 · 106 |
| HNO3 = H3O+ + N${\text{О}}_{3}^{ - }$ | 2 · 1010 |
| H3O+ + N${\text{О}}_{3}^{ - }$ = HNO3 | 4.4 · 108 |
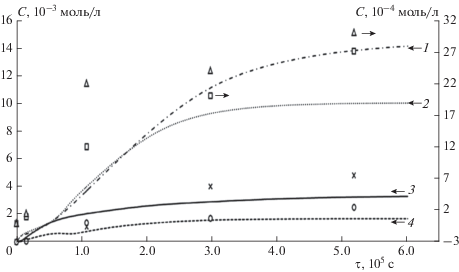
На рис. 3 приведены расчетные кривые кинетического моделирования и полученные нами экспериментальные результаты по кинетике изменения концентрации Н2 и СО2 при радиолизе водных растворов смесей муравьиная – щавелевая – азотная кислоты в зависимости от времени γ-облучения. Как видно из рис. 3, расчетные данные хорошо согласуются с экспериментальными. Вычисленные по результатам экспериментов радиационно-химические выходы газообразных продуктов реакций составляют G(H2) = 0.4 молекул/100 эВ и G(CO2) = 0.6 молекул/100 эВ. Полученные данные показывают, что присутствие кислот не влияет на образование молекулярного водорода при радиолизе их водных растворов в условиях экспериментов. Как видно, рост содержания азотной кислоты в смеси приводит к уменьшению стационарной концентрации образующего углекислого газа и водорода, что согласуется с данными по изменению показателей рН и ХПК, приведенными выше.
Рис. 3.
Кинетические кривые образования газообразных продуктов СО2 (1, 2) и Н2 (3, 4) при γ-радиолизе водных растворов смесей НСООН + НООС-СООН + HNO3 в зависимости от времени облучения (τ) для двух концентраций HNO3 0.25 ∙ 10–3 M и 2.5 ∙ 10–3 M: линии – расчет, точки – эксперимент. Мощность дозы J = 0.16 Гр/с.
ЗАКЛЮЧЕНИЕ
На основе полученных экспериментальных данных о дозовой зависимости показателей рН и ХПК, а также изучения процесса образования газообразных продуктов превращений предложена кинетическая модель, описывающая радиационно-кинетические процессы при радиолизе водных растворов смесей муравьиной, щавелевой и азотной кислот под действием γ-излучения и учитывающая 80 элементарных реакций. Проведено сравнение расчетных и экспериментальных зависимостей концентрации CO2 и H2 от поглощенной дозы γ-излучения.
Список литературы
Голубков Г.В., Григорьев Г.Ю., Набиев Ш.Ш., Палкина Л.А., Голубков М.Г. // Хим. физика. 2018. Т. 37. № 10. С. 3; https://doi.org/10.1134/S0207401X18090054
Гордеев А.В., Ершов Б.Г. // Матер. рос. конф. “Фундаментальные аспекты безопасного захоронения РАО в геологических формациях”. М.: Граница, 2013. С. 37.
Ершов Б.Г., Гордеев А.В., Косарева И.М. // Радиохимия. 2014. Т. 56. № 5. С. 545.
Государственный стандарт Республики Беларусь. Качество воды. Определение перманганатной окисляемости. СТБ ISO 8467-2009. Минск: БелГИСС, 2009.
Жесткова Т.П., Жукова Т.П., Макаров И.Е. // Химия высоких энергий. 2011. Т. 45. № 2. С. 115.
Ким Д.Ч., Ким Д.Х., Ким Д.К. и др. // Там же. 1999. Т. 33. № 6. С. 413.
Гордеев А.В., Ершов Б.Г., Косарева И.М. // Химия высоких энергий. 2005. Т. 39. № 4. С. 250.
Аристова Н.А., Мокина Т.С. // ЖОХ. 2003. Т. 73. Вып. 5. С. 756.
Карташева Л.И., Чулков В.Н. // Химия высоких энергий. 2000. Т. 34. № 6. С. 467.
Ershov B.G., Gordeev A.V., Bykov G.L., Moisy P. // Radiochim. Acta. 2012. V. 100. № 12. P. 919; https://doi.org/10.1524/ract.2012.1977
Gurbanov M.A., Gulieva U.A. // J. Radiat. Res. ANAS. 2018. V. 5. № 1. P. 46.
Кулиева У.А., Курбанов М.А., Абдуллаев Э.Т. // Матер. 68 Междунар. конф. “Ядро-2018” “Фундаментальные проблемы ядерной физики, атомной энергетики и ядерных технологий”. СПб.: ВВМ, 2018. С. 51.
Кулиева У.А., Курбанов М.А., Абдуллаев Э.Т. // Изв. НАН Азербайджана. Сер. физ.-техн. и мат. наук. 2018. № 5. С. 154.
Пикаев А.К. Современная радиационная химия: Радиолиз газов и жидкостей. М.: Наука, 1986.
Кеба В.В., Семиколенова Н.А. // Мат. структуры и моделирование. 2000. Вып. 6. С. 72.
Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф. Краткий справочник по химии. Киев: Наук. думка, 1974.
Поскребышев Г.А., Нета П., Хуи Р.Е. // Журн. геофиз. исслед.: Атмосфера. 2001. Т. 106. № D5. P. 4995; https://doi.org/10.1029/2000JD900702
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


