Химическая физика, 2020, T. 39, № 2, стр. 69-75
Влияние типа матрицы на процесс сорбционного концентрирования и люминесцентное определение пирена
О. А. Плотникова 1, *, А. Г. Мельников 1, Е. И. Тихомирова 1, А. Ж. Адылова 1
1 Саратовский государственный технический университет им. Гагарина Ю.А.
Саратов, Россия
* E-mail: plotnikova_o_a@mail.ru
Поступила в редакцию 29.11.2018
После доработки 28.02.2019
Принята к публикации 20.03.2019
Аннотация
Исследовано влияние типа матрицы на процесс сорбционного концентрирования пирена (одного из наиболее известных экотоксикантов ряда полициклических ароматических углеводородов (ПАУ)) – в гомогенных и гетерогенных растворах [дистиллированная вода, растворитель Р-12 (смесь толуола, бутилацетата и ксилола), водно-мицеллярный раствор анионного поверхностно-активного вещества додецилсульфата натрия], а также на последующее определение его методом твердофазной люминесценции. Проведено сравнение сорбционных свойств следующих матриц: целлюлозного сорбента (фильтровальная бумага), фильтрующих материалов на основе полипропилена, вискозы и полиэстера. Экспериментально обнаружено, что при исследовании растворов пирена в воде и растворителе Р-12 для сорбции и последующей регистрации твердофазной люминесценции более пригодна гидрофобная полипропиленовая матрица, однако при использовании водно-мицеллярных растворов додецилсульфата натрия осуществлять сорбцию и наблюдать твердофазную люминесценцию пирена предпочтительнее на вискозной матрице. Полученные результаты могут быть использованы для разработки высокочувствительного метода контроля содержания пирена в различных средах.
ВВЕДЕНИЕ
К началу XXI века мировая экологическая обстановка заметно ухудшилась в связи с интенсивным развитием транспорта, усиленной химизацией производства и сельского хозяйства, накоплением токсических продуктов антропогенного происхождения. Это определяет актуальность разработки новых методов контроля содержания опасных химических веществ в объектах окружающей среды. К одним из наиболее опасных загрязнителей, обладающих к тому же выраженными канцерогенными и мутагенными свойствами, относятся полициклические ароматические углеводороды (ПАУ) [1–4]. ПАУ образуются, главным образом, в результате неполного сгорания органических веществ (например, угля, масла, бензина и древесины). Изучение физико-химических процессов взаимодействия экотоксикантов с различными средами позволяет создать необходимые условия для определения экотоксикантов с наибольшей чувствительностью и селективностью.
Стандартные процедуры определения ПАУ в сложных образцах окружающей среды основаны на хроматографических методах [5, 6]. Хотя аналитическая эффективность этих методов широко признана, анализ ПАУ в этом случае характеризуется как трудоемкий, относительно дорогостоящий и отнимающий много времени процесс. В связи с этим большой интерес представляет разработка более простых и чувствительных методов или улучшение существующих методов для обнаружения и определения соединений ПАУ.
Определенными преимуществами в качестве альтернативного метода обладает флуоресцентная спектроскопия [7, 8]. Она широко применяется для исследования физико-химических процессов взаимодействия многих органических соединений с различными сорбентами, а также для качественного и количественного их анализа в биологических, биомедицинских, пищевых объектах и окружающей среде. Данный метод позволяет обнаруживать ПАУ на уровнях следовых концентраций, благодаря люминесцентным свойствам этих соединений, и обеспечивает недорогой и быстрый метод анализа [9]. Большинство ПАУ являются флуорофорами, которые начинают испускать характерное свечение при возбуждении молекул оптическим излучением определенной длины волны [10]. Это обеспечивает широкое применение люминесцентной спектроскопии, включающее регистрацию как флуоресценции, так и фосфоресценции молекул ПАУ для изучения процессов взаимодействия флуорофоров с сорбентами и упрощает идентификацию ПАУ [11].
В последние годы были разработаны методы для улучшения процедур люминесцентного анализа. Так, например, было предложено использовать организованные среды, содержащие мицеллы, которые широко используются в настоящее время в люминесцентных методах, что позволяет повысить чувствительность и селективность анализа [12–14]. Используя мицеллярные среды, можно улучшить растворимость и изменить микроокружение аналитов, тем самым увеличив их сигнал люминесценции [13].
Нужно отметить, что определение ПАУ в водных средах довольно сложно, так как их концентрации в воде чрезвычайно низки из-за их низкой растворимости и при отборе проб и хранении часто происходят значительные потери, т.е. при анализе ПАУ всегда необходим этап предварительного концентрирования. Обычные методы предварительного концентрирования требуют большого количества токсичных органических растворителей, а также большого времени экстракции (12–24 ч). Чтобы устранить или, по крайней мере, минимизировать использование органических растворителей, применяемых в обычной жидкостно-жидкостной экстракции, были разработаны другие методы, среди которых наиболее распространенным является метод твердофазной экстракции [15].
Иммобилизация люминофоров на твердых матрицах позволяет сочетать сорбционное концентрирование веществ с их последующим люминесцентным определением непосредственно в фазе сорбента, минуя этап десорбции вещества органическим растворителем, что повышает чувствительность анализа и воспроизводимость результатов. Так, в работе [16] предложено использовать нейлоновые мембраны в качестве твердой поверхности для флуоресцентного и фосфоресцентного определения одного из самых канцерогенных ПАУ бензо[a]пирена в водах различного происхождения. Этот подход был основан на твердофазной экстракции аналита и его люминесцентном определении на поверхности нейлона. Флуоресцентные характеристики нескольких ПАУ на пяти типах твердой поверхности изучались для разработки новых оптических датчиков для скрининга ПАУ в окружающей среде [17]. В работе [18] оценивается аналитический потенциал твердофазной экстракции и флуориметрии при комнатной температуре для скрининга ПАУ в образцах воды. Фильтровальная бумага (целлюлозная матрица), обработанная растворами поли(водородметилсилоксана) и дихлордиметилсилана, была использована для твердофазной экстракции и регистрации твердофазной флуоресценции и фосфоресценции ПАУ в водных растворах [19]. В работе [20] исследовали возможности твердофазной экстракции и флуоресценции с временным разрешением для скрининга ПАУ в водных образцах. Авторы использовали октадецильные мембраны для извлечения ПАУ и их метаболитов [21] из образцов воды и в качестве твердой подложки для обнаружения флуоресценции ПАУ. В работе [22] были также предложены пенополиуретаны для извлечения ПАУ из воды и их последующего определения в твердой фазе методом люминесцентной спектроскопии. Таким образом, принятая процедура определения ПАУ в экологических матрицах перечисленными выше методами основана на предварительном концентрировании аналитов на твердых носителях с последующим измерением их флуоресценции [23, 24, 17 ].
Цели данной работы – изучение влияния типа матриц на процесс сорбционного концентрирования и последующее люминесцентное твердофазное определение экотоксикантов ПАУ на примере пирена в различных растворах и подбор оптимальных условий такого процесса. Для сравнительного исследования сорбционных свойств были выбраны следующие типы матриц: целлюлозный сорбент (фильтровальная бумага), фильтрующие материалы на основе полипропилена, вискозы и полиэстера. В качестве наиболее доступной и недорогой матрицы наибольшее распространение получила фильтровальная бумага. Однако она характеризуется гидрофильностью и недостаточной эффективностью сорбции ПАУ. Для повышения эффективности концентрирования можно использовать водно-мицеллярные растворы поверхностно-активных веществ [12, 13, 25], что подтверждено нашими исследованиями. Также экспериментально выявлено увеличение интенсивности сигнала флуоресценции пирена при его сорбции на твердые матрицы, что связано с более жестким закреплением его сорбированных молекул и, тем самым, увеличением эффективности излучательных процессов дезактивации энергии электронного возбуждения молекул [26, 27].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве ПАУ использовали пирен (Sigma, США), образцы которого дополнительно не очищали и контролировали по спектрам поглощения и люминесценции. В качестве растворителей применяли: дистиллированную воду, растворитель Р‑12 марки “о. с. ч.” для хроматографии (смесь толуола, бутилацетата и ксилола, ТУ 6-09-1710-77) и 0.05 М водно-мицеллярный раствор (ВМР) анионного поверхностно-активного вещества (ПАВ) додецилсульфата натрия (ДСН) марки “ч.д.а.” (“ОАО Реактив”, ТУ 6-09-10-1405-79).
Исходные растворы пирена готовили растворением навесок вещества в соответствующем растворителе при помощи ультразвуковой ванны ПСБ-4035-05 объемом 4 л (ЗАО “ПСБ-Галс”, Москва). Рабочие растворы готовили разбавлением исходных. Контроль за растворением проводили измеряя оптические плотности растворов. Растворение протекает полностью в течение суток. В рабочих растворах в связи с различием массы навесок и растворимости пирена его концентрация отличалась, а именно: в дистиллированной воде – 7 ∙ 10–8 М, в растворителе Р-12 – 4 ∙ 10–6 М, в 0.05 М ВМР ДСН – 5 ∙ 10–6 М.
В работе для сорбционного концентрирования (твердофазной экстракции) и люминесцентных исследований применяли различные по гидрофобности матрицы, основные характеристики которых, указанные производителем, представлены в табл. 1. Гидрофильная целлюлозная матрица – это фильтровальная бумага марки “ФБ” (маркировка “красная лента”, ТУ 6-09-1678-95, “ЭКРОС”, Санкт-Петербург). Гидрофобные матрицы (из полипропилена, вискозы и полиэстера) – фильтровальные нетканые, (“Ленфильтр”, Санкт-Петербург).
Таблица 1.
Характеристики и свойства поверхности исследуемых матриц
| Характеристики | Состав | Плотность, г/м2 | Толщина, мм |
|---|---|---|---|
| Гидрофильная матрица – фильтровальная бумага марки ФБ, маркировка “красная лента” | целлюлоза |
80 |
0.2 |
| Гидрофобные матрицы: | |||
| KP* | полипропилен | 70 | 0.47 |
| KV* | вискоза (ксантогенат целлюлозы) | 70 | 0.39 |
| KS* | полиэстер (полиэтилентерефталат) | 70 | 0.55 |
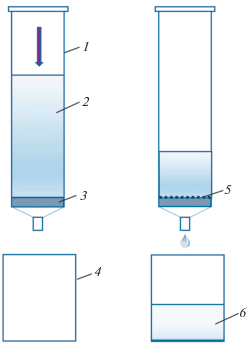
Сорбцию пирена на различные матрицы проводили в динамическом режиме в сорбционной колонке, представленной на рис. 1. Раствор пропускали через слой сорбента, находящийся в пластиковой сорбционной колонке. Затем сорбент сушили 10 мин при температуре 60 °С. После этого регистрировали спектры твердофазной люминесценции (ТФЛ) пирена, сорбированного на матрицы.
Рис. 1.
Схема колонки для твердофазной экстракции пирена: 1 – колонка, 2 – анализируемый раствор до сорбции, 3 – зафиксированная сорбционная матрица, 4 – резервуар для приема раствора, 5 – слой сорбированного компонента, 6 – раствор после сорбции.
Исследования проводили флуоресцентными методами, в частности, методом люминесцентного зонда пирена, вибронная структура спектра флуоресценции которого чувствительна к изменению полярности микроокружения его молекул [28–31]. По соотношению интенсивностей первого максимума I1 к интенсивности третьего максимума I3 флуоресценции пирена определяли его индекс полярности, равный I1/I3. Флуоресценцию пирена в растворах и спектры ТФЛ на матрицах исследовали на люминесцентном спектрометре LS-55 PerkinElmer (США) и анализаторе жидкости спектрофлуориметре “Флуорат-02-Панорама” (“Люмекс”, Россия). Фотометрический анализ растворов проводили на двухлучевом сканирующем спектрофотометре ПЭ-6100УФ (“ПромЭкоЛаб”, Россия). Спектры флуоресценции пирена регистрировали в диапазоне 350–420 нм при возбуждении светом с длиной волны 334 нм. Все измерения проводили при температуре 25 ± 2 °С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Определение спектральных характеристик пирена в различных растворах
На первоначальном этапе экспериментальных исследований были изучены спектральные характеристики пирена в различных растворах. На рис. 2 представлены нормированные к единице спектры флуоресценции пирена в водном растворе, в 0.05 М ВМР ДСН и растворителе Р-12.
Рис. 2.
Спектры флуоресценции пирена в различных растворителях: 1 – в водном растворе, 2 – в 0.05 М ВМР ДСН, 3 – в растворителе Р-12.
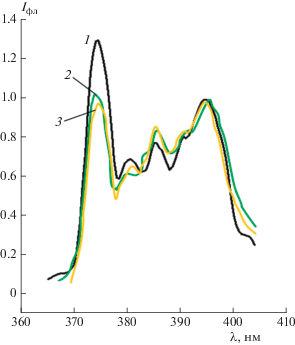
В спектрах флуоресценции пирена (рис. 2) наблюдается перераспределение интенсивности первого и третьего пиков, свидетельствующие об изменении полярности микроокружения молекул пирена в различных растворителях. Значения индекса полярности пирена свидетельствуют об уменьшении полярности микроокружения молекул пирена при переходе от водных к водно-мицеллярным растворам, что связано с солюбилизацией молекул пирена в гидрофобном ядре мицелл ПАВ. Определенный нами индекс полярности пирена I1/I3 в воде составил 1.67, в 0.05М ВМР ДСН – 1.19, а в растворителе Р-12 – 1.10, что согласуется с литературными данными [31].
Определение эффективности сорбции пирена из различных растворов спектрофотометрическим методом с учетом фоновых сигналов
Определение эффективности сорбции пирена из различных растворов на матрицы проводили по измерению оптической плотности растворов до и после сорбции на изучаемые матрицы. Известно [22], что эффективность сорбции реагента на сорбент оценивается с помощью степени извлечения по следующей формуле:
где С0 и С – концентрация реагента в исходном растворе до и после сорбции соответственно.
Результаты определения степени извлечения пирена из изученных растворов при его однократной фильтрации через гидрофильную и гидрофобные матрицы представлены в табл. 2. Из данных табл. 2 следует, что гидрофобная полипропиленовая матрица обладает наилучшей эффективностью сорбции пирена из водных растворов и растворителя Р-12, тогда как из водно-мицеллярного раствора лучше сорбирует пирен вискозная матрица. Повысить эффективность сорбции пирена на исследуемые матрицы можно, увеличив время сорбции, и многократной фильтрацией одного и того же раствора через матрицы.
Таблица 2.
Cтепень извлечения (R, %) пирена твердыми матрицами из исследуемых растворов
| Раствор пирена | Матрицы, через которые осуществлялась фильтрация | |||
|---|---|---|---|---|
| целлюлоза | полипропилен | вискоза | полиэстер | |
| Дистиллированная вода | 28 ± 2 | 48 ± 4 | 43 ± 2 | 5 ± 1 |
| Растворитель Р-12 | 25 ± 2 | 87 ± 3 | 45 ± 2 | 30 ± 2 |
| 0.05 М ВМР ДСН | 45 ± 3 | 50 ± 2 | 65 ± 3 | 25 ± 2 |
ТФЛ пирена при сорбции из различных растворов с учетом фоновых сигналов матрицы
Следующим этапом работы было изучение вклада фонового сигнала в общую флуоресценцию, наблюдаемую при сорбции пирена из различных растворов на различные матрицы. В табл. 3 приведены сравнительные данные по вкладу фонового сигнала в общий сигнал ТФЛ пирена при длине волны максимума излучения пирена 395 нм. Экспериментально выявлено, что на матрице из полиэстера при сорбции изученных растворов флуоресценция пирена имеет минимальное значение, близкое к фоновому сигналу матрицы. В связи с этим данная матрица не применялась в дальнейших исследованиях ТФЛ пирена.
Таблица 3.
Вклад фонового сигнала исследуемых матриц (в %) в ТФЛ пирена
| Матрица | Растворитель | ||
|---|---|---|---|
| дистиллированная вода | растворитель Р-12 | 0.05 М ВМР ДСН | |
| Целлюлоза | 1.3 | 2.8 | 3.0 |
| Полипропилен | 3.7 | 4.8 | 7.1 |
| Вискоза | 7.5 | 6.5 | 1.3 |
Из табл. 3 следует, что вклады фонового сигнала в флуоресценцию пирена на гидрофильной целлюлозной матрице и гидрофобной полипропиленовой матрице возрастают в ряду растворов как: вода, растворитель Р-12, 0.05 М ВМР ДСН, а на гидрофобной вискозной матрице наблюдается противоположная зависимость, что, вероятно, объясняется различными свойствами изученных матриц. Фоновый сигнал матрицы не является помехой для получения сигнала флуоресценции пирена, но его необходимо учитывать при разработке методов ТФЛ для аналитического определения ПАУ.
На рис. 3 приведен пример спектров флуоресценции пирена с учетом фоновых сигналов на различных матрицах при его сорбции из водных растворов. Наибольший сигнал ТФЛ пирена получен на гидрофобных полипропиленовой и вискозной матрицах, что объясняется большей эффективностью сорбции гидрофобного пирена из воды на гидрофобные матрицы, чем на гидрофильную целлюлозную матрицу (фильтровальную бумагу). Кроме того, на рис. 3 мы наблюдаем перераспределение интенсивности первого и третьего пиков в спектре флуоресценции пирена. Индекс полярности пирена I1/I3 при сорбции из воды на целлюлозу превышает значение I1/I3 на гидрофобных матрицах (табл. 4). Аналогично были получены спектры ТФЛ пирена при сорбции из других изученных растворов. Сравнительные данные спектральных характеристик пирена на различных матрицах представлены в табл. 4.
Рис. 3.
Спектры ТФЛ пирена при сорбции из водных растворов на изучаемые матрицы: 1 – полипропилен, 2 – вискоза, 3 – целлюлоза.
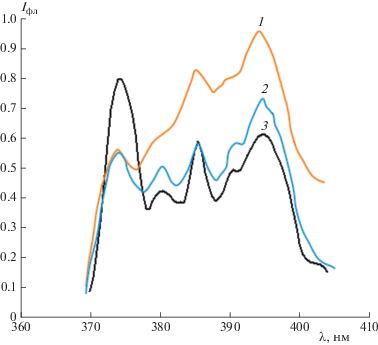
Таблица 4.
Сравнительные данные относительной интенсивности ТФЛ (395 нм) и индекса полярности пирена I1/I3 при сорбции на матрицы из различных растворов
| Матрица | I1/I3 | I5 отн* |
|---|---|---|
| Сорбция пирена из раствора в дистиллированной воде: | ||
| целлюлоза | 1.67 ± 0.03 | 0.61 |
| полипропилен | 0.67 ± 0.02 | 1 |
| вискоза | 0.95 ± 0.03 | 0.75 |
| Сорбция пирена из раствора Р-12: | ||
| целлюлоза | 1.12 ± 0.03 | 0.26 |
| полипропилен | 0.58 ± 0.02 | 1 |
| вискоза | 0.84 ± 0.02 | 0.85 |
| Сорбция пирена из 0.05 М ВМР ДСН: | ||
| целлюлоза | 1.25 ± 0.03 | 0.22 |
| полипропилен | 0.56 ± 0.02 | 0.45 |
| вискоза | 0.95 ± 0.02 | 1 |
ЗАКЛЮЧЕНИЕ
Таким образом, проанализированы спектры флуоресценции пирена и выявлено увеличение интенсивности сигнала флуоресценции при его сорбции на твердые матрицы. Определена степень извлечения пирена из различных растворов: максимальную степень для воды и растворителя Р-12 наблюдали у гидрофобной полипропиленовой матрицы; для 0.05 М ВМР ДСН – у вискозной матрицы. У целлюлозной и вискозной матриц эффективность сорбции увеличилась при использовании ВМР, тогда как у полипропиленовой и полиэстерной матриц максимальная эффективность наблюдалась при сорбции пирена из растворителя Р-12.
После процесса фильтрации на матрицах обнаружены фоновые сигналы флуоресценции. При сорбции пирена из исследуемых растворов на целлюлозную матрицу наблюдаются наименьшие фоновые сигналы, при сорбции из раствора ВМР ДСН минимальные значения наблюдаются у вискозной матрицы. Из приведенных в статье данных следует, что при сорбции изученных растворов на матрице из полиэстера флуоресценция пирена имеет минимальное значение, сравнимое с фоновым сигналом матрицы, т.е. данную матрицу не рекомендуется использовать для ТФЛ ПАУ.
Таким образом, можно заключить, что при сорбции пирена из воды и растворителя Р-12 для регистрации ТФЛ пирена более пригодна гидрофобная полипропиленовая матрица, однако при использовании ВМР пирена в ДСН следует использовать вискозную матрицу, на которой наблюдается значительно более интенсивные сигналы ТФЛ пирена. В результате проведенных исследований предложен новый способ определения пирена, который может быть рекомендован для экологического мониторинга его в водных средах.
Результаты работы получены в рамках выполнения государственного задания № 5.3922.2017/64 Минобрнауки России.
Список литературы
Skupinska K., Misiewicz I., Kasprzycka-Guttman T. // Acta Pol. Pharm. 2004. V. 61. № 3. P. 233.
Abdel-Shafy H.I., Mansour M.S.M. // Egypt. J. Petrol. 2016. V. 25. № 1. P. 107; https://doi.org/10.1016/j.ejpe.2015.03.011
Menzie C.A., Potocki B.B., Santodonato J. // Environ. Sci. Technol. 1992. V. 26. № 7. P. 1278; https://doi.org/10.1021/es00031a002
Lamichhane S., Bal Krishna K.C., Sarukkalige R. // Chemosphere. 2016. V. 148. P. 336; https://doi.org/10.1016/j.chemosphere.2016.01.036
Wise S.A., Sander L.C., Schantz M.S. // Polycycl. Aromat. Comp. 2015. V. 35. № 2–4. P. 187; https://doi.org/10.1080/10406638.2014.970291
Poster D.L., Schantz M.M., Sander L.C. et al. // Anal. Bioanal. Chem. 2006. V. 386. № 4. P. 859; https://doi.org/10.1007/s00216-006-0771-0
Morales T.V., Esponda S.M., Rodriguez J.J.S. et al. // Maced. J. Chem. Chem. Eng. 2010. V. 29. № 1. P. 1.
Das S., Powe A.M., Baker G.A. et al. // Anal Chem. 2012. V. 84. № 2. P. 597; https://doi.org/10.1021/ac202904n
Elcoroaristizabal S., de Juan A., García J.A. et al. // Chemom. Intell. Lab. Syst. 2014. V. 132. P. 63; https://doi.org/10.1016/j.chemolab.2014.01.005
Owen C.J., Axler R.P., Nordman D.R. et al. // Chemosphere. 1995. V. 31. № 5. P. 3345; https://doi.org/10.1016/0045-6535(95)00179-C
Dickert F.L., Besenböck H., Tortschanoff M. // Adv. Mater. 1998. V. 10. № 2. P. 149; https://doi.org/10.1002/(SICI)1521-4095(199801)10:2<149::AID-ADMA149>3.0.CO;2-2
Wandruszka R. von. // Crit. Rev. Anal. Chem. 1992. V. 23. № 3. P. 187; https://doi.org/10.1080/10408349208050854
Santana Rodriguez J.J., Halko R., Betancort Rodriguez J.R. et al. // Anal. Bioanal. Chem. 2006. V. 385. № 3. P. 525; https://doi.org/10.1007/s00216-006-0342-4
Lazaro E., San Andres M.P., Vera S. // Anal. Chim. Acta. 2000. V. 413. № 1–2. P. 159; https://doi.org/10.1016/S0003-2670(99)00731-X
Ncube S., Madikizela L., Cukrowska E. et al. // TrAC, Trends Anal. Chem. 2018. V. 99. P. 101; https://doi.org/10.1016/j.trac.2017.12.007
Bortolato S.A., Arancibia J.A., Escandar G.M. // Anal. Chim. Acta. 2008. V. 613. № 2. P. 218; https://doi.org/10.1016/j.aca.2008.03.004
Fernandez-Sanchez J.F., Segura Carretero A., Cruces-Blanco C. et al. // Talanta. 2003. V. 60. № 2–3. P. 287; https://doi.org/10.1016/S0039-9140(03)00100-0
Whitcomb J.L., Campiglia A.D. // Ibid. 2001. V. 55. № 3. P. 509.
Ackerman A.H., Hurtubise R.J. // Anal. Chim. Acta. 2002. V. 474. № 1–2. P. 77; https://doi.org/10.1016/S0003-2670(02)01002-4
Whitcomb J.L., Bystol A.J., Campiglia A.D. // Ibid. 2002. V. 464. № 2. P. 261; https://doi.org/10.1016/S0003-2670(02)00425-7
Calimag-Williams K., Goicoechea H.C., Campiglia A.D. // Talanta. 2001. V. 85. № 4. P. 1805; https://doi.org/10.1016/j.talanta.2011.07.009
Dmitrienko S.G., Gurariy E.Y., Nosov R.E. et al. // Anal. Lett. 2001. V. 34. № 3. P. 425; https://doi.org/10.1081/AL-100102584
Ackerman A.H., Hurtubise R.J. // Appl. Spectrosc. 1999. V. 53. № 7. P. 770; https://doi.org/10.1366/0003702991947540
Fernandez-Sanchez J.F., Segura Carretero A., Cruces-Blanco C. et al. // Anal. Chim. Acta. 2004. V. 506. № 2. P. 1; https://doi.org/10.1016/j.aca.2003.11.002
Zhu L., Zhou W. // Environ. Pollut. 2008. V. 152. № 1. P. 130.
Дячук О.А., Губина Т.И., Мельников Г.В. // ЖАХ. 2009. Т. 64. № 1. С. 7.
Дячук О.А., Мельников Г.В., Губина Т.И., Тихомирова Е.И. // Хим. физика. 2012. Т. 31. № 10. С. 21.
Pineiro L., Novo M., Al-Soufi W. // Adv. Colloid Interface Sci. 2015. V. 215. P. 1; https://doi.org/10.1016/j.cis.2014.10.010
Avakyan V.G., Nazarov V.B., Koshkin A.V. et al. // High Energ Chem. 2015. V. 49. № 3. P. 177; https://doi.org/10.1134/S0018143915030030
Karpovich D.S., Blanchard G J. // J. Phys. Chem. 1995. V. 99. № 12. P. 3951; https://doi.org/10.1021/j100012a014
Kalyanasundaram K., Thomas J.K. // J. Amer. Chem. Soc. 1977. V. 99. № 7. P. 2039; https://doi.org/10.1021/ja00449a004
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


