Химическая физика, 2020, T. 39, № 2, стр. 58-68
Сравнение влияния остаточной радиоактивности и загрязнения почв пестицидами на генотоксичность
Е. А. Саратовских *
Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: easar@icp.ac.ru
Поступила в редакцию 06.03.2019
После доработки 19.04.2019
Принята к публикации 22.04.2019
Аннотация
Выполнен сравнительный анализ влияния на живые организмы двух факторов воздействия – радиационного (остаточная радиация 137Cs) и химического (пестициды) – по показателю “генотоксичность”. Проведены исследования отдельных пестицидов и водных вытяжек проб почв. Отбор проб почв проведен на территории Орловской области с 12 по 15 мая 2010 г., т.е. через 24 года после аварии на Чернобыльской АЭС. Рассмотрены изменения мутагенного индекса в тесте Эймса (Salmonella/микросомы) и на культуре клеток млекопитающих в тесте Cricetulus griseus (Chinese hamster – хомячок китайский) образцов почв в зависимости от активности радиоактивного цезия и содержания пестицидов в этих образцах. Показано, что при низких дозах радиации (20 мкР/ч) не наблюдается прямой корреляции величины дозы с генотоксичностью, определяемой в форме производимых мутаций ДНК как по типу сдвига рамки считывания, так и по типу замены оснований. Напротив, проявляется четкая тенденция возрастания генотоксичности с ростом концентраций пестицидов и всей суммы техногенных токсикантов в изученных образцах почв.
ВВЕДЕНИЕ
Авария на Чернобыльской АЭС в 1986 г. привела к загрязнению радионуклидами (в большей степени 137Cs) почти 2 млн га земель сельскохозяйственного назначения [1]. В мае 2010 г. нами был проведен экологический мониторинг почв восьми районов Орловской области – дозиметрические измерения и исследование содержания радионуклидов; определение наличия техногенных токсикантов, в первую очередь пестицидов [2]. В настоящей работе поставлена задача проанализировать данные физико-химических и радиологических исследований и попытаться выяснить наиболее опасные факторы для здоровья населения, проживающего на этих территориях.
Для радиационно-эпидемиологических исследований весьма важным является изучение влияния малых и средних доз облучения на частоту онкологических заболеваний и смертности. Наличие пестицидов в почве, растениях и пище людей – также не менее опасный фактор риска. Поэтому в качестве критерия сравнения влияния химического и радиационного воздействий нами был выбран параметр “генотоксичность” как присущий обоим видам загрязнения.
Генетические последствия радиационного поражения живых организмов хорошо известны [3–6]. Ионизирующее излучение повреждает ДНК, РНК и белки непосредственно, разрывает химические связи в молекулах, угнетает иммунную систему организма и повышает восприимчивость к различным заболеваниям. Низкие дозы его вмешиваются в пролиферацию клеток и приводят к появлению злокачественных опухолей, главным образом – лейкозов (рис. 1) [4, 6]. Данные обследования жителей Хиросимы и Нагасаки свидетельствуют о наличии зависимости малых и средних доз облучения на частоты заболеваемости онкологическими заболеваниями [5].
Рис. 1.
Относительная среднестатистическая вероятность заболевания раком после получения однократной дозы в 1 рад (0.01 Гр) при равномерном облучении всего тела.
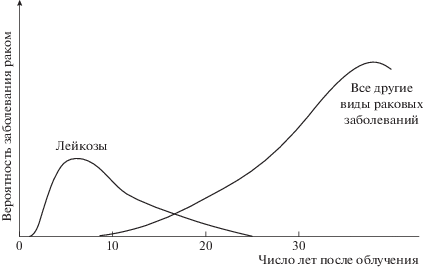
Отдаленные генетические последствия воздействия ионизирующего излучения выражаются в том, что то или иное изменение будет передаваться из поколения в поколение. Так, хроническое облучение при дозе 1 Гр, полученной в течение 30 лет, приводит к появлению около 2000 случаев генетических заболеваний на каждый миллион новорожденных [4].
Радионуклиды замещают атомы стабильных элементов в различных структурах клеток и биологически активных соединениях. В результате этого они накапливаются в различных органах [4].
Генотоксичность пестицидов показана в многочисленных исследованиях [7–9]. Международное агентство по исследованию рака классифицировало как канцерогенные 56 пестицидов, среди которых хлор- и фосфорсодержащие, а также феноксикислоты [10], приводящие к возникновению различных опухолей, включая лейкоз [11–13] и множественную миелому [14].
Генотоксичность пестицидов проявляется в отдаленных последствиях в форме канцерогенного или репродуктивного действий: большинство признаны потенциальными химическими мутагенами, приводящими к мутации генов, хромосомным изменениям и повреждениям ДНК [15–19]. Например, фосфорорганический гербицид раундап (глифосат) приводит к гибели клеток эмбрионов, клеток пуповинной крови и плаценты человека; препятствует клеточному дыханию, разрушает мембраны, разрушает ДНК; его метаболиты более токсичны, чем исходный препарат [20]. Он имеет химическое строение, схожее с боевым отравляющим веществом зарином нервно-паралитического действия, и демонстрирует близкое биологическое поведение (табл. 1).
Таблица 1.
Сравнение химического строения и свойств раундапа (глифосата) и зарина
| Вещество | Химическая формула | Свойства |
|---|---|---|
| Раундап (глифосат) | 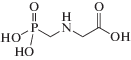 |
N-фосфонометилглицин; ингибирует ферменты 5-еноилпирувил-шикимат-3-фосфат-синтазу (EPSPS [21], КФ 2.5.1.19) и, как все фосфорорганические пестициды, – холинэстеразу [22] и НАДН-оксидоредуктазу [23] |
| Зарин | 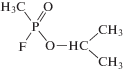 |
Изопропиловый эфир фторангидрида метилфосфоновой кислоты; SP-энантиомер (левовращающий изомер), обладающий большим сродством к ферменту ацетилхолинэстеразе [24, 25]; реагирует с нуклеофилами, замещающими фтор [26, 27] |
Выполненные нами исследования показали, что хлор- и фосфорсодержащие пестициды накапливаются в живых организмах за счет концентрирования в жирной фазе мембран [28], образуют комплексы с металлами [29–31] и нуклеотидами [32, 33], проявляют генотоксичность в тесте Эймса [34]. В связанном с гумусом виде они остаются в почве и далее переходят в растения, организмы животных и человека.
Цель настоящей работы – сравнить влияние низких доз остаточной радиации в почве и присутствия в ней пестицидов на генотоксичность проб почв.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В данной работе объектами исследования были пестициды коммерческих марок, основные свойства которых приведены в табл. 2. Действующие вещества из коммерческих форм выделяли согласно методике, описанной в работе [30]. Действующим веществом гербицида лонтрела является 3,6-дихлорпиколиновая кислота (L-изомер). Синтез комплексов лонтрела с металлами (ML) выполняли описанным в работах [29, 30] методом.
Таблица 2.
Значения констант распределения октанол/вода, коэффициентов биоаккумуляции (КБ) и скоростей перехода пестицидов в октанол [28]
| Вещество | Kокт/вода (20 мин) | Kокт/вода (18 мес.) | КБ | V1 ∙ 10–3, М/ч (20 мин) | V3 ∙ 10–8, М/ч(18 мес.) |
|---|---|---|---|---|---|
| Зенкор | 66.6 ± 2.0 | 100.4 ± 3.0 | 0.99 ± 0.01 | 32.84 | 0.37 |
| Лонтрел | 2.6 ± 0.1 | 3.4 ± 0.1 | 0.77 ± 0.03 | 23.97 | 4.06 |
| Кузагард | 0.30 ± 0.01 | 0.77 ± 0.03 | 0.44 ± 0.01 | 18.47 | 32.60 |
| Раундап | 0.46 ± 0.014 | 2.27 ± 0.07 | 0.69 ± 0.02 | 10.50 | 18.90 |
| Сетоксидим | 7.83 ± 0.23 | 25.0 ± 0.8 | 0.96 ± 0.03 | 2.96 | 0.58 |
| Базагран | 52.2 ± 1.8 | 70.4 ± 2.12 | 0.99 ± 0.01 | 3.27 | 0.04 |
Установление величин липофильности выполняли на основании определения констант распределения октанол/вода (Kокт/вода) так же, как в [28].
Генотоксические свойства пестицидов, их комплексов с металлами и водных вытяжек проб почв были исследованы в тесте Эймса Salmonella/микросомы [34] и на культуре клеток млекопитающих в тесте Cricetulus griseus Chinese hamster – хомячок китайский [35]. Образцы почвы на территории Орловской области были отобраны в период 12–15 мая 2010 г. Координаты мест отбора проб почвы приведены в [2]. Пробы почв отбирали методом конверта, согласно [36], очищали, перемешивали методом квартования, растирали и готовили водные вытяжки в соответствии с принятой методикой [37, 38].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно, что скорость полураспада радиоактивного изотопа 137Cs составляет 30.5 лет [39]. Весь этот период времени доза излучения постепенно уменьшается во времени. Пестициды ведут себя принципиально иначе. С одной стороны, они характеризуются высокой устойчивостью в водных растворах [40], а с другой – накапливаются в почве и живых организмах [28].
1. Биоаккумуляция пестицидов в организмах
В табл. 2 представлены величины констант Kокт/вода, определенные через 20 мин после перемешивания водного раствора пестицида с октиловым спиртом и в конце наблюдения (через 18 мес.). Наибольшую липофильность – способность в большей степени растворяться в жирной фазе – октаноле проявляют зенкор и базагран. Соответственно, у них самые высокие значения этих констант: Kокт/вода = 66.6 и 52.2. Далее по величинам липофильности изученные пестициды располагаются в следующей последовательности: зенкор > базагран > сетоксидим > лонтрел > раундап > кузагард.
Процесс перехода пестицидов из воды в октанол – неполярную фазу характеризуется несколькими временны́ми стадиями с различной скоростью переноса. В первые 20 мин относительная скорость накопления пестицидов в октаноле (V1 ∙ 10–3, М/ч) у всех соединений максимальна: около 98% зенкора и базаграна, 90% седоксидима переходят из водной фазы в н-октанол. На следующем временнóм отрезке: от 20 мин до 6 мес., скорость перехода пестицидов из воды в неполярную фазу существенно падает, и процесс приближается к насыщению. Для всех рассмотренных соединений и после 18 мес. наблюдения процесс накопления их в неполярной фазе не выходит на равновесное стационарное состояние, а переход веществ из водного раствора в н-октанол явно продолжается и в дальнейшем. По величинам скоростей накопления пестицидов в октаноле на первом участке, V1, все рассмотренные соединения могут быть расположены в следующий ряд: зенкор > лонтрел > кузагард > раундап > базагран > сетоксидим.
Для моделирования процесса биоаккумуляции измерения величин Kокт/вода повторяли через 15 и 30 сут, 3, 6, 12, 18 мес. Отношение максимальной их концентрации пестицидов в октаноле к исходной их концентрации в водном растворе обозначено нами как коэффициент биоаккумуляции: КБ = [С18окт]/[Сисх]. Рассчитанные значения КБ представлены в табл. 2. Минимальное значение КБ = 0.44 получено для кузагарда; а наибольшее, равное 0.99, – для зенкора и базаграна. Последовательность расположения веществ по убыванию значения КБ: зенкор = базагран > сетоксидим > > лонтрел > раундап > кузагард, соответствует последовательности их расположения по значениям липофильности (или ${{K}_{{{{{\text{окт}}} \mathord{\left/ {\vphantom {{{\text{окт}}} {{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} \right. \kern-0em} {{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}$) и остается неизменной для всех рассмотренных соединений в течение всего периода наблюдений [28].
В литературе представлены данные только для трех из изученных нами соединений: базаграна, зенкора и раундапа. В табл. 3 приведены величины токсичности этих препаратов по отношению к различным видам многоклеточных организмов, полученные по параметру “аккумуляция”.
Таблица 3.
Значения величин доз токсичности базаграна, зенкора и раундапа, аккумулирующихся в различных организмах
| Вещество | Общее имя | Научное название | Жизненная стадия | Время, сут | Токсическая доза, 10–6 | Ссылка | |
|---|---|---|---|---|---|---|---|
| г/л | М | ||||||
| Ракообразные | |||||||
| Базагран | Fiddler crab | Uca minax | не указано | 11 | 86 | 0.358 | [41] |
| Водные насекомые | |||||||
| Базагран | Southern house mosquito | Culex quinquefasciatus | не указано | 30 | 86 | 0.358 | [41] |
| Зоопланктон | |||||||
| Базагран | Water flea | Daphnia magna | 30 | 86 | 0.358 | [41] | |
| Водоросли | |||||||
| Зенкор | Green algae | Chlorella fusca | 1 | 51 | 0.238 | [42] | |
| Chlorella fusca vacuolata | 1 | 50 | 0.233 | [43] | |||
| Базагран | Algae, algal mat | Algae | 30 | 86 | 0.358 | [41] | |
| Рыбы | |||||||
| Зенкор | Carp | Leuciscus idus melanotus | 5–6 см, 1.5 г | 3 | 54 | 0.225 | [43] |
| Ide, silver or golden orfe | Leuciscus idus | 2–5 г | 3 | 54 | 0.225 | [42] | |
| Раундап | Cyprinus carpio | Cyprinus carpio | 3.5–4.0 см | 0.5 | 531 | 3.14 | [44] |
| 3.5–4.0 см | 1 | 508 | 3.004 | [44] | |||
| 3.5–4.0 см | 2 | 518 | 3.063 | [44] | |||
| 3.5–4.0 см | 3 | 344 | 2.034 | [44] | |||
| 3.5–4.0 см | 5 | 264 | 1.561 | [44] | |||
| 3.5–4.0 см | 7 | 110 | 0.651 | [44] | |||
| 3.5–4.0 см | 14 | 151 | 0.893 | [44] | |||
Поскольку построение липидного бислоя различных клеточных мембран принципиально одинаково, полученные результаты позволяют предположить, что in vivo в биологических системах рассмотренные токсиканты будут образовывать комплексы с липидами клеточных мембран. По этой же причине раундап (глифосат) разрушает клеточные мембраны [20]. Образование комплекса пестицида с фосфатидилхолином состава 1 : 1 установлено в работах [45–48]. Такие же данные имеются по паратиону и малатиону [49, 50], 4,4'-дихлордифенилтрихлорэтану (ДДТ) [51, 52], метоксихлору [53] и 2,4-дихлорфеноксиуксусной кислоте (2,4-Д) [54] – соединениям c близким химическим строением.
2. Генотоксические свойства пестицидов и их комплексов с металлами
Генотоксические свойства пестицидов и их комплексов с металлами были исследованы в тесте Эймса Salmonella/микросомы [34]. Результаты приведены в табл. 4. Штамм бактерий ТА-100 показывает мутации ДНК типа замены оснований. На штамме ТА-100 кузагард проявил слабую прямую мутагенную активность (мутагенный индекс – МИ = 1.8). Все пестициды проявили мутагенность на штамме ТА-98.
Таблица 4.
Величины мутагенных индексов пестицидов и их металлокомплексов [34]
| Пестициды | Штамм ТА-98 | Штамм ТА-100 | Комплексы | Штамм ТА-98 | Штамм ТА-100 | ||||
|---|---|---|---|---|---|---|---|---|---|
| МА+ | МА– | МА+ | МА– | МА+ | МА– | МА+ | МА– | ||
| Контроль | 1 | 1 | 1 | 1 | MoL2 | 3.3 | 5.2 | 1.4 | 1.5 |
| Зенкор | 3.2 | 25.2 | 1.1 | 1.3 | FeL2 | 4.2 | 2.8 | 1.5 | 1.1 |
| Лонтрел | 5.5 | 2.0 | 0.4 | 1.1 | CoL2 | 3.0 | 1.8 | 1.4 | 1.1 |
| Кузагард | 5.3 | 2.0 | 1.6 | 1.8 | NiL2 | 5.2 | 4.3 | 1.2 | 1.4 |
| Раундап | 5.3 | 1.8 | 1.7 | 1.1 | СuL2 | 3.1 | 1.6 | 1.4 | 1.2 |
| Сетоксидим | 3.0 | 0.9 | 0.7 | 0.9 | MnL2 | 2.5 | 2.0 | 0.8 | 1.2 |
| Базагран | 2.3 | 2.2 | 1.5 | 1.5 | ZnL2 | 4.3 | 1.7 | 1.5 | 1.2 |
| Тачигарен | 2.0 | 1.5 | 1.4 | 1.5 | MgL2 | 2.3 | 3.8 | 1.8 | 1.3 |
Самым активным мутагеном оказался зенкор – прямой мутагенный эффект с индексом мутагенной активности МА– = 25.2. Остальные пестициды обнаружили слабый прямой мутагенный эффект с величиной МА– < 10. По величине МИ пестициды располагаются в следующем ряду активности: зенкор > базагран > лонтрел = кузагард > раундап > тачигарен > сетоксидим. Зенкор, базагран, лонтрел и кузагард вызывают у бактерий S. typhimurium на штамме ТА-98 мутации ДНК типа сдвига рамки считывания.
Пестициды активно метаболизируются монооксигеназной системой печени (табл. 4). Метаболиты зенкора оказались менее генотоксичными, чем исходное соединение. Метаболиты лонтрела, кузагарда, раундапа и тачигарена проявили мутагенные активности, заметно возросшие по сравнению с прямой активностью этих веществ. В результате метаболической активации их МИ возрастают в 1.5–2.9 раза. Генотоксичность раундапа, сетоксидима и тачигарена проявилась только после метаболической активации – они оказались промутагенами. При этом МИ раундапа возрастает в 3 раза, а сетоксидима – в 3.3 раза. Указания на то, что метаболиты раундапа более токсичны, чем исходное соединение, имеются в литературе [20]. Рассмотренные пестициды вызывают у штамма ТА-98 мутации типа сдвига рамки считывания. По величине МИ они располагаются в следующем ряду: зенкор > лонтрел > кузагард > раундап > > сетоксидим > базагран > тачигарен.
Известно, что пестициды легко образуют прочные химические соединения с металлами, широко распространенными как в почве, так и в форме свободного пула находящихся в растениях и живых организмах [29, 30]. В связи с этим были определены МИ комплексов хлорсодержащего гербицида лонтрела с металлами [34].
Все комплексы металлов с лонтрелом (табл. 4) проявили прямую активность на штамме ТА-98. Максимальная активность выявлена у комплекса MоL2 (МИ = 5.2). За ним следуют NiL2 > MgL2 > > FeL2 > L > MnL2. Не обнаружили прямой мутагенной активности CoL2, ZnL2 и CuL2.
После метаболической активации все металлокомплексы проявили генотоксичность с МИ < 10. Мутагенная активность метаболитов MоL2 и MgL2 снизилась по сравнению с пробами без метаболической активации, у FeL2, NiL2, MnL2 – возросла. У метаболитов комплексов CoL2, ZnL2 и CuL2 обнаружен только промутагенный эффект. Мутагенная активность метаболитов в два раза выше, чем у комплексов. По промутагенной активности они выстраиваются в следующий ряд: L ~ NiL2 > ZnL2 ~ FeL2 > MоL2 ~ CuL2 ~ CoL2 > > MnL2 ~ MgL2. Активность метаболита комплекса NiL2 близка к исходному лонтрелу, а у MnL2 и MgL2 она существенно ниже.
Комплексы MоL2, NiL2, FeL2 и MgL2 проявили прямую мутагенную активность, более высокую, чем у лонтрела. У комплекса MnL2 обнаружена слабая активность, близкая к таковой у лонтрела. Генотоксичность комплексов CuL2, CoL2 и ZnL2 ниже, чем у лонтрела, и проявляется только после метаболической активации. Только у NiL2 метаболическая мутагенная активность соизмерима с таковой лонтрела.
3. Генотоксические показатели образцов почв Орловской области
Нами была сделана попытка сравнить влияние остаточной радиоактивности и постоянного применения пестицидов на генотоксичность. Для этого были проведены исследования образцов почв, отобранных на территории Орловской области с 12 по 15 мая 2010 г., на содержание техногенных токсикантов [2]. Параллельно определяли генотоксичность в тесте Эймса Salmonella/микросомы и на культуре клеток млекопитающих в тесте Cricetulus griseus [35]. Анализировались пробы почв, взятые в тех же самых точках, в которых измеряли уровень радиации и содержание радионуклидов [2].
В табл. 5 представлены результаты анализа экстрактов проб почв при помощи теста Эймса Salmonella/микросомы [35]. Пробы №№ 3, 6, 7а, 8 и 9 продемонстрировали только токсический эффект, который проявляется в виде подавления роста колоний сальмонеллы. Ни в одной из проб, тестированных на штамме ТА-100, не был выявлен мутагенный эффект. Пробы №№ 2, 3, 7, 7а, 8 и 9 проявили слабую прямую мутагенную активность (МА–) на штамме ТА-98. Из этого списка самой высокой мутагенной активностью обладала проба № 7а (с. Лубянки, пахота) с МИ = 3.9.
Таблица 5.
Результаты исследования экстрактов почв на мутагенную и токсикологическую активность по тесту Эймса Salmonella typhimurium/микросомы
| № пробы | Населенный пункт/район | Штамм ТА-98 | Заключение | Штамм ТА-100 | Заключение | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| МА+ | МА– | МА+ | МА– | ||||||||
| КК | МИ | КК | МИ | КК | МИ | КК | МИ | ||||
| Контроль – ДМСО | 34 | 1 | 22 | 1 | нет | 89 | 1 | 95 | 1 | нет | |
| Контроль – 2-амино-антрацен | 540 | 16 | 33 | 1.5 | М | 405 | 4.6 | 65 | 0.7 | нет | |
| 1 | с. Дросково/Покровский | 56 | 1.6 | 27 | 1.2 | нет | 76 | 0.9 | 89 | 0.9 | нет |
| 2 | с. Коровник/Залегощенский | 87 | 2.6 | 62 | 2.8 | М | 89 | 1.0 | 102 | 1.1 | нет |
| 3 | с. Домнино/Свердловский | 73 | 2.1 | 60 | 2.7 | М | 32 | 0.4 | 24 | 0.3 | Т |
| 4 | с. Куракино/Свердловский | 71 | 2.1 | 36 | 1.6 | ПМ | 69 | 0.8 | 77 | 0.8 | нет |
| 5 | с. Кр. Слободка (целина)/Глазуновский | 67 | 2 | 54 | 1.4 | ПМ | 91 | 1.0 | 146 | 1.5 | нет |
| 6 | с. Кр. Слободка/Глазуновский | 79 | 2.3 | 57 | 1.6 | ПМ | 34 | 0.4 | 34 | 0.4 | Т |
| 7 | с. Лубянки/Дмитровский | 107 | 3.1 | 49 | 2.2 | М | 118 | 1.3 | 94 | 1.0 | нет |
| 7а | с. Лубянки (пахота)/Дмитровский | 101 | 3.0 | 86 | 3.9 | М | 34 | 0.4 | 28 | 0.3 | Т |
| 8 | п/л “Елочка”/Болховский | 54 | 1.6 | 52 | 2.4 | ПМ | 32 | 0.4 | 27 | 0.3 | Т |
| 9 | с. Репнино/Болховский | 101 | 3.0 | 39 | 1.8 | М | 42 | 0.5 | 36 | 0.4 | Т |
Примечание: ДМСО – диметилсульфоксид – растворитель, 2-аминоантрацен – мутаген – контрольное вещество; “нет” – без мутагенной активности или нетоксично, М – мутаген, ПМ – промутаген, Т – токсикант; КК – количество колоний на чашку, среднее из трех повторностей; координаты точек отбора проб приведены в работе [2].
Как видно из табл. 5, по тесту на штамме ТА-98, вещества, содержащиеся в экстрактах проб почв №№ 4, 5 и 6, оказались промутагенами; они индуцируют мутации типа сдвига рамки считывания при использовании метаболической активации. Это означает, что метаболиты данного штамма являются более генотоксичными соединениями, чем исходные загрязняющие вещества. В частности, такими генотоксическими свойствами обладают большинство полициклических ароматических углеводородов и полихлорированных бифенилов.
4. Анализ влияния на генотоксичность почв остаточного радиационного загрязнения и постоянного применения пестицидов на основании теста Эймса
Результаты определения мутагенных индексов были проанализированы с точки зрения экспозиционной дозы γ-излучения и содержания радионуклидов (137Cs), взятых из работы [2], в тех же самых образцах почв. Рисунки 2 и 3 демонстрируют проведенное сопоставление. Поле точек со всей очевидностью демонстрирует, что ни на одном из штаммов мутагенный индекс не показал явной корреляции с экспозиционной дозой γ-излучения и содержанием радионуклидов в почве (137Cs). Приведенная на рисунках прямая есть результат гипотетической экстраполяции и указывает на глобальную тенденцию.
Рис. 2.
Изменение мутагенного индекса МА+ и МА– на штамме ТА-98 в тесте Эймса образцов почв в зависимости от величины γ-излучения в этих образцах: МА+ – черные квадраты; МА– – круги; гипотетическая прямая – аппроксимация данных; величина γ‑излучения на расстоянии 1 м над поверхностью почвы; цифры на рисунке – номера образцов в соответствии с табл. 5.
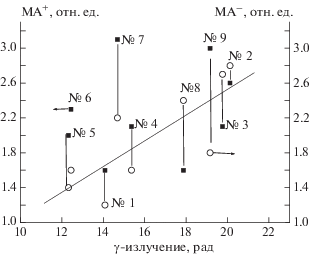
Рис. 3.
Изменение мутагенного индекса МА+ и МА– на штамме ТА-98 в тесте Эймса образцов почв от активности радиоактивного цезия в этих образцах: МА+ – правая ось, черные квадраты, МА– – левая ось, круги; гипотетическая прямая – аппроксимация данных; активность 137Cs в образце почвы; цифры на рисунке – номера образцов в соответствии с табл. 5.
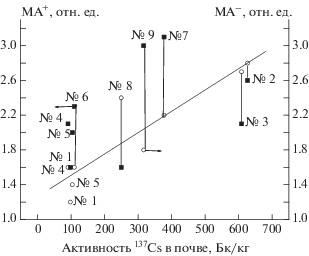
Необходимо отметить, что в пробе № 1 (табл. 5) не была выявлена мутагенная активность ни на штамме ТА-100, ни на штамме ТА-98. Эта проба была отобрана на площадке Дросково с низким уровнем дозы γ-излучения и с минимальным содержанием 137Cs. Вместе с тем, согласно полученным нами ранее результатам [2], данная площадка (проба № 1) характеризуется одним из наиболее высоких уровней содержания пестицидов (гексахлорбензол (ГХБ), 4,4'-дихлордифенилдихлорэтан (ДДД), 4,4'-дихлордифенилдихлорэтилен (ДДЭ), ДДТ, γ-гексахлорциклогексан (γ-ГХЦГ), известный также как гербицид Линдан) – до 0.69 мг/кг и незначительным содержанием таких веществ-канцерогенов, как флуорантен и бензопирен – < 0.05 мкг/кг.
Следующие три пробы проявили мутагенные свойства с различными значениями мутагенного индекса (табл. 5):
– проба № 8 (п/л “Елочка”), которая характеризовалась минимальным содержанием пестицидов (порядка 0.21–0.10 мг/кг) при относительно высоком уровне содержания 137Cs в 250 Бк/кг;
– проба № 3 (площадка Домнино) с максимальным, среди исследованных образцов, содержанием пестицидов (1.73 мг/кг) и максимальным же содержанием 137Cs при повышенном уровне дозы γ-излучения;
– проба № 2 (бывшая деревня Коровник), которая характеризовалась минимальной концентрацией пестицидов (порядка 0.06 мг/кг) при максимальном содержании радионуклида 137Cs в 627 Бк/кг.
Однако полученные результаты не позволяют сделать окончательного заключения о том, что загрязняющие вещества или радионуклиды являются причиной промутагенной и мутагенной активности тест-штаммов. Рисунки 2 и 3 показывают, что остаточная концентрация радионуклидов не влияет на проявление генотоксичности, а причиной промутагенных эффектов могут быть пестициды, продукты их разложения и другие органические соединения, содержащиеся в почве.
5. Оценка генотоксического состояния почв Орловской области с использованием теста индукции аберраций хромосом в клетках Cricetus griseus
Для оценки влияния загрязняющих веществ на клетки млекопитающих в форме индукции хромосомных аберраций нами были выполнены исследования с использованием клеток C. griseus [2]. Методика основана на анализе числа аберрантных клеток и частоты аберраций хромосом, возникающих под воздействием различных мутагенов, присутствующих в тестируемой воде, по сравнению с воздействием контрольной культуры, не содержащей токсических веществ.
Были исследованы аберрации хромосомного и хроматидного типов. Аберрации хромосомного типа отражают повреждение хромосомы на предсинтетической стадии (фаза G1), когда хромосома представляет собой однонитевую структуру, тогда как аберрации хроматидного типа возникают при повреждении хромосомы на двунитевой стадии, т.е. в фазах S и G2. В силу различия механизмов образования аберраций хромосомного и хроматидного типов имеется возможность сделать заключение о природе мутагенного фактора. Так, значительное число аберраций хроматидного типа может свидетельствовать о наличии химического мутагена, тогда как высокая частота аберраций хромосомного типа указывает на радиационный фактор [55, 56].
Результаты, полученные с использованием клеток млекопитающих, представлены в табл. 6. Анализ результатов показывает, что почвенная вытяжка пробы № 8 (п/л “Елочка”) оказала существенное мутагенное действие на клетки, повысив частоту аберраций хромосомного и хроматидного типов в 6.3 и 8 раз, соответственно, по сравнению с контролем. Отличия от контроля, как по доле аберрантных клеток, так и по общей частоте аберраций, являются статистически значимыми на уровне 95%. Результаты данного анализа согласуются с выявленным мутагенным и токсичным эффектом по тесту Эймса (табл. 5).
Таблица 6.
Результаты оценки генотоксичности образцов почвенных вытяжек из различных районов Орловской области по тесту индукции аберраций хромосом в клетках Cricetulus griseus линии CHO-K1
| № пробы | Число клеток | Доля аберраций клеток, % | Частота аберраций/100 клеток | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| хромосомные | хроматидные | общая частота (сумма) | ||||||||
| дицентрики | парные фрагменты | центр кольца | всего | одиночный фрагмент | обмены | всего | ||||
| Контроль | 1594 | 0.69 ± 0.21 | 0.44 ± 0.17 | 0 | 0 | 0.44 ± 0.17 | 0 | 0.25 ± 0.13 | 0.25 ± 0.13 | 0.69 ± 0.21 |
| 1 | 200 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 2 | 200 | 1.0 ± 0.7 | 0 | 0 | 0 | 0 | 0 | 1.0 ± 0.7 | 1.0 ± 0.7 | 1.0 ± 0.7 |
| 3 | 200 | 1.5 ± 0.9 | 0.50 ± 0.50 | 0 | 0 | 0.50 ± 0.50 | 0 | 1.0 ± 0.7 | 1.0 ± 0.7 | 1.5 ± 0.9 |
| 6 | 200 | 2.0 ± 1.0 | 1.0 ± 0.7 | 0 | 0 | 1.0 ± 0.7 | 0 | 1.0 ± 0.7 | 1.0 ± 0.7 | 2.0 ± 1.0 |
| 8 | 800 | 4.6 ± 0.7* | 2.0 ± 0.5 | 0.25 ± 0.18 | 0.50 ± 0.50 | 2.75 ± 0.59* | 0 | 2.0 ± 0.5* | 2.0 ± 0.5* | 4.75 ± 0.79* |
| 9 | 200 | 0.50 ± 0.50 | 0.50 ± 0.50 | 0 | 0 | 0.50 ± 0.50 | 0 | 0 | 0 | 0.50 ± 0.50 |
Почвенные вытяжки проб № 1 и № 9 не оказали мутагенного действия на клетки C. griseus, поскольку частота аберраций оказалась ниже контрольного уровня. Почвенные вытяжки проб № 2, № 3 и № 6 индуцировали общую частоту аберраций выше контрольного уровня, однако это превышение оказалось статистически недостоверным (табл. 6).
Таким образом, результаты анализа проб почв с помощью цитогенетического теста на клетках C. griseus позволили выделить две пробы с выраженными генотоксичными свойствами. Это экстракты из проб № 8 (п/л “Елочка”) и № 6 (с. Кр. Слободка), которые продемонстрировали наибольшую общую частоту аберраций, превышающую контроль в 2.9 раз. Помимо высокой общей частоты аберраций, соотношение типов аберраций в этих двух пробах указывает на возможность наличия факторов не только химической, но и радиационной природы, особенно для пробы № 8.
При анализе всей совокупности результатов по обоим тестам следует отметить, что наибольшая токсичность была выявлена у пробы № 8 (п/л “Елочка”), что обусловлено, скорее всего, не столько повышенным содержанием радионуклидов (250 Бк/кг 137Cs [2]), сколько высоким содержанием в этой пробе химических токсикантов. Действительно, в данной пробе содержались 2,4-Д, ГХБ, ДДД, ДДЭ, ДДТ и γ-ГХЦГ в общем количестве 0.206 мг/кг. Такой уровень концентрации химических токсикантов существенно превышает допустимые значения. Аналогично выполнен анализ изменения частоты аберраций в зависимости от величины γ-излучения или активности радионуклида 137Cs. Изменения носят хаотичный алогичный, не поддающийся никакой аппроксимации характер.
6. Анализ изменения частоты аберраций в клетках C. griseus от величины остаточного радиационного загрязнения и наличия пестицидов в образцах почв Орловской области
Для того чтобы установить, какие именно факторы – радиационные или химические в большей степени влияют на формирование токсичности проб почв, был выполнен анализ всех приведенных выше данных. В работе [2] приведены данные по содержанию пестицидов и других органических загрязняющих веществ в пробах почв, на которых выполнен анализ на генотоксичность. Все пробы как пахотных, так и целинных почв содержат практически одни и те же пестициды. Наиболее низкий уровень содержания пестицидов показали пробы № 5 (с. Кр. Слободка, целина), № 9 (с. Репнино) и № 7 (с. Лубянки).
На рис. 4 представлена зависимость изменения частот аберраций клеток от суммы содержаний пестицидов, определенной в каждой пробе [2], а на рис. 5 – от суммарного содержания всех токсичных загрязняющих веществ. Видно, что с ростом концентраций пестицидов или всех техногенных токсикантов происходит увеличение числа аберрантных клеток.
Рис. 4.
Изменение частоты аберраций клеток в зависимости от суммарного количества пестицидов в пробе (согласно [2]); гипотетическая прямая – аппроксимация данных; номера образцов соответствуют нумерации из табл. 5.
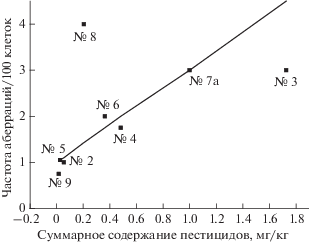
Рис. 5.
Изменение частоты аберраций клеток в зависимости от суммарного количества техногенных токсикантов в пробе (согласно [2]); гипотетическая прямая – аппроксимация данных; номера образцов соответствуют нумерации из табл. 5.
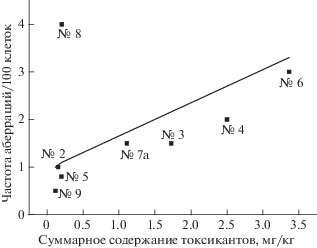
Интересные данные были получены при исследовании пробы № 2 (Коровник). Люди из этой деревни были отселены в 1986 г. за 30-километровую зону, и поэтому на этих сельскохозяйственных угодьях в течение 25 лет не проводились посевные работы. Поэтому и пестициды в почву не вносились. В результате содержание пестицидов в пробе № 2 составило 0.055 мг/кг, а в их состав входили различные соединения – ДДД, ДДЭ, ДДТ и γ-ГХЦГ. Концентрация пестицидов в пробах № 8 (п/л “Елочка”) и № 7 (с. Лубянки) оказалась значительно выше – 0.2 мг/кг, в том числе и на почве, не подвергавшейся вспашке. Кроме того, как показывают данные хромато-масс-спектрометрического анализа, в большинстве образцов почв могли содержаться токсичные соединения техногенного происхождения, мутагенные свойства которых были выявлены при помощи теста Эймса (табл. 4).
После снижения радиационного фона на загрязненных территориях возобновлена регулярная агропромышленная деятельность с интенсивным земледелием, что приводит к дополнительному поступлению в почву различных пестицидов, обладающих, как правило, мутагенными свойствами. Поэтому выявленная при помощи теста Эймса генотоксичность почвы может быть связана как с внесением в почву пестицидов, так и с присутствием в ней загрязняющих веществ, поступающих при переносе воздушных масс или присутствовавших в этих местах ранее в период применения ДДТ в сельскохозяйственной практике.
ЗАКЛЮЧЕНИЕ
Биологическое тестирование проб почвы загрязненных районов Орловской области, отобранных через 24 года после аварии на Чернобыльской АЭС, при помощи различных тест-объектов (штаммы бактерий ТА-98, ТА-100 в тесте Salmonella typhimurium/микросомы и клетки Cricetus griseus) выявило мутагенные и генотоксичные свойства исследованных образцов почв. Представленные данные показывают, что при низких дозах радиации (20 мкР/ч) не наблюдается прямой корреляции величины дозы с генотоксичностью, определяемой в форме производимых мутаций ДНК как по типу сдвига рамки считывания, так и по типу замены оснований. Напротив, четко проявляется тенденция возрастания генотоксичности с ростом концентраций как пестицидов, так и всей суммы техногенных токсикантов в образцах почв. Накопление пестицидов в жирной фазе мембран, показанное на примере восьми исследованных пестицидов, приводит к их накоплению в почве.
Работа выполнена по теме госзадания (№ государственной регистрации 0089-2019-0014).
Список литературы
Атлас современных и прогнозных аспектов последствий аварии на Чернобыльской АЭС на пострадавших территориях России и Белоруссии / Под ред. Израэля Ю.А., Богдевича И.М. М.–Минск: Инфрасфера – НИА “Природа”, 2009.
Андрияшина Т.В., Саратовских Е.А., Мартынова В.Ф. и др. // Хим. физика. 2015. Т. 34. № 6. С. 48; https://doi.org/10.7868/S0207401X15060023
Bushberg J.T. Radiation Injury. MSD Manual. Consumer Version; https://www.msdmanuals.com/home/injuries-and-poisoning/radiation-injury/radiation-injury?query= bushberg
Василенко О.И., Ишханов Б.С., Капитонов И.М. и др. Радиация. М.: Изд-во МГУ, 1996.
Цыб А.Ф., Иванов В.К. // Радиация и риск. Бюл. национ. радиац.-эпидемиолог. регистра. 2005. № S2.
Samoylov A.S., Buchmanov A.Yu., Udalov Yu.D. et al. // Radiat. Prot. Dosimetry. 2018. V. 182. № 1. P. 85.
Bolognesi C. // Mutat. Res. Rev. Mutat. Res. 2003. V. 543. № 3. P. 251; https://doi.org/10.1016/S1383-5742(03)00015-2
Bull S., Fletcher K., Boobis A.R., Battershill J.M. // Mutagenesis. 2006. V. 21. № 2. P. 93; https://doi.org/10.1093/mutage/gel011
Gundogan K., Donmez-Altuntas H., Hamurcu Z. et al. // Mutat. Res. Genet. Toxicol. Environ. Mutagen. 2018. V. 825. P. 1; https://doi.org/10.1016/j.mrgentox.2017.11.005
IARC Monographs on the Evaluation of Carcinogenic Risk to Humans. 1971. V. 1 – to 2002. V. 82.
Zahm S.H., Ward M.H., Blair A. // Occup. Med. State Art. Rev. 1997. V. 12. P. 269.
Zahm S.H., Ward M.H. // Environ. Health Perpect. 1998. V. 106. S. 3. P. 893.
Daniels J.L., Olsha A.R., Savitz D.A. // Ibid. 1997. V. 105. P. 1068.
Khuder S.A., Mutgi A.B. // Amer. J. Ind. Med. 1997. V. 32. P. 510.
Bolognesi C., Merlo F. Encyclopedia of Environmental Control Technology / Ed. Chereminisoff P.E. Houston: Gulf Publ. Co., 1995. Ch. 28.
IARC Monographs on the Evaluation of Carcinogenic Risk to Humans, Genetic and Related Effects: An Updating of Selected IARC Monographs. 1987. V. 1 – to V. 42.
Dearfield K.L., McCarroll N.E., Protzel A. et al. // Mutat. Res. 1999. V. 443. P. 183.
Dearfield K.L., Stack H.F., Quest J.A. et al. // Ibid. 1993. V. 297. P. 197.
Garrett N.E., Stack H.F., Waters M.D. // Ibid. 1986. V. 168. P. 301.
Benachour N., Séralini G.-E. // Chem. Res. Toxicol. 2009. V. 22. № 1. P. 97.
Кузнецова Е.М., Чмиль В.Д. // Соврем. пробл. токсикологии. 2010. № 1. С. 87.
Грин Д., Гольдбергер Р. Молекулярные аспекты жизни. М.: Мир, 1968.
Саратовских Е.А., Коршунова Л.А., Гвоздев Р.И. и др. // Изв. РАН. Сер. хим. 2005. № 5. С. 1284.
Kovarik Z., Radic Z., Berman H.A. et al. // Biochem. J. 2003. V. 373. № 1. P. 33.
Benschop H.P., De Jong L.P.A. // Acc. Chem. Res. 1988. V. 21. № 10. P. 368.
Сондерс Б. Химия и токсикология органических соединений фосфора и фтора. М.: Изд-во иностр. лит., 1961.
Александров В.Н., Емельянов В.И. Отравляющие вещества. М.: Воениздат, 1990.
Саратовских Е.А., Козлова Н.Б. // Токсикол. вестн. 2008. № 1. С. 29.
Алиев З.Г., Атовмян Л.О., Саратовских Е.А. и др. // Изв. АН СССР. Сер. хим. 1988. № 11. С. 2495.
Саратовских Е.А. // Изв. АН СССР. Сер. хим. 1989. № 10. С. 2327.
Саратовских Е.А., Орлов В.И., Криничный В.И. // Изв. АН СССР. Сер. хим. 1989. № 11. С. 2477.
Саратовских Е.А, Кондратьева Т.А., Психа Б.Л. и др. // Изв. АН СССР. Сер. хим. 1988. № 11. С. 2501.
Саратовских Е.А., Личина М.В., Психа Б.Л. и др. // Изв. АН СССР. Сер. хим. 1989. № 9. С. 1984.
Саратовских Е.А., Глазер В.М., Кастромина Н.В. и др. // Экол. генетика. 2007. Т. 5. № 3. С. 46.
Андрияшина Т.В., Саратовских Е.А., Пятенко В.С. и др. // Медико-биол. пробл. жизнедеят. 2015. Т. 13. № 1. С. 19.
Квасникова Е.В., Жукова О.М., Гордеев С.К. и др. // Изв. РАН. Сер. геогр. 2009. № 5. С. 66.
Нечаев Л.А., Баранов В.М., Торубаров Н.П. Мелиорация земель в адаптивноландшафтном земледелии центральной лесостепи ЦЧО. Орел: ФГУ “Управление "Орелмелиоводхоз”, 2004.
Бязров Л.Г. Лишайники в экологическом мониторинге. М.: Научный мир, 2002.
Василенко И.Я. // Природа. 1999. № 3. С. 70.
Саратовских Е.А., Козлова Н.Б., Папин В.Г. и др. // Прикл. биохим. и микробиол. 2006. Т. 42. № 1. С. 44.
Booth G.M., Yu C.C., Hansen D.J. // J. Environ. Qual. 1973. V. 2. № 3. P. 408.
Korte F., Freitag D., Geyer H. et al. // Chemosphere. 1978. V. 7. № 1. P. 79.
Freitag D., Geyer H., Kraus A. et al. // Ecotoxicol. Environ. Saf. 1982. V. 6. P. 60.
Wang Y.S., Jaw C.G., Chen Y.L. // Water Air Soil Pollut. 1994. V. 74. № 3/4. P. 397.
Hilton B.D., Brien R.D.O. // Pestic. Biochem. Physiol. 1973. V. 3. № 2. P. 206.
Arold W.M., Zimmerman U., Pauli W. et al. // Biochim. Biophys. Acta. 1988. V. 942. № 1. P. 83.
Gabrielska J., Kuczera J., Oswiecimska M. et al. // Stud. Biophys. 1981. V. 82. № 2. P. 149.
Omann G., Lakowicz J.R. // Biochim. Biophys. Acta. 1982. V. 684. P. 83.
Fisher D.J. // Pestic. Sci. 1973. V. 4. № 6. P. 845.
Venis M.A., Blackman G.E. // J. Exp. Bot. 1966. V. 17. № 53. P. 771.
Leo A. Pesticide Synthesis through Rational Approaches. Washington: Amer. Chem. Soc., 1984. Ch. 13. P. 213;https://doi.org/10.1021/bk-1984-0255.ch013
Kennedi C.D., Stemart R.A. // J. Exp. Bot. 1980. V. 31. № 120. P. 135.
Antunes-Madeira M.C., Madeira V.M.C. // Biochim. Biophys. Acta. 1985. V. 820. P. 165.
Голубев В.Н., Контуш А.С. // Биофизика. 1989. Т. 34. № 1. С. 42.
Бочков Н.П. // Цитология и генетика. 1977. Т. 11. № 3. С. 195.
Бочков Н.П., Чеботарев А.Н. Наследственность человека и мутагены внешней среды. М.: Медицина, 1989.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


