Химическая физика, 2020, T. 39, № 2, стр. 50-57
Химико-токсикологический анализ территорий, подверженных радиационно-химическому загрязнению. III. Перекисное окисление липидов и эффекты токсичности природных вод (in vivo)
Ю. И. Скурлатов 1, Е. В. Штамм 1, *, Л. Н. Шишкина 2, А. В. Рощин 1, В. О. Швыдкий 2, Л. В. Семеняк 3
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
3 Всероссийский институт рыбного хозяйства и океанографии
Москва, Россия
* E-mail: Ekochem@yandex.ru
Поступила в редакцию 05.06.2019
После доработки 05.06.2019
Принята к публикации 20.06.2019
Аннотация
С применением методов биотестирования, основанных на анализе совокупного влияния присутствующих в анализируемой пробе воды токсических веществ на процессы перекисного окисления липидов (ПОЛ), проведено исследование токсических свойств речных и подземных вод Жиздринского и Ульяновского районов Калужской области, в наибольшей степени подвергшихся загрязнению долгоживущими радиоизотопами в результате аварии на Чернобыльской АЭС. В опытах in vivo при однократном потреблении per os гексан-эфирных экстрактов из питьевой воды опытными животными определяли содержание продуктов ПОЛ и внеклеточной ДНК в плазме крови мышей, частоту хромосомных аберраций в клетках костного мозга мышей, антиоксидантный статус тканей мышей и суммарное количество нарушений в структуре молекул ДНК лимфоцитов крови мышей, оцениваемое по величине относительной константы скорости щелочной элюции. В опытах in vitro с использованием модельной тест-системы ПОЛ липосом, полученных из лецитина – фосфолипида куриного желтка, определяли содержание продуктов ПОЛ в нативных пробах воды. Совокупность полученных данных свидетельствует о наличии взаимосвязи между параметрами системы регуляции ПОЛ и повреждением структуры ДНК и позволяет предложить метод инициированного окисления липосом, сформированных из лецитина, для первичной оценки интенсивности ПОЛ в водной среде.
ВВЕДЕНИЕ
Важнейшей задачей системы экологического контроля действующих или планируемых к введению в действие потенциально опасных объектов (ПОО) является обеспечение их экологической безопасности. Нередко ПОО расположены в районах, подверженных химическому загрязнению от действующих антропогенных источников эмиссии загрязняющих веществ (ЗВ), либо радиоактивному загрязнению в результате проводимых в 50-е годы испытаний ядерного оружия, аварий в Челябинской области и на Чернобыльской АЭС.
Действующие системы контроля и наблюдения за эмиссией “приоритетных” ЗВ ограничиваются, как правило, измерением их содержания в объектах окружающей среды, элементах пищевой цепочки человека и животных в сравнении с нормативными требованиями. При нормальной работе содержание контролируемых ЗВ в выбросах и/или сбросах ПОО обычно не превышает допустимых нормативов. Значительное превышение концентраций, при которых возможна острая реакция биологических объектов, возможно только в случае крупных аварий. В то же время существующие нормативные требования не отражают опасность для здоровья людей, которые длительное время проживают на территориях, подвергающихся воздействию большого числа ЗВ, концентрация которых в окружающей среде может и не превышать нормативных требований. В этой связи необходимо не только контролировать уровни содержания в природных средах отдельных ЗВ, но и оценивать близкие и отдаленные последствия воздействия всей совокупности техногенных и неблагоприятных природных факторов на человека и окружающую среду в районе размещения ПОО с учетом возможного массопереноса ЗВ в атмосфере.
Для населения, проживающего в зоне воздействия ПОО, наиболее существенные последствия могут быть связаны с эффектами генотоксичности – изменениями в структуре и функции ДНК, сопровождающимися генетическими нарушениями и злокачественными образованиями. Считается [1], что ключевую роль в возникновении генотоксических эффектов играют первичные повреждения молекулы ДНК, приводящие к потере, увеличению или замене ее оснований. На анализе генотоксичности проб воды и почвенных вытяжек основаны методы биотестирования in vitro с использованием в качестве тест-объектов клеточных культур млекопитающих [2]. При этом критерием генотоксичности тестируемой среды является возникновение в клетке хромосомных перестроек, генных мутаций или повреждений ДНК.
Для прогнозирования токсических свойств воды, наряду с цитогенетическими методами, перспективными также являются методы биотестирования (in vitro и in vivo). Они основаны на определении параметров процессов перекисного окисления липидов (ПОЛ), протекающих при окислении жирных кислот, содержащихся в клеточных мембранах (in vivo) [3] или в модельной тест-системе, содержащей липосомы яичного желтка (in vitro) [4].
Процессы ПОЛ, протекающие во всех типах клеточных мембран, играют определяющую роль в регуляции клеточного метаболизма в норме и при действии различных повреждающих факторов. Состояние клеточных мембран оказывает влияние на интенсивность и полноту репарации ДНК, на биосинтез ДНК и функциональную активность генома.
Поскольку инициаторами ПОЛ в тканях животных являются активные формы кислорода, участвующие в повреждении компонентов клеток, в том числе мембран и ДНК [5–7], можно предположить существование взаимосвязи между интенсивностью ПОЛ и повреждением генетических структур при совокупном воздействии на организм содержащихся в водной среде токсикантов.
В опытах in vivo тест-реакция на основе ПОЛ включает в себя измерение содержания продуктов ПОЛ и внеклеточной ДНК в плазме крови мышей либо суммарного количества нарушений в структуре молекул ДНК лимфоцитов крови мышей, оцениваемого по константе скорости щелочной элюции. В опытах in vitro модельная система ПОЛ липосом является одной из наиболее чувствительных и экспрессных тест-систем для оценки токсического воздействия природных и сточных вод [8].
В предыдущих публикациях данной серии были рассмотрены уровни химического загрязнения водных объектов территорий Калужской области, в наибольшей степени подвергшихся радиационному загрязнению после чернобыльской аварии [9] и проведена оценка токсичности проб речной и питьевой воды методами биотестирования, включая тесты мутагенной активности [10].
Цель данной работы – провести сравнительный анализ влияния тех же проб речной и питьевой воды на интенсивность ПОЛ липосом и уровень хромосомных аберраций в клетках костного мозга мышей, а также на состояние процессов ПОЛ и ДНК в компонентах крови мышей при введении им экстрактов питьевой воды с разным соотношением бенз(а)пирена (БП) и полихлорбифенилов (ПХБ) в широком диапазоне их концентраций.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве базового теста на мутагенную активность in vivo был выбран метод учета частоты хромосомных аберраций, которые возникают в клетках костного мозга самок мышей линии SHK массой 20–28 г при введении им гексан-эфирных экстрактов питьевой воды. Сухие остатки экстрактов растворяли в оливковом масле и полученную смесь вводили мышам однократно перорально зондом в количестве 0.2 см3 на 20 г массы тела в дозе 1.0 мг/кг. Контрольной группе мышей по этой же схеме вводили оливковое масло. Для цитогенетического анализа отбирались метафазы с 38–40 хромосомами. Учитывали одиночные и парные фрагменты, обмены хроматидного и хромосомного типов. Ахроматические повреждения (пробелы) не регистрировали. Критерием отличия фрагмента от пробела служило смещение положения фрагмента по отношению к оси хроматиды или по ее длине. Для каждого животного анализировалось по 100 метафаз.
Препараты метафаз костного мозга готовили по методике из работы [11]. Отбор метафазных пластинок и учет аберраций хромосом проводили в соответствии с Методическими рекомендациями [12].
Тест-система ПОЛ in vitro
Для инициирования процессов ПОЛ липосом в качестве прооксиданта используется каталитическая система, состоящая из 10–3 М аскорбиновой кислоты и 10–4 М двухвалентного железа (сернокислого 7-водного). Данная система является источником активных промежуточных частиц – ОН-радикалов и комплексов железа в сверхокисленном состоянии [13].
Продуктом реакции ПОЛ является малоновый диальдегид (МДА). Метод анализа МДА основан на образовании окрашенного триметинового комплекса (ε532 = 1.56 ∙ 105 М–1 ∙ см–1), содержащего одну молекулу МДА и две молекулы тиобарбитуровой кислоты (ТБК) [14].
Показателем тест-реакции ПОЛ служит индекс токсичности – количество МДА (СМДА), образовавшегося в анализируемой пробе воды, выраженное в % по отношению к контролю:
Степень токсичности воды считается допустимой при 80 ≤ СМДА ≤ 120%; при 40 < СМДА < 80% или СМДА > 120% вода умеренно токсична; при СМДА < 40% анализируемая вода высокотоксична [15, 16].
Тест-системы ПОЛ in vivo
С целью оценки влияния загрязнения окружающей среды на нарушение структуры и количественные показатели ДНК, связанные с протеканием процессов ПОЛ в живых организмах [17], в данной работе использовали анализ ТБК-активных продуктов (ТБКАП) ПОЛ в плазме крови мышей; определение показателей антиоксидантного статуса липидов; анализ содержания внеклеточной ДНК в плазме крови; использование константы скорости щелочной элюции как интегрального показателя суммарного количества повреждений в ДНК. Определение тбкап в плазме крови подопытных мышей проводили по методу, изложенному в работе [14].
Опыты выполнены на 240 самках мышей массой 21–28 г. Однократное введение мышам per os масляных экстрактов питьевой воды осуществляли в следующих дозах: 5.3, 0.053 и 5.3 ∙ 10–5 мг/кг. Забой мышей проводили через 7, 14 и 31 сут после начала эксперимента. Одновременно проводили забой контрольных мышей. В качестве контроля служили мыши, которым однократно per os вводили оливковое масло. Кровь от мышей в группе объединяли от 3–4 особей и собирали в пробирки, обработанные 5%-ным раствором цитрата натрия. Плазму крови отделяли центрифугированием в градиенте плотности фиколл-верографина (плотность – 1.077 г/см3). Липиды из эритроцитов крови выделяли по методу Блая и Дайера в модификации Кейтса [18].
Величину антиокислительной активности (АОА) липидов определяли на метилолеатной окислительной модели [19]. Содержание белка с помощью микробиуретового метода [20].
Структурные повреждения ДНК лимфоцитов периферической крови определяли методом щелочной элюции [21]. Содержание внеклеточной ДНК в плазме крови определяли по спектрам возбуждения и флуоресценции комплекса ДНК с дихлоргидратом 4',6-диамидино-2-фенилиндолона [22]. Метод позволяет проводить количественное определение ДНК при концентрациях 5 ∙ 10–10 г/см3.
Экспериментальные данные по влиянию органических экстрактов из проб питьевой воды на процессы ПОЛ в тканях и содержание ДНК в плазме крови обрабатывали общепринятыми методами вариационной статистики и с помощью компьютерного пакета программ KINS [23].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 1 представлены данные по содержанию продуктов ПОЛ в пробах воды Ульяновского и Жиздринского районов Калужской области. Значения показателя ПОЛ слабо коррелируют с содержанием в тех же анализируемых пробах воды ионов тяжелых металлов [9, табл. 3 ] и с увеличением индекса суммарного загрязнения [9, табл. 6 ] в результате превышения ПДК по содержанию тяжелых металлов в питьевой воде.
Таблица 1.
Содержание продуктов ПОЛ липосом (in vitro) в нативных пробах воды Ульяновского и Жиздринского районов Калужской области (весна 2000 г.)
| Ульяновский район | Жиздринский район | ||
|---|---|---|---|
| место отбора | ПОЛ, % | место отбора | ПОЛ, % |
| Ульяново | 68 | Судимир | 114 |
| Заречье | 143 | Жиздра | 100 |
| Дудоровский | 41 | Мужитино | 60 |
| Кцынь | 68 | Зикеево | 74 |
| Река Вытебеть | 145 | Река Жиздра | 69 |
| Река Рессета | 72 | ||
Следующим этапом работы был сравнительный анализ результатов тест-системы ПОЛ с влиянием опытных проб воды на частоту хромосомных аберраций в клетках костного мозга мышей. В табл. 2 приведены результаты метафазного анализа хромосомных аберраций в костном мозге мышей в опыте in vivo при действии гексан-эфирных экстрактов. Из сравнения данных, приведенных в табл. 2, с результатами анализа генотоксичности экстрактов питьевой воды в опытах in vitro [10, табл. 5 ] можно заключить, что даже на фоне относительно слабых эффектов мутагенной активности наблюдается качественная корреляция при использовании теста in vitro без метаболической активации и теста in vivo. Это согласуется и с полученными данными о наибольшей повторяемости случаев с высоким числом структурных нарушений хромосом в опытах in vivo под воздействием экстрактов из воды поселка Судимир, содержащими наиболее высокую концентрацию БП. Кроме того, этот результат согласуется с предположением [2], что при сверхнизких концентрациях (ниже предела растворимости в воде) в тестируемой среде последний проявляет цитогенетическое воздействие, находясь в водорастворимой форме.
Таблица 2.
Частота метафаз с аберрациями хромосом в костном мозге мышей под действием анализируемых экстрактов воды (in vivo)
| Место отбора проб | Число клеток с аберрациями, % | Количество аберраций хромосом на 100 метафаз | Типы аберраций на 100 метафаз | ||
|---|---|---|---|---|---|
| одиночные фрагменты | обмены хроматидного типа | парные фрагменты | |||
| Контроль (масло) | 1.17 ± 0.40 | 1.17 ± 0.40 | 0.83 ± 0.31 | 0.17 ± 0.17 | 0.17 ± 0.17 |
| Судимир | 1.33 ± 0.56 | 1.33 ± 0.56 | 1.17 ± 0.48 | 0 | 0.17 ± 0.17 |
| Зикеево | 0.67 ± 0.21 | 0.67 ± 0.21 | 0.67 ± 0.21 | 0 | 0 |
| Мужитино | 1.50 ± 0.34 | 1.50 ± 0.34 | 1.33 ± 0.33 | 0 | 0.17 ± 0.17 |
| Коллективизатор | 2.0 ± 0.24 | 2.0 ± 0.24 | 1.67 ± 0.21 | 0.17 ± 0.17 | 0.17 ± 0.17 |
На рис. 1 представлены результаты тестирования сухих остатков гексан-эфирных экстрактов питьевой воды в опытах in vivo с помощью метафазного анализа хромосомных аберраций в костном мозге мышей в зависимости от содержания в нативных пробах воды продуктов ПОЛ липосом, определяемых тест-системой ПОЛ in vitro (см. табл. 1).
Рис. 1.
Результаты тестирования сухих остатков гексан-эфирных экстрактов питьевой воды в опытах in vivo с помощью метафазного анализа хромосомных аберраций в костном мозге мышей в зависимости от содержания в тех же пробах воды продуктов ПОЛ липосом (in vitro): 1 – общее количество аберраций хроматидного типа, 2 – количество фрагментов, 3 – количество обменов [1, 12].
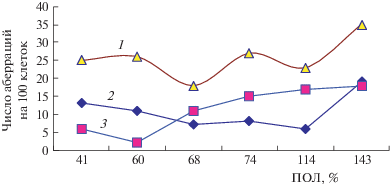
Из сравнения результатов анализа генотоксичности экстрактов питьевой воды в опытах in vitro и in vivo можно заключить, что даже на фоне относительно слабых эффектов мутагенной активности наблюдается качественная корреляция при использовании теста in vitro без метаболической активации и теста in vivo. Это означает, что даже незначительные по интенсивности эффекты генотоксичности, которые удается достоверно регистрировать в опытах in vitro, имеют вероятность проявить себя и на организменном уровне. Данный факт имеет большое значение, поскольку онкологические заболевания относятся к числу вероятностных событий.
Другим значащим фактом является то, что результаты биотестирования с помощью тест-реакции ПОЛ качественно коррелируют с частотой обменов в спектре хромосомных аберраций, индуцируемых нативными пробами воды в клетках китайского хомячка (КХ) [7] (рис. 2). Стационарность процессов ПОЛ в норме обеспечивается физико-химической системой регуляции окислительных реакций в липидах, параметрами которой являются АОА и состав липидов, способность их к окислению, структурные переходы в компонентах мембран. Влияние однократного введения per os масляных растворов исследуемых экстрактов на величины АОА и исходный уровень пероксидов в липидах эритроцитов крови мышей было изучено через 7 и 31 сут после начала эксперимента (рис. 3).
Рис. 2.
Динамика изменения содержания продуктов ПОЛ в плазме крови мышей после однократного введения экстрактов из проб питьевой воды поселков Мужитино (а) и Зикеево (б) разных концентраций относительно контроля: 1 – 10–5, 2 – 10–2, 3 – 1.0 мг.
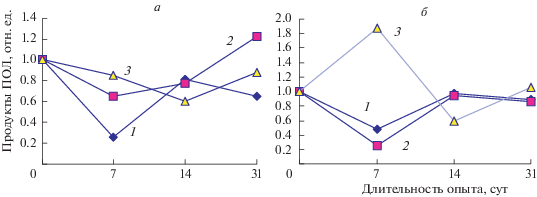
Рис. 3.
Величины АОА липидов эритроцитов крови контрольных мышей SHK (K) через 7 (1) и 31 сут (2) после введения гексан-эфирных экстрактов из проб воды поселков Зикеево и Мужитино.
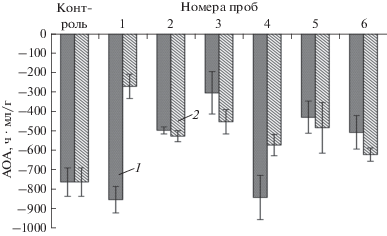
Анализ данных, представленных на рис. 3, показывает, что липиды эритроцитов крови контрольных мышей после однократного введения per os оливкового масла, как и лабораторных грызунов других видов [24], обладают прооксидантными свойствами, величина которых достоверно не изменяется в течение месяца после воздействия. Между величинами АОА липидов эритроцитов крови в опытных группах мышей и концентрацией экстракта и его состава отсутствует линейная зависимость. В пробах воды из пос. Зикеево через 31 сут после начала эксперимента установлено достоверное уменьшение в 2.8 раза прооксидазных свойств липидов эритроцитов крови в группе мышей, которым вводили экстракт в самой низкой дозе: 5.3 ∙ 10–5 мг/кг. Во всех остальных опытных группах величины АОА липидов практически не зависели от концентрации экстракта и его состава.
Аналогичные особенности обнаружены и для динамики изменения начального количества пероксидов в липидах эритроцитов крови. Эти показатели системы регуляции ПОЛ закономерно тесно связаны между собой, однако корреляционные зависимости между величинами АОА липидов и содержанием в них пероксидов спустя месяц после воздействия различаются [25].
Высокая чувствительность проницаемости мембран к окислительному повреждению [26] и повреждение оснований ДНК инициаторами ПОЛ [27, 28] обуславливают наличие взаимосвязи между константами скорости щелочной элюции ДНК лимфоцитов крови и/или содержанием внеклеточной ДНК в плазме крови мышей и интенсивностью процессов ПОЛ в плазме крови интактных мышей разных линий [17, 29]. Ранее было установлено существенное изменение масштаба и характера этих взаимосвязей при действии на организм слабых повреждающих факторов разной природы [17, 29, 30]. Изменение содержания внеклеточной ДНК в плазме крови относительно нормы и контроль этого показателя в динамике рассматриваются в качестве перспективного теста для оценки функционирования иммунных систем организма [30] и диагностического показателя при многих патологических состояниях [31].
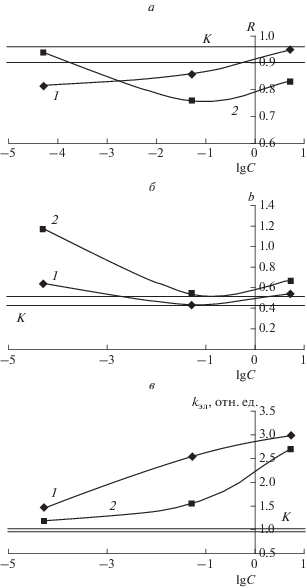
На рис. 4 представлено влияние экстрактов на коэффициенты корреляции и линейной регрессии между интенсивностью ПОЛ и содержанием внеклеточной ДНК в плазме крови, а также на относительные константы скорости щелочной элюции ДНК лимфоцитов крови мышей, отражающей суммарное повреждение оснований в молекуле ДНК, после однократного введения per os проб воды из поселков Мужитино и Зикеево. Обнаружена прямая корреляционная взаимосвязь между содержанием ДНК и количеством продуктов ПОЛ в плазме крови контрольных мышей с коэффициентом корреляции R = 0.93 ± 0.035 (n = 15) и коэффициентом линейной регрессии b = 0.47 ± ± 0.036 (рис. 4а, б). Между содержанием внеклеточной ДНК и интенсивностью ПОЛ четкая корреляция отсутствует. Константа скорости щелочной элюции ДНК лимфоцитов крови (рис. 4в) наиболее значительно увеличивается в группах мышей, которым вводили экстракт из проб воды с повышенным содержанием БП.
Рис. 4.
Влияние концентрации экстрактов на величины: а – коэффициентов корреляции (R); б – коэффициентов линейной регрессии взаимосвязи между содержанием внеклеточной ДНК и количеством ТБК-АП в плазме крови; в – относительной константы скорости щелочной элюции ДНК (kэл) лимфоцитов крови мышей линии SHK (самки) через месяц после однократного введения per os проб воды из поселка Мужитино (1) и Зикеево (2); K – доверительный интервал контрольных величин.
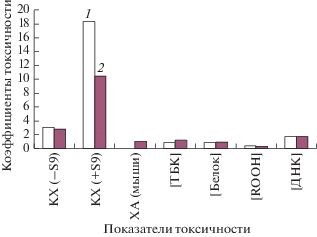
На рис. 5 приведены значения коэффициентов токсичности, полученные при тестировании экстрактов с помощью краткосрочного метода in vitro по частоте индуцированных аберраций хромосом в клетках КХ в отсутствие (–S) и в присутствии (+S) системы метаболической активации, результаты анализа частоты хромосомных аберраций (ХА) в клетках костного мозга подопытных животных, а также данные по воздействию экстрактов на показатели системы регуляции ПОЛ и содержание внеклеточной ДНК в плазме крови мышей в опытах in vivo. Видно, что методы биотестирования обладают высокой чувствительностью, что позволяет использовать их при оценке потенциальной опасности радиационно-химического загрязнения окружающей среды.
ЗАКЛЮЧЕНИЕ
Таким образом, совокупность полученных данных свидетельствует о потенциальной опасности для здоровья населения, проживающего на территориях Калужской области, наиболее подвергшихся радиационно-химическому загрязнению. Показано, что нарушение регуляции окислительных процессов взаимосвязано с возникновением мутаций, повреждением структуры ДНК при повышенном содержании БП в составе токсикантов и ростом содержания внеклеточной ДНК в плазме крови опытных мышей при повышенном содержании ПХБ. Однако отсутствие линейной зависимости уровня токсического воздействия от концентрации приоритетных токсикантов, в частности БП и ПХБ, обнаруженное на всех этапах работы, обуславливает необходимость использования биологических тест-систем для оценки состояния регуляторных клеточных процессов и влияния на метаболизм действия совокупности ЗВ, содержащихся в анализируемых пробах воды. Результаты цитотоксикологических исследований с использованием тестов in vitro и in vivo объективно отражают потенциальную мутагенную опасность состояния окружающей среды в населенных пунктах Калужской области, подверженных радиационному загрязнению долгоживущими радионуклидами после аварии на Чернобыльской АЭС в 1986 году.
Проведенный цикл исследований по использованию различных подходов к оценке последствий для населения долгосрочного воздействия химических и радиационных факторов низкой интенсивности показывает бесперспективность использования традиционных методов гидрохимического контроля (мониторинга) для оценки качества воды как источника питьевого водоснабжения и как среды обитания водных организмов. Высокая чувствительность интенсивности процессов ПОЛ in vivo к воздействию неблагоприятных экологических факторов разной природы в малых дозах позволяет предложить использовать содержание ТБКАП в плазме крови мышей в качестве информативного теста для интегральной оценки токсического воздействия окружающей среды на организм млекопитающих.
Высокую эффективность показали тесты in vitro с использованием как модельной тест-системы ПОЛ липосом, так и клеточных культур млекопитающих. Информативны также традиционные методы биотестирования, позволяющие охарактеризовать текущее состояние токсичности водной среды в отношении водных организмов и выявить источник (либо причину) токсического воздействия. В качестве экспресс-метода наиболее перспективным является краткосрочный метод ПОЛ in vitro.
Важнейшим результатом проведенных исследований, по мнению авторов, является вывод о том, что в действующей системе контроля качества водной среды и безопасности водных объектов, являющихся источниками питьевого водоснабжения, не учитывается вклад в токсичность, вносимый водорастворимыми веществами, обладающими выраженными восстановительными либо, напротив, окислительными свойствами. В первом случае “жертвами” становятся водные организмы с интенсивным водообменом с внешней средой, в частности личинки рыб на ранних стадиях развития, во втором – взрослые рыбы, жабродышащие водные животные и млекопитающие. В целом, при нарушении внутриводоемных окислительно-восстановительных процессов происходит деградация всей водной экосистемы, сопровождающаяся появлением в воде неизвестных ранее токсических факторов.
Работа выполнена в рамках Программы фундаментальных исследований ИХФ РАН № 46.15 государственного задания № 0082-2014-0005 (номер государственной регистрации ЦИТИС: АААА-А17-117091220076-4).
Список литературы
Руководство по краткосрочным тестам для выявления мутагенных и канцерогенных химических веществ. Сер. “Гигиенические критерии состояния окружающей среды”. Вып. 51. Женева: ВОЗ, 1989.
Скурлатов Ю.И., Штамм Е.В., Рощин А.В. и др. // Хим. физика. 2019. Т. 39. № 11. С. 16.
Панорама современной химии России. Химическая и биологическая кинетика. Новые горизонты. Т. 2. Биологическая кинетика. М.: Химия, 2005.
Семенова И.В., Эрнестова Л.С., Конев В.В., Рябченко Н.И. // Гигиена и санитария. 1997. № 1. С. 51.
Sies H. Oxidative Stress. London: Academic Press, 1985.
Burlakova Ye.B., Pal’mina N.P., Mal’tseva Ye.L. // Membrane Lipid Oxidation / Ed. Vigo-Pelfrey C. V.III. Boston: CRC Press, 1991. P. 209.
Valko M., Leibfritz D., Moncol J. et al. // Intern. J. Biochem. Cell Biol. 2007. V. 39. P. 44; https://doi.org/10.1016/j.biocel.2006.07.001
Штамм Е.В., Шишкина Л.Н. Козлова Н.Б и др. // Водоснабжение и санит. техника. 1997. Т. 16. № 10. С. 18.
Скурлатов Ю.И., Штамм Е.В., Рощин А.В. и др. // Хим. физика. 2019. Т. 38. № 11. С. 65.
Штамм Е.В., Скурлатов Ю.И., Рощин А.В. и др. // Хим. физика. 2020. Т. 39. № 2.
Ford C.E., Hamerton J.L. // Stain Technol. 1956. V. 31. № 6. P. 247; https://doi.org/10.3109/10520295609113814
Методические рекомендации “Метод учета хромосомных аберраций как биологический индикатор влияния факторов внешней среды на человека”. М.: Институт медицинской генетики АМН СССР, 1974.
Сычев А.Я., Травин С.О., Дука Г.Г., Скурлатов Ю.И. Каталитические реакции и охрана окружающей среды. Кишинев: Штиинца, 1983.
Стальная И.Д., Гаришвили Т.Г. // Современные методы в биохимии / Под ред. Ореховича В.Н. М.: Наука, 1977. С. 63.
РД 52.18. Методические указания. Методика определения биологической полноценности природных и сточных вод по реакции перекисного окисления липидов. М., 1991.
РД 52.18.682-2006. Методические указания. Определение токсичности вод и донных отложений. Методика выполнения измерений индекса токсичности методом биотестирования по реакции перекисного окисления липидов липосом. Н. Новгород: Вектор Тис, 2007.
Шишкина Л.Н., Смотряева М.А. // Биофизика. 2000. Т. 45. Вып. 5. С. 844.
Кейтс М. Техника липидологии. М.: Мир, 1975.
Бурлакова Е.Б., Алесенко А.В., Молочкина Е.М. и др. Биоантиоксиданты в лучевом поражении и злокачественном росте. М.: Наука, 1975.
Itzhaki R., Gill D.M. // Anal. Biochem. 1964. V. 9. P. 401; https://doi.org/10.1016/0003-2697(64)90200-3
Блюхтерова Н.В., Смотряева М.А., Круглякова К.Е. // Изв. РАН. Сер. биол. 1996. № 3. С. 276.
Kapuściński J., Skoczylas B. // Anal. Biochem. 1977. V. 83. № 1. P. 252; https://doi.org/10.1016/0003-2697(77)90533-4
Брин Э.Ф., Травин С.О. // Хим. физика. 1991. Т. 10. № 6. С. 830.
Урнышева В.В., Шишкина Л.Н. // Биофизика. 2003. Т. 48. Вып. 4. С. 747.
Шишкина Л.Н., Хрустова Н.В. // Биофизика. 2006. Т. 51. Вып. 2. С. 340.
Niki E., Yamamato Y., Takahashi M. et al. // J. Nutr. Sci. Vitaminol. 1988. V. 34. P. 507; https://doi.org/10.3177/jnsv.34.507
Auroma O.I., Halliwell B., Gajewski E., Dizdaroglu M. // J. Biol. Chem. 1989. V. 264. № 34. P. 20509.
Floyd R.A., Schneider J.E. // Membrane Lipid Oxidation / Ed. Vigo-Pelfrey C. V.III. Boston: CRC Press, 1991. P. 69.
Shishkina L.N., Klimovich M.A., Kozlov M.V., Smotryaeva M.A. // Chemical and Biochemical Kinetics. New Perspectives / Ed. Zaikov G. N.Y.: Nova Sci. Publ., 2011. P. 157.
Балева Л.С., Сипягина А.Е., Смотряева М.А. и др. // Изв. РАН. Сер. биол. 1995. № 6. С. 657.
Grill S., Rusterholz C., Zanetti-Dallenbach R. et al. // Reprod. Biol. Endocrinol. 2009. V. 7. P. 70; https://doi.org/10.1186/1477-7827-7-70
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика