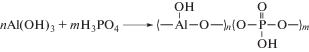Химическая физика, 2020, T. 39, № 3, стр. 66-70
Термопластичные поликомплексы металлофосфата и первичных аминов
Е. М. Нечволодова 1, Р. А. Сакович 1, А. В. Грачев 1, Л. А. Ткаченко 1, А. Ю. Шаулов 1, *
1 Институт химической физики им. Н.Н. Семёнова, Российской академии наук
Москва, Россия
* E-mail: ajushaulov@yandex.ru
Поступила в редакцию 13.02.2019
После доработки 15.05.2019
Принята к публикации 20.05.2019
Аннотация
Исследованы реакции олигомерного алюмоборофосфата с гексаметилендиамином и пентиламином и свойства полученных продуктов, которые представляют собой поликомплексы с участием водородных связей, что подтверждается результатами квантовохимических расчетов. Изменения релаксационных свойств поликомплексов определены по температурам размягчения и текучести, измеренным методом термомеханического анализа. Показано, что модификация полифосфатов первичными аминами в “мягких” условиях приводит к повышению водостойкости полученных поликомплексов.
ВВЕДЕНИЕ
Химически активные полиоксиды на основе металлофосфатов широко применяются для получения термостойких материалов. В абсолютном большинстве случаев для этого используются водные суспензии с дисперсными отвердителями и наполнителями [1, 2].
Вместе с тем металлофосфаты как олигомерные оксогидроксиды могут быть использованы в качестве неорганических термопластов для их дальнейшей поликонденсации и разработки новых материалов. Однако их получение связано с необходимостью регулирования процесса поликонденсации, молекулярной массы полимера и его устойчивости к воде.
Ранее была показана возможность эффективного регулирования глубины превращения гидроксидов бора за счет образования сильных донорно-акцепторных связей между гидроксильными группами и азотсодержащими соединениями п-фенилендиамином [3], имидазолом [4], а также алюмофосфата с анилином [5]. В настоящей работе рассмотрено влияние первичных органических аминов на свойства продуктов взаимодействия моно- и бифункционального первичных аминов с алюмофосфатом (АФС).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали 55%-ный водный раствор алюмоборофосфата (Al/P = 2) (Торговый дом ВЗХР, г. Воскресенск, Россия), гексаметилендиамин (ГМДA) марки “ч” (Acros, Бельгия), пентиламин с чистотой 98% (Acros, Бельгия). Термическую обработку образцов проводили при повышении температуры со скоростью 10 °С/мин с последующей выдержкой при заданном значении. Термомеханический анализ проведен на приборе Netzsch–TMA 402/2/G (Netzsch, Германия), для термогравиметрического анализа использовали прибор Netzsch-DSС STA 449 F3 Jupiter (Netzsch, Германия). Скорость изменения температуры составляла в обоих случаях 10 °С/мин. Влагопоглощение образцов определяли при Т = = 20 °С в течение 48 ч при 98%-ной влажности атмосферы.
Квантовохимические расчеты выполнены с помощью суперкомпьютерного комплекса МГУ им. М.В. Ломоносова методом теории функционала плотности DFT [6] с функционалом bh-lyp [7] при помощи квантовохимического пакета Turbomole [8]. Оптимизацию геометрии проводили в двойном-дзета базисе SVP [9], а для расчета энергий взаимодействия применяли абсолютные электронные энергии комплексов, рассчитанные в тройном-дзета базисе TZVP [10], при использовании которого ошибка вычисления энергии комплексообразования BSSE резко уменьшается и ею можно пренебречь [11]. Эффект растворителя в вычислениях не учитывался.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Использованный в работе металлофосфат является олигомерным продуктом взаимодействия гидроксида алюминия и фосфорной кислоты при соотношении Al/P = 1/2, полученным в соответствии с уравнением
В качестве второго компонента реакционной смеси были использованы пентиламин и гексаметилендиамин как моно- и бифункциональное соединения, содержащие аминогруппы, способные к взаимодействию с гидроксильными группами фосфата и образованию прочных водородных связей. По результатам квантовохимических вычислений определено, что для обоих аминов в качестве акцепторов электронов выступают –Р–ОН-группы, в то время как взаимодействие с Al–OH-группой значительно менее энергетически выгодно.
Очевидно, что при использовании монофункционального пентиламина следует ожидать модификации цепи алюмофосфата (АФС) боковой группой, тогда как в случае гексаметилендиамина физические сшивки должны сопровождаться образованием пространственно-сшитого поликомплекса с частичным образованием циклов. Логично предположить, что образование таких комплексов должно быть связано с изменением релаксационных свойств исходных соединений, а блокирование гидрофильных групп полигидроксида – с увеличением устойчивости к воде.
Изменение релаксационных свойств продуктов взаимодействия при различном содержании аминов определяли по температурам размягчения (Тразм) и текучести (Ттек) поликомплексов, измеренным термомеханическим методом (рис. 1а, б). Полученные данные отражают различные закономерности взаимодействия аминов с АФС. Экстремальные зависимости Тразм и Ттек от С ГМДА демонстрируют значительное увеличение Тразм и Ттек при увеличении концентрации амина до 15–25 мас.% и последующее уменьшение этих температур. Последнее может означать пластификацию поликомплекса избыточным количеством амина, не вступившего во взаимодействие с гидроксильными группами АФС, что сопровождается уменьшением Тразм и вязкости расплава и, как следствие, значения Ттек.
Рис. 1.
Зависимости температуры размягчения (а) и текучести (б) поликомплексов от концентрации аминов: 1 – ГМДА, 2 – пентиламин.
Иной характер зависимости наблюдается при использовании пентиламина – монотонный рост значений Тразм и Ттек во всем интервале соотношений компонентов. Стехиометрическое соотношение мономерных звеньев и молекул аминов, соответствующее полной реакции образования поликомплексов между гидроксильными и аминогруппами, можно определить по уравнению
где n1 и n2 – число мономерных звеньев АФС и молекул амина, m1 и m2 – массы АФС и амина, М1 и М2 – молекулярные массы мономерного звена АФС (а. е. = 232) и ГМДА (а. е. = 104).
Рассчитанное значение массового соотношения АФС/ГМДА, соответствующее n1/n2 = 1, составляет 1/0.22 или 18% от общей массы компонентов, что с большой точностью совпадает с концентрацией амина в области экстремума на рис. 1а, кривая 1. Полученный результат означает, что для образования пространственной сетки необходимы две аминогруппы, и на каждую гидроксильную группу в области экстремума приходится одна аминогруппа.
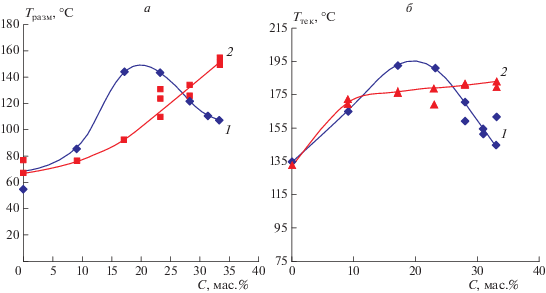
Блокирование гидроксильных групп алюмофосфата сопровождается увеличением его гидролитической устойчивости, растущей по мере увеличения содержания ГМДА и за пределами области экстремума. Это означает наличие, наряду с гидроксильными группами, других гидрофильных фрагментов, влияющих на устойчивость алюмофосфата к воде (рис. 2).
Рис. 2.
Зависимость влагопоглощения поликомплексов АФС/амин от концентрации С амина при выдержке в атмосфере с 98%-ной влажностью (20 °С, 48 ч): 1 – ГМДА, 2 – пентиламин.
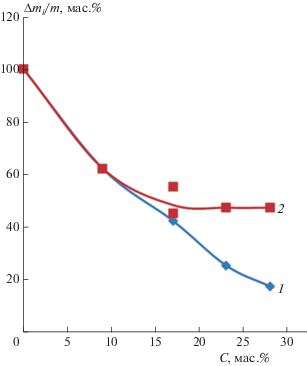
Интересно отметить характер концентрационной зависимости влагопоглощения для пентиламина, содержащего вдвое меньше аминогрупп. Эффективность влияния его при концентрациях амина вплоть до значений, соответствующих экстремальной области, аналогична действию ГМДА. Отсюда следует, что для увеличения устойчивости к воде, определяемой гидроксильными группами, достаточно блокирования половины их количества (рис. 2). Изучена температурная зависимость Тразм поликомплексов в интервале 50–180 °С, отражающая энергетический барьер перегруппировки гидратной оболочки цепочки алюмофосфата и образование водородных связей с амином (рис. 3).
Рис. 3.
Температуры размягчения поликомплексов АФС/ГМДА (80/20 мас.%), полученных в различных температурных условиях.
Проведено компьютерное моделирование структур комплексов, полученных при расчете оптимальной геометрии основного электронного состояния мономерного звена олигомерного алюмофосфата (Al/2P) (рис. 4а), молекулы гексаметилендиамина (рис. 4б), молекулы пентиламина (рис. 4в), а также бимолекулярных комплексов АФС/ГМДА (рис. 4г) и АФС/пентиламин (рис. 4д). В таких комплексах атомы азота аминов связываются с атомами водорода гидроксильных групп фосфата водородными связями длиной 0.157–0.170 нм.
Рис. 4.
Оптимальная структура основного состояния АФС (а), гексаметилендиамина (б), пентиламина (в), комплекса АФС/ГМДА (г), комплекса АФС/пентиламин (д).
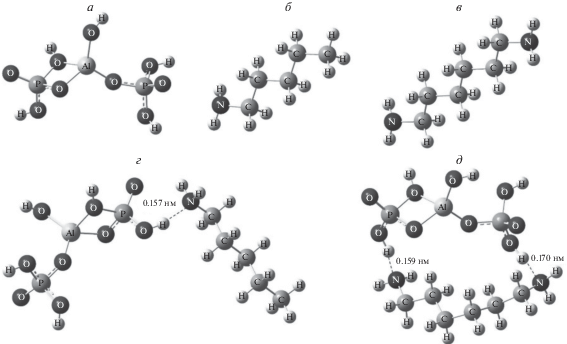
Для определения энергий водородных связей рассчитывали полную энергию всех пяти соединений в оптимальной геометрии и вычисляли суммарный выигрыш энергии комплексообразования как разность между энергией комплекса и составляющих его молекул. Для комплекса АФС/ГМДА выигрыш составил 29.8 ккал/моль, а для АФС/пентиламин – 16.2 ккал/моль. Таким образом, энергия одной водородной связи N∙∙∙H–O равна 14.9–16.2 ккал/моль.
На рис. 5 представлена полученная при квантовохимических расчетах структура комплекса из двух молекул АФС и молекулы ГМДА, отражающая процесс физической сшивки алюмофосфата, сопровождающийся увеличением температуры размягчения образовавшегося продукта. Учитывая, что поликомплексы могут проявлять термопластичные свойства, представлялось важным определить их термическую стабильность. Проведенные калориметрические и термогравиметрические измерения и сравнение с аналогичными измерениями исходного алюмофосфата позволяют выделить на основе статистических данных четыре температурные области термических превращений (рис. 6, табл. 1):
Рис. 5.
а – Структура комплекса, состоящего из двух мономеров АФС и молекулы ГМДА; б – схематическое изображение.
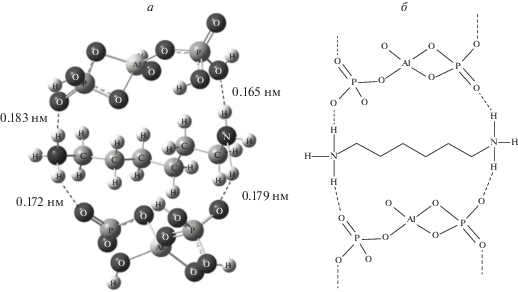
Рис. 6.
Термогравиметрические и калориметрические данные для АФС и поликомплекса АФС/20 мас.% ГМДА: 1 – потери массы АФС, 2 – потери массы поликомплекса, 3 – тепловые эффекты, сопровождающие нагревание поликомплекса.
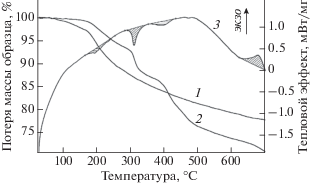
Таблица 1.
Термогравиметрические и калориметрические данные АФС и поликомплекса АФС/ГМДА, подвергнутых термической обработке (Т = 160 °С, 30 мин)
| Состав | I 50−270 °С |
II 270−340 °C |
III 350−420 °C |
IV 600−700 °C |
||||
|---|---|---|---|---|---|---|---|---|
| −Δm, мас.% |
−Q, Дж/г |
−Δm, мас.% |
−Q, Дж/г |
−Δm, мас.% |
−Q, Дж/г |
−Δm, мас.% |
+Q, Дж/г |
|
| АФС | 10.2 | 79.3 | 4.2 | − | 2.3 | − | 5.3 (420−700 °С) |
− |
| АФС/20% ГМДА | 5.0 | 19.1 | 6.5 | 43 | 5.0 | 22.8 | 12.5 | 53.7 |
I – 50–250 °С – потеря воды,
II – 270–340 °С – деструкция ГМДА, образование сопряженных структур,
III – 350–420 °С – циклизация и карбонизация продуктов деструкции,
IV – 600–700 °С – окисление карбонизованных продуктов деструкции.
В качестве примера приведены термогравиметрические и калориметрические данные АФС и поликомплекса АФС/20 мас.% ГМДА, полученных при Т = 160 °С, 30 мин (рис. 6). Суммарная потеря массы образцов АФС и АФС/20 мас.% ГМДА, подвергнутых термической обработке при 160 °С, 30 мин, при измерении в интервале Т = = 20−700 °С составляет 22 и 29% соответственно.
Ожидаемая суммарная потеря массы поликомплекса в случае полного удаления ГМДА согласно представленному составу составляет 23%, что заметно меньше измеренного значения 29%. О неполном удалении ГМДА в процессе нагревания свидетельствует также наличие коксового остатка. Возможным объяснением этого результата может служить высокая эффективность амина в процессе удаления воды из алюмофосфата при Т > 400 °C.
Работа выполнена в рамках госзадания Министерства науки и образования России (тема 45.11, 0082-2014-0009, № АААА-А17-117040610309-0).
Список литературы
Голынко-Вольфсон С.Л., Сычев М.М., Судакас Л.Г., Скобло Л.И. Химические основы технологии и применения фосфатных связок и покрытий. Л.: Химия, 1968.
Копейкин В.А., Петрова А.П., Рашкован И.Л. Материалы на основе металлофосфатов. М.: Химия, 1976.
Нечволодова Е.М., Сакович Р.А., Грачев А.В., Глаголев Н.Н., Мотякин М.В., Шаулов А.Ю., Берлин А.А. // Хим. физика. 2017. Т. 36. № 5. С. 82.
Нечволодова Е.М., Грачев А.В., Сакович Р.А., Владимиров Л.В., Шашкин Д.П., Ткаченко Л.А., Шаулов А.Ю., Берлин А.А. // Хим. физика. 2017. Т. 36. № 9. С. 66.
Шаулов А.Ю., Нечволодова Е.М., Сакович Р.А., Владимиров Л.В., Грачев А.В., Ткаченко Л.А. // Хим. физика. 2019. Т. 38. № 2. С. 66.
Gross E.K.U., Kohn W. // Adv. Quantum Chem. 1990. V. 21. P. 255.
Becke A.D. // J. Chem. Phys. 1993. V. 98. P. 1372.
Furche F., Ahlrichs R., Hattig C. et al. // Comput. Mol. Sci. 2014. V. 4. P. 91.
Weigend F., Ahlrichs R. // Phys. Chem. Chem. Phys. 2005. V. 7. P. 3297.
Mentel L.M., Baerends E.J. // J. Chem. Theory Comput. 2014. V. 10. № 1. P. 252.
Jastrzebski M., Sitarz M., Rokita M., Bulat K. // Spectrochim. Acta A. 2011. V. 49. № 4. P. 722.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика