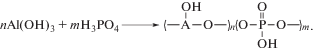Химическая физика, 2020, T. 39, № 5, стр. 78-83
Энергия внутримолекулярных взаимодействий и структура поликомплексов металлофосфатов с молекулами воды и азотсодержащими соединениями
Р. А. Сакович 1, *, А. Ю. Шаулов 1, Е. М. Нечволодова 1, Л. А. Ткаченко 1
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: ruslan.sakovich@gmail.com
Поступила в редакцию 15.04.2019
После доработки 19.05.2019
Принята к публикации 20.05.2019
Аннотация
При помощи квантовохимического метода DFT (density functional theory) рассчитаны энергии взаимодействия фрагментов цепей алюмоборофосфата с молекулами воды и азотосодержащими соединениями. Проанализированы конформационные изменения мономерных звеньев алюмофосфата и молекулярных комплексов в процессе образования водородных связей. Рассмотрен процесс комплексообразования алюмоборофосфата с различными азотсодержащими соединениями, приводящий к вытеснению воды с “поверхности” цепи, и рассчитаны тепловые эффекты образования комплексов. Измерено влагопоглощение смесей олигомерного алюмоборофосфата с аминами при различных соотношениях компонентов.
ВВЕДЕНИЕ
Металлофосфаты – водорастворимые олигомерные продукты химического взаимодействия гидроксида алюминия и фосфорной кислоты, полученные в соответствии с уравнением
Продукты поликонденсациии таких фосфатов обладают негорючестью, высокой термо- и теплостойкостью и находят широкое применение в металлургии, строительстве и при решении задач, связанных с получением высокотермостойких материалов [1–3]. Вместе с тем олигомерные металлофосфаты, обладающие активными гидроксильными группами, могут быть использованы для получения широкого круга неорганических и гибридных материалов различного назначения [4]. Необходимым условием получения таких материалов является удаление воды – не только “растворной”, но и окклюдированной на макромолекулах фосфатов. Первое достигается термической обработкой при температурах 100–150 °С, удаление же окклюдированной воды требует более высоких температур, достигающих 250–300 °С.
В работе рассмотрена возможность использования аминов, атомы азота которых образуют сильные донорно-акцепторные связи с полиоксидами, для ускорения процесса удаления воды, окклюдированной на макромолекулах фосфатов [5, 6]. Квантовохимическими методами были рассчитаны энергии взаимодействия фрагментов цепей фосфатов с молекулами воды в процессе гидратации, а также с азотосодержащими соединениями. Проведено компьютерное моделирование конформационных изменений мономерного звена алюмофосфата и полученных комплексов в процессе образования водородных связей, а также рассчитаны тепловые эффекты, сопровождающие вытеснение воды с “поверхности” цепи.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Квантовохимические расчеты выполнены методом DFT [7] (density functional theory) с функционалом bh-lyp [8] при помощи квантово-химического пакета Turbomole с использованием ресурсов суперкомпьютерного комплекса МГУ им. М.В. Ломоносова [9]. Оптимизация геометрического строения проводилась в двойном-дзета-базисе SVP [10], для расчета энергий взаимодействия использовали абсолютные электронные энергии комплексов, рассчитанные в тройном-дзета-базисе TZVP [11]. В качестве модельной системы использовали металлофосфат ([Al]/[P] = 3) и 55%-ный водный раствор алюмоборофосфата аналогичного состава (Торговый дом ВЗХР, г. Воскресенск, Россия). Влагопоглощение определяли при выдержке образцов в атмосфере с 98%-ной влажностью при комнатной температуре в течение 48 ч.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Построение сольватной оболочки алюмофосфата
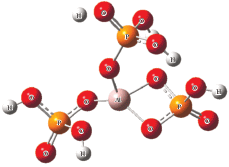
С целью определения энергетического влияния аминов на процессы окклюзии воды на “поверхности” металлофосфата в процессе моделирования построена гидратная оболочка вокруг изолированного мономерного звена олигомерного алюмофосфата (АФС) Al/3P (рис. 1 ) и рассчитано изменение энергии системы при добавлении аминов. Предварительно для изолированной молекулы АФС в вакууме найдена оптимальная геометрическая конфигурация основного электронного состояния, а затем при последовательном добавлении к системе по одной молекуле воды оптимизирована геометрическая структура мономерного звена комплекса до полного заполнения первой сольватной оболочки алюмофосфата, что соответствует концентрации алюмофосфата в воде, равной 59 мас.%.
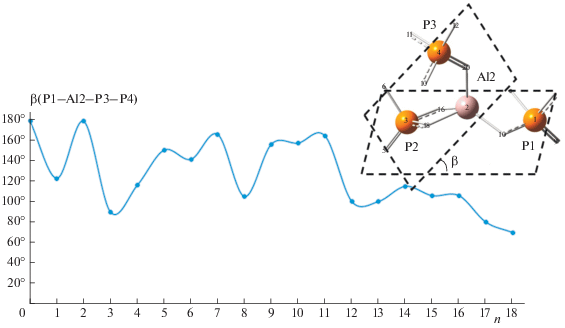
Структура комплекса алюмофосфата с 18 молекулами воды показана на рис. 2 . В данном комплексе три молекулы воды образуют координационные связи с атомом алюминия, в то время как взаимодействие остальных молекул воды с алюмофосфатом сопровождается образованием водородных связей атомов водорода и кислорода гидроксильной группы воды с фосфатной группой: H–O–H…O=P и Н2–O…H–O–P.
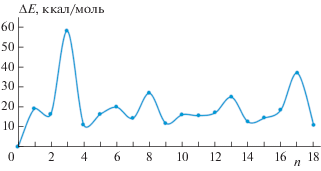
Для каждого из полученных комплексов рассчитывали полную энергию комплекса и определяли ее убыль по мере введения в систему молекулы воды:
По мере насыщения сольватной оболочки первые три молекулы воды образовывали координационную связь с атомами алюминия с энергиями 58, 27 и 25 ккал/моль при n = 3, 8 и 13 соответственно. Остальные же молекулы воды на каждом шаге итерации образовывали, как правило, по две новых водородных связи с кислородом и водородом фосфатных групп с суммарными энергиями в диапазоне от 11 до 20 ккал/моль.
Детальный анализ геометрического строения комплексов позволил разделить водородные связи на четыре типа:
– кислород молекулы воды образует водородную связь с алюминием. Такой тип связи реализуется при n = 1 и 5;
– водород молекулы воды образует связь с кислородом одной фосфатной группы, а кислород молекулы воды образует связь с водородом другой фосфатной группы. Этот тип комплексов реализуется при n = 2 и 9;
– водород и кислород образуют связь соответственно с кислородом и водородом одной и той же фосфатной группы, что наблюдается только при n = 10;
– во всех остальных случаях одна водородная связь образуется с фосфатной группой, а вторая – с молекулой воды.
Средняя суммарная энергия взаимодействия молекулы воды с АФС составила 20 ккал/моль.
На рис. 4 изображена геометрическая структура комплексов для n = 2 и 3. Видно, что при n = 2 молекула воды, выделенная овалом, образует водородную связь с алюминием длиной 0.207 нм, а при n = 3 происходит перенос протона с молекулы воды на алюмофосфат и образуется более прочная связь длиной 0.174 нм.
Вероятно, в представленной модели молекула воды может образовывать такую связь с алюминием только при n = 3 из-за конформационных особенностей алюмофосфата. Так, при n = 1 две связи Al–O–P лежат практически в одной плоскости, а третья связь перпендикулярна им. Однако при добавлении молекул воды происходит сближение гидроксильных групп фосфора друг с другом, в результате чего становится возможным перенос протона и, как следствие, образование связи.
Для того чтобы проследить за изменениями конформации алюмофосфата при образовании комплексов, исследована зависимость величины двугранного угла β(P1–Al2–P3–P4) от количества молекул воды (рис. 5 ). Как видно, минимумы на графике точно совпадают с первыми тремя максимумами на графике рис. 3 . Отсюда можно заключить, что при уменьшении величины двугранного угла β до 100° становится возможным эффективное образование координационной связи молекулы воды с алюминием. Как следствие, согласно нашей модели сольватация при n = 3, 8 и 13 сопровождается образованием дополнительной химической связи, после чего координационное число алюминия становится равным шести и происходит насыщение. Из рис. 5 также следует планомерное уменьшение угла β при увеличении количества молекул воды в окружении АФС.
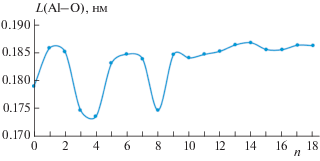
Происходящие структурные изменения при образовании координационной связи молекул воды с алюминием может проиллюстрировать зависимость длины связи Al–O от n, представленная на рис. 6 . Образование координационных связей с первыми двумя молекулами воды при n = 3 и 8 приводит к резкому сокращению длины связи Al–O на 6.7%, возвращающейся затем к нормальному значению. Следует отметить отсутствие зависимости длины связи Р–ОН– от числа молекул воды окружения: ее величина колеблется в пределах от 0.155 до 0.161 нм.
Взаимодействие алюмофосфата с азотосодержащими соединениями
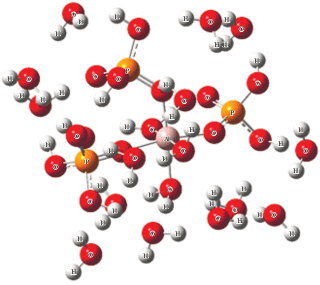
После построения сольватной оболочки АФС было исследовано ее взаимодействие с азотсодержащими соединениями (анилин, диаминопропан, п-фенилендиамин, имидазол, пиперидин, пиримидин, пиридин, уротропин) в вакууме и в водной среде. На рис. 7 приведены структуры комплексов, соответствующие минимумам на поверхности потенциальной энергии бимолекулярных соединений АФС с аминами в вакууме, и указаны длины (в нм) возникающих межмолекулярных водородных связей.
Рис. 7.
Оптимальная геометрическая структура бимолекулярных комплексов АФС в вакууме с анилином (а), уротропином (б), п-фенилендиамином (в), пиримидином (г), пиридином (д), диаминопропаном (е), имидазолом (ж), гексиламином (з), гексаметилендиамином (и).
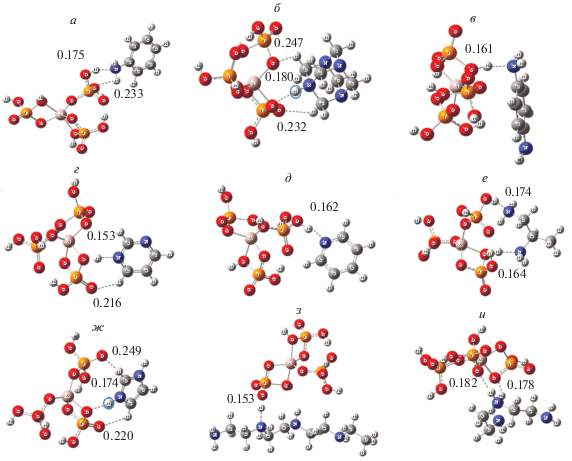
В табл. 1 представлены энергетические и геометрические характеристики связей, образовавшихся в результате взаимодействия АФС с аминами. Наибольшие суммарные энергии образовавшихся связей имеют уротропин, имидазол и полиэтиленполиамин благодаря образованию сразу двух или трех водородных связей и переносу протона с АФС на амин. Кроме того, полиэтиленполиамин – единственный амин, “точкой контакта” которого является кислород, связанный с атомом алюминия. Для всех остальных аминов наиболее выгодным является образование водородных связей с фосфатными группами АФС. В данном случае точный расчет длины каждой отдельной связи представляет крайне трудоемкую задачу, однако можно заключить, что связи –Р–ОН…N– АФС с аминами имеют длину 0.15–0.18 нм и энергию взаимодействия 13–17 ккал/моль. Связи же –Р–О…H– имеют длину 0.21–0.25 нм и энергию 3–5 ккал/моль.
Таблица 1.
Энергия и длина водородных связей, образовавшихся в результате взаимодействия АФС с аминами в вакууме
| Амин | Длина связей, нм | Суммарная энергия образовавшихся связей, ккал/моль | “Контактные” точки |
|---|---|---|---|
| Анилин | 0.175 0.233 |
16.3 | –Р–ОН…N– –Р=О…H– |
| Уротропин | 0.180 0.232 0.247 перенос протона |
33.4 | –Р–ОН…N– –Р=О…Н– –Р=О…Н– |
| п-ФДА | 0.161 | 15.7 | –Р–ОН…N– |
| Пиримидин | 0.153 0.216 |
16.7 | –Р–ОН…N– –Р=О…Н– |
| Пиридин | 0.162 | 13.0 | –Р–ОН…N– |
| Имидазол | 0.174 0.220 0.249 перенос протона |
31.6 | –Р–ОH…N– –Р=О…Н– –Р=О…Н– |
| Диаминопропан | 0.174 0.164 |
26.1 | –Р–ОН…N– –Р–ОН…N– |
| Тетраэтилентетрамин | 0.153 | 13.6 | –Р–ОН…N– |
| Полиэтиленполиамин | 0.182 0.178 перенос протона |
35.0 | –Al–О…H-N– –Al–О…H-N– |
При добавлении аминов к АФС в водном окружении амин вытесняет несколько молекул воды с поверхности цепи, что сопровождается значительной перестройкой водной оболочки и выигрышем в энергии (табл. 2). Очевидно, что блокирование гидрофильных групп алюмофосфата должно приводить к большей его устойчивости к воде, что было проверено в экспериментах по влагопоглощению полученных образцов. С этой целью образцы водных растворов АФС с различными аминами были подвергнуты термической обработке при Т = 130 °С в течение 1.5 ч (скорость подъема температуры до заданной величины составляла 5 °/мин), после чего их помещали в эксикатор с 98%-ной влажностью (Т = 20 °С, 48 ч).
Таблица 2.
Выигрыш энергии при введении амина в водную оболочку АФС
| Амин | Полный выигрыш энергии при добавлении амина, ккал/моль |
|---|---|
| Анилин | 9.6 |
| Уротропин | 19.1 |
| п-ФДА | 21.1 |
| Пиримидин | 12.7 |
| Пиридин | 18.1 |
| Имидазол | 10.6 |
| Диаминопропан | 11.2 |
| Тетраэтилентетрамин | 17.7 |
| Полиэтиленполиамин | 27.8 |
Полученные данные отражают снижение влагопоглощения с повышением концентрации амина, при этом наибольший эффект наблюдается при использовании первичных аминов тетраэтилентетрамина и полиэтиленполиамина (рис. 8). Как видно из табл. 2 уменьшение влагопоглощения хорошо коррелирует с выигрышем в энергии при взаимодействии с азотсодержащими соединениями, что свидетельствует в пользу взаимосвязи этих двух параметров.
Рис. 8.
Влагопоглощение поликомплексов алюмоборофосфата с аминами, полученных при Т = 130 °С в течение 1.5 ч: 1 – анилин, 2 – дициандиамид, 3 – имидазол, 4 – тетраэтилентетрамин, 5 – полиэтиленполиамин.
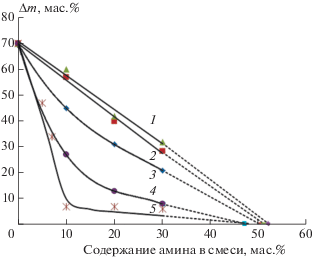
Полученные данные позволяют оценить соотношение мономерных звеньев алюмоборофосфата (a.е.м. = 281) и молекул наиболее эффективных аминов – тетраэтилентетрамина H2N–(CH2)4–NH2 (a.е.м. = 116) и полиэтиленполиамина (HN–CH2–CH2)n–(N–CH2–CH2–NH2)–)m (a.е.м. = 98) для случая минимального влагопоглощении. В соответствии с расчетом мольное соотношение мономерное звено АФС/амин больше единицы, что отражает недостаток содержания амина для полного исключения влагопоглощения. Аналогичный вывод верен и для других аминов. Массовое соотношение АФС/амин при нулевом поглощении влаги, полученное экстраполяцией кривых зависимости влагопоглощения от состава поликомплексов, составляет ~50/50.
Работа выполнена в рамках госзадания Министерства образования и науки России (тема 45.11, 0082-2014-0009, № АААА-А17-117040610309-0).
Список литературы
Голынко–Вольфсон С.Л., Сычев М.М., Судакас Л.Г., Скобло Л.И. Химические основы технологии и применения фосфатных связок и покрытий. Л.: Химия, 1968.
Копейкин В.А., Петрова А.П., Рашкован И.Л. Материалы на основе металлофосфатов. М.: Химия, 1976.
Копейкин В.А., Клементьева B.C., Красный Б.Л. Огнеупорные растворы на фосфатных связующих. М: Металлургия, 1986.
Шаулов А.Ю. Дис. … д-ра хим. наук. М.: ИХФ РАН, 2014.
Нечволодова Е.М., Сакович Р.А., Грачев А.В., Глаголев Н.Н., Мотякин М.В., Шаулов А.Ю., Берлин А.А. // Хим. физика. 2017. Т. 36. № 5. С. 82.
Нечволодова Е.М., Грачев А.В., Сакович Р.А., Владимиров Л.В., Шашкин Д.П., Ткаченко Л.А., Шаулов А.Ю., Берлин А.А. // Хим. физика. 2017. Т. 36. № 9. С. 66.
Gross E.K.U., Kohn W. // Adv. Quantum Chem. 1990. V. 21. P. 255.
Becke A.D. // J. Chem. Phys. 1993. V. 98. P. 1372.
Furche F., Ahlrichs R., Hattig C., Klopper W., Sierka M., Weigend F. // Comput. Mol. Sci. 2014. V. 4. P. 91.
Weigend F., Ahlrichs R. // Phys. Chem. Chem. Phys. 2005. V. 7. P. 3297.
Mentel L.M., Baerends E.J. // J. Chem. Theory Comput. 2014. V. 10. № 1. P. 252.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика