Химическая физика, 2020, T. 39, № 6, стр. 47-51
Исследование фототоксических свойств ретиналя и его производных в фоторецепторной клетке методом импульсного фотолиза
Г. Р. Каламкаров 1, *, Т. Ф. Шевченко 1, П. В. Аболтин 1, Т. С. Константинова 1, П. П. Левин 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: kalam2@rambler.ru
Поступила в редакцию 23.10.2019
После доработки 23.10.2019
Принята к публикации 20.11.2019
Аннотация
Предполагается, что одна из причин фотоповреждения сетчатки глаза – накопление в зрительных клетках полностью-транс-ретиналя. Однако полностью-транс-ретиналь в процессе фотолиза образуется внутри диска фоторецепторной клетки и переносится в цитоплазму клетки, где с высоким выходом преобразуется в ретинол – нефототоксическое соединение. Внутри диска, где полностью-транс-ретиналь может накапливаться, он может образовывать с аминогруппами белков и липидов шиффовы основания, которые также не являются фототоксическими соединениями. Кроме того, образующиеся свободные изомеры ретиналя связываются со специфическими ретинальсвязывающими белками, которые могут экранировать их от кислорода. Таким образом, вопрос о том, в каких концентрациях свободный полностью-транс-ретиналь может накапливаться внутри клетки, не ясен. В данной работе предложено оценивать концентрацию свободного полностью-транс-ретиналя в клетке по выходу возбужденного триплетного состояния, поскольку ни шиффовы основания полностью-транс-ретиналя, ни ретинол в возбужденное триплетное состояние не переходят. Показано, что в равновесном состоянии в нативной клетке 70% полностью-транс-ретиналя образуют шиффовы основания. Это существенно снижает вероятность того, что именно полностью-транс-ретиналь является основным индуктором фотоповреждения. Кроме того, показано, что квантовый выход реакции образования возбужденного триплетного состояния ретиналя при его связывании с межфоторецепторными белками существенно снижается.
ВВЕДЕНИЕ
Ретиналь (R) является хромофором светочувствительного белка сетчатки глаза родопсина. Первичным процессом, запускающим фототрансдукцию – каскад реакций преобразования света зрительной клеткой в сенсорный сигнал – является фотоизомеризация R из 11-цис-конфигурации в полностью-транс-конфигурацию [1]. В ходе этих реакций полностью-транс-ретиналь (all-trans-retinal (ATR)) отделяется от белка, транспортируется в пигментный эпителий (ПЭ), где ферментативным путем преобразуется в 11-цис-конфигурацию и переносится обратно в фоторецепторную клетку [2].
Перенос ретиналя осуществляется системой ретинальсвязывающих белков, которые сходны по своей структуре с сывороточным альбумином и обеспечивают перенос R в водной фазе (в цитоплазме клетки), а также его прохождение через клеточные мембраны. Перенос от родопсина в ПЭ происходит в форме ретинола, а из ПЭ к родопсину – в форме ретиналя [3]. Поскольку R и его производные являются гидрофобными соединениями, они локализованы либо в белках, либо в липидном бислое фоторецепторной мембраны, где возможно образование конъюгатов R, способных фотогенерировать активные формы кислорода [4–6].
То обстоятельство, что в сетчатке до 5% ретиналя находится в несвязанной с родопсином форме, является, как предполагается, одной из причин фотоповреждения структур сетчатки и пигментного эпителия, приводящего к развитию ряда патологий [5]. Одним из наиболее ярких примеров таких патологий является болезнь Штаргардта – заболевание, при котором в сетчатке из-за генетических дефектов образуется фототоксический конъюгат ретиналя – А2Е, который и считается причиной дегенеративных изменений [6].
Основными механизмами фототоксического действия ретиналя и его конъюгатов являются генерация под действием света активных форм кислорода (АФК) и последующее окисление белков и липидов клетки. Однако при количественной оценке возможной концентрации свободного ретиналя эти представления сталкиваются с рядом трудностей. Концентрация родопсина благодаря плотной упаковке дисков в наружном сегменте фоторецептора составляет порядка 3 ммоль/л [7], а по другим данным – 3.8 ммоль/л [8], и поэтому формально при интенсивном освещении, приводящем к полному обесцвечиванию родопсина, в фоторецепторной клетке могло бы образовываться до 4 ммоль/л ATR. Под обесцвечиванием в биологической литературе понимается изменение окраски родопсина (λmax = = 500 нм) при освещении, приводящем к распаду последнего на белок опсин и хромофор ATR (λmax = = 380 нм). Ясно, что при такой огромной концентрации, несмотря на невысокий квантовый выход генерации АФК, ATR оказывал бы катастрофическое повреждающее действие. В нативной клетке этого не происходит из-за высокой активности ретинолдегидрогеназы – фермента, катализирующего переход ATR в полностью-транс-ретинол [9]. Именно высокая активность фермента есть причина того, что даже при очень высоких освещенностях значительные количества R не удается обнаружить в фоторецепторной клетке. Однако восстановление R в ретинол происходит в цитоплазме клетки, а высвобождается он во внутридисковое пространство, откуда транспортируется в цитоплазму. Во внутридисковом пространстве ATR образует шиффовы основания с аминогруппами, прежде всего с аминогруппами фосфатидилэтаноламина (ФЭА), концентрация которого в фоторецепторе составляет 10 ммоль/л [10]. Как известно, шиффовы основания ATR не образуют триплетного состояния, и поэтому не являются активными генераторами АФК. Таким образом, свободный полностью-транс-ретиналь может находиться только во внутридисковом пространстве и при этом – в равновесии с шиффовыми основаниями с аминогруппами белков и липидов.
В связи с этим мы поставили задачу определить, какая часть ATR во внутридисковом пространстве образует шиффовы основания и не обладает фототоксическими свойствами. Поскольку шиффовы основания не образуют триплетов, по концентрации возбужденного триплетного состояния ретиналя (3ATR) можно определить константы равновесия шиффовых оснований как в липосомах из ФЭА, так и в нативных, содержащих родопсин, фоторецепторных мембранах (ФРМ).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для того чтобы более точно определить локализацию ретиналя, методом лазерного фотолиза [11, 12] проведено исследование спектрально-кинетических характеристик 3ATR в разбавленных водных растворах межрецепторного ретинальпереносящего белка (МРПБ) и липосом из фосфатидилхолина (ФХ). Методы приготовления образцов МРПБ белка и липосом описаны в работе [13].
Импульсное фотовозбуждение ATR в растворах липосом из ФХ (8 ∙ 10–3 моль/л ФХ) приводит за время лазерной вспышки к образованию 3ATR, характеризующегося известным спектром поглощения с λmax около 470 нм (рис. 1, спектр 1) [12, 14–16]. Квантовый выход 3ATR в растворах липосом из ФХ примерно в 5 раз ниже, чем в растворах метанола. Такой же результат был получен ранее для липосом из кардиолипина, что свидетельствует о том, что ATR находится в полярном молекулярном окружении [12, 14–16].
Рис. 1.
Дифференциальные спектры поглощения промежуточных продуктов, полученные при лазерном фотолизе обескислороженных растворов ATR (10–5 моль/л) в присутствии липосом из фосфатидилхолина (8 ∙ 10–3 моль/л ФХ) через 0.5 (1) и 100 мкс (2).
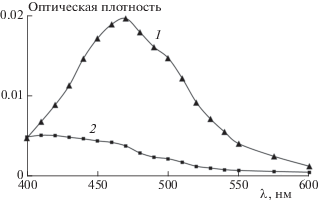
Кинетика гибели 3ATR как в обескислороженном, так и в воздушнонасыщенном растворе липосом из ФХ при низкой начальной концентрации 3ATR описывается уравнением первого порядка. Полученное значение константы скорости тушения 3ATR молекулярным кислородом близко к аналогичному значению, полученному ранее в 100%-ном метаноле и водной суспензии липосом из кардиолипина, и существенно выше, чем в водном растворе [12]. Высокое значение этой константы в липосомах обусловлено высокой концентрацией О2 в липидном бислое (выше, чем в водном объеме) и его высокой латеральной подвижностью [17].
Фотолиз ATR в водном растворе МРПБ приводит к образованию 3ATR (λmax около 460 нм) с низким квантовым выходом (примерно в 2 раза ниже, чем в липосомах из ФХ). В присутствии МРПБ происходит, с одной стороны, ускорение, а с другой – замедление гибели 3ATR в обескислороженных растворах. Аппроксимация кинетических кривых по двухэкспоненциальному закону дает их “быструю” и “медленную” компоненты приблизительно с одинаковыми вкладами и различающимися в 10 раз значениями константы скорости [13]. Двухэкспоненциальный характер кинетики указывает на наличие по меньшей мере двух центров связывания ретиналя, что для МРПБ выявлено ранее другими методами [18].
При переходе к воздушнонасыщенным растворам наблюдается ускорение “быстрой” компоненты и возрастание ее вклада [13]. Константа скорости гибели “медленной” компоненты практически не изменяется. Низкие наблюдаемые величины константы скорости тушения 3ATR молекулярным кислородом свидетельствуют о том, что в белковых растворах 3ATR защищен от кислорода, причем в МРПБ – заметно сильнее, чем в сывороточном альбумине [12]. Аналогичные эффекты наблюдались ранее при связывании с альбуминами триплетных состояний других органических молекул [19–22]. В качестве возможных причин обсуждается низкая локальная концентрация и/или подвижность растворенного кислорода в местах локализации триплетных состояний, а также стерические факторы [17, 19–23].
Введение в белковые растворы липосом приводит к резкому ускорению гибели 3ATR в воздушнонасыщенных растворах. Кинетика гибели 3ATR описывается в этом случае одноэкспоненциальной зависимостью с константой скорости, близкой к значению константы скорости гибели 3ATR в растворах липосом в отсутствие белков. Однако в обескислороженных растворах кинетика гибели 3ATR остается двухэкспоненциальной. По мере увеличения концентрации ФХ “быстрая” компонента замедляется (рис. 2), а ее вклад возрастает. Константа скорости “медленной” компоненты при этом практически не изменяется. Таким образом, ATR остается локализованным в белках и в присутствии липосом. Только при большой концентрации ФХ (≥5 мМ, что соответствует мольному соотношению ФХ/белок = 500) кинетика гибели 3ATR совпадает с кинетикой гибели 3ATR в липосомах.
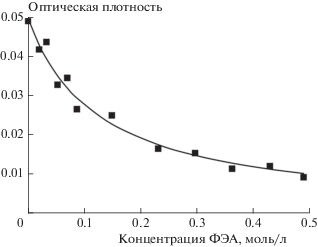
Рис. 2.
Зависимость интенсивности поглощения 3ATR при 470 нм, зарегистрированная через 20 нс после лазерного импульса в присутствии л-ФХ (4 ∙ 10–3 моль/л ФХ), от концентрации ФЭА в системе.
В целом можно сделать вывод о том, что ретиналь при наличии в системе достаточного количества ретинальпереносящих белков (как альбумина, так и специфического МРПБ из сетчатки глаза) будет переходить из липидного бислоя в белковые “карманы”. Существенная защита ретиналя от молекулярного кислорода при его связывании с белками значительно снижает вероятность образования под действием света АФК и, таким образом, оказывает существенное протекторное действие, защищающее клеточные компоненты от вредного действия света.
Целью дальнейших экспериментов была попытка выяснить, какое максимальное количество свободного АТR может образовываться в нативной фоторецепторной клетке с учетом того, что значительная его часть будет образовывать шиффовы основания с аминогруппами белков и липидов как снаружи, так и внутри фоторецепторного диска. С этой целью регистрировалась относительная концентрация возникающего под действием света 3ATR, которая пропорциональна концентрации свободного ретиналя в системе, где АТR и шиффовы основания находятся в равновесии.
В экспериментах использовали два типа липидов – ФХ, не содержащий аминогруппы, и ФЭА, содержащий одну аминогруппу. В первой серии экспериментов к суспензии липосом из ФХ (л-ФХ) добавляли суспензию липосом из ФЭА. Введение в раствор ФЭА приводит к уменьшению наблюдаемого выхода 3ATR, но не влияет на кинетику его гибели. Фосфатидилэтаноламин формирует шиффово основание с ATR, которое не образует триплетное состояние при прямом фотолизе. Соответствующая концентрационная зависимость (рис. 1) указывает на существование равновесия
Зависимость на рис. 1 хорошо описывается соответствующим выражением:
(2)
${{\left[ {^{3}{\text{ATR}}} \right]}_{{{\text{набл}}}}} = {{{{{\left[ {^{3}{\text{ATR}}} \right]}}_{0}}} \mathord{\left/ {\vphantom {{{{{\left[ {^{3}{\text{ATR}}} \right]}}_{0}}} {\left( {1 + K\left[ {{\text{ФЭА}}} \right]} \right)}}} \right. \kern-0em} {\left( {1 + K\left[ {{\text{ФЭА}}} \right]} \right)}},$где [3ATR]набл – наблюдаемая начальная концентрация 3ATR в присутствии ФЭА, [3ATR]0 – начальная концентрация 3ATR, наблюдавшаяся в отсутствие ФЭА, а K = 8.0 (мольн. доля)–1 – константа равновесия. Выражение (2) получается при соответствующем рассмотрении кинетической схемы (1) при условии [ATR] $ \ll $ [ФЭА], которое хорошо выполняется в данных экспериментальных условиях.
В следующей серии экспериментов использовали суспензию ФРМ, выделенных из зрительных клеток и засвеченных до полного распада комплекса опсина с 11-цис-ретиналем (рис. 3). Фотолиз такого образца приводит к образованию 3ATR, спектрально-кинетические характеристики которого практически полностью совпадают с аналогичными параметрами л-ФХ (рис. 1).
Рис. 3.
Дифференциальные спектры поглощения промежуточных продуктов, полученные при лазерном фотолизе растворов ATR (10–5 моль/л) в присутствии л-ФХ (4 ∙ 10–3 моль/л ФХ) и в ФРМ через 0.02 и 5 мкс после лазерного импульса: 1 – дифференциальный спектр поглощения ATR в л-ФХ через 0.02 мкс; 2 – дифференциальный спектр поглощения ATR в ФРМ через 0.02 мкс; 3 – дифференциальный спектр поглощения ATR в л-ФХ через 5 мкс; 4 – дифференциальный спектр поглощения ATR в ФРМ через 5 мкс.
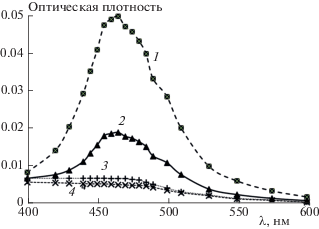
Однако квантовый выход 3ATR в фоторецепторных мембранах составляет только 30% от соответствующего выхода, получающегося при фотолизе ATR, добавленного в раствор л-ФХ в эквимолярном количестве. Таким образом, на основании полученных данных можно сделать вывод, что при полном обесцвечивании родопсина 70% ATR образует шиффовы основания и не генерирует АФК.
Важно отметить, что определить константы равновесия процесса перехода ATR в шиффовы основания можно было бы по сдвигу максимума поглощения, однако в нативной фоторецепторной мембране, содержащей родопсин, это сделать невозможно из-за наличия долгоживущих продуктов фотолиза родопсина, максимум поглощения которых отличается от аналогичной характеристики ATR из-за его локализации в “белковых карманах” родопсина. Поэтому можно полагать, что определение равновесия по квантовому выходу 3ATR является более адекватным методом. Использование метода исследования кинетики тушения возбужденных триплетных состояний для изучения нативной биологической системы оказалось крайне плодотворным. Такой подход применялся только к химическим или модельным биологическим системам [24–27].
ЗАКЛЮЧЕНИЕ
Фоторецепторные клетки сетчатки позвоночных работают в условиях высокого содержания кислорода. Относительный объем водной фазы фоторецепторной клетки очень мал, практически весь объем клетки занимают фоторецепторные диски, представляющие собой замкнутые мембранные образования с крайне высоким содержанием ненасыщенных жирных кислот, а концентрация кислорода в липидной фазе существенно выше, чем в воде. Более 90% фоторецепторных клеток сетчатки человека в силу ее эволюционного развития составляют палочки – клетки, которые должны работать при крайне низкой освещенности, а находятся в условиях, когда освещенность много выше. При высоких освещенностях в ходе фотолиза родопсина свободный полностью-транс-ретиналь образуется в значительных количествах, а он является фототоксическим соединением, которое генерирует активные формы кислорода с высоким квантовым выходом. При рассмотрении возможных механизмов повреждения фоторецепторных клеток одним из ключевых является вопрос о том, как долго АТR может оставаться в свободном состоянии.
В данной работе путем измерения квантового выхода возбужденного триплетного состояния АТR в нативных фоторецепторных дисках нам удалось показать, что, хотя в зрительной клетке при высокой освещенности образуется АТR, он либо образует с аминогруппами белков и липидов шиффовы основания, которые не являются фототоксичными, либо связан с ретинальпереносящими белками, которые экранируют его от кислорода и существенно снижают квантовый выход активных форм кислорода.
Список литературы
Filipek S., Stenkamp R.E., Teller D.C., Palczewski K. // Annu. Rev. Physiol. 2003. V. 65. P. 851.
Strauss O. // Physiol. Rev. 2005. V. 85. № 3. P. 845.
Noy N. // Biochem. J. 2000. V. 348. P. 438.
Rozanowska M., Jarvis-Evans J., Korytowsky V.V. et al. // J. Biol. Chem. 1995. V. 270. P. 18825.
Maeda A., Maeda T., Golczak M. et al. // J. Biol. Chem. 2009. V. 284. P. 15173.
Sparrow J.R., Wu Y., Kim C.Y., Zhou J. // J. Lipid Res. 2010. V. 51. P. 247.
Lamb T.D., Pugh E.N., Jr. // Prog. Retin. Eye Res. 2004. V. 23. № 3. P. 307.
Rozanowska M., Sarna T. // J. Photochem. Photobiol. 2005. V. 81. № 6. P. 1305.
Palczewski K., Jager S., Buczylko J. et al. // Biochem. 1994. V.33. P.13741.
Fliesler S.J., Anderson R.E. // Prog. Lipid Res. 1983. V. 22. № 2. P. 79.
Левин П.П., Татиколов А.С., Панова И.Г., Сультимова Н.Б. // Химия высоких энергий. 2010. Т. 44. № 3. С. 244.
Левин П.П., Аболтин П.В., Шевченко Т.Ф., Каламкаров Г.Р. // Химия высоких энергий. 2010. Т. 44. № 6. С. 555.
Левин П.П., Аболтин П.В., Константинова Т.С., Шевченко Т.Ф., Каламкаров Г.Р // Химия высоких энергий. 2013. Т. 47. № 3. С. 191.
Бенсассон Р., Лэнд Э., Траскот Т. Флеш-фотолиз и импульсный радиолиз. Применение в биохимии и медицинской химии. М.: Мир, 1987.
Becker R.S. // Photochem. Photobiol. 1988. V. 48. P. 369.
Harper W.S., Gaillard E.R. // Photochem. Photobiol. 2001. V. 73. P. 71.
Abuin E.B., Lissi E.A. // Prog. React. Kinet. 1991. V. 16. P. 1.
Chen Y., Noy N. // Biochemistry. 1994. V. 33. № 35. P. 10658.
Borissevitch I.E., Tominaga T.T., Schmitt C.C. // J. Photochem. Photobiol., A. 1998. V. 114. P. 201.
Lang K., Wagnerova D.M., Engst P., Kubat P. // Intern. J. Res. Phys. Chem. Chem. Phys. 1994. V. 187. P. 213.
Qu X., Komatsu T., Sato T. et al. // Bioconjugate Chem. 2008. V. 19. P. 1556.
Alarcon E., Edwards A.M., Aspee A., Borsarelli C.D., Lissi E.A. // Photochem. Photobiol. Sci. 2009. V. 8. P. 933.
Boch R., Mohtat N., Lear Y. et al. // Photochem. Photobiol. 1996. V. 64. P. 92.
Лобанов А.В., Дмитриева Г.С., Сультимова Н.Б., Левин П.П. // Хим. физика. 2014. Т. 33. № 5. С. 15.
Мардалейшвили И.Р., Левин П.П., Иванов В.Б. // Хим. физика. 2009. Т. 28. № 7. С. 34.
Куценова А.В., Кутыркин В.А., Левин П.П. // Хим. физика. 1989. Т. 8. С. 1388.
Куценова А.В., Сультимова Н.Б., Левин П.П. // Хим. физика. 2010. Т. 29. № 9. С. 65.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


