Химическая физика, 2020, T. 39, № 6, стр. 87-92
Исследование супрамолекулярных структур методом атомно-силовой микроскопии
Л. И. Матиенко 1, *, Е. М. Миль 1, В. И. Бинюков 1
1 Институт биохимической физики им. Н.М. Эмануэля, Российской академии наук
Москва, Россия
* E-mail: matienko@sky.chph.ras.ru
Поступила в редакцию 23.10.2019
После доработки 23.10.2019
Принята к публикации 20.11.2019
Аннотация
Предложен новый подход к изучению методом АСМ супрамолекулярных комплексов и возможной роли водородных связей при образовании наноструктур металлокомплексов, моделирующих активные центры ферментов. Образование таких структур происходит за счет нековалентных межмолекулярных взаимодействий и в определенной степени отражает строение комплексов, участвующих в механизмах реакций гомогенного и ферментативного катализа.
ВВЕДЕНИЕ
Атомно-силовая микроскопия (АСМ) стала широко используемым методом для характеристики различных свойств биологических, органических и неорганических материалов, связанных с поверхностью [1]. Метод АСМ способствовал развитию нанотехнологии как дисциплины и до сих пор регулярно используется для изучения наноматериалов, таких как углеродные нанотрубки и графен.
Супрамолекулярная химия на поверхности − это область исследований, доля которых значительно выросла за последние годы. В недавних исследованиях была разработана концепция использования супрамолекулярных взаимодействий, включая координационные, галогеновые и водородные связи, для управления молекулярной организацией на поверхностях [2].
Механизм катализа часто включает в себя образование супрамолекулярных структур за счет водородных связей в процессе каталитической реакции. Супрамолекулярные структуры открывают весьма перспективное направление анализа нековалентных взаимодействий [3].
Нами предложен новый подход к изучению методом АСМ супрамолекулярных комплексов и роли водородных связей при образовании супрамолекулярных структур на основе металлокомплексов, являющихся катализаторами процессов окисления и моделями активных центров ферментов, а также к изучению структурных изменений клеток. В настоящем сообщении коротко представлены результаты АСМ-исследований авторов, полученные за последние 7 лет.
В АСМ-исследованиях использовали атомно-силовой микроскоп SOLVER P47/SMENA/ с кремниевым кантиливером NSG11S (NT MDT), радиусом кривизны 10 нм, высотой наконечника 10–15 мкм и углом конуса ≤22°; в режиме записи на пленку была использована резонансная частота в 150 кГц. Топографические изображения объектов получены в режиме “tapping mode” [4]. С целью изучения возможности связывания с поверхностью и дальнейшего роста за счет межмолекулярных H-связей супрамолекулярных структур на основе гетеролигандных комплексов никеля и железа была использована гидрофобная химически модифицированная кремниевая поверхность в качестве субстрата.
Образование супрамолекулярных структур на поверхности обусловлено балансом между взаимодействиями молекул с поверхностью и межмолекулярными взаимодействиями [5]. Если межмолекулярных связей нет или они слабы, то роста стабильных структур практически не происходит. Разработаны методы фиксации на поверхности за счет H-связей и количественной оценки размерных параметров растительных митохондрий и эритроцитов. Получены топографические изображения объектов в режиме “tapping mode”.
РОЛЬ СУПРАМОЛЕКУЛЯРНЫХ СТРУКТУР В МЕХАНИЗМАХ КАТАЛИЗА ГЕТЕРОЛИГАНДНЫМИ КОМПЛЕКСАМИ НИКЕЛЯ РЕАКЦИЙ ОКИСЛЕНИЯ АЛКИЛАРЕНОВ МОЛЕКУЛЯРНЫМ КИСЛОРОДОМ
Проблема снижения активности гомогенного катализатора в ходе реакции окисления углеводородов молекулярным кислородом – одна из основных проблем катализа, так как функционирование катализатора всегда сопровождается процессами его дезактивации [5]. Метод модификации металлокомплексных катализаторов, направленный на повышение селективности и степени конверсии окисления алкиларенов в соответствующие гидропероксиды, впервые предложенный Л.И. Матиенко [5], заключается во введении дополнительных моно- или мультидентатных модифицирующих лигандов L2 в каталитические комплексы ${\text{ML}}_{n}^{{\text{1}}},$ где M = NiII, FeII, III, L1 = acac–, enamac–. Исследован механизм действия L2 и разработаны новые эффективные катализаторы селективного окисления этилбензола в α-фенилэтил гидропероксид (ФЭГ). Механизм катализа заключается в формировании in situ первичных комплексов ${{\left( {{{{\text{M}}}^{{{\text{II}}}}}{\text{L}}_{{\text{2}}}^{{\text{1}}}} \right)}_{x}}{{\left( {{{{\text{L}}}^{{\text{2}}}}} \right)}_{y}}$ и образовании эффективных гетеролигандных комплексов ${\text{M}}_{x}^{{{\text{II}}}}{\text{L}}_{y}^{{\text{1}}}{{\left( {{\text{L}}_{{ox}}^{{\text{1}}}} \right)}_{z}}{{({{{\text{L}}}^{{\text{2}}}})}_{n}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{m}},$ которые являются промежуточными продуктами окисления комплексов ${{\left( {{{{\text{M}}}^{{{\text{II}}}}}{\text{L}}_{{\text{2}}}^{{\text{1}}}} \right)}_{x}}{{({{{\text{L}}}^{{\text{2}}}})}_{y}}$ кислородом в ходе процесса окисления этилбензола [5]. Наиболее эффективными каталитическими системами селективного окисления этилбензола в ФЭГ молекулярным кислородом являются трехкомпонентные системы {Ni(acac)2 + L2 + PhOH} (L2 = = NMP (N-метил-2-пирролидон), HMPA, MSt; M = Na, Li)1)1) [5, 6]. Эти системы включают в себя фенол в качестве третьего компонента. Образование комплексов Ni(acac)2 ∙ L2 ∙ PhOH доказано кинетически. Тройные системы не окисляются молекулярным кислородом и очень стабильны в ходе процесса окисления этилбензола.
Мы предположили, что высокая эффективность катализаторов ${\text{N}}{{{\text{i}}}_{x}}{\text{L}}_{y}^{{\text{1}}}{{\left( {{\text{L}}_{{ox}}^{{\text{1}}}} \right)}_{z}}{{({{{\text{L}}}^{{\text{2}}}})}_{n}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{m}}$ (L1 = = acac−, ${\text{L}}_{{ox}}^{{\text{1}}}$ = CH3COO−) и Ni(acac)2 ∙ L2 ∙ PhOH в процессе селективного окисления RH в ФЭГ могла быть связана с образованием устойчивых супрамолекулярных структур за счет межмолекулярных водородных связей и, возможно, других нековалентных взаимодействий [5]. Действительно, методом АСМ зарегистрирована самоорганизация супрамолекулярных структур на основе Ni2(acac)(OAc)3 ∙ NMP ∙ 2H2O (${\text{N}}{{{\text{i}}}_{x}}{\text{L}}_{y}^{{\text{1}}}{{\left( {{\text{L}}_{{ox}}^{{\text{1}}}} \right)}_{z}}{{({{{\text{L}}}^{{\text{2}}}})}_{n}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{m}},$ L2 = NMP), а также тройных комплексов Ni(acac)2 ∙ L2 ∙ PhOH (L2 = NMP, HMPA, MSt; M = Na, Li) в очень стабильные супрамолекулярные структуры (с максимальной высотой h частиц − до 100 нм). Полученные АСМ-данные указывают на высокую вероятность образования стабильных супрамолекулярных структур на основе гетеролигандных комплексов никеля Ni2(acac)(OAc)3 ∙ NMP ∙ 2H2O и Ni(acac)2 ∙ ∙ L2 ∙ PhOH за счет межмолекулярных H-связей и, возможно, других нековалентных взаимодействий в реальных условиях каталитического окисления [4, 7].
ПРЕДПОЛАГАЕМАЯ РОЛЬ СУПРАМОЛЕКУЛЯРНЫХ СТРУКТУР В МЕХАНИЗМАХ ДЕЙСТВИЯ ФЕРМЕНТОВ НА ОСНОВЕ АСМ-ДАННЫХ
Ранее мы установили механизм окислительной трансформации комплексов никеля и железа, активированных добавками электронодонорных лигандов $\left( {{{{\left( {{{{\text{M}}}^{{{\text{II}}}}}{\text{L}}_{{\text{2}}}^{{\text{1}}}} \right)}}_{x}}{{{({{{\text{L}}}^{{\text{2}}}})}}_{y}}} \right)$ в процессе окисления этилбензола молекулярным O2 [5]. Маршруты превращений комплексов различны, но приводят к образованию аналогичных гетеролигандных комплексов: ${\text{M}}_{x}^{{{\text{II}}}}{\text{L}}_{y}^{{\text{1}}}{{\left( {{\text{L}}_{{ox}}^{{\text{1}}}} \right)}_{z}}{{({{{\text{L}}}^{{\text{2}}}})}_{n}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{m}}$ (${\text{L}}_{{ox}}^{{\text{1}}}$ = OAc−). В случае M = Ni присоединение O2 по γ-С-атому одного из (acac)– лигандов приводит к разрыву образующейся циклической конфигурации с образованием хелатного иона ${\text{L}}_{{ox}}^{{\text{1}}}$ = (OAc)–, ацетальдегида и элиминированием CO (через Criegee перегруппировку) по аналогии с механизмом действия Ni-ARD – ациредуктон диоксигеназы [8] или Cu- и Fe-содержащих кверцетин-2,3-диоксигеназ [8, 9]. Гипотетический механизм трансформации комплекса железа в результате присоединения O2 по γ-С-атому (acac)–-лиганда включает в себя образование интермедиата, содержащего 1,2-диоксетановый фрагмент, с последующим его распадом на хелатный (OAc)– лиганд и метилглиоксаль без образования CO [9] по аналогии с действием Fe-ациредуктон диоксигеназы (Fe-ARD) и Fe-ацетилацетон диоксигеназы (Dke 1) [8, 9].
Ациредуктон-диоксигеназы Ni(Fe)-ARD являются ферментами, участвующими в универсальном процессе превращения серосодержащих метаболитов в метионин (methionine salvage pathway (MSP)). Оба фермента Ni(Fe)-ARD являются членами структурного суперсемейства, известного как “cupins” (купины), включающего Dke 1 и цистеин диоксигеназу. Семейство купинов использует три лиганда гистидина (His), а также один или два атома кислорода из воды и кислорода карбоксилатной группы (Glu) для связывания с Fe(Ni)-центром [8, 9]. В зависимости от природы иона металла в активном месте ферменты различаются структурой и механизмом действия в отношении общих субстратов (1,2-дигидрокси-3-оксо-5 (метилтио) пент-1-ен (β-дикетон ациредуктон) и молекулярный кислород) [8]. По аналогии с действием Dke1 фермент Fe-ARD катализирует присоединение O2 к ациредуктону с образованием формиата и 2-кето-4-(тиометил) бутирата, предшественника метионина. Фермент Ni-ARD катализирует трансформацию, не приводящую к образованию метионина. В результате этой реакции образуется CO, являющийся нейротрансмиттером, который идентифирован в качестве антиапоптозной молекулы у млекопитающих [8].
Поскольку комплексы ${{\left( {{{{\text{M}}}^{{{\text{II}},{\text{III}}}}}{\text{L}}_{n}^{{\text{1}}}} \right)}_{x}} \cdot {{\left( {{{{\text{L}}}^{{\text{2}}}}} \right)}_{y}},$ ${\text{M}}_{x}^{{{\text{II}}}}{\text{L}}_{y}^{{\text{1}}}{{\left( {{\text{L}}_{{ox}}^{{\text{1}}}} \right)}_{z}}{{({{{\text{L}}}^{{\text{2}}}})}_{n}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{m}}$ (M = Ni, Fe), Ni(acac)2 ∙ L2 ∙ · PhOH являются структурными и функциональными моделями активных центров Ni(Fe)-ARD, результаты АСМ-исследований могут быть полезными при объяснении механизма действия этих ферментов. Образование многомерных форм может быть одним из возможных способов регулирования активности ферментов Ni(Fe)-ARD в цикле MSP. Так, с формированием стабильных структур, подобных Ni2(acac)(OAc)3 ∙ NMP ∙ 2H2O [4], может быть связано снижение активности Ni-ARD в цикле MSP. Мы впервые высказали предположение о том, что, рассматривая механизм действия ферментов Ni(Fe)-ARD, необходимо принимать во внимание роль их второй координационной сферы, включающей фрагмент тирозин (Tyr). Например, участие Tyr-фрагмента предполагалось в действии Homoprotocatechuate 2,3-диоксигеназы [7].
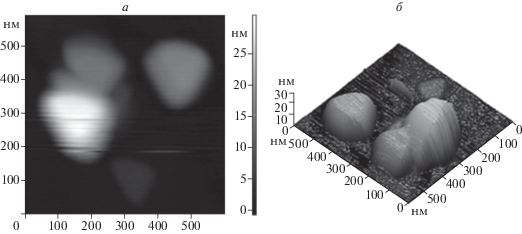
Образованием стабильных супрамолекулярных структур за счет H-связей на основе модельных комплексов {Ni(acac)2 ∙ L2 ∙ L3} (L2 = NMP, HMPA, L3 = PhOH), и {Ni(acac)2 ∙ L2 ∙ Tyr} (L2 = = NMP, (His)), можно объяснить снижение активности Ni-ARD и регуляторную роль Tyr- и His-фрагментов (рис. 1) [7, 10]. Данные УФ-спектроскопии свидетельствуют о внутри- и внешнесферной координации экстралигандов Tyr и His с Ni(acac)2 [10].
Рис. 1.
а − Трехмерное АСМ-изображение наноструктур (h = 40 нм) на основе тройных систем {Ni(acac)2 + His + Tyr} (His = L-гистидин, Tyr = L-тирозин); б − диаграмма средних значений объемов частиц на основе бинарных (1) {Ni(acac)2 + His} и тройных (2) систем {Ni(acac)2 + His + Tyr} (на диаграмме – 95%-ный доверительный интервал); в − эмпирическое и теоретическое кумулятивное логнормальное распределение объемов частиц на основе системы {Ni(acac)2 + His + Tyr}.
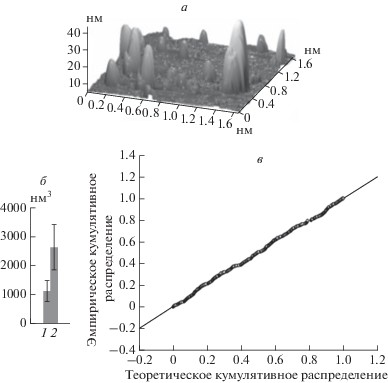
В случае катализа Fe-ARD самоорганизация комплексов железа в супрамолекулярные структуры может благоприятствовать реакциям, приводящим к образованию метионина. Методом АСМ нами установлена самоорганизация за счет H-связей комплексов ${\text{Fe}}_{x}^{{{\text{III}}}}$(acac)y18C6m(H2O)n и ${\text{Fe}}_{x}^{{{\text{III}}}}$(acac)y (His)m(Tyr)n(H2O)p, моделирующих активный центр Fe-ARD, в супрамолекулярные структуры, напоминающие по форме трубочки белка тубулина (рис. 2) [10]. Бинарные системы {Fe(acac)3 + His} в отсутствие L-тирозина образуют менее четкие структуры, характеризующиеся меньшей стабильностью.
Рис. 2.
а – Трехмерное АСМ-изображение наноструктур (h = 4 нм) на основе комплексов ${\text{Fe}}_{x}^{{{\text{III}}}}$(acac)y18C6m(H2O)n; б – структура клеточных микротрубочек; в и г – двух- и трехмерное изображение наноструктур (h = 5 нм) на основе тройных комплексов ${\text{Fe}}_{x}^{{{\text{III}}}}$(acac)y(His)m(Tyr)n(H2O)p (His = L-гистидин, Tyr = L-тирозин).
Мы предположили, что механизм действия Fe-ARD включает в себя стадию активации кислорода FeII + O2 → FeIII–${\text{O}}_{{\text{2}}}^{{ - \,\centerdot }}$ по аналогии с механизмом, предполагаемым для Dke1 [9]. Образование структур, подобных трубочкам тубулина, как это происходит, например, в случае формирования модельных комплексов ${\text{Fe}}_{x}^{{{\text{III}}}}$(acac)y18C6m(H2O)n и ${\text{Fe}}_{x}^{{{\text{III}}}}$(acac)y(His)m(Tyr)n(H2O)p (рис. 2), может способствовать активации O2, региоселективному присоединению активированного O2 к ациредуктон лиганду и последующим реакциям, ведущим к образованию метионина.
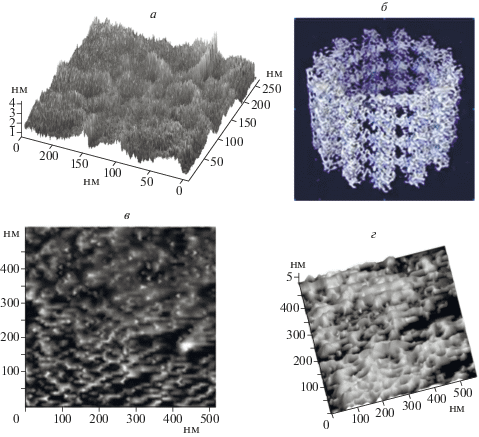
Н-связывание в случае порфиринов − это тип связи, который обычно наблюдается в природе. Одним из наиболее простых искусственных типов самоорганизующихся супрамолекулярных порфириновых систем является димер, образующийся на основе функциональной группы карбоновой кислоты [11]. Согласно литературным данным о регуляторной роли Tyr-фрагмента в функционировании ферментов (гемовых белков) семейства P450 [12], возможно формирование наноструктур на модифицированной кремниевой поверхности за счет H-связей на основе модельных тройных систем, включающих Tyr-фрагмент. Мы действительно наблюдали самоорганизацию модельных систем {Hem + Tyr + His} (Hem = гемин) в стабильные наноструктуры (рис. 3, h = 20–30 нм). Интересно, что самоорганизация двойных систем {Hem + Tyr} и {Hem + His} на модифицированной кремниевой поверхности не наблюдается.
ИССЛЕДОВАНИЕ СТРУКТУРНЫХ ИЗМЕНЕНИЙ КЛЕТОК МЕТОДОМ АСМ
С помощью метода АСМ обнаружено увеличение размеров митохондрий (способное привести к программированной клеточной смерти − апоптозу) при стрессовых воздействиях холодом (14 °С) и недостаточном увлажнении, которые предотвращались действием антиоксидантов и стимуляторами роста растений. Методом АСМ обнаружены изменения функционального состояния эритроцитов мыши, при гликолитическом голодании и в процессе опухолевого роста при трансплантации клеток карциномы Льюис. Прослежено изменение морфологии эритроцитов при введении мышам in vivo водных растворов антиоксидантов, синтезированных в ИБХФ РАН, таких как фенозан калия, ИХФАН-10 и анфен натрия, в большом диапазоне их концентраций. Актуальность таких исследований связана с тем, что фенозан калия введен в медицинскую практику как противосудорожный препарат, в то время как анфен натрия, как показано нами, является перспектиным противоопухолевым препаратом, вызывающим апоптоз по митохондриальному пути, воздействуя на белки семейства Bcl-2 [13–15].
ЗАКЛЮЧЕНИЕ
Предложен новый подход − метод АСМ для изучения возможности образования супрамолекулярных структур, а также роли межмолекулярных водородных связей (и других нековаленных взаимодействий) в механизмах реакций гомогенного и ферментативного катализа гетеролигандными комплексами никеля и железа. Факт образования на поверхности супрамолекулярных структур, полученных на основе комплексов никеля и железа за счет межмолекулярных водородных связей и, возможно, других нековалентных взаимодействий, свидетельствует о высокой вероятности образования подобных структур в реальных условиях каталитического окисления. Полученные АСМ-данные для комплексов никеля и железа, моделирующих активные центры ферментов, могут приблизить нас к пониманию механизмов действия ферментов Ni(Fe)-ARD, в частности роли Tyr- и His-фрагментов в синтезе метионина и CO, а также в функционировании ферментов семейства P450. Разработаны методические подходы атомно-силовой микроскопии для изучения структурных изменений клеток.
Часть работы, касающаяся АСМ-исследования роли супрамолекулярных структур в механизмах ферментативного катализа, получила финансовую поддержку РАН 14П (номер НИОКТР: АААА-А17-117121920169-0).
Список литературы
Atomic Force Microscopy for materials. Microscopy EKB Series Editor: Dr Julian Heath Spectroscopy and Separations EKB Series / Ed. Taylor N. The Atrium, Southern Gate, Chichester, West Sussex: John Wiley & Sons Ltd., PO19 8SQ, UK, 2017.
Slater A.G., Perdigão L.M.A., Beton P.H. et al. // Acc. Chem. Res. 2014. V. 47. № 12. P. 3417.
Biedermann F., Schneider H.-J. // Chem. Rev. 2016. V. 116. № 9. P. 5216.
Matienko L.I., Binyukov V.I., Mosolova L.A. et al. // Chem. and Chem. Tech. 2014. V. 8. № 3. P. 339.
Matienko L.I., Mosolova L.A., Zaikov G.E. Selective Catalytic Hydrocarbons Oxidation. New Perspectives, New York: Nova Science Publ. Inc. USA, 2010.
Matienko L.I., Binyukov V.I., Mosolova L.A. // Oxid. Commun. 2014. V. 37. № 1. P. 20.
Matienko L.I., Binyukov V.I., Mosolova L.A. et al. // Oxid. Commun. 2017. V. 40. № 2. P. 569.
Deshpande A.R., Pochapsky T.C., Ringe D. // Chem. Rev. 2017. V. 117. № 15. P. 10474.
Leitgeb St., Straganz G.D., Nidetzky B. // Fed. Europen Biochem. Soc. J. 2009. V. 276. № 20. P. 5983.
Matienko L.I., Binyukov V.I., Mil E.M. et al. // Oxid. Commun. 2018. V. 41. № 3. P. 429.
Beletskaya I.P., Tyurin V.S., Tsivadze A.Yu. et al. // Chem. Rev. 2009. V. 109. № 5. P. 1659.
Basom E.J., Manifold B.A., Thielges M.C. // Biochemistry. 2017. V. 56. № 25. P. 3248.
Бинюков В.И., Миль Е.М., Жигачева И.В. и др. // Докл. РАН. 2012. Т. 446. № 2. С. 222.
Миль Е.М., Бинюков В.И., Жигачева И.В. и др. // Вестн. Казанск. технол. ун-та. 2013. № 3. С. 141.
Mil E.M., Erokhin V.N. // Bull. Exp. Biol. and Med. 2018. V.164. № 5. P. 673; https://doi.org/10.1007/s10517-018-4056-3
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика