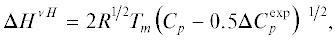Химическая физика, 2020, T. 39, № 6, стр. 63-70
Структурные и термодинамические характеристики крахмалов картофеля в зависимости от генотипа растений и условий их культивирования
Л. А. Вассерман 1, 2, *, А. В. Кривандин 1, А. Г. Филатова 2, В. Г. Васильев 3, О. О. Колачевская 4, В. Ф. Тарасов 2, И. Г. Плащина 1, Г. А. Романов 4
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Федеральный исследовательский центр химической физики
им. Н.Н. Семенова Российской академии наук
Москва, Россия
3 Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
Москва, Россия
4 Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: lwasserma@mail.ru
Поступила в редакцию 23.10.2019
После доработки 23.10.2019
Принята к публикации 20.11.2019
Аннотация
Создание новых высокопродуктивных форм картофеля методами генной инженерии ставит вопрос о качестве трансгенных клубней, что в первую очередь относится к свойствам такого важного запасного соединения, как крахмал. В статье приведены результаты исследований, посвященных анализу морфологии, структуры и термодинамических параметров крахмалов, экстрагированных из клубней картофеля, экспрессирующего ген tms1 биосинтеза ауксина из Agrobacterium tumefaciens и отличающегося повышенной продуктивностью в условиях in vitro. Трансформированные и контрольные растения культивировали в условиях in vitro на искусственной стерильной среде, а также in vivo в почве. В работе использованы методы сканирующей электронной микроскопии, широкоуглового рентгеновского рассеяния и дифференциальной сканирующей микрокалориметрии. Установлено, что трансформация растений конструкцией с геном tms1 под контролем клубнеспецифичного промотора гена пататина вызывает существенные изменения ряда термодинамических параметров крахмала, в первую очередь – увеличение толщины кристаллической ламели и температуры плавления, что, по всей видимости, отражает повышение упорядоченности строения основной фракции крахмала (около 90%) в клубнях этих трансформантов. Наряду с этим установлен эффект накопления в составе крахмалов фракции с менее упорядоченной структурой, коррелирующий с эктопической экспрессией гена tms1 биосинтеза ауксина. При этом В-тип полиморфной структуры крахмала сохраняется неизменным. Однако выявленные изменения затрагивают главным образом крахмал растений, культивируемых in vitro. Крахмал трансгенных растений, выращенных в почве, по своим основным характеристикам мало отличается от крахмала нетрансгенных контрольных растений.
ВВЕДЕНИЕ
Крахмал – это наиболее распространенный в природе запасной полисахарид растений, состоящий из двух типов полисахаридов: амилозы и амилопектина. Особенности строения и соотношение амилозы и амилопектина в крахмалах определяют их общую структуру, физико-химические и функциональные свойства. Крахмалы разного ботанического происхождения и их модификаты широко применяются в различных областях промышленности как загустители, стабилизирующие и гелеобразующие агенты для производства продуктов пищевого и фармацевтического назначения, а также в качестве составляющих новых композиционных и биоразлагаемых материалов [1–5].
Одним из наиболее коммерчески значимых источников крахмала являются клубни картофеля (Solanum tuberosum L.) – важнейшей пищевой, кормовой и технической культуры. Крахмал играет важную физиологическую роль в жизненном цикле клубня картофеля. Он активно накапливается в растущем клубне, служит долговременным хранилищем углеводов в период покоя и ремобилизуется в ходе прорастания [6]. Метаболизм крахмала в клубнях картофеля был и остается предметом многочисленных исследований, посвященных установлению регулирующих механизмов и типов ферментов, участвующих в процессах прорастания и клубнеобразования [7]. Молекулярные механизмы, лежащие в основе клубнеобразования этого растения, процессы эндогенной регуляции его роста и развития еще далеки от полного понимания. В частности, остаются вопросы, касающиеся особенностей структуры и функций крахмала в ходе онтогенеза клубней.
Клубнеобразование картофеля регулируется многими внешними и внутренними факторами. Среди последних существенную роль играют фитогормоны [8], определяющие особенности протекания морфогенеза растений и их устойчивость к неблагоприятным факторам внешней среды. Возможность управления данными процессами открывает перспективы создания более продуктивных и устойчивых сортов. Для этого необходимо знание основ действия фитогормонов на молекулярном и клеточном уровнях и, в частности, важно понимание особенностей их воздействия на свойства ценных запасных отложений в клубнях, в первую очередь крахмала. Один из подходов к изучению клубнеобразования – использование культивируемых in vitro растений картофеля. Преимуществом клубнеобразования in vitro является синхронное и более быстрое реагирование растений на стандартизованные условия эксперимента, а также возможности круглогодичных исследований большого числа проростков при варьировании условий в более широком диапазоне, чем при выращивании in vivo [9–11]. Однако результаты, полученные при выращивании растений в искусственных условиях, не всегда соответствуют результатам, полученным в природных условиях [12], поэтому сравнительный анализ растений, выращенных in vitro и in vivo, всегда крайне желателен.
Публикации, касающиеся исследований структурных и термодинамических особенностей крахмалов клубней картофеля в зависимости от гормонального статуса, в литературе не обнаружены. Тем не менее, отдельные исследования показали, что воздействие ауксина (1 мг ⋅ л–1) на одноузловые черенки картофеля in vitro приводит к повышению содержания крахмала в формирующихся клубнях и некоторому увеличению размера крахмальных гранул [13]. Еще в большей степени эта тенденция проявилась у линии картофеля с трансгеном rolB из агробактерий A. tumefaciens, который оказывает ауксиноподобное действие. Крахмал rolB-трансгенного картофеля был основательно изучен с применением современных методов [14]. Были установлены отличия физико-химических свойств крахмала rolB-трансформантов от крахмала контрольных растений, в том числе уменьшение толщины и температуры плавления кристаллической ламели. Эти результаты были подтверждены в дальнейшем; кроме того, оказалось, что условия выращивания растений (in vitro или in vivo) также влияют на свойства крахмала [12].
Цель данной работы – исследование структуры, морфологии гранул крахмалов и термодинамических параметров их плавления из клубней растений картофеля, культивированных in vitro и in vivo, в том числе с измененным гормональным статусом. Исследования проводились с крахмалами, экстрагированными из клубней трансформантов картофеля, эктопически экспрессирующих агробактериальный ген tms1 биосинтеза ауксина [15]. Этот трансген активно экспрессировался в клубнях под контролем клубнеспецифичного промотора гена пататина класса I (промотор B33). Установлено, что экспрессия конструкции B33::tms1 в растениях картофеля, выращиваемого in vitro, вызывает повышение уровня ауксина главным образом в клубнях, что приводило к увеличению продуктивности (количества и веса клубней) трансформантов по сравнению с контрольными растениями [15].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
МАТЕРИАЛЫ
Трансгенные растения картофеля сорта Дезире (четыре независимые линии), экспрессирующие агробактериальный ген tms1 биосинтеза ауксина под контролем клубнеспецифичного промотора гена пататина класса I, были получены ранее [15]. Трансформанты вегетативно размножали одноузловыми черенками и выращивали в стерильных пробирках, где индуцировали клубнеобразование повышенным содержанием (5%) сахарозы в среде. Часть полученных микроклубней была высажена в почву и помещена (параллельно с контрольными микроклубнями) в условия длинного дня при температуре 22–24 °С, где из них выросли полноценные растения и сформировали клубни. Из полученных клубней и микроклубней экстрагировали крахмал по методике из работы [16].
Сканирующая электронная микроскопия
Структуру гранул крахмала характеризовали с помощью сканирующей электронной микроскопии. Микрофотографии гранул крахмалов получены с помощью сканирующего электронного микроскопа Mira3 LMU (Tescan, Брно, Чехия) при комнатной температуре в условиях высокого вакуума и ускоряющем напряжении 500 В.
Рентгеноструктурный анализ
Тип полиморфной структуры устанавливали с помощью метода широкоуглового рентгеновского рассеяния. Рентгенодифракционное исследование крахмалов проводили в воздушно-сухом состоянии методом Брэгга–Брентано на дифрактометре HZG 4 (Freiberger Präzisionsmechanik, Германия) [17, 18] с использованием рентгеновского Cu(Kα)-излучения, λ = 1.542 Å).
Дифференциальная сканирующая микрокалориметрия
Термодинамические параметры плавления 0.3 вес.% водных дисперсий крахмалов определяли с помощью высокочувствительной дифференциальной сканирующей микрокалориметрии (ДСК) на микрокалориметре ДАСМ-4 (Пущино, Россия). Объем образца составлял 0.5 см3 в закрытой ячейке. Измерения проводили в области температур 20–100 °С при постоянном давлении 2.5 МПа и скорости нагревания 2 °С/мин. Шкалу избыточной теплоемкости для каждого эксперимента калибровали с помощью эффекта Джоуля–Ленца. Ранее показано, что в данных условиях нет необходимости в учете термического запаздывания и продолжительности обработки образца в калориметрической ячейке [19]. В качестве раствора сравнения при измерении использовали деионизованную воду, полученную с использованием фильтров Millipore Direct-Q3 (Merck, Germany) с удельным сопротивлением 18.2 МОм ⋅ см при температуре 25 °C.
Средние значения термодинамических параметров плавления кристаллических ламелей крахмалов определяли не менее чем по трем параллельным измерениям. Значение температуры плавления соответствовало максимуму пика теплоемкости на термограмме. Значение экспериментальной энтальпии плавления соответствовало площади под пиком кривой избыточной теплоемкости как функции температуры. Расчет молярной энтальпии плавления (ΔHm) проводили на ангидроглюкозный остаток (162 г/моль). Процесс плавления крахмалов в первом приближении можно считать квазиравновесным [17–21], что дает возможность применять одностадийную модель плавления, в которой процесс плавления крахмалов описывается как равновесная реакция между нативным и расплавленным состояниями.
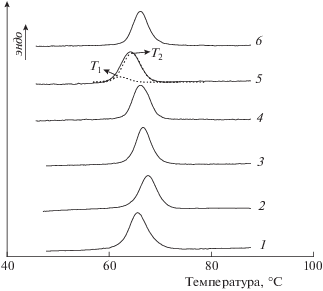
Значения энтальпии Вант-Гоффа (ΔHνH) рассчитывали, как было описано ранее [17, 20], используя следующее уравнение:
где R – универсальная газовая постоянная, Tm – температура плавления кристаллической ламели крахмала, Cp – максимум ординаты пика теплоемкости на термограмме, ${\Delta }C_{p}^{{{\text{exp}}}}$ – разность значений теплоемкостей между расплавленным и нативным состоянием крахмальных дисперсий.
Кооперативную единицу плавления (v) рассчитывали, как описано в работах [19, 21]:
(2)
${v} = {{\Delta {{H}^{{{v}H}}}} \mathord{\left/ {\vphantom {{\Delta {{H}^{{{v}H}}}} {\Delta {{H}_{m}}}}} \right. \kern-0em} {\Delta {{H}_{m}}}},$где ΔHm – экспериментальная молярная энтальпия плавления кристаллической ламели.
Толщину кристаллической ламели, Lcr. l, рассчитывали на основании следующего уравнения [21]:
где 0.35 нм – проекция ангидроглюкозного остатка на ось двойной спирали амилопектина [22, 23].
Для деконволюции термограмм применяли программу Peak Fit (AISN Software Incorporated, Version 4). Рассчитывали термодинамические параметры, соответствующие каждому термодинамическому переходу [21].
Реология гелей
Реологические характеристики 9%-ных водных гелей крахмалов исследовали на реометре Anton Paar MCR 302 (Австрия) в режиме осциллирующих синусоидальных колебаний. Подготовленные образцы гелей крахмалов помещали в зазор между измерительными поверхностями, представляющими собой плоскость–плоскость (d = 25 мм). Измерения проводили в интервале частот 0–400 рад/с при t = = 20 °С.
Приготовление образцов 9%-ных гелей проводили путем диспергирования навески сухого крахмала в деионизованной воде при непрерывном перемешивании в течение 5–7 мин. Полученную суспензию при постоянном перемешивании нагревали до 95 °C и, не прекращая перемешивание, выдерживали в течение 7 мин. Часть расплава помещали в цилиндрическую тефлоновую ячейку диаметром 25 мм и высотой 5 мм и выдерживали при 20 °C в течение 24 ч.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Методом сканирующей электронной микроскопии показано, что все исследуемые крахмалы характеризуются наличием гранул разного размера, как крупных, так и мелких (рис. 1). Гранулометрический анализ показал, что экспрессия трансгена tms1 синтеза ауксина приводит к образованию в крахмалах большего количества гранул нерегулярной или кубической формы по сравнению с крахмалом из клубней нетрансформированных (НТ) растений; гранулы крахмалов трансгенных растений характеризуются большей долей крупных гранул. При этом обнаруженные закономерности проявляются при обоих условиях культивирования растений (in vivo и in vitro). Аналогичные результаты ранее наблюдались для крахмалов как из нетрансформированных, так и для rol-трансгенных растений [12, 24]. Следует отметить, что крахмальные гранулы в клубнях in vivo характеризуются большими размерами и большей долей гранул нерегулярной формы, чем in vitro, что, вероятно, связано как с особенностями физиологии растения, из которого выделяется крахмал, так и биологическими свойствами хлоропласта или амилопласта [25, 26].
Рис. 1.
Микрофотографии гранул крахмала, экстрагированного из клубней НТ-растений (а, б) и из клубней tms1-трансформантов картофеля (в, г), культивированных in vitro (а, в) и in vivo (б, г).

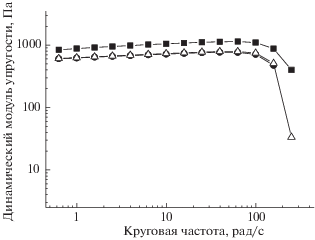
Методом рентгеновского рассеяния установлен тип полиморфной кристаллической структуры крахмалов. На рис. 2 приведены дифрактограммы крахмалов из нетрансформированных и трансформированных геном tms1 биосинтеза ауксина клубней, культивированных in vivo. Тип кристаллической структуры определяли по положению дифракционных максимумов (рефлексов) на дифрактограммах методом Брэгга–Брентано [27]. Положения рефлексов для образцов с различной степенью экспрессии гена tms1 синтеза ауксина наблюдались при одних и тех же значениях 2θ, которые соответствовали В-типу полиморфной структуры. Следует отметить, что все картофельные крахмалы, экстрагированные из клубней in vivo, характеризовались также одинаковой степенью кристалличности.
Рис. 2.
Дифрактограммы картофельных крахмалов из НТ-клубней (а), трансформированных геном tms1 синтеза ауксина клубней (б). Растения культивировали in vivo.
В условиях культивирования in vitro для сравнительной характеристики типа полиморфной структуры крахмалов из нетрансформированных и трансгенных растений был применен метод ДСК, основанный на сравнении влияния 0.6 М КСl на температуру плавления кристаллических ламелей крахмала [28].
Известно, что в случае полиморфной структуры крахмала А-типа под влиянием 0.6 М КСl температура плавления, как правило, увеличивается на 7–12 град по сравнению с водной дисперсией, а в случае полиморфной структуры В-типа – всего на 0.5–4 град [29]. В нашем случае для крахмала линии A4-7 в условиях in vitro, которая характеризуется высокой степенью экспрессии трансгена tms1 [15], установлено, что в растворе 0.6 М KCl температура плавления увеличивалась по сравнению с водной дисперсией на 0.7 град, что характерно для полиморфной структуры B-типа (термограмма на рис. 3 не приведена).
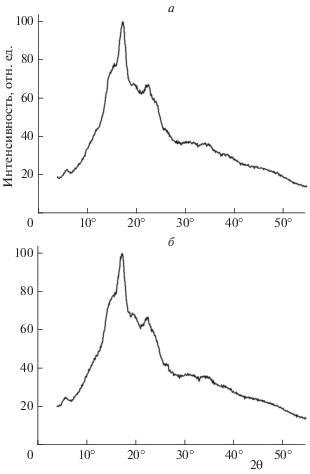
Рис. 3.
ДСК-термограммы плавления водных дисперсий крахмалов c концентрацией 0.3 вес.%, экстрагированных из клубней картофеля, культивированных in vitro (1–3) и in vivo (4–6): 1, 4 – НТ-растений; 2, 5 и 3, 6 – tms1-трансформантов картофеля (независимые линии А1-2 и А4-7). Штриховые линии на кривой 5 – результат деконволюции ДСК-термограммы (Т1 – низкотемпературный переход, Т2 – высокотемпературный переход).
Таким образом, введение гена tms1 синтеза ауксина не вызывает in vivo и in vitro изменения типа полиморфной структуры крахмала в клубнях растений картофеля. Аналогичный результат был получен нами ранее для крахмалов картофеля, в условиях экспрессии rol-трансгенов [12, 14].
Термодинамические параметры плавления и термограммы плавления кристаллических ламелей гранул картофельных крахмалов, экстрагированных из нетрансформированных и генно-модифицированных (ГМ) растений, экспрессирующих агробактериальный ген tms1 биосинтеза ауксина, приведены в табл. 1 и на рис. 3. Значения температуры плавления кристаллической ламели для крахмалов из трансформантов in vitro достоверно увеличиваются с одновременным уменьшением значения экспериментальной энтальпии плавления крахмалов по сравнению с соответствующими значениями для крахмала из НТ-растений (табл. 1). Расчет термодинамических параметров по одностадийной модели показал, что энтальпия Вант-Гоффа меняется разнонаправлено, т.е. достоверного изменения этого параметра у обеих линий не наблюдается. В то же время у трансформантов in vitro существенно возрастают значения параметров v и Lcr. l (табл. 1), характеризующие кооперативную единицу плавления (в среднем на 24%) и толщину кристаллической ламели (в среднем на 22%).
Таблица 1.
Термодинамические и структурные параметры плавления кристаллической ламели крахмалов из клубней нетрансформированного (НТ) и tms1-трансформантов картофеля независимых линий А1-2 и А4-7 в условиях in vitro и in vivo
| Условия культивирования | Вариант (линия) | Tm, °C | ΔHm, кДж/моль | ΔHvH, кДж/моль | v, отн. ед. | Lcr. l, нм |
|---|---|---|---|---|---|---|
| in vitro | НТ | 64.2 ± 0.1 | 4.1 ± 0.1 | 53.3 ± 0.2 | 12.9 ± 0.1 | 4.6 ± 0.1 |
| А1-2 | 66.1 ± 0.1 | 3.3 ± 0.1 | 50.9 ± 0.1 | 15.4 ± 0.5 | 5.4 ± 0.1 | |
| А4-7 | 65.9 ± 0.1 | 3.3 ± 0.1 | 53.9 ± 0.2 | 16.3 ± 0.1 | 5.7 ± 0.1 | |
| in vivo | НТ | 65.5 ± 0.1 | 4.0 ± 0.2 | 49.9 ± 1.5 | 12.7 ± 0.1 | 4.4 ± 0.1 |
| А1-2 | 63.7 ± 0.1 | 4.3 ± 0.1 | 49.4 ± 0.9 | 11.4 ± 0.3 | 4.0 ± 0.1 | |
| А4-7 | 65.5 ± 0.1 | 4.2 ± 0.1 | 50.6 ± 1.0 | 10.0 ± 0.9 | 4.3 ± 0.3 |
Однако все вышеприведенные изменения характеристик относятся к крахмалам, выделенным из растений, культивируемых in vitro. В случае крахмалов из трансформантов in vivo, экспрессирующих трансген синтеза ауксина, температура и энтальпия плавления, а также толщина кристаллической ламели практически не изменяются по сравнению с соответствующими значениями для крахмала из НТ-растений (табл. 1). Эти результаты в целом соответствуют сделанным ранее наблюдениям о том, что крахмалы ГМ- и НТ-растений, выращенных в почве, больше соответствуют друг другу по сравнению с крахмалами растений, культивируемых in vitro [12].
Учитывая, что термограммы исследуемых крахмалов характеризуются некоторой асимметрией пиков плавления, можно предположить, что это есть проявление наличия более одного независимого перехода кристаллических структур с различной температурой плавления. Данные деконволюции кривых теплоемкости по модели двух независимых переходов “все или ничего” приведены в табл. 2. Пример деконволюции ДСК-термограммы приведен на рис. 3 для линии А 1-2 в условиях in vivo (штриховые линии на кривой 5).
Таблица 2.
Результаты деконволюции термограмм плавления крахмалов из клубней нетрансформированного (НТ) и tms1-трансформатов картофеля независимых линий А1-2 и А4-7 в условиях in vitro и in vivo
| Условия культивирования | Вариант | Низкотемпературный переход | Высокотемпературный переход | ||
|---|---|---|---|---|---|
| Tm1, °C | α1, % | Tm2, °C | α2, % | ||
| in vitro | НТ | 60.8 | 7.8 | 65.1 | 92.2 |
| линия А1-2 | 63.8 | 9.2 | 67.0 | 90.8 | |
| линия А4-7 | 63.2 | 12.1 | 66.1 | 87.9 | |
| in vivo | НТ | 62.6 | 8.9 | 65.6 | 91.1 |
| линия А1-2 | 61.4 | 15.2 | 64.8 | 84.8 | |
| линия А4-7 | 65.1 | 17.8 | 65.5 | 82.2 | |
Из приведенных в табл. 2 данных видно, что при плавлении исследуемых крахмалов, как из нетрансформированных, так и трансгенных растений, проявляются два независимых перехода, обусловленных плавлением структур, температуры плавления которых различны. Наличие низкотемпературного перехода в случае крахмалов из НТ-растений, вероятно, отражает плавление кристаллических ламелей с более дефектной структурой, чем основной пик. Известно, что плавление кристаллических ламелей начинается с разрушения дефектных участков в кристаллах крахмала, таких как концы сегментов цепей и петель [30].
Структурные и термодинамические параметры для каждого из переходов, рассчитанные по результатам деконволюции термограмм, приведены в табл. 2 и 3. Отметим, что параметры крахмалов НТ-растений (контроля), культивированные in vivo и in vitro, значительно различаются. Поэтому в дальнейшем речь пойдет об относительных изменениях параметров крахмалов трансгенных растений по сравнению с параметрами крахмалов НТ-растений в данных условиях культивирования.
Таблица 3.
Рассчитанные в результате деконволюции термограмм структурные и термодинамические параметры плавления кристаллических ламелей гранул крахмалов из клубней нетрансформированного (НТ) и tms1-трансформантов картофеля независимых линий А1-2 и А4-7 in vitro и in vivo
| Условия культивирования | Вариант | Низкотемпературный переход | Высокотемпературный переход | ||||
|---|---|---|---|---|---|---|---|
| ΔHm 1, кДж/моль | v1, отн. ед. | Lcr. l1, нм | ΔHm 2, кДж/моль | v2, отн. ед. | Lcr. l 2, нм | ||
| in vitro | НТ | 0.32 | 1.0 | 0.4 | 3.8 | 11.9 | 4.2 |
| линия А1-2 | 0.30 | 1.4 | 0.5 | 3.0 | 14.0 | 5.0 | |
| линия А4-7 | 0.40 | 2.0 | 0.7 | 2.9 | 14.3 | 5.0 | |
| in vivo | НТ | 0.35 | 1.1 | 0.4 | 3.6 | 11.6 | 4.0 |
| линия А1-2 | 0.65 | 1.7 | 0.6 | 3.6 | 9.7 | 3.4 | |
| линия А4-7 | 0.75 | 1.8 | 0.8 | 3.5 | 8.3 | 3.6 | |
В табл. 2 приведены значения параметра α, представляющего собой долю энтальпии плавления каждого из переходов 1 и 2 в общей экспериментальной энтальпии плавления. Очевидно, что в условиях экспрессии гена tms1 синтеза ауксина доля α1 структур, соответствующих низкотемпературному переходу 1, увеличилась по сравнению с α1 крахмала НТ-растений, причем наблюдаемый эффект характерен для обоих условий культивирования (in vitro и in vivo). Для обоих условий культивирования характерно также уменьшение разности температур переходов 1 и 2 в условиях экспрессии трансгена tms1 (табл. 2).
В условиях культивирования in vitro температуры плавления, соответствующие как низко-, так и высокотемпературному переходам, повышаются в ряду крахмалов “НТ-растения – трансгенные растения”, при этом повышаются также величины кооперативной единицы плавления, а также толщины кристаллической ламели. Энтальпия перехода 1 изменяется разнонаправлено, тогда как энтальпия перехода 2 понижается.
При культивировании in vivo возрастает разброс экспериментальных данных (табл. 3). Наблюдается тенденция к повышению температуры перехода 1, тогда как температура высокотемпературного перехода не изменяется. Можно отметить также, что в условиях in vivo наблюдаются те же тенденции к увеличению энтальпии низкотемпературного перехода 1, величины кооперативной единицы плавления и толщины кристаллической ламели для обоих переходов, как и в условиях культивирования in vitro. Энтальпия плавления высокотемпературного перехода 2 практически не изменяется (табл. 2 и 3).
Таким образом, введение гена tms1 синтеза ауксина в растения картофеля не вызывает у них в данных экспериментальных условиях изменение типа полиморфной структуры крахмалов, но сопровождается изменением формы и размера гранул, в частности увеличением доли гранул нерегулярной формы. Как следует из данных деконволюции термограмм, экспрессия гена tms1 синтеза ауксина сопровождается изменением в условиях in vitro термодинамических и структурных параметров кристаллических ламелей основной доли крахмала в сторону увеличения толщины и большей упорядоченности (≈ 90%) и при этом – накоплением структур, плавящихся при более низкой температуре (≈ 10%), как в условиях in vitro, так и in vivo.
Для оценки влияния экспрессируемого гена tms1 синтеза ауксина на вязкоупругие свойства гелей картофельного крахмала получены предварительные данные по реологии 9%-ных гелей в воде. На рис. 4 приведены кривые зависимости динамического комплексного модуля упругости от круговой частоты гелей крахмалов, выделенных из НТ-растений и tms1-трансгенных растений двух независимых линий (линии А1-2 и А4-7), культивированных in vivо. Очевидно, что введение гена tms1 синтеза ауксина в растения картофеля вызывает уменьшение комплексного динамического модуля упругости крахмального геля, полученного из трансформатов, по сравнению с гелем крахмала из НТ-растений. Этот результат коррелирует с накоплением в составе крахмалов при модификации генома фракции (≈ 10%), характеризующейся менее упорядоченной структурой по сравнению с крахмалами из НТ-растений.
ЗАКЛЮЧЕНИЕ
Из приведенных выше результатов исследований гранул картофельных крахмалов следует, что трансформация растений картофеля при введении в них гена tms1 синтеза ауксина:
– сопровождается изменением гранулометрического состава крахмалов – увеличивается доля гранул нерегулярной формы и большего размера;
– не вызывает изменения В-типа полиморфной структуры крахмалов;
– вызывает в условиях in vitro изменение термодинамических и структурных параметров плавления кристаллических ламелей основной доли (≈ 90%) крахмала клубней картофеля (повышение температуры и величины кооперативной единицы плавления, рост толщины кристаллической ламели), а также накопление в крахмалах трансформантов менее упорядоченных структур;
– понижает вязкоупругие свойства гелей крахмала, выделенного из ГМ-растений, что происходит в условиях накопления в составе крахмала фракции с менее упорядоченной структурой по сравнению с основной фракцией ламелей.
Несмотря на существенные количественные различия, наблюдаются и общие закономерности в изменении структурных и термодинамических параметров плавления крахмалов у tms1-трансгенных растений, культивированных в условиях in vivo и in vitro. С практической точки зрения это означает, что экспрессия гена tms1 синтеза ауксина в растениях картофеля не приводит к существенным нарушениям в образовании и структуре крахмала в трансформантах.
Работа выполнена при поддержке грантом Российского научного фонда № 17-74-20181 (получение и анализ трансгенных растений картофеля) и частичной поддержке Министерством науки и высшего образования РФ, темы 0084-2014-0005 (№ 01201253307) и 0082-2018-0006 (№ АААА-А-18-118020890097-1).
Список литературы
Zeeman S.C., Kossmann J., Smith A.M. // Annu. Rev. Plant Biology. 2010. V. 61. P. 209.
Сергеев А.И., Шилкина Н.Г., Вассерман Л.А., Шилов С.И., Staroszczyk H. // Хим. физика. 2017. Т. 36. С. 71.
Асеева Р.М., Сахаров П.А., Сахаров А.М. // Хим. физика. 2009. Т. 28. С. 89.
Роговина С.З., Алексанян К.В., Владимиров Л.В., Берлин А.А. // Хим. физика. 2019. Т. 38. С. 39.
Жорина Л.А., Кузнецова О.П., Роговина С.З., Владимиров Л.В., Грачев А.В., Прут Э.В., Берлин А.А. // Хим. физика. 2018. Т. 37. С. 74.
Аксенова Н.П., Сергеева Л.И., Константинова Т.Н., Голяновская С.А., Колачевская О.О., Романов Г.А. // Физиология растений. 2013. Т. 60. С. 307.
Geigenberger P. // Plant Physiology. 2011. №155. P. 1566.
Аксенова Н.П., Константинова Т.Н., Голяновская С.А., Сергеева Л.И., Романов Г.А. // Физиология растений. 2012. Т. 59. С. 482.
Xu X., Vreugdenhil D., van Lammeren A.A.M. // J. Exp. Bot. 1998. V. 49. P. 573.
Аксенова Н.П., Константинова Т.Н., Голяновская С.А., Коссманн Й., Вилльмитцер Л., Романов Г.А. // Физиология растений. 2000. Т. 47. С. 420.
Shan J., Song W., Zhou J. et al. // Genomics. 2013. V. 102. P. 388.
Wasserman L.A., Sergeev A.I., Vasil’ev V.G., Plashchina I.G., Aksenova N.P., Konstantinova T.N., Golya-novskaya S.A., Sergeeva L.I., Romanov G.A. // Carbohydr. Polym. 2015. V. 125. P. 214.
Гукасян И.А., Голяновская С.А., Гришунина Е.В., Константинова Т.Н., Аксенова Н.П., Романов Г.А. // Физиология растений. 2005. Т. 52. С. 913.
Аксенова Н.П., Вассерман Л.А., Сергеева Л.И., Константинова Т.Н., Голяновская С.А., Кривандин А.В., Плащина И.Г., Блазчак В., Форнал Й., Романов Г.А. // Физиология растений. 2010. Т.57. С. 703.
Kolachevskaya O.O., Alekseeva V.V., Sergeeva L.I., Rukavtsova E.B., Getman I.A., Vreugdenhil D., Buryanov Y.I., Romanov G.A. // J. Integrative Plant Biology. 2015. V. 57. P. 734.
Richter M., Augustat S., Schierbaum F. Selected methods in starch chemistry. Stuttgart: Wissenschaftlliche Verlagsgesellschaft GmbH, 1968.
Bocharnikova I.I., Wasserman L.A., Krivandin A.V. et al. // J. Therm. Anal. and Calorim. 2003. V. 74. P. 681.
Wasserman L.A., Papakhin A.A., Borodina Z.M., Krivandin A.V., Sergeev A.I., Tarasov V.F. // Carbohydr. Polym. 2019. V. 212. P. 260.
Andreev N.R., Kalistratova E.N., Wasserman L.A., Yuryev V.P. // Starch-Starke. 1999. V. 50. P. 422.
Privalov P.L., Potekhin S.A. // Methods Enzymol. 1986. V. 131. P. 4.
Matveev Y.I., van Soest J.J.G., Nieman C., Wasserman L.A., Protserov V.A., Ezernitskaja M.G., Yuryev V.P. // Carbohydr. Polym. 2001. V. 44. P. 151.
Gernat Ch., Radosta S., Anger H., Damaschun G. // Starch-Starke. 1993. V. 45. P. 309.
Imberty A., Chanzy H., Perez S., Buleon A., Tran V. // J. Mol. Biol. 1988. V. 201. P. 365.
Jaspreet S., Narpinder S. // Food Hydrocolloids. 2003. V. 17. P. 63.
Singh J., Singh N. // Food Chem. 2001. V. 75. P. 67.
Svegmark K., Hermansson A.M. // Food Struct. 1993. V. 12. P. 181.
Cairs P., Bogracheva T., Ring S.G., Hedley L.L., Morris V.J. // Carbohydr. Polym. 1997. V. 31. P. 275.
Yuryev V.P., Wasserman L.A., Andreev N.R., Tolstoguzov V.B. // Starch and starch containing origins – structure, properties and new technologies / Eds. Yuryev V.P., Cesaro A., Bergthaller W. New York: Nova Sci. Publ., 2002. P. 23.
Bogracheva T.Ya., Morris V.J., Ring S. G., Hedley C.L. // Biopolymers. 1998. V. 45. P. 323.
Jenkins P.J., Cameron R.E., Donald A.M. // Starch-Starke. 1995. V. 45. P. 417.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика