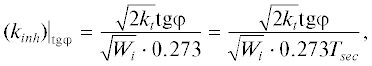Химическая физика, 2020, T. 39, № 7, стр. 41-48
Антиоксидантные и антирадикальные свойства ресвератрола и его антистрессовая активность
И. В. Жигачева 1, *, В. И. Бинюков 1, И. Ф. Русина 2, Е. М. Миль 1, И. П. Генерозова 3
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
3 Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: zhigacheva@mail.ru
Поступила в редакцию 12.04.2019
После доработки 18.05.2019
Принята к публикации 20.05.2019
Аннотация
Исследованы антирадикальные свойства и биологическая активность природного полифенола – ресвератрола. Методом хемилюминесценции зарегистрированы высокие значения антирадикальной активности этого препарата. На модельной системе показано, что препарат в диапазоне концентраций 10–5–10–12 М предотвращал активацию перекисного окисления липидов в мембранах митохондрий проростков гороха, что могло свидетельствовать о наличии у этого препарата антистрессовых свойств, которые исследовали в условиях дефицита воды, вызывающего перекисное окисление липидов и приводящего к набуханию митохондрий. Обработка семян ресвератролом (3 ⋅ 10–5 М) в этих условиях приводила к снижению количества набухших и появлению мелких митохондрий, что, возможно, было признаком активации биогенеза митохондрий. Ресвератрол, предотвращающий перекисное окисление липидов, способствовал сохранению функционального состояния митохондрий и активации энергетического метаболизма за счет увеличения их числа, что отразилось на физиологических показателях: препарат предупреждал снижение темпов роста проростков гороха в условиях дефицита воды. На основании полученных данных делается предположение, что препарат обладает антистрессовыми свойствами в том концентрационном интервале, в котором он проявляет антиоксидантный эффект.
ВВЕДЕНИЕ
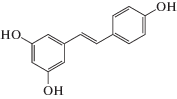
Ресвератрол (РВ) – транс-3,4,5-тригидроксистилбен – представляет собой природный полифенол со структурой стильбена. Его химическая структура была охарактеризована в 1940 г., когда он был выделен из корня Veratrum grandiflorum [1]. В настоящее время он найден более чем в 72 видах растений [2]. Его содержание в растениях варьирует и увеличивается в ответ на биотические и абиотические стрессы [3, 4].Растения, содержащие реcвератрол, эффективно используются в народной медицине более 2000 лет. Однако изучение его биологической активности началось лишь после опубликования результатов исследований Баура и Синклера [5]. Тогда выяснилось, что ресвератрол значительно продлевает срок жизни дрожжей Saccharomyces cerevisiae и плодовых мушек-дрозофил. В ряде работ показано наличие у ресвератрола антимикробной, кардиопротекторной и противоопухолевой активности [6–8]. Известно, что он также подавляет пролиферацию различных опухолевых клеток через каспазо-8-зависимый (рецептор-опосредованный) или каспазо-9-зависимый (митохондриальный) путь [9].
Несмотря на низкую биодоступность, ресвератрол проявляет эффективность in vivo. Это можно объяснить повторным превращением как сульфатов, так и глюкуронидов ресвератрола в органах-мишенях, таких как печень [10, 11]. Наконец, его эффекты in vivo можно объяснить активностью его метаболитов.
Основная мишень для ресвератрола – митохондрии, являющиеся “энергетическими станциями” клеток и играющие одну из основных ролей в ответе организма на действие стрессовых факторов. Стрессовые воздействия приводят к смещению антиоксидантно-прооксидантного равновесия в сторону увеличения генерации активных форм кислорода (АФК) митохондриями, что вызывает развитие ряда патологических состояний [12]. Известно, что ресвератрол способен осуществлять защиту от окислительного стресса in vitro и in vivo путем экспрессии гена SOD 2 (митохондриальной Mn-SOD), либо активируя разобщающий белок UCP2 в мембранах митохондрий [13]. Тем не менее, в зависимости от концентрации препарата и типа клеток, он может проявлять и прооксидантные свойства, что приводит к окислительной модификации клеточной ДНК в присутствии ионов переходных металлов [14]. В ряде работ показано, что полифенольные соединения, в том числе и ресвератрол, оказывают непосредственное влияние на ультраструктуру и функцию митохондрий. В связи с этим довольно актуальна проблема исследования молекулярных механизмов, лежащих в основе протекторного действия ресвератрола на структуру и функции митохондрий.
Целью нашего исследования было изучение антирадикальной и биологической активности ресвератрола, формула которого приведена ниже:
Поскольку ресвератрол обладает низкой биодоступностью, его антистрессовые свойства исследовали на семенах гороха, которые замачивали в водных растворах препарата, что обеспечивало его поступление к клеткам зародыша и эндосперма.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Антирадикальные свойства препарата исследовали по проявлению им эффекта торможения жидкофазного окисления этилбензола, которое инициировали термическим распадом азобисизобутиронитрила (АИБН). Эффективную антирадикальную активность ресвератрола измеряли хемилюминесцентным (ХЛ) методом, суть которого состоит в регистрации интенсивности свечения хемилюминесценции, сопровождающей инициированное окисление углеводорода (RH) при известной скорости инициирования после введения в систему ингибитора окисления [15–17].
Инициатор – АИБН и растворители – хлорбензол (ХБ) и этилбензол очищали стандартными методами [18, 19]. Этилбензол дополнительно очищали, пропуская его через слой оксида алюминия. Роль продуктов реакции при низкой скорости инициирования (Wi = 1 · 10–8 М ⋅ с–1) была минимальна и не влияла на результаты измерений. Окисляющуюся реакционную смесь в объеме 5 мл помещали в термостатированную при 50 °С кювету хемилюминометра и насыщали кислородом путем барботирования воздуха нагнетающим устройством “Скалярий”. Слабое первичное триплет-синглетное свечение кетона – эмиттера свечения усиливали за счет переноса энергии на эффективный люминофор дибромантрацен с испусканием света в области 360 нм.
Измерения интенсивности ХЛ проводили на хемилюминометре СНК-7, разработанном и изготовленном в ИХФ РАН, с фотоумножителем ФЭУ-38 в качестве регистратора света в видимой части спектра (310–650 нм). Скорость инициирования Wi контролировали непосредственно в реакционной смеси до и после опыта по кинетике тушения хемилюминесценции после введения известного количества стандартного ингибитора хромана C1 (CrC1) – синтетического аналога токоферола, для которого стехиометрический коэффициент ингибирования f = 2, и определяли по формуле
(1)
${{W}_{i}} = {{f\left[ {{\text{In}}{{{\text{H}}}_{0}}} \right]} \mathord{\left/ {\vphantom {{f\left[ {{\text{In}}{{{\text{H}}}_{0}}} \right]} {{{\tau }_{{0.5}}}}}} \right. \kern-0em} {{{\tau }_{{0.5}}}}} = {{2{{{\left[ {{\text{Cr}}{{{\text{C}}}_{1}}} \right]}}_{0}}} \mathord{\left/ {\vphantom {{2{{{\left[ {{\text{Cr}}{{{\text{C}}}_{1}}} \right]}}_{0}}} {{{\tau }_{{0.5}}}}}} \right. \kern-0em} {{{\tau }_{{0.5}}}}},$Рис. 1.
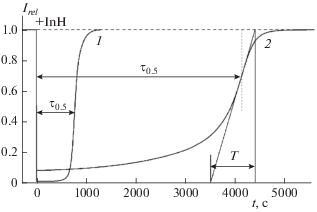
Кинетика хемилюминесценции при окислении этилбензола (20%-ный раствор в хлорбензоле, Wi = 1.05 ⋅ ⋅ 10–8 M ⋅ c–1; 50 °C) после введения хромана в концентрации [CrC1] = 4 ⋅ 10–6 M (кривая 1) и ресвератрола в концентрации [InH0] = 1.65 ⋅ 10–5 M (кривая 2); Т – обратная крутизна наклона кинетической кривой в точке перегиба; τ0.5 – время восстановления интенсивности ХЛ до уровня 0.5Irel.
По мере расходования антиоксиданта интенсивность хемилюминесценции постепенно восстанавливается по S-образной кривой, тангенс угла наклона которой в точке перегиба описывается уравнением
где kt – константа скорости рекомбинации пероксидных радикалов модельного углеводорода (этилбензол, kt = 1.9 ⋅ 107 л/моль ⋅ с), φ – максимальный угол наклона кинетической кривой восстановления свечения ХЛ в точке перегиба.По формуле (2) рассчитывалась константа kinh, характеризующая эффективность антиоксиданта. Зная скорость инициирования Wi, измерив площадь S1 затушенного ингибитором свечения и пронормировав ее на площадь S0, пропорциональную количеству образовавшихся ${\text{RO}}_{{\text{2}}}^{\centerdot }$ в модельной реакции за время измерения Т*, можно количественно рассчитать стехиометрический коэффициент ингибирования f при известной концентрации ингибитора [InH]0 по упрощенной формуле:
(3)
$f = \frac{{{{W}_{i}}T{\text{*}}({{{{S}_{1}}} \mathord{\left/ {\vphantom {{{{S}_{1}}} {{{S}_{0}}}}} \right. \kern-0em} {{{S}_{0}}}})}}{{{\text{[InH]}}}}.$При глубоком тушении ХЛ допускается симметричную площадь под S-образной кривой заменить прямоугольником высотой ΔI и длиной τ0.5 – время достижения “полувосстановления” свечения ХЛ, и получить упрощенную формулу для расчета f или скорости инициирования Wi:
Работу проводили на митохондриях пятидневных проростков гороха (Pisum sativum L.) сорта Флора-2.
Семена гороха промывали водой с мылом и 0.01%-ным раствором КMnO4. Контрольную группу семян в течение 30 мин замачивали в воде, а опытную группу – в 3 ⋅ 10–5 М растворе РВ. Затем все семена переносили на влажную фильтровальную бумагу, где они находились в темноте в течение суток. После этого половину семян контрольной группы и семена, обработанные РВ, на 2 сут переносили на сухую фильтровальную бумагу (условия дефицита воды). Спустя 2 сут все проростки переносили на влажную фильтровальную бумагу, где они оставались в течение последующих 2 сут. Вторая половина семян контрольной группы оставалась на влажной фильтровальной бумаге в течение 5 сут. На пятые сутки выделяли митохондрии из эпикотилей проростков всех исследуемых групп.
Выделение митохондрий из эпикотилей этиолированных проростков гороха проводили методом дифференциального центрифугирования [20]. Эпикотили гороха гомогенизировали в среде, содержащей: 0.4 М сахарозу, 5 мМ ЭДТА, 20 мМ КН2РО4 (рН 8.0), 10 мМ КСl, 2 мМ дитиотреитол и 0.1%-ный бычий сывороточный альбумин (БСА), свободный от жирных кислот. Гомогенат центрифугировали при 25 000g в течение 5 мин. Полученный осадок ресуспендировали в 8 мл среды и центрифугировали при 3000g в течение 3 мин. Осаждение митохондрий проводили в течение 10 мин при 11 000g. Осадок ресуспендировали в 2–3 мл среды, содержащей 0.4 М сахарозу, 20 мМ КН2РО4 (рН 7.4), 0.1%-ный БСА (свободный от жирных кислот), и вновь осаждали митохондрии при 11 000g в течение 10 мин.
Уровень перекисного окисления липидов (ПОЛ) оценивали флуоресцентным методом [21]. Липиды экстрагировали смесью хлороформ: метанол в соотношении 2 : 1 (по объему) из митохондрий, содержащих 3–5 мг белка. Соотношение митохондрии : смесь хлороформ–метанол равно 1 : 10. Регистрацию флуоресценции проводили в кварцевых кюветах с длиной оптического пути 10 мм на спектрофлуориметре FluoroMax-Horiba Yvon GmbH (Германия). В контрольную кювету добавляли 3 мл хлороформа, а затем – 0.3 мл метанола. Длина волны возбуждения флуоресценции была 360 нм, испускания – 420–470 нм. Результаты выражали в условных единицах флуоресценции, пересчитанных на мг белка.
Морфологию митохондрий исследовали методом атомно-силовой микроскопии (АСМ). Образцы митохондрий фиксировали 2%-ным глутаровым альдегидом в течение 1 ч с последующей промывкой водой и осаждением методом центрифугирования. Митохондрии наносили на поверхность кремниевой подложки и подсушивали на воздухе. Исследование проводили с использованием сканирующего зондового микроскопа SOLVER P47 SMENA на частоте 150 кГц в полуконтактном режиме с использованием кантилевера NSG11 с радиусом кривизны 10 нм. Некоторые геометрические параметры объемного изображения митохондрий определяли, используя программу “Image Analysis”. Сечение изображения проводили на высоте 30 нм. Объем митохондрий исследуемых препаратов митохондрий соответствовал произведению площади сечения изображения митохондрии на среднюю высоту данного имиджа в области сечения.
Статистическую обработку экспериментальных данных проводили путем определения их средних арифметических и стандартных ошибок. Достоверность различий между вариантами была со значимостью Р ≤ 0.05.
В эксперименте использовали реактивы следующих фирм: метанол, хлороформ (Merck, Германия); сахароза, Трис, глутаровый альдегид (Sigma-Aldrich, США); БСА, свободный от жирных кислот (Sigma-Aldrich, США); HEPES (МР Biomedicals, Германия); дитиотреитол (AppliChem GmbH, Германия).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кинетические кривые ингибированного окисления этилбензола в присутствии исследуемого ингибитора – ресвератрола представлены на рис. 1. Полученные значения коэффициента антирадикальной активности РВ, kInH, и стехиометрического коэффициента ингибирования f в сравнении с аналогичными параметрами известных антиоксидантов представлены в табл. 1.
При измерении стехиометрического коэффициента площадь под S-образной кривой по правилам подобия заменяли прямоугольником высотой Irel = 1 и длиной τ0.5 – время достижения значения в 0.5Irel, т.е. время “полувосстановления” хемилюминесценции по мере расходования ингибитора (рис. 1, кривая 2). Тогда cтехиометрический коэффициент f определяется по упрощенной формуле (4):
Предварительно величину скорости инициирования Wi рассчитывали по периоду индукции τ0.5 хромана (рис. 1, кривая 1):
Отметим, что скорость инициирования Wi окисления этилбензола после полного израсходования РВ была выше (на 10–20%), чем в начале опыта. Эта особенность проявлялась слабее при низких концентрациях ресвератрола ([InH] ≤ 10–6 М), что, вероятно, свидетельствует о прооксидантных свойствах препарата в области высоких концентраций.
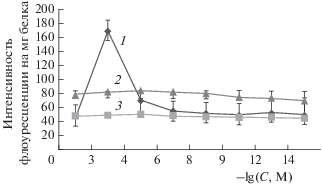
Обладая довольно высокими значениями антирадикальной активности, РВ, вероятно, может проявлять антистрессовые свойства, ингибируя свободно-радикальные процессы. Известно, что в условиях стресса одним из основных источников активных форм кислорода являются митохондрии [22]. В связи с этим для имитации стрессовых воздействий мы использовали модель “старения” митохондрий (инкубация митохондрий в гипотонической среде при комнатной температуре, содержащей 1 мм KH2PO4), что позволило определить концентрации РВ, снижающие генерацию АФК митохондриями и, следовательно, предотвращающие активацию ПОЛ [23]. “Старение” приводило к увеличению интенсивности ПОЛ, что нашло отражение в 3–4-кратном повышении интенсивности флуоресценции конечных продуктов ПОЛ (оснований Шиффа) в мембранах митохондрий проростков гороха (рис. 2). Введение РВ в среду инкубации митохондрий снижало интенсивность флуоресценции продуктов ПОЛ и имело дозовую зависимость. Препарат в концентрационном интервале 10–5–10–12 М предотвращал активацию ПОЛ в мембранах митохондрий проростков гороха, что может свидетельствовать о наличии антистрессовых свойств. Отметим, что в концентрации 10–4 М препарат не влиял на интенсивность ПОЛ в мембранах “стареющих” митохондрий, а в концентрации 10–3 М РВ проявлял прооксидантный эффект, что согласуется с данными исследования его антирадикальной активности хемилюминесцентным методом.
Рис. 2.
Спектры флуоресценции продуктов ПОЛ в мембранах митохондрий при введении различных концентраций ресвератрола (С) в среду инкубации: 1 – ресвератрол, 2 – “старение”, 3 – контроль.
Антистрессовые свойства ресвератрола исследовали в условиях дефицита воды. Выбор данной модели абиотического стресса обусловлен тем, что вода является одним из наиболее существенных экологических факторов, влияющих на развитие растительного организма [24]. Дефицит воды снижает функциональную активность как хлоропластов, так и митохондрий [25]. В связи с этим интересно было выяснить, изменятся ли функциональные характеристики митохондрий в условиях дефицита воды при обработке семян гороха ресвератролом.
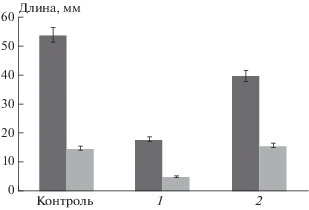
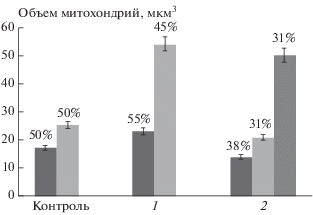
Поскольку морфология изолированных митохондрий, возможно, отражает их функциональное состояние [26, 27], проверку протекторных свойств препарата проводили, исследуя морфологию митохондрий проростков гороха, подвергнутых двухдневному воздействию дефицита воды и обработанных 3 ⋅ 10–5 М ресвератролом (концентрацией, в которой он снижал интенсивность ПОЛ в модельной системе). Такое воздействие приводило к изменению морфологии митохондрий (рис. 3): АСМ-изображения митохондрий проростков гороха, находившихся в условиях двухдневного дефицита воды, существенно отличались от изображений контрольных образцов, где в равных количествах наблюдали митохондрии малого (V = 0.017 ± 0.003 мкм3) и среднего (V = 0.025 ± 0.003 мкм3) размеров (рис. 4). В то же время в условиях дефицита воды в 55% случаев обнаруживаются митохондрии среднего размера (V = 0.023 ± 0.002 мкм3), а в 45% – митохондрии большого размера (V = 0.054 ± 0.003 мкм3). Обработка семян ресвератролом (3 ⋅ 10–5М) приводила к снижению количества митохондрий большого объема и появлению мелких митохондрий, что свидетельствовало об активации биогенеза митохондрий и усилении энергетического метаболизма в клетках проростков (рис. 3, 4). Эти результаты согласуются с опубликованными ранее данными, полученными разными исследователями, по индукции биогенеза митохондрий ресвератролом в клетках млекопитающих [28]. Кроме того, сопоставляя полученные в нашем эксперименте данные с литературными, можно было предположить, что в условиях дефицита воды, вероятно, происходило увеличение генерации АФК митохондриями с последующим их набуханием [29, 30].
Рис. 3.
АСМ-изображения митохондрий проростков гороха: а – контрольной группы, б – находящихся в условиях дефицита воды, в – находящихся в условиях дефицита воды и обработанных 3 ⋅ 10–5 М раствором ресвератрола. На рисунках а, б, в показано двумерное изображение митохондрии; г – АСМ-изображение (3D) митохондрий, выделенных из проростков гороха контрольной группы.
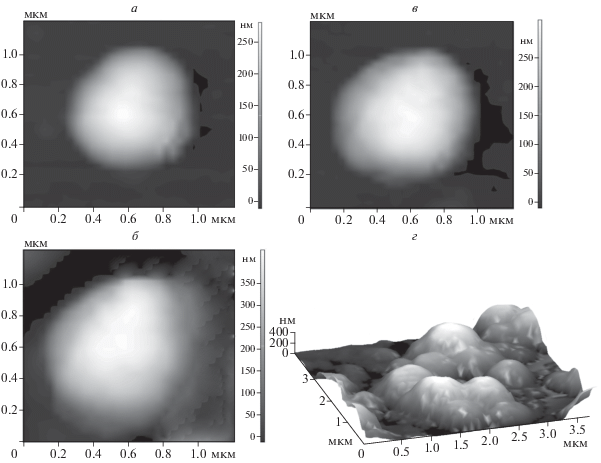
Рис. 4.
Влияние дефицита воды и ресвератрола на объем митохондрий: 1 – проростки гороха, находящиеся в условиях дефицита воды; 2 – проростки гороха, находящиеся в условиях дефицита воды и обрабатываемые 3 ⋅ 10–5 М раствором ресвератрола. Столбики – объем митохондрий в данной группе образцов. Цифры – процент митохондрий в образце, имеющих соответствующий объем.
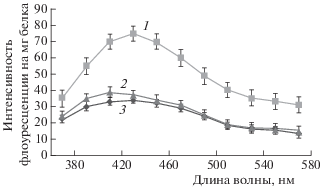
Действительно, дефицит воды вызывал активацию свободно-радикального окисления в мембранах митохондрий проростков гороха, на что указывает трехкратный рост интенсивности флуоресценции продуктов перекисного окисления липидов (рис. 5). Это согласуется с опубликованными данными о влиянии водного стресса на активацию свободно-радикального окисления в мембранах проростков пшеницы [31, 32]. Обработка семян гороха 3 ⋅ 10–5 М раствором препарата вызывала снижение содержания продуктов ПОЛ в мембранах митохондрий: интенсивность флуоресценции продуктов ПОЛ снижалась почти до контрольного уровня.
Рис. 5.
Спектры флуоресценции продуктов ПОЛ в мембранах митохондрий проростков гороха в условиях дефицита воды и обработки семян и проростков гороха 3 ⋅ 10–5 М ресвератролом: 1 – проростки гороха, находящиеся в условиях дефицита воды; 2 – проростки гороха, находящиеся в условиях дефицита воды и обработанные 3 ⋅ 10–5 М раствором РВ; 3 – проростки гороха контрольной группы.
Изменения функционального состояния митохондрий проростков гороха отразились и на физиологических показателях, а именно: на ростовых процессах. На начальных стадиях роста проростки гороха более чувствительны к дефициту воды, чем на последующих [33]. Наши эксперименты мы проводили, используя наиболее чувствительную к водному стрессу стадию роста проростков гороха (двухдневные проростки). Дефицит воды резко тормозил рост проростков (рис. 6). Обработка семян и проростков гороха исследуемым препаратом снижала торможение роста корней и побегов в этих условиях.
ЗАКЛЮЧЕНИЕ
Можно предположить, что адаптогенные свойства исследуемого препарата ресвератрола обусловлены его антиоксидантной и антирадикальной активностью. Антирадикальная активность РВ, возможно, связана с его способностью ингибировать активность комплекса III электрон-транспортной цепи митохондрий за счет конкуриренции с коферментом Q. Это, возможно, позволяет ему снижать генерацию АФК митохондриями не только благодаря его антирадикальным свойствам, но и за счет ингибирования комплекса, который генерирует свободные радикалы [34]. Снижение интенсивности процессов свободно-радикального окисления проявляется в низкой интенсивности ПОЛ (уменьшение интенсивности флуоресценции конечных продуктов перекисного окисления липидов) в мембранах митохондрий проростков гороха, что может быть обусловлено также активацией митохондриальной MnSOD и увеличением содержания этого белка в митохондриях [35]. Предотвращая активацию ПОЛ, ресвератрол, по-видимому, способствует сохранению энергетического метаболизма клеток за счет стимулирования биогенеза митохондрий [36]. Образование юных митохондрий и снижение генерации АФК митохондриями предотвращает окислительный стресс, восстанавливает клеточную энергетику и предупреждает программированную гибель клетки [37]. Поддерживая метаболические процессы в клетках на высоком энергетическом уровне, ресвератрол, вероятно, обеспечивает устойчивость растений к действию стрессовых факторов.
Работа выполнена в рамках государственного задания ФАНО России 0082-2018-0006 (№ АААА-А18-118020890097-1; 0084-2014-0004). Регистрации в ЦИТиС № 01201-253-310.
Список литературы
Takaoka M.J. // J. Faculty. Sci. Hokkaido Imper. Univ. 1940. V. l. № 3. P. 1.
Dercks W., Creasy L.L. // Physiol. Mol. Plant. Pathol. 1989. V. 34. P. 203.
Jeandet P., Douillet-Breuil A.C., Bessis R. et al. // J. Agricul. Food Chem. 2002. V. 50. № 10. P. 2731.
Adrian M., Jeandet P., Veneau J., Weston L.A., Bessis R. // J. Chem. Ecol. 1997. V. 23. № 7. P. 1689.
Baur J.A. Sinclair D.A. // Nature. 2003. V. 425. P. 191.
Athar M., Back J.H., Kopelovich L. et al. // Arch. Biochem. Biophys. 2009. V. 486. P. 95.
Mahal H.S., Mukherjee T. // Res. Chem. Intermed.2006. V. 32. P. 59.
Leifert W.R., Abeywardena M.Y. // Nutr. Res. 2008. V. 28. № 12. P. 842.
Roman V., Billard C., Kern C. et al. // Br. J. Haematol. 2002. V. 117. P. 842.
Wenzel E., Somoza V. // Mol. Nutrit. Food Res. 2005. V. 49. № 5. P. 472.
Vitrac X., Desmoulière A., Brouillaud B. et al. // Life Sci. 2003. V. 72. № 20. P. 2219.
Tailor N.L., Day D.A., Millar A.H. // J. Exp. Bot. 2003. V. 55. № 394. P. 1.
Moreira C., Silva A.M., Santos M.S., Sardão V.A. // Food Chem. Toxicol. 2013. V. 53. P. 18.
Ahmad A., Syed F.A., Singh S., Hadi S.M. // Toxicol. Lett. 2005. V. 159. № 1. P. 1.
Эмануэль Н.М., Гал Д. Окисление этилбензола (модельная реакция). М.: Наука, 1984.
Шляпинтох В.Я., Карпухин О.Н., Постников Л.М. и др. Хемилюминесцентные методы исследования медленных химических процессов. М.: Наука, 1966.
Русина И.Ф., Карпухин О.Н., Касаикина О.Т. // Хим. физика. 2013. Т. 32. № 8. С. 49.
Вайсбергер А., Проскауер Д., Риддик Дж.Э., Тупс А. Органические растворители. М.: Изд-во иностр. лит., 1958.
Беляков В.А., Васильев Р.Ф., Федорова Г.Ф. // Кинетика и катализ. 2004. Т. 45. № 3. С. 1.
Попов В.Н., Руге Э.К., Старков А.А. // Биохимия. 2003. Т. 68. № 7. С. 910.
Fletcher B.I., Dillard C.D., Tappel A.L. // Anal. Biochem. 1973. V. 52. P. 1.
Зоров Д.Б., Исаев Н.К., Плотников Е.Ю. и др. // Биохимия. 2007. Т. 72. С. 1371.
Zhigacheva I., Generozova I., Shugaev A. et al. // Annu. Res. & Rev. Biol. 2015. V. 5. № 1. P. 85.
Хван А.В. // Вопросы биологии. Благовещенск, 1969. С. 104.
Шугаева Н.А., Выскребенцева Е.И., Орехова С.О., Шугаев А.Г. // Физиол. раст. 2007. Т. 54. № 3. С. 373.
Claypool S.M., McCaffery J.M., Koehler C.M. // J. Cell Biol. 2006. V. 174. № 3. P. 379.
Бинюков В.И., Миль Е.М., Жигачёва И.В., Албантова А.А., Генерозова И.П. // ДАН. 2012. Т. 446. № 2. С. 222.
De-Oliveira M.R., Nabavi S.F., Manay A. et al. // Biochem. Biophys. Acta – Gen. Subj. 2016. V. 1860. № 4. P. 727.
Zhang L., Yinshu Li, Da-Xing, Caiji Gao // J. Exp. Bot. 2009. V. 60. № 7. P. 2073.
Scott I., Logan D.C. // New Phytol. 2008. V. 177. P. 90.
Selote D.S., Bharti S., Khanna-Chopra R. // Biochem. Biophys. Res. Commun. 2004. V. 314. № 3. P. 724.
Miller G., Suzuki N., Ciftci-Yilmaz S., Mittler R. // Plant, Cell & Environ. 2010. V. 33. № 4. P. 453.
Генерозова И.П., Шугаев А.Г. // Физиол. раст. 2012. Т. 59. С. 262.
Zini R., Morin C., Bertelli A. et al. // Drugs Experimen. Clin. Res. 1999. V. 25. № 2–3. P. 87.
Jackson J.R., Ryan M.J., Hao Y., Alway S.E. // Amer. J. Physiol. – Regulat. Integr. Comp. Physiol. 2010. V. 299. № 6. P. R1572–R1581.
Csiszar A., Labinskyy N., Podlutsky A. et al. // Amer. J. Physiol. Heart Circ. Physiol. 2008. V. 294. P. H2721–2735.
Ungvari Z., Sonntag W.E., Rfael de Cabo, Baur J.A., Csisrar A. // Exer. Sport Sci. Rev. 2011. V. 39. № 3. P. 128.
Эмануэль Н.М., Денисов Е.Т., Майзус З.К. Цепные реакции окисления углеводородов в жидкой фазе. М.: Наука, 1965.
Азатян Н.А., Карпухина Г.В., Белостоцкая И.С., Комиссарова Н.М. // Нефтехимия. 1973. Т. 33. С. 435.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика