Химическая физика, 2021, T. 40, № 1, стр. 55-68
Краун-эфиры – селективные сорбенты радиоактивных и тяжелых металлов
В. Ф. Громов 1, М. И. Иким 1, *, Г. Н. Герасимов 1, Л. И. Трахтенберг 1, 2
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: ikim1104@rambler.ru
Поступила в редакцию 18.05.2020
После доработки 18.05.2020
Принята к публикации 22.06.2020
Аннотация
Систематизирован и проанализирован экспериментальный материал по методам получения сорбирующих систем, содержащих краун-эфиры, и их комплексообразующим свойствам с катионами некоторых радиоактивных и тяжелых металлов. Показано, что сорбенты, в которых краун-эфиры связаны с органической или неорганической подложкой ковалентными связями, обладают более высокой стабильностью в процессах очистки коммунальных и производственных сточных вод от радионуклидов и тяжелых металлов. Основным фактором, определяющим эффективность сорбции катиона, является соответствие между размером катиона и диаметром полости краун-эфира.
ВВЕДЕНИЕ
Широкое развитие химических технологий, в частности процессов, используюших радиоактивные элементы и соли тяжелых металлов, потребовало разработки эффективных и недорогих методов очистки сточных вод, а также извлечения и утилизации содержащихся в них ценных продуктов (см., например, [1]). Проблема очистки жидких отходов различных производств, приносящих огромный вред окружающей среде и здоровью населения, в последнее время приобрела статус приоритетной в ряде научных дисциплин и является предметом исследований различных научных коллективов.
Наиболее опасными являются отходы радиоактивных, радиохимических и гальванических производств, которые могут содержать тяжелые и радиоактивные металлы (не только в виде солей, но и в виде металлорганических соединений), а также примеси органических соединений. В отличие от содержащихся в воде органических загрязнителей, ионы тяжелых и радиоактивных металлов, многие из которых обладают токсическим и канцерогенным действием, не являются биоразлагаемыми и имеют тенденцию накапливаться в живых организмах.
Существующие методы утилизации жидких отходов, содержащих соли тяжелых металлов и радиоактивные элементы, очень дороги, трудоемки и часто неэффективны. Кроме того, применяемые в ряде случае методы химического осаждения, а также электрохимические методы не позволяют проводить глубокую очистку и не могут быть использованы для обработки разбавленных растворов радиоактивных веществ, так как даже в малых концентрациях оставшиеся в растворе радиоактивные элементы могут оказывать серьезное воздействие на здоровье человека [2–6].
Один из способов очистки разбавленых и полуразбавленных растворов загрязняющих веществ заключается в использовании сорбируюших систем. При этом главная проблема заключается в создании селективных сорбентов, способных извлекать катионы “вредных” тяжелых металлов и радиоактивных элементов в присутствии “баластных” ионов (таких, например, как Са2+, Mg2+, Na+ и др.), не оказывающих вредного влияния на окружаюшую среду.
В настоящее время для очистки сточных вод широко применяются синтетические ионообменники и природные иониты (гранулированный бентонит, монтмориллорит и др.), которые обладают высокой сорбционной емкостью [7]. Однако энергия связи ионов металлов с функциональными группами в обычных ионитах не превышает 8–12 кДж/моль, что не позволяет извлекать с помощью таких сорбентов ионы металлов из сильно разбавленных растворов. Кроме того, обычные иониты не обладают достаточно высокой селективностью.
В то же время используемые для очистки в ряде случаев хелатные смолы характеризуются высокой прочностью связи с ионами металлов (энергия связи достигает 60–100 кДж/моль). Такая высокая прочность связи способствует достижению высокой эффективности сорбции хелатной смолы по отношению к различным катионам. Однако при этом возникают трудности с осуществлением регенерации смолы и утилизации сорбированных элементов [8]. Поэтому такие ионообменники с сорбированными элементами обычно подвергают “захоронению”, что представляет серьезную экологическую проблему.
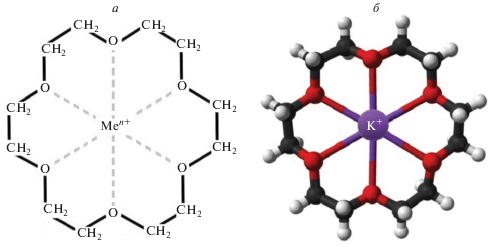
Более перспективным представляется использование открытых в 70-х годах прошлого века Нобелевским лауреатом C.D. Pedersen краун-эфиров (КЭ) для селективного извлечения катионов металлов. Большой интерес к макроциклическим полиэфирам (далее – макроциклам), или КЭ, обусловлен главным образом их способностью сорбировать присутствующие в растворах ионы металлов в результате внедрения последних во внутреннюю полость молекулы-носителя и прочно удерживать их в ней. Константы устойчивости образующихся при этом комплексов существенно выше, чем в случае соединений, где в роли лигандов выступают линейные аналоги с тем же числом донорных атомов. На рис. 1 приведены схемы комплексов ионов металлов с КЭ, из которых видно, что в циклополиэфирных комплексах реализуется особый эффект взаимодействия иона металла с несколькими атомами-донорами в сравнительно небольшом замкнутом объеме.
В результате такого кооперативного донорно-акцепторного взаимодействия и обеспечивается довольно прочная связь между ионом и донором (макроциклический эффект) [9]. Высокая прочность связи ионов металлов с краун-эфирами делает эти комплексы перспективными продуктами для извлечения различных металлов, в частности тяжелых и радиоактивных, из растворов. С термодинамической точки зрения используемые в качестве сорбентов КЭ занимают промежуточное положение между простыми и хелатными ионообменными смолами. В зависимости от структуры энергия связи КЭ с катионами металлов находится в пределах от 20 до 40 кДж/моль. Такая прочность связи, с одной стороны, способствует высокоэффективному извлечению металла из раствора и, с другой – дает возможность регенерировать сорбент путем элюирования из него поглощенных катионов.
Селективность комплексообразующей способности КЭ, а следовательно, и эффективность извлечения из раствора определенного металла в значительной степени зависят от соответствия между размерами диаметра полости полиэфирного цикла и катиона извлекаемого металла, природы заместителя в макроцикле, а также вида донорных атомов.
Работы по использованию КЭ для извлечения из растворов различных радиоактивных (стронций, цезий, литий) и тяжелых (свинец, медь и другие) металлов ведутся уже более 50 лет. Первые обзоры, посвященные комплексообразованию макроциклов с катионами металлов, появились уже в 80–90-х годах прошлого столетия [10–14].
За последнее время выполнено большое число работ, посвященных разработке новых эффективных сорбентов на основе КЭ и изучению процесса извлечения металлов из растворов. В данном обзоре сделана попытка систематизировать имеющиеся в литературе экспериментальные результаты по способам получения высокоэффективных сорбентов на основе КЭ, предназначенных для извлечения радиоактивных и некоторых других металлов, а также обобщить развитые к настоящему времени представления о природе сорбционного процесса.
МЕТОДЫ ИММОБИЛИЗАЦИИ КРАУН-ЭФИРОВ
Хотя КЭ способны образовывать комплексы с ионами металлов, и их растворы можно применять в качестве эффективного экстрагента, к сожалению, использование таких растворов имеет ряд недостатков, включая образование эмульсии, большое количество вторичных отходов и др. Для практического использования КЭ в процессе извлечения ионов металлов из разбавленных водных растворов необходимо получить сорбирующие материалы путем связывания КЭ с соответствующей органической или минеральной матрицей. В качестве минеральных подложек можно использовать пластинки, изготовленные из простого или пористого кварцевого стекла, а также из керамического материала, обычно применяемого для приготовления тугоплавких тиглей.
Пористую подложку необходимо выбирать таким образом, чтобы диаметр пор был несколько больше размера молекул КЭ. С учетом длин связей и валентных углов, а также величин ван-дер-ваальсовских радиусов атомов максимальный размер, например такой крупной молекулы, как дибензо-18-краун-6-эфир, составляет около 15 Å. Поэтому в качестве пористой подложки для получения сорбентов следует использовать силикагель с диаметром пор около 40 Å. Такое различие в размерах позволяет молекулам КЭ свободно проникать в поры подложки и осаждаться на их поверхности. Из-за относительно малого размера пор формирование кристаллов КЭ в этих порах затруднено. Поэтому КЭ присутствуют в системе в молекулярной форме в виде малых молекулярных кластеров, что существенно облегчает взаимодействие между КЭ и катионами металлов.
Наиболее простым способом иммобилизации КЭ является их адсорбция на носителе, или пропитка носителя раствором краун-эфира в соответствующем растворителе. Именно таким образом 18-краун-6-эфир и его производные (такие, например, как бензо- и дибензозамещенные 18-краун-6-эфиры) наносили на силикагель, кизельгур, карбоксилохром и графитированную сажу для использования в хроматографическом разделении органических веществ [15–18].
В 90-х годах предпринимались попытки создания твердых экстрагирующих систем путем пропитки пористых минеральных пластин растворами 15-краун-5- и 18-краун-6-эфиров, не содержащих заместителей, с последующим удалением растворителя [19, 20]. Однако практическая ценность таких систем в качестве сорбентов ограничена вследствие вымывания КЭ из системы в процессе эксплуатации. Как результат, эффективность этих сорбентов заметно снижается с увеличением срока их эксплуатации.
Процесс иммобилизации КЭ в органическую или минеральную матрицу может приводить либо к образованию химической связи между матрицей и КЭ, либо сопровождаться физическим импрегнированием макроцикла в объем матрицы без какого-либо химического взаимодействия между компонентами. Естественно, что способ связывания с матрицей влияет на основные закономерности взаимодействия ионов металлов с макроциклами и главным образом на эффективность, стабильность и селективность комплексообразования.
Для увеличения прочности связи КЭ с минеральной или органической подложкой ее обрабатывают веществом, содержащим реакционноспособные группы, способные реагировать как с поверхностью подложки, так и со специально привитыми к молекулам КЭ функциональными группами, например NH2-группами [21]. Следует отметить, что введение в макроцикл функциональных групп, способных реагировать с поверхностью сорбента, является трудоемким и дорогостоящим процессом. Это в значительной степени ограничивает возможность приготовления наиболее подходящего сорбента для конкретного катиона металла.
Для получения твердого сорбента использовали наночастицы карбоксилированного оксида железа (Fe3O4–R–COOH), химически связанные с молекулами 18-краун-6-эфира, предварительно модифицированными введением в них амино-группы [22]. В результате получался сорбент, обладающий суперпарамагнитными характеристиками. Аналогичным образом при взаимодействии силикагеля, иммобилизованного γ-хлорпропилсиланом (SGN), с динитробензо-18-краун-6-эфиром синтезировали твердый экстрагент дибензо-18-краун-6-SGN (DB18C6SGN) [23]. Кроме того, при взаимодействии обработанного хлорпропилтриметоксисиланом (CPTES) мезопористого кремнезема с диаминобензо-18-краун-6-эфиром получается сорбент на основе мезопористого силикагеля, модифицированного диаминобензозамещенным производным 18-краун-6-эфира (DAB18C6) [24]. При этом, однако, в результате прививки CPTES и DAB18C6 удельная поверхность мезопористого кремнезема снижается с 916 до 478 м2/г.
В работе [25] для извлечения ионов стронция Sr2+ использован композит из титанатных нанотрубок, пропитанных 18-краун-6-эфиром, содержащим в качестве заместителя дициклогексановые группировки (TNTs–DCH18C6). Для получения такого сорбента взвешенное количество DCH18C6 растворяли в н-октаноле, затем к раствору добавляли необходимое количество титанатных нанотрубок и смесь перемешивали в течение 24 ч. После этого избыток растворителя удаляли с помощью роторного испарителя. Импрегнированные КЭ титанатные нанотрубки сушили в вакууме при 50 °C. Показано, что синтезированный таким образом гибридный композит обладает высокой стабильностью в агрессивной кислой среде и способен эффективно извлекать ионы Sr2+ из кислого раствора.
Для получения сорбентов, содержащих такие импрегнированные КЭ, как бензо-15-краун-5, 18-краун-6, 15-краун-5, а также оксиметил-12-краун-4, использовались также многослойные углеродные нанотрубки [26]. Одним из основных недостатков применения этих дорогих макроциклических лигандов в качестве высокоэффективных ионообменников является их растворимость в обрабатываемых средах, что приводит к выводу 18-краун-6-эфира и его производных из процесса адсорбции. Для решения этой проблемы разработан новый многослойный композит на основе α‑цирконийфосфата (α-ZrP), состоящий из органических и неорганических слоев и содержащий 4-аминобензо-18-краун-6-эфир [27]. Этот композит α-ZrP (AM–ZrP) обладает превосходной радиационной стабильностью, а также стабильностью в кислых растворах и эффективно снижает потери 4-аминобензо-18-краун-6-эфира в процессе адсорбции.
Перспективным способом получения эффективных сорбентов для извлечения металлов из растворов является нанесение КЭ на полимерные подложки, способные набухать в обрабатываемом растворе. Таким путем еще в 80–90-х годах КЭ наносили на пенополиуретан [28, 29], полистирол [30, 31] и полиметилметакрилат [32]. Преимуществом такого способа является его простота, а основными недостатками – вымывание макроциклов с поверхности подложки и неопределенность их состояния.
Кроме того, различные азакраун-эфиры прививали на сополимеры хлорметилированного стирола и дивинилбензола [33–36]. При нанесении на катиониты различной природы закрепление макроциклического соединения происходит за счет реакции конденсации между ОН-группой катионита и аминогруппой макроцикла или присутствующего в нем заместителя [37, 38].
Для нанесения полимерных макроциклических соединений проводили полимеризацию дибензозамещенных макроциклов с формальдегидом на поверхности подложки [39]. При использовании для инициирования ионизирующего излучения, образование полимера может сопровождаться ковалентным связыванием КЭ с поверхностью подложки [40]. Нанесение КЭ на полимерные подложки, способные набухать в обрабатываемом растворе, было использовано, например, в работе [41], в которой в качестве сорбента применяли инертную полимерную подложку, импрегнированную раствором 4,4'(5')-бис(трет-бутилциклогексо)-18-краун-6-эфира в октаноле.
Простой и технологичный метод получения стабильных сорбентов, предназначенных для извлечения катионов металлов из водных растворов, заключается в радиационно-химической прививке КЭ к поверхности подложки. Полимерные сорбирующие системы получали в результате полимеризации акриламида или N-винилпирролидона в присутствии 15-краун-5- и 18-краун-6-эфиров и их бензозамещенных аналогов [42].
При γ-облучении реакционной смеси, содержащей мономер и КЭ, происходят одновременно несколько процессов, а именно: полимеризация присутствующего в смеси мономера, радиационно-химическое сшивание образующихся полимерных цепей и радиационно-химическая прививка КЭ к молекулам полимера. В итоге вследствие радиационной полимеризации в присутствии КЭ образуется сшитый полимер, содержащий привитые полиэфиры: в ИК-спектре этих полимеров появляются полосы поглощения в области 3000 см–1, характеризующие молекулы КЭ.
Высокомолекулярный набухающий в воде сшитый полиакриламид, содержащий иммобилизованные молекулы КЭ, получается при полимеризации акриламида в присутствии краун-эфира также под действием персульфата калия. В качестве сшивающего агента в этом случае используется метилен-бис-акриламид [42]. В отличие от полимерного сорбента, синтезированного под действием радиационного излучения, в полученном таким образом продукте молекулы КЭ как бы “захоронены” внутри полимерной сетки, однако они не связаны химическими связями с полимерными цепями. Такое различие сказывается на сорбционной активности полученных сорбентов.
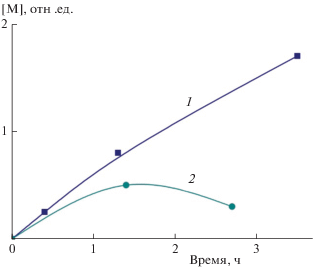
Действительно, при использовании полимерного сорбента, полученного в результате радиационной полимеризации, количество поглощенного из раствора катиона металла монотонно возрастает с увеличением времени выдержки сорбента в растворе соли. Для полимерного сорбента, полученного под действием персульфата калия, когда молекулы КЭ иммобилизованы в полимерной матрице, зависимость эффективности сорбции от времени проходит через максимум (рис. 2). Такое поведение обусловлено вымыванием из сорбента не связанного с полимерной цепью КЭ. Радиационная прививка 18-краун-6- или 15-краун-5-эфиров и их бензозамещенных аналогов к пористым минеральным подложкам или полимерной матрице, позволяет получить твердые сорбенты, которые в течение длительной эксплуатации не теряют свою сорбирующую активность по отношению к ионам свинца и меди [21, 42–45].
Рис. 2.
Зависимость количества сорбированного свинца [М] от времени пропускания водного раствора ацетата свинца через колонку с 18-краун-6-эфиром: 1 – 18-краун-6-эфир в полиакриламиде, полученном путем радиационной полимеризации; 2 – 18-краун-6-эфир иммобилизован в полимерной матрице, полученной под действием персульфата калия.
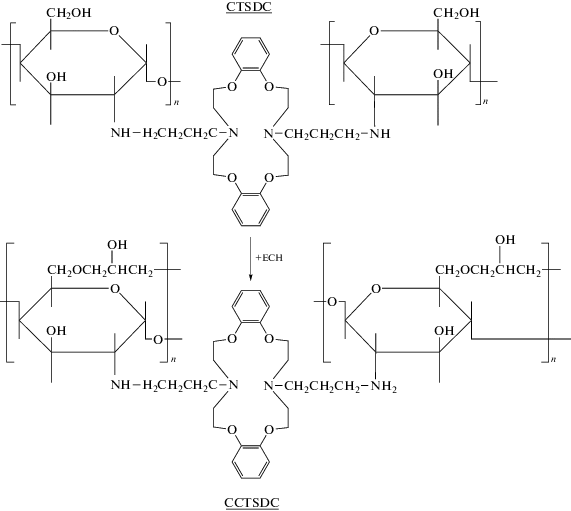
Гамма-радиолиз КЭ сопровождается одновременным образованием различных радикалов (рис. 3). Однако эффективными для извлечения ионов металлов из солевых растворов являются лишь сорбенты, получаемые при взаимодействии подложки с радикалами 1, образующимися при радиолизе КЭ в результате отрыва атома водорода от метиленовой группы КЭ и содержащими замкнутый полиэфирный цикл. Доля таких радикалов в продуктах радиолиза зависит от природы КЭ. Так, при радиолизе 18-краун-6- или 15-краун-5-эфира доля радикалов с замкнутым полиэфирным циклом составляет 10–11% [42, 46, 47]. Отметим, что при γ-облучении комплекса КЭ с металлом количество таких радикалов в значительной степени зависит от природы катиона металла. Например, при облучении комплекса КЭ–Ме, состоящего из 15-краун-5-эфира и Ве2+, Mg2+ или Ca2+, количество образовавшихся радикалов КЭ с замкнутым полиэфирным циклом составляет 1, 27 и 2% соответственно [46].
В то же время при радиолизе замещенных КЭ, таких, например, как бензо- или дибензозамещенные краун-эфиры, образование свободных радикалов может происходить за счет отрыва атома водорода не только от полиэфирного цикла, но и от бензильной группы. В результате содержание в продуктах радиолиза таких замещенных КЭ свободных радикалов 1 с замкнутым полиэфирным циклом существенно возрастает, что способствует повышению количества КЭ, привитого к полимерной цепи.
Использование полимерной матрицы для импрегнирования циклических макроэфиров описано в ряде работ [48–56]. В качестве полимеров, используемых для импрегнирования в них различных КЭ, в этих работах в основном применяли сшитые сополимеры на основе акриловых мономеров. Так, в работе [48] разработаны полимерные сорбенты для хроматографического разделения ионов различных металлов, в том числе некоторых радионуклидов.
Для получения таких сорбентов использовали ионообменник, синтезированный в результате радиационной сополимеризации акриламида, акриловой кислоты и акрилонитрила, а также N,N'-метиленбисакриламида. Полученный нерастворимый, но частично набухающий в воде продукт в течение 24 ч выдерживали в 0.1 М растворе NaOH, в результате чего происходила трансформация звеньев акриловой кислоты в солевую форму. После этого твердый полимер поли-(акриламид – акриловая кислота – акрилонитрил)-N,N'-метилендиакриламид [P(АМ-АA-АN)-DАМ] отфильтровывали и сушили при 100 °С. Частицы полимера размером 0.5–1.0 мм выдерживали в течение 24 ч в растворе одного из трех КЭ – 18-краун-6, дибензо-18-краун-6 или ди-трет-бутилбензо-18-краун-6 – в нитробензоле и затем сушили при 50 °С в течение 24 ч. Полученные таким образом сорбенты использовали для исследования сорбции различных радионуклидов.
В обзоре [57] систематически обобщены и проанализированы результаты, полученные за последние 10–15 лет, при использовании для извлечения цезия из водного раствора сорбентов на основе производных каликсаренов, представляющих собой продукты циклической олигомеризации фенола с формальдегидом и содержащих макроцикл, объем внутренней полости которого в среднем равен 10 Å3.
К полимерным сорбентам для извлечения ионов металлов можно отнести хитозан (поли-D-глюкозамин), получаемый при деацетилировании хитина, который является наиболее распространенным природным полисахаридом. Благодаря наличию большого количества высокоактивных первичных аминогрупп и гидроксильных групп хитозан является сорбентом для ионов тяжелых и благородных металлов (см., например, работу [58]). Для дальнейшего улучшения сорбционных свойств хитозана в работе [59] получены два новых производных хитозана (CTSDC и CCTSDC) с привитым к нему N,N'-диаллил-дибензо-18-краун-6-эфиром.
Для получения полимерного сорбента CTSDC порошок хитозана растворяли в уксусной кислоте, смесь нагревали до 35 °С в атмосфере азота и добавляли к ней раствор FeSO4. Полученный раствор смешивали с раствором N,N'-диаллил-дибензо-18-краун-6-эфира в этаноле и затем медленно добавляли к нему H2O2. Смесь перемешивали в течение 24 ч при 35 °С, после чего охлаждали до комнатной температуры. Образовавшийся твердый продукт отфильтровывали и после сушки экстрагировали этанолом для удаления непрореагировавшего КЭ. При взаимодействии CTSDC, предварительно выдержанного в течение 12 ч при комнатной температуре в 0.1 М растворе NaOH, с эпихлоргидрином (ECH) получали полимерный сорбент СCTSDC (рис. 4).
Как видно из приведенных в табл. 1 данных, сорбенты CTSDC и CCTSDC обладают высокой селективностью при отделении содержащихся в водных растворах ионов серебра от ионов других металлов. Аналогичная картина наблюдается и при разделении смеси ионов палладия с другими ионами. По своей сорбционной активности и селективности полимерные сорбенты CTSDC и CCTSDC [59] значительно превосходят известные производные хитозана [60, 61].
Таблица 1.
Селективность адсорбции CTSDC и CCTSDC для водных растворов, содержащих ионы Ag+, Pb2+, Ni2+ (соотношение ионов металлов 1 : 1 : 1, рН = 4) [59]
| Адсорбент | Адсорбционная емкость, мг/г | Коэффициент селективности | |||
|---|---|---|---|---|---|
| Ag+ | Pb2+ | Ni2+ | ${{K}_{{{{{\text{A}}{{{\text{g}}}^{ + }}} \mathord{\left/ {\vphantom {{{\text{A}}{{{\text{g}}}^{ + }}} {{\text{P}}{{{\text{b}}}^{{{\text{2}} + }}}}}} \right. \kern-0em} {{\text{P}}{{{\text{b}}}^{{{\text{2}} + }}}}}}}}$ | ${{K}_{{{{{\text{A}}{{{\text{g}}}^{ + }}} \mathord{\left/ {\vphantom {{{\text{A}}{{{\text{g}}}^{ + }}} {{\text{N}}{{{\text{i}}}^{{{\text{2}} + }}}}}} \right. \kern-0em} {{\text{N}}{{{\text{i}}}^{{{\text{2}} + }}}}}}}}$ | |
| CTSDC | 66.5 | 3.1 | 2.1 | 21.5 | 31.7 |
| CCTSDC | 44.6 | 1.1 | 0 | 40.5 | ∞ |
В работах [62, 63] описана мембранная хроматографическая система, использующая в качестве стационарной фазы пористые полимерные мембраны из полисульфона (PSf), к которому привит графт-4'-аминобензо-15-краун-5-эфир (PSf-g-AB15C5). Такая система может быть использована для хроматографического разделения изотопов 7Li и 6Li. В качестве хроматографической системы для разделения этих изотопов использовались мембраны, состоящие из смеси поливинилацетата с хитозаном, модифицированным бензо-15-краун-5-эфиром [64].
В отличие от твердожидкостных экстракционных систем [62–64], состоящих из пористой полимерной подложки, с которой химически связаны бензопроизводные аналоги 15-краун-5-эфира, система жидкостной экстракции изотопов лития с использованием последнего [65, 66] характеризуется значительно меньшей сорбционной активностью, а также большими потерями КЭ в процессе экстракции. Это делает ее малопригодной для практического применения.
КОМПЛЕКСООБРАЗУЮЩИЕ СВОЙСТВА СОРБЕНТОВ НА ОСНОВЕ КРАУН-ЭФИРОВ
Одной из важных проблем, которая ограничивает применение сорбционного метода для извлечения желаемых ионов из растворов, содержащих смеси солей, является ионная селективность сорбента. Наиболее подходящими для образования комплекса с катионами таких металлов, как медь, цинк, ртуть и кадмий, диаметр которых находится в пределах 1.5–2.0 Å, являются 12-краун-4- и 15-краун-6-эфиры с размером полости в интервале от 1.2 до 2.2 Å. Для комплексного связывания катионов свинца и золота с ионным диаметром 2.40 и 2.74 Å, соответственно, подходят краун-эфиры с несколько большим размером полости.
Данные, подтверждающие зависимость сорбционной активности краун-эфиров от соответствия между размерами полости КЭ и сорбируемого катиона, приведены также в работах [42, 43, 67]. Так, после контакта с водным раствором хлорной меди (при концентрации соли в растворе 10–3 моль/л) интенсивность сигнала меди в РФА-спектре изменяется от 989 до 8113 отн. ед. при анализе соответственно исходной пластинки и пластинки с привитым к ней 18-краун-6-эфиром. В еще большей степени радиационная прививка 18‑краун-6-эфира влияет на сорбцию из водного раствора ионов свинца. Интенсивность сигнала свинца в УФ-спектре обрабатываемого раствора изменяется приблизительно в 30 раз при использовании в качестве сорбента пористой пластинки из силикагеля, к которой был привит 18-краун-6-эфир.
Обратная картина наблюдается при использовании 15-краун-5-эфира: в этом случае сорбент более эффективно поглощает катион меди, чем катион свинца. Этот результат свидетельствует о высокой селективности сорбентов на основе КЭ: 18-краун-6-эфир более эффективно захватывает катион свинца, ионный размер которого (2.40 Å) в гораздо большей степени соответствует размеру полости этого КЭ (2.60 Å), чем катион меди (1.44 Å). В то же время, как следует из приведенных в табл. 2 данных, размер полости 15-краун-5-эфира (1.70 Å) в большей степени соответствует размеру катиона меди (1.44 Å).
Таблица 2.
Размеры катионов и полости краун-эфиров
| Ион | Ионный диаметр, Å | Краун-эфир | Диаметр полости, Å |
|---|---|---|---|
| Na+ | 2.04 | 15-краун-5 | 1.7–2.2 |
| Ag+ | 2.52 | 18-краун-6 | 2.6–3.2 |
| K+ | 2.76 | 18-краун-6 | 2.6–3.2 |
| Cs+ | 3.34 | 18-краун-6 | 2.6–3.2 |
| Zn2+ | 1.48 | 15-краун-5 | 1.7–2.2 |
| Cu2+ | 1.44 | 15-краун-5 | 1.7–2.2 |
| Au+ | 2.74 | 18-краун-6 | 2.6–3.2 |
| Cd2+ | 1.94 | 15-краун-5 | 1.7–2.2 |
| Hg+ | 1.52 | 15-краун-5 | 1.7–2.2 |
| Hg2+ | 2.20 | 15-краун-5 18-краун-6 |
1.7–2.2 2.6–3.2 |
| Pb2+ | 2.40 | 18-краун-6 | 2.6–3.2 |
| Sr2+ | 2.72 | 18-краун-6 | 2.6–3.2 |
Цезий
Цезий является основным продуктом деления урана и наиболее распространенным радионуклидом в загрязняющих окружающую среду радиоактивных отходах. В этом отношении 137Cs – один из наиболее опасных изотопов, обладающий высокой растворимостью в воде. При авариях на АЭС, в частности при взрыве на Чернобыльской АЭС или повреждении АЭС “Фукусима-дайити” в результате землетрясения, в окружающую среду было выброшено значительное количество радиоактивного цезия, что привело к опасному ее загрязнению.
Наиболее сложной задачей является извлечение ионов Cs+ из природной воды соленых озер или сточных вод, содержащих различные типы ионов. Эти ионы увеличивают ионную силу обрабатываемого раствора и, кроме того, могут составлять конкуренцию цезию в процессе сорбции. Фактически, в водных растворах ионы цезия часто сосуществуют с другими щелочными ионами, такими как Li+, Na+ и K+.
Одним из эффективных сорбентов ионов цезия, способных извлекать эти ионы даже в присутствии высоких концентраций других ионов, является система Fe3O4 – 18-краун-6-эфир [22]. Разработанный сорбент обладает суперпарамагнитными свойствами, что обеспечивает легкую переработку и высокую емкость адсорбции их на КЭ. Величина равновесной адсорбционной емкости из солевых растворов, содержащих 0.75 моль/л соли одного иона, составляет 0.182, 0.063, 0.041, 0.023, 0.019 и 0.014 ммоль/г для ионов Cs+, ${\text{NH}}_{{\text{4}}}^{ + },$ Rb+, K+, Na+ и Li+ соответственно. Еще большее различие наблюдается при проведении сорбции из растворов, содержащих одинаковые концентрации солей этих металлов (при общей концентрации солей в растворе 4.5 ммоль/л). В этом случае максимальная адсорбционная емкость составляет 0.1226, 0.0217, 0.0113, 0.0063, 0.011, 0.009 ммоль/г соответственно. Порядок изменения сорбционной активности в обоих случаях совпадает с порядком изменения ионных диаметров исследованных ионов.
Таким образом, в присутствии в растворе ионов ${\text{NH}}_{{\text{4}}}^{ + },$ Rb+, K+, Na+ и Li+ полученный сорбент обладает благоприятной селективностью в отношении Cs+, особенно в системах с несколькими ионами. Такое поведение обусловлено соответствием между размерами полости 18-краун-6-эфира (2.6–3.2 Å) и иона цезия, в то время как сосуществующие катионы (${\text{NH}}_{{\text{4}}}^{ + },$ Rb+, K+, Na+ и Li+) имеют меньшие ионные радиусы, чем Cs+, что несколько затрудняет формирование стабильных хелатных структур с 18-краун-6-эфиром.
Полученные экспериментальные результаты хорошо согласуются с теоретическими расчетами, проведенными на основании теории функционала плотности. Таким образом, Fe3O4–18-краун-6-эфир обладает высоким сродством к ионам Cs+ и действительно является эффективным сорбентом Cs+ в водных растворах. Как следует из данных, приведенных в работе [68], логарифм константы устойчивости (lgK1) комплекса 18-краун-6-эфира с ионом Cs+ составляет 0.99.
Для извлечения цезия из радиоактивных сточных вод использовался другой класс циклических макроэфиров – каликс-краун-эфиры [69–75]. Эффективность экстракции зависит от природы добавляемого к обрабатываемой системе разбавителя и изменяется в том же порядке, что и его диэлектрическая проницаемость [69]. При общей дозе радиации до 1000 кГр оптимальными разбавителями, обеспечивающими наиболее эффективную экстракцию, являются октиловый и изодециловый спирты.
Дибензо-24-краун-8-эфир (DB24C8), внедренный в мезопористый кремнезем, обладает высокой адсорбционной способностью по отношению к цезию (77.70 мг/г) и сохраняет селективность по отношению к нему даже в присутствии в растворе Na+ и K+ в высокой концентрации [76]. Несмотря на то, что DB24C8 во избежание разрушения координационных структур не был связан с диоксидом кремния ковалентными связями, сорбент обладает достаточно высокой стабильностью в процессе сорбции. Адсорбционная емкость сорбента практически не изменялась в течение несколько циклов регенерации. Исследовалась также сорбция цезия с использованием сорбента на основе ДБ24С8, импрегнированного в полимерную матрицу [77].
Набухающие в воде гидрогели на основе сополимеров акриловой кислоты с акриламидом, содержащие привитый бензо-18-краун-6-эфир (B18C6Am), обладают высокой сорбционной селективностью по отношению к ионам цезия за счет образования “сэндвичевых” комплексов Cs+ и B18C6Am [78]. Наличие в полимерной матрице звеньев акриловой кислоты является дополнительным фактором, усиливающим сорбционную емкость сорбента. Это обусловлено тем, что помимо комплексообразования Cs+ с КЭ в этой системе происходит также электростатическое взаимодействие между положительно заряженными ионами Cs+ и присутствующими в полимерной цепи отрицательно заряженными группами –СОО– акриловой кислоты. Адсорбция Cs+ гидрогелем B18C6Am протекает с высокой скоростью по реакции псевдовторого порядка и завершается в течение 30 мин.
Стронций
Другим долгоживущим изотопом, наносящим большой вред окружающей среде и здоровью человека, является образующийся в процессе деления урана изотоп 90Sr, легко растворимый в воде. Решением проблемы извлечения стронция из сточных вод занимаются во многих исследовательских лабораториях.
Соответствие между размерами ионного радиуса Sr и полости 18-краун-6-эфира (см. табл. 2) позволяет использовать для извлечения стронция в качестве хелатообразующего агента сорбенты на основе 18-краун-6-эфира и его замещенных аналогов. Подробный обзор выполненных до 2010 года исследований по использованию различных сорбентов на основе этого эфира и некоторых его производных для извлечения стронция из растворов представлен в работе [79].
Существенное влияние на активность сорбентов оказывает природа матрицы, в которую внедрены молекулы КЭ. Одним из перспективных материалов для такой матрицы являются нанотрубки, в частности титанатные нанотрубки. Основными свойствами, которые позволяют использовать одномерные титанатные нанотрубки, являются их высокие значения удельной поверхности [80, 81] и ионообменной емкости [82–85]. Однако немодифицированные нанотрубки титаната обладают малой селективностью по отношению к стронцию и низкой эффективностью в процессе сорбции, что ограничивает область их применения.
Для повышения селективности выделения ${\text{Sr}}_{{\text{2}}}^{ + }$ из водного раствора нитрата стронция в качестве сорбента использовали композит, состоящий из титанатных нанотрубок, пропитанных дициклогексано-18-краун-6-эфиром (ТНТ–DCH18C6) [25]. Исследование влияния добавок этого препарата к раствору азотной кислоты показало, что количество извлеченного из раствора Sr2+ неуклонно возрастает с увеличением концентрации HNO3 от 1 до 6 моль/л. Равновесная адсорбционная способность при этом увеличилась от 38.3 мг/г до максимального значения в 49 мг/г; в этих условиях из раствора удалялось более 95% Sr2+. Дальнейшее увеличение концентрации азотной кислоты до 7 моль/л сопровождалось некоторым уменьшением эффективности сорбции. Такой же эффект оказывает увеличение ионной силы обрабатываемого раствора при добавлении к нему NaNO3.
В отличие от ТНТ–DCH18C6 немодифицированные титанатные нанотрубки демонстрируют лучшую адсорбцию только в основном растворе (при pH около 10) с максимальным равновесным поглощением Sr2+, равным 24.67 мг/г [86]. Такое их поведение показывает, что в отличие от сорбентов на основе 18-краун-6-эфира и его производных, иммоблизованных кремний-органическими связующими [56, 87], сорбент ТНТ–DCH18C6 является достаточно стабильным в агрессивной кислой среде.
Эффективный сорбент AM–ZrP для извлечения стронция из кислых растворов получен путем интеркаляции 4-амино-бензо-18-краун-6-эфира в межслойную структуру α-цирконийфосфата (Zr(HPO4)2 ∙ H2O) [27]. Помимо исключительной селективности в отношении Sr2+ сорбент AM–ZrP, так же как и рассмотренный выше ТНТ–DCH18C6, обладает превосходной термостабильностью, стабильностью в кислотных растворах и при воздействии радиации. Отметим, что сорбция Sr2+ в полости на AM–ZrP протекает с высокой скоростью. Максимальная сорбционная способность AM–ZrP к Sr2+ составляет 320.16 мг/г. По этому показателю AM–ZrP значительно превосходит другие сорбенты на основе циркония (табл. 3).
Таблица 3.
Адсорбция Sr2+ на сорбентах на основе циркония [27]
| Сорбент | рН | Сорбционная емкость, мг/г |
|---|---|---|
| Аморфный фосфат циркония | 11.4 | 134.2 |
| Пористый фосфат циркония, монолит | 7.0 | 22 |
| Фосфат циркония на активированном угле | 6.0 | 2.9 |
| ZrO2–TiO2 | 9.0 | 28.01 |
| Фосфат циркония | 1.0 | 34 |
| Цветкоподобный α-ZrP | 4.0 | 293.43 |
| ZrP–SO3H | 4.0 | 183.21 |
| α-ZrP | 5.0 | 63.14 |
| AM–ZrP | 5.0 | 320.16 |
При добавлении AM–ZrP около 90% присутствующих в исходном растворе ионов Sr2+ сорбируется в течение первых 60 мин. Равновесное состояние достигается примерно за 150 мин.
Активность сорбента AM–ZrP для выделения Sr2+ была исследована и на сложных системах, моделирующих радиоактивные сточные воды и содержащих различные ионы металлов, такие как Cs+, K+, Na+, Eu3+, La3+, Ni2+. Показано, что AM–ZrP демонстрирует превосходную способность селективного удаления Sr2+ из таких систем в присутствии HNO3. По этому показателю AM–ZrP заметно превосходит α-ZrP. Такое различие свидетельствует о том, что для улучшения селективности очень важна интеркаляция 4-амино-бензо-18-краун-6-эфира в α-ZrP. С одной стороны, внедрение 4-аминобензо-18-краун-6-эфира расширяет межслоевое расстояние α-ZrP и увеличивает скорость контакта адсорбента и адсорбата. С другой – размер полости 4-амино-бензо-18-краун-6-эфира соответствует размеру ионного радиуса Sr2+, а логарифм константы устойчивости комплекса (lgK1) Sr2+ c дибензозамещенным 18-краун-6-эфиром равен 1.00 [68]. Все эти факторы обуславливают отличную селективность сорбента AM–ZrP при извлечении Sr2+ из растворов, содержащих ионы других металлов.
Еще одним сорбентом для извлечения Sr2+ из водных растворов является система, состоящая из 4,4',(5')-ди(трет-бутилциклогексано)-18-краун-6-эфира (DtBuCH18C6), иммобилизованного в виде раствора в 1-октаноле в порах подложки из макропористых частиц SiO2–P [88]. Этот сорбент обладает селективностью извлечения Sr2+ из радиоактивных отходов с высоким уровнем активности, содержащих такие типичные продукты деления, как Мо6+, Y3+, La3+, Ru3+, Cs1+, а также Na+ и K+.
При пропускании через хроматографическую колонку, заполненную (DtBuCH18C6 + Oct)/ SiO2–P, 2.0 М раствора HNO3, содержащего ~5.0 ⋅ ⋅ 10–3 моль/л исследуемых металлов, в колонке оставался только Sr2+, который затем можно было удалить из колонки чистой водой.
Сорбционная активность 4,4'(5')-бис(трет-бутилциклогексо)-18-краун-6-эфира, иммобилизованного в виде раствора в октаноле на инертной полимерной подложке, в процессе отделения Sr от связанных элементов (Na, K, Ca, Mg и Ba) была исследована в работе [41]. При использовании в качестве элюента 8.0 М HNO3 пропускание такой смеси солей через заполненную сорбентом хроматографическую колонку приводит к моментальному элюированию Ba и связанных с ним элементов, тогда как Sr удерживался в колонке. Затем адсорбированный Sr можно было удалить из колонки при замене элюента на 0.05 М HNO3. Такой метод был проверен при определении содержания Sr в карбонате бария (BaCO3) и в морской воде и дал отличные результаты.
Следует отметить, что авторы работы [89] полагают, что более эффективным разбавителем ди-(трет-бутилциклогексано)-18-краун-6-эфира, используемого для синтеза сорбентов на его основе, является не 1-октанол, а нитробензол или 1,7-тригидрододекафторгептанол-1.
Литий
Способность краун-эфиров сорбировать катионы металлов из растворов привелa к широкому применению этих соединений для хроматографического разделения металлов, к числу которых относятся и изотопы 6Li и 7Li. Применяемые в ядерной энергетике 6Li и 7Li имеют разные сечения поглощения тепловых нейтронов и продукты реакций. Как следствие, сферы их применения несколько различны. В то время как 6Li обычно используется в качестве замены радиоактивного, нестабильного и неудобного в обращении трития, жидкий 7Li, благодаря высокой удельной теплоемкости и низкому сечению захвата тепловых нейтронов, служит эффективным теплоносителем в ядерных реакторах.
Краун-эфиры, в частности 15-краун-5-эфир и его производные, благодаря соответствию диаметра их полости размеру катиона лития, в течение ряда лет широко использовались в качестве функциональных экстракционных агентов для разделения изотопов лития [90–96]. Сравнительно недавно была разработана хроматографическая система на основе PSf-g-AB15C5, позволяющая эффективно осуществлять количественное разделение изотопов лития 6Li+ и 7Li+ [62, 63]. Коэффициент разделения изотопов, достигнутый в результате одностадийной мембранной хроматографии, составляет 1.0232. Увеличение числа стадий элюирования приводило к постепенному повышению содержания 7Li+ и 6Li+. Относительные содержания 7Li+ и 6Li+, полученные в результате четырехстадийной мембранной хроматографии, увеличились на 0.26% (с 92.40 до 92.66%) и 0.2% (с 7.60 до 7.80%) соответственно.
При воздействии бензо-15-краун-5-эфира на систему хлороформ–вода, содержащую йодид лития, методом ИК-спектроскопии установлено комплексообразование КЭ с LiI в органической фазе [66]. Коэффициент разделения изотопов в этой системе для пары 6Li–7Li составил 1.017, причем более легкий изотоп лития концентрируется в органической фазе.
Для адсорбционного разделения изотопов лития методом фазовой инверсии в работе [64] была изготовлена пористая мембрана, состоящая из смеси поливинилацетата и хитозана, импрегнированного бензо-15-краун-5-эфиром. Увеличение в смеси доли импрегнированного хитозана от 20 до 50 вес.% приводило к постепенному изменению пальцеобразной структуры мембраны до губчатой структуры, причем средний размер пор увеличивался с 0.33 до 0.73 мкм. Изменение степени иммобилизации КЭ в хитозане от 1.07 до 2.60 ммоль/г сопровождалось увеличением коэффициента одностадийного разделения изотопов с 1.008 до 1.046. Изотопы 6Li и 7Li в этом случае концентрировались в мембранной и водной фазах соответственно.
Эффективный сорбент для извлечения ионов лития из водных растворов, содержащих другие ионы, был получен в результате иммобилизации окси-дибензо-14-краун-4-эфира в углеродные нанотрубки [97]. При использовании этого сорбента эффективность сорбции изменялась в следующем ряду: Li+ > Na+ > Mg2+ > Ca2+, K+, Sr2+.
Другие радионуклиды
Эффективность новых ионообменников, в частности поли-(акриламид – акриловая кислота – акрилонитрил)-4,4'(5)-ди-трет-бутил-бензо-18-краун-6-эфир [P(AM-AA-AN)-DAM/DtBB18C6], поли-(акриламид – акриловая кислота – акрилонитрил)-N,N'-метилендиакриламид-дибензо-18-краун-6-эфир [P(AM-AA-AN)-DAM/DB18C6] и поли-(акриламид – акриловая кислота – акрилонитрил)-N,N'-метилендиакриламид-18-краун-6-эфир [P(AM-AA-AN)-DAM/18C6], исследовалась в процессе хроматографического извлечения некоторых радионуклидов [48].
Извлечение радионуклидов 134Cs, 60Co, 65Zn и (152 + 154)Eu из жидких радиоактивных отходов с низким уровнем активности проводилось на хроматографических колонках, заполненных P(AM-AA-AN)-DAM/DtBB18C6, через которые пропускали растворы солей металлов, содержащих соответствующие радионуклиды. Установлено, что этот полимерный сорбент в солевой форме Na+ является более эффективным, чем в форме Н+. При замене в полимере акриловой кислоты на акрилат натрия эффективность сорбции 137Cs, 134Cs, 60Co и 65Zn изменяется от 9, 13.3, 33 и 56.3% до 55.1, 54, 87.6 и 88.4% соответственно.
Подобный эффект наблюдался и в других исследованиях. Так, в экстракционной хроматографии для улучшения эффективности разделения катионов ионообменную смолу активируют раствором NaCl [49–55]. Следует отметить, что при сорбции ионов цезия полимерный сорбент в виде Na+-формы является также более эффективным, чем его K+-форма. Это связано с меньшим различием ионных радиусов Cs+ (1.67 Å) и K+ (1.38 Å) по сравнению с Cs+ и Na+ (1.02 Å). Поэтому ион K+ в большей степени конкурирует с ионом Cs+ в процессе сорбции, т.е. может внедряться в полость 18-краун-6-эфира, что и приводит к меньшей эффективности сорбента на основе K+-формы P(АМ-АA-АN)-DАМ.
Для получения радиофармпрепаратов используется связывание короткоживущих радионуклидов, таких как 64Cu, 67Cu, 88Y, 90Y, 89Zr, 212Pb, 177Lu, 212Bi, 213Bi, 225Ac, с азокраун-эфирами [98]. Варьирование размера макроцикла, введение новых и модификация присутствующих в макроцикле заместителей позволяет значительно улучшить хелатирующие свойства лигандов, а также повысить устойчивость образующихся комплексных соединений. В частности, комплексы радионуклидов с 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислотой (DOTA), содержащей в своем составе макроцикл, обладают высокой термодинамической и кинетической стабильностью. Однако присоединение этого лиганда к радиоактивным катионам протекает с малой скоростью, и образование комплексов наблюдается лишь при высокой температуре. Наибольшей эффективностью комплекс DOTA обладает в случае связывания катионов редкоземельных металлов, имеющих заряд 3+, а также Bi3+.
Для очистки поверхности нержавеющей стали от ионов 137Cs и 90Sr раствор поливинилбутираля в диоксане, содержащий различные КЭ, наносили на обрабатываемую поверхность [99]. В результате испарения растворителя на поверхности образуется полимерная пленка, способная экстрагировать радионуклиды. В зависимости от природы краун-эфира эффективность сорбентов при экстракции 137Cs возрастает в ряду 12-краун-4 < 18-краун-6 < дициклогексил-18-краун-6 < 15-краун-5, а при экстракции 90Sr – в ряду 15-краун-5 < дициклогексил-18-краун-6 < 18-краун-6 < 12-краун-4. Радиоактивность поверхности после трехкратной обработки полимерными растворами с такими добавками имеет значения, близкие к фоновым.
Гафний, цирконий
Благодаря очень малому сечению захвата тепловых нейтронов не содержащий гафния цирконий и его сплавы находят широкое применение в ядерной промышленности. Во всех земных месторождениях цирконию сопутствует гафний, который вследствие изоморфного замещения атома Zr входит в минералы циркона. Среднее содержание гафния в циркониевых рудах составляет 2.5 вес.%. Обычно для отделения гафния от циркония использовались различные ионообменники [100, 101]. Недавно для разделения этих элементов был разработан более эффективный твердый экстрагент (SGN18), который представляет собой силикагель, содержащий 17 вес.% привитого к нему дибензо-18-краун-6-эфира [23].
Сорбционная способность SGN18 при экстракции из водных растворов, содержащих соли Zr4+ и Hf4+, в значительной степени зависит от кислотности раствора и возрастает при повышении величины рН от 0.5 до 1.5. Поглощение ионов циркония и гафния сорбентом DB18C6 протекает с одинаковой скоростью. Максимальная концентрация адсорбированных ионов Zr4+ и Hf4+ при рН = 1.5 составляет соответственно 420.88 и 18.71 мкмоль/г. Такое различие в активности этого сорбента при экстракции Zr4+ и Hf4+ обусловлено тем, что энергия связи Hf4+ с комплексом DB18C6 выше, чем для Zr4+. С повышением кислотности адсорбционная способность SGN18 сначала (в интервале рН от 0.5 до 1.5) возрастает, а при дальнейшем увеличении рН раствора вплоть до рН = 2.0–2.5 – значительно уменьшается, но затем вновь увеличивается в интервале рН = 2.5–3.0.
Такое влияние кислотности раствора на сорбционную активность сорбента обусловлено существованием различных форм Zr4+ и Hf4+ в разных диапазонах значений pH. В водном растворе Zr4+ существует в различных формах, таких как Zr4+, ZrO2+, [Zr(OH)]3+, [Zr(OH)2]2+, [Zr(OH)4 и [Zr(OH)5]–, но преобладающей его формой в растворе вплоть до pH = 3 является ZrO2+ [56, 102]. Именно наличием в растворе различных форм Zr4+, обладающих различным сродством к сорбенту, можно объяснить изменение его эффективности при изменении рН водного раствора. Найденный экспериментально более высокий коэффициент извлечения Zr4+ из раствора по сравнению с Hf4+ хорошо соответствует результатам, полученным с использованием теории функционала плотности для комплексов [Zr–(DB18C6)] и [Hf–(DB18C6)] [23].
Серебро
Согласно российским санитарным нормам серебро относится к “высокоопасным” химическим веществам, и предельно допустимая концентрация серебра в питьевой воде составляет 0.05 мг/л [103]. При длительном поступлении в организм избыточных доз серебра развивается аргирия, внешне выражающаяся в серой окраске слизистых оболочек и кожи, причем преимущественно на освещенных участках тела вследствие отложения частичек восстановленного серебра. Ионы серебра оказывают генотоксичный эффект, разрушая целостность молекул ДНК в клетках, в том числе вызывая перестройки в хромосомах и фрагментацию последних.
Мезопористый кремнезем, модифицированный диаминобензозамещенным производным 18-краун-6-эфира (MSCD), является эффективным сорбентом, позволяющим селективно извлекать ионы Ag+ из водных растворов, содержащих соли других металлов [24]. По своей эффективности этот сорбент превосходит используемые ранее препараты, не содержащие краун-эфиров [104, 105]. При проведении сорбции при комнатной температуре и концентрации в растворе 10 мг/л Ag+, Cu2+, Zn2+ и Pb2+ адсорбционная способность модифицированного мезопористого кремнезема по серебру составляет 24.6 мг/г, что в 1.7 раза выше, чем для немодифицированного кремнезема. Максимальная адсорбционная емкость достигается в течение 2 ч. В то же время адсорбционная способность MSCD для ионов Cu2+, Zn2+ и Pb2+ составляет 5.11, 4.18 и 7.58 мг/г соответственно.
Увеличение концентрации соли до 80 мг/л приводит к увеличению адсорбционной емкости до 46.2 и 17.0 мг/г для MSCI и немодифицированного адсорбента соответственно. Адсорбционная емкость по отношению к другим ионам при этом практически не изменяется. Сорбент MSCD является химически стабильным и пригоден для многократного использования. После обработки этим сорбентом раствора с начальной концентрацией Ag+, равной 10 мг/л, остаточная концентрация иона серебра в растворе составляет менее 0.04 мг/л, т.е. ниже значения предельно допустимой дозы [103].
Эффективным сорбентом для серебра являются также сорбенты на основе хитозана: CTSDC и CCTSDC [59], обладающие, как это видно из приведенных в табл. 1 данных, высокой селективностью при отделении содержащихся в водных растворах ионов серебра от ионов других металлов.
ЗАКЛЮЧЕНИЕ
Приведенные в обзоре данные свидетельствуют о возможности получения высокоэффективных сорбентов на основе КЭ для извлечения ряда радиоактивных и тяжелых металлов, которые могут присутствовать в виде солей в коммунальных сточных водах, а также в отходах различных промышленных производств. Высокая скорость сорбционных процессов с участием композитов на основе КЭ, относительно невысокая стоимость этих продуктов, а также их высокая сорбционная емкость и селективность по отношению к извлекаемым элементам указывают на перспективность использования таких сорбентов в очистных сооружениях в промышленных масштабах. Приведенные в обзоре данные могут помочь в выборе подходящих сорбентов для конкретных приложений.
Работа выполнена за счет субсидии, выделенной ИХФ РАН (с мая 2019 г. – ФИЦ ХФ РАН) на выполнение государственного задания по теме 45.22 “Фундаментальные основы создания наноструктурированных систем нового поколения с уникальными эксплуатационными свойствами” (АААА-А18-118012390045-2), и при финансовой поддержке Российским фондом фундаментальных исследований в рамках проекта № 18-29-25038_мк.
Список литературы
Рощин А.В., Усин В.В. // Хим. физика. 2017. Т. 36. № 7. С. 3.
Wilmarth W.R., Lumetta G.I., Johnson M.E. et al. // Solvent Extr. Ion Exch. 2011. V. 29. P. 1.
Shou H., Connery K.E., Bartsch R.A. et al. // Ibid. 2013. V. 31. № 7. P. 683.
Григорьев Е.И., Трахтенберг Л.И. // Рос. хим. журн. 1998. Т. 62. С. 101.
Burlakova E.B., Goloschapov A.N., Gurevich S.M. et al. // Eur. J. Oncol. 1998. V. 3. № 4. P. 367.
Grigor’ev E.I., Trakhtenberg L.I. Radiation-Chemical Processes in Solid State. USA: CRC Press, 1996.
Григорьева Г.А., Волков В.И., Николаев Н.И. и др. Ионный обмен. М.: Химия, 1981.
Morovov A.P., Danilin L.D., Zhimailo V.V. et al. // Adv. X-ray Anal. 1998. V. 41. P. 822.
Фегтле Ф., Вебер Э. Химия комплексов “гость–хозяин”, синтез, структуры и применение. М.: Химия, 1988.
Хираока М. Краун-соединения. Свойства и применения. М.: Мир, 1986.
Izatt R.M., Bradshaw J.S., Nielsen S.A. et al. // Chem. Rev. 1985. V. 85. P. 271.
Izatt R.M., Pawlak K., Bradshaw J.S. et al. // Ibid. 1991. V. 91. P. 1721.
Григорьев Е.И., Нестеров С.В., Трахтенберг Л.И. // ЖФХ. 1995. Т. 69. № 10. С. 1735.
Grigor’ev E.I., Nesterov S.V., Trakhtenberg L.I. // Environmental Applications of Ionizing Radiation / Ed. Cooper W.J., Curry R.D., O’Shea K.E. N.Y.: J. Wiley and Sons, Inc., 1998.
Zagorevskaya E.V., Kovaleva N.V. // J. Chromatogr. 1986. V. 361. № 1. P. 7.
Черноплекова В.А., Григорьев Е.И., Ковалева Н.В. и др. // ЖФX. 1991. Т. 65. № 11. С. 3028.
Загоревская Е.В., Ковалева Н.В., Ларионов О.Г. и др. // Там же. 1992. Т. 66. № 4. С. 1021.
ogami M., Haratani T., Tachibana Y. et al. // J. Radioanal. Nuclear Chem. 2015. V. 303. P. 1549
Левкин А.В. // Тез. докл. IX Всесоюз. конф. по экстракции. М.: Наука, 1991. С. 57.
Абакумов Н.И., Ремез В.П. // Тез. докл. II Всесоюз. конф. по теоретической и прикладной радиационной химии. М.: Наука, 1990. С. 5.
Григорьев Е.И., Нестеров С.В., Трахтенберг Л.И. Сорбент для очистки водных сред от ионов металлов и способ его получения. Патент РФ 2057146, 1996.
Liu Z., Zhou Y., Guo M. et al. // J. Hazard. Mater. 2019. V. 371. P. 712.
Qin W., Xu S., Xu G. et al. // Chem. Eng. J. 2013. V. 225. P. 528.
Hong M., Wang X., You W. et al. // Ibid. 2017. V. 313. P. 1278.
Ma J., Zhang Y., Ouyang J. et al. // Solid State Sci. 2019. V. 90. P. 49.
Du L.-J., Hu Y.-H., Wang Q.-Y. et al. // Food Chem. 2018. V. 262. P. 118.
Mu W., Yu Q., Gu J. et al. // Sep. Purif. Technol. 2020. V. 240. P. 116658.
Khan A.S., Baldwin W.G., Chow A. // Canad. J. Chem. 1981. V. 59. № 10. P. 1490.
Сухан В.В., Назаренко Н.Ю., Михайлов П.И. // Укр. хим. журн. 1990. Т. 56. № 1. С. 43.
Al-Aminar S.M.S., Ashworth D.C., Narayanaswamy K. et al. // Talanta. 1989. V. 36. № 6. P. 645.
Nahum W.H., Hozwath C. // J. Chromatogr. 1981. V. 203. № 1. C. 53.
Muller F.R., Yandel H., Guglielmetti R. // Helv. Chem. Acta. 1983. V. 66. №25. P. 1525.
Percelay L., Appriou P., Handel H. et al. // Anal. Chem. Acta. 1988. V. 209. P. 249.
Paredas R.S., Valera N.S., Lindoy L.F. // Aust. J. Chem. 1986. V. 39. P. 1071.
Louvet V., Handel H., Appriou P. et al. // Europ. Polym. J. 1987. V. 23. P. 585.
Пасекова Н.А., Плетнев И.В., Формановский А.А. и др. // Вестн. МГУ. Сер. 2, Химия. 1991. Т. 32. № 6. С. 607.
Богатский А.В., Лукьяненко Н.Г., Пастушок В.Н. // Докл. АН СССР. 1983. Т. 272. № 1. С. 115.
Басюк В.А. // Журн. аналит. химии. 1991. Т. 46. № 4. С. 741.
Blasius E., Jansen K.P. // Instr. J. Chem. 1985. V. 26. P. 25.
Брук М.А., Павлов С.А. Полимеризация на поверхности твердых тел. М.: Химия, 1990.
Wu S.-C., Sun C.-Y. // Chin. Chem. Lett. 2013. V. 24. № 7. P. 633.
Громов В.Ф., Герасимов Г.Н., Иким М.И. и др. // Хим. физика. 2020. Т. 39. № 5. С. 59.
Громов В.Ф., Герасимов Г.Н., Иким М.И. и др. // Хим. физика. 2020. Т. 39. № 11. С. 67.
Tsukanov A.V., Dubonosov A.D., Bren V.A. et al. // Chem. Heterocyclic Comp. 2008. V. 44. P. 899.
Трахтенберг Л.И., Щукин Е.Р., Герасимов Г.Н. и др. // Хим. физика. 2006. Т. 25. С. 50.
Grigor’ev E.I., Mikhalitsyna O.V., Nesterov S.V. et al. // Mendeleev Commun. 1994. № 2. P. 66.
Grigor’ev E.I., Glebova O.V., Nesterov S.V. и дp. // Radiat. Phys. Chem. 1995. V. 45. № 4–6. P. 553.
Attallah M.F., Borai E.H., Hilal M.A. et al. // J. Hazard. Mater. 2011. V. 195. P. 73.
Attallah M.F. Ph.D. Thesis. Cairo, Egypt: Chemistry Department, Faculty of Science, Ain Shams University, 2009.
Attallah M.F., Borai E.H., Allan K.F. // Radiochem. 2009. V. 51. № 6. P. 622.
Borai E.H., Hilal M.A., Attallah M.F. et al. // Radiochim. Acta. 2008. V. 96. P. 44.
Shehata F.A., Attallah M.F., Borai E.H. et al. // Appl. Radiat. Isot. 2010. V. 68. P. 239.
Borai E.H., Harjula R., Malinen L. et al. // J. Hazard. Mater. 2009. V. 172. P. 416.
Siyam T., Abdel-Hamid M.M., El-Naggar I.M.M. // Macromol. Rep. A. 1995. V. 32. P. 871.
Siyam T., El-Naggar I.M., Aly H.F. // Proc. Intern. Topical Meeting on Nuclear and Hazards Waste Management (Spectrum-96). La Grange Park, Ill.: American Nuclear Society, 1996. P. 66.
Zhang A., Wei Y.-Z., Kumagai M. et al. // J. Radioanal. Nucl. Chem. 2004. V. 262. P. 739.
Wang J., Zhuang S. // Nucl. Eng. Technol. 2020. V. 328. P. 52.
Ng J.C.Y., Cheung W.H., McKay G. // J. Coll. Inter. Sci. 2002. V. 255. P. 64.
Ding S., Zhang X., Feng X. et al. // React. Funct. Polym. 2006. V. 66. P. 357.
Baba Y., Kawano Y., Hirakawa H. // Bull. Chem. Soc. Jpn. 1996. V. 69. P. 1255.
Michiaki M., Toshiyuki S., Kazuo K. // Sep. Purif. Technol. 2002. V. 29. P. 229.
Pei H., Yan F., Wang Z. et al. // J. Chromatogr. A. 2019. V. 1602. P. 206.
Pei H., Yan F., Ma X. et al. // Eur. Polym. J. 2018. V. 109. P. 288.
Zeng Y., Pei H., Wang Z. et al. // ACS Omega. 2018. V. 3. № 1. P. 554.
Nishizawa K., Ishino S.-I., Watanabe H. et al. // J. Nucl. Sci. Technol. 1984. V. 21. P. 694.
Шокурова Н.А., Демина Л.И., Жилов В.И. и др. // ЖФХ. 2016. Т. 60. С. 787.
Трахтенберг Л.И., Герасимов Г.Н., Громов В.Ф. и др. // ЖФХ. 2004. Т. 78. № 4. С. 696.
Абрамов А.А. // Вестн. МГУ. Сер. 2, Химия. 2000. Т. 41. № 1. С. 3.
Rajeswari A.S., Kadam B.R.M. // J. Environ. Chem. Eng. 2019. V. 7. № 4. P. 103216.
Зарипов С.Р. Дис. … канд. хим. наук. Казань: Казанский федеральный университет, 2018.
Zhang A., Zhang W., Wang Y. et al. // Separ. Purif. Technol. 2016. V. 171. P. 17.
Wang J., Zhuang S. // Nucl. Eng. Technol. 2020. V. 52. P. 328.
Jagasia P., Dhami P.S., Mohapatra P.K. et al. // J. Environ. Chem. Eng. 2017. V. 5. P. 4134.
Raut D.R., Mohapatra P.K., Ansari S.A. et al. // Desalination. 2008. V. 232. P. 262.
Liu C., Zhang D.X., Zhao L.T. et al. // Appl. Sci. 2016. V. 6. P. 212.
Awual M.R., Yaita T., Taguchi T. et al. // J. Hazard Mater. 2014. V. 278. P. 227.
Губа Л.В, Довгий И.И., Ляпунов А.Ю. и др. // Радиохимия. 2015. Т. 57. № 5. С. 518.
Yu H.-R., HuJ.-Q., Liu Z. et al. // J. Hazard. Mater. B. 2017. V. 323. P. 632.
Бежин Н.А., Довгий И.И. // Успехи химии. 2015. Т. 84. С. 1279.
Xiong L., Yang Y., Mai J.X. et al. // Chem. Eng. J. 2010. V. 156. P. 313.
Xu M.Z., Wei G.D., Li S. et al. // J. Nanosci. Nanotechnol. 2011. V. 12. P. 6374.
Kukovecz Á., Kordás K., Kiss J. at al. // Surf. Sci. Rep. 2016. V. 71. P. 473.
Madarász D., Pótári G., Sápi A. et al. // Phys. Chem. Chem. Phys. 2013. V. 15. P. 15917.
Madarász D., Szenti I., Sápi A. et al. // Chem. Phys. Lett. 2014. V. 591. P. 161.
Pusztai P., Puskás R., Varga E. et al. // Phys. Chem. Chem. Phys. 2014. V. 16. P. 26786.
Kasap S., Piskin S., Tel H. // Radiochim. Acta. 2012. V. 100. P. 925.
Ye G., Bai F.F., Wei J.C. et al. // Procedia Chem. 2012. V. 7. P. 616.
Zhang A., Xiao C., Liu Y. et al. // J. Porous Mater. 2010. V. 17. P. 153.
Dovhyi I. // J. Nucl. Med. Radiat. Therapy. 2016. V. 7. № 6 (Suppl). P. 48.
Kim D.W., Lee N.S., Kim C.S. et al. // Eur. Polym. J. 2002. V. 38. P. 2101.
Ban Y., Nomura M., Fujii Y. // J. Nucl. Sci. Technol. 2002. V. 39. P. 279
Otake K., Suzuki T., Kim H.-J. et al. // Ibid. 2006. V. 43. P. 419.
Boda A., Ali S.M., Rao H. et al. // J. Mol. Model. 2012. V.18. P. 3507.
Xiao J., Jia Y., Shi C. et al. // J. Mol. Liq. 2017. V. 241. P. 946.
Sugiyama T., Sugiura K. // Fusion Sci. Technol. 2017. V. 71. P. 473.
Cui L., Yang X., Wang J. et al. // Chem. Eng. J. 2019. V. 358. P. 435.
Torrejos R.E.C., Nisola G.M., Park M.J. et al. // Ibid. 2015. V. 264. P. 89.
Егорова Б.В., Федорова О.А., Калмыков С.Н. // Успехи химии. 2019. Т. 88. С. 901.
Кумпаненко И.В., Рощин А.В., Иванова Н.А. и др. // Хим. физика. 2015. Т. 34. № 2. С. 82.
Hubicki Z. // Solvent Extr. Ion Exc. 1988. V. 6. P. 183.
Poriel L., Pellet-Rostaing S., Lamotte V. et al. // Sep. Sci. Technol. 2006. V. 41. P. 2711.
Milonjic S., Boskovic M., Ceranic T. // Ibid. 1992. V. 27. P. 1643.
СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. М.: Минздрав РФ, 2002.
Camagong C.T., Honjo T. // Anal. Bioanal. Chem. 2002. V. 373. P. 856.
Song. X., Li C., Xu R. et al. // Ind. Eng. Chem. Res. 2012. V. 51. P. 11261.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика