Химическая физика, 2021, T. 40, № 10, стр. 76-84
Времязависимый захват O3 и NO2 на покрытии из метановой сажи в условиях их конкурентной адсорбции
В. В. Зеленов 1, *, Е. В. Апарина 1
1 Федеральный исследовательский центр химической физики
им. Н.Н. Семёнова Российской академии наук
Черноголовка, Россия
* E-mail: v.zelenov48@gmail.com
Поступила в редакцию 24.02.2021
После доработки 06.04.2021
Принята к публикации 20.04.2021
Аннотация
С использованием проточного реактора с подвижной вставкой и масс-спектрометрической регистрации установлен и исследован захват O3 (6.6 ⋅ 1012–4.3 ⋅ 1013 cм–3) на покрытии из метановой сажи, предварительно экспонированном к потоку NO2 до полного прекращения его захвата. Исходя из зависимости коэффициента захвата от времени экспозиции и концентрации О3, предложено аналитическое представление коэффициента захвата γ(t) = γ (t = 0)exp(–krθt), γ (t = 0) = γ0/(1 + KL[O3]), выраженное через элементарные параметры, такие как амплитудная величина коэффициента захвата γ0, коэффициент Лэнгмюра KL и константа скорости kr мономолекулярного распада. Аналитические зависимости получены в предположении механизма захвата, происходящего через реакцию на поверхности с адсорбированной частицей. На основании этих параметров, а также параметров для захвата NО2 и O3 на свежей поверхности метановой сажи обсуждается модель захвата О3 и NО2 в условиях их конкурентной адсорбции. Сделаны оценки влияния дополнительного канала стока О3 на твердых продуктах захвата NO2 на величину коэффициентов захвата и характерное время переработки сажи при типичных приземных концентраций этих газов-реагентов.
ВВЕДЕНИЕ
Химический состав атмосферы формируется потоками аэрозолей различного происхождения с земной поверхности и химически активных газовых составляющих, а также их последующими превращениями вследствие химических реакций. Состав этих потоков определяется различными процессами природного и антропогенного происхождения, включающими жизнедеятельность почвенной биоты и морского планктона, лесные пожары, грозовые разряды, сгорание топлив в двигателях внутреннего сгорания и многими другими [1–7]. Малые газовые составляющие NO2 и O3 участвуют в процессах окисления органических соединений [8–13], а твердые продукты окисления сажевого аэрозоля характеризуются повышенной токсичностью [14, 15]. К настоящему времени имеется множество данных полевых измерений содержания NO2 и O3 в приземном слое тропосферы. Относительное количество NO2 в экологически чистых местностях вдали от густонаселенных регионов составляет от 1 до 8 ppb а среднее содержание O3 равно 20–70 ppb [16–19]. Существенное превышение относительных концентраций NO2 до 50 ppb наблюдается над мегаполисами, при этом содержание озона достигает пиковых значений: 80–100 ppb [16, 19–23].
К настоящему времени уже создан ряд математических моделей, предназначенных для долговременного прогноза химического состава атмосферы [24, 25]. Входными параметрами для этих моделей служат совокупность массовых потоков природных загрязнителей, характерных для данного региона, погодообразующие факторы, такие как динамика воздушных масс и солнечная радиация, а также совокупность кинетических параметров, описывающих взаимодействие отдельных компонентов.
Экспериментальные работы по изучению гетерогенных реакций NO2 и O3 с сажами горения топлив достаточно многочисленны [26]. Измерены коэффициенты захвата каждого из этих реагентов при варьировании их концентраций, определены газофазные и твердые продукты их реакции на поверхности саж. Исходя из данных по захвату отдельных газов, был проанализирован совместный захват газов-реагентов NO2 и O3 с учетом их конкурентной адсорбции на бензапирене как представителе полициклических ароматических соединений [27].
Целью данной работы было экспериментальное исследование захвата NO2 и O3 как на свежих образцах метановой сажи при варьировании концентрации каждого реагента, так и при последовательной обработке сажи сначала одним реагентом, а затем другим. Полученные результаты позволили получить оценку ряда кинетических параметров захвата на базе общепринятой лэнгмюровской модели конкурентной адсорбции с учетом дополнительного канала стока О3 на твердых продуктах реакции NO2 с сажевым покрытием.
ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА
Исследование захвата газа-реагента NO2 на свежем сажевом покрытии с последующим захватом О3 проводили с использованием проточного реактора с подвижным стержнем и масс-спектрометрическим детектированием газофазных реагентов и продуктов методом электронной ионизации [28]. Реактор сопряжен с секторным магнитным масс-спектрометром высокого разрешения. Сажевое покрытие наносили на стержень в пламени диффузионного горения метана без дополнительной подачи окислителя.
В проточном реакторе основной поток гелия протекает по стеклянной трубке, покрытой тефлоновой пленкой марки Teflon FEP, и через регулируемый вентиль откачки. Потоки разбавленных газов-реагентов в гелии подаются в зону контакта с сажевым покрытием через боковые вводы. Стержень из нержавеющей стали с сажевым покрытием перемещается вдоль оси реактора через разделительную стеклянную трубку из компенсирующего объема, в котором он находится до момента начала измерения, в зону контакта. Перемещение стержня проводится с помощью внешнего магнита. Через компенсирующий объем подается дополнительный поток гелия во избежание неконтролируемого диффузионного потока газа-реагента в обратном направлении и отравления сажевого покрытия до начала измерения. Отбор пробы в масс-спектрометр проводится в виде молекулярного пучка через отверстие диаметром 0.35 мм в вершине напускного конуса, расположенного соосно с трубкой реактора.
Основные параметры реактора
Внутренний диаметр трубки реактора dR = 1.3 см; внешний диаметр стержня из нержавеющей стали dr = 0.2 см; максимальная длина стержня L = 50 см; давление p = 1–2 Торр; скорость потока газа-носителя гелия u = 100–400 см ⋅ с–1.
Приготовление и состав реакционной смеси
Озон приготавливали из кислорода марки “ОСЧ”, перемораживали в пропассивированный фтором бачок из нержавеющей стали и добавляли гелий до давления в 1 атм. Абсолютную концентрацию озона в реакторе определяли на основе материального баланса при полном его переводе в кислород путем нагрева участка трубки подачи. Калибровку масс-спектрометра по кислороду и двуокиси азота проводили в отдельном опыте при известном давлении в реакторе и заданном потоке смеси газа-реагента с гелием. Измерения интенсивностей ионных токов O3 (m/z = 48), NO2 (m/z = 46) и O2 (m/z = 32) проводили при энергии ионизирующих электронов Ee = 50 эВ для О3 и NO2 и Ee = 12.5 эВ для О2. В последнем случае исключается вклад осколочного иона ${\text{О}}_{2}^{ + }$ из масс-спектра озона.
Нанесение сажи
Сажу наносили на металлический стержень в пламени метана с использованием лабораторной горелки, присоединенной к газовой магистрали, без дополнительной подачи воздуха. Согласно техническим условиям по содержанию дезодорирующих присадок в бытовом газе присутствуют производные меркаптана в количестве 0.0036 г ⋅ м–3. Таким образом, в составе сажи могут быть твердые продукты окисления этих присадок. Поверхностная плотность покрытия ρm составляла не более 120 мкг ⋅ см–2 и во всех случаях не превышала величины, при которой необходимо учитывать пористость покрытия [29, 30].
Процедура измерения и обработка данных
При рабочих скоростях потока и давлении в реакторе кинетика расхода газа-реагента при его захвате на сажевом покрытии после его ввода в зону контакта описывается уравнением первого порядка:
(1)
${{ - d\left[ {{\text{М}}({{t}_{c}},t)} \right]} \mathord{\left/ {\vphantom {{ - d\left[ {{\text{М}}({{t}_{c}},t)} \right]} {d{{t}_{c}}}}} \right. \kern-0em} {d{{t}_{c}}}} = {{k}_{w}}(t)\left[ {{\text{М}}({{t}_{c}},t)} \right],$(2)
$\gamma {\text{(}}t{\text{)}} = \frac{{{\text{ln(}}{{{{I}^{0}}} \mathord{\left/ {\vphantom {{{{I}^{0}}} {I{\text{(}}t{\text{)}}}}} \right. \kern-0em} {I{\text{(}}t{\text{)}}}}{\text{)}}}}{{{{t}_{c}}}}\frac{{d_{R}^{{\text{2}}}}}{{{{c}_{{\text{M}}}}{{S}_{{spec}}}{{\rho }_{m}}{{d}_{r}}}},$Времязависимый захват NO2 и O3 на сажевом покрытии
Для предварительной обработки сажи потоком NO2 стержень со свежим покрытием периодически вводили в поток газа-реагента до полного прекращения его захвата. Условия обработки и временнóй профиль измеряемой концентрации NO2 приведен на рис. 1. Соответствующие этому профилю значения времязависимого коэффициента захвата NO2 на свежей сажевой поверхности, вычисленные по формуле (2), приведены на рис. 2 светлыми символами. Аналогичным образом проводили предварительную обработку покрытия потоком озона для проверки возможного последующего захвата на этой поверхности двуокиси азота. Результат этой процедуры приведен на рис. 3, а значения рассчитанного времязависимого коэффициента захвата приведены на рис. 2 темными символами. Видно, что формы этих зависимостей для обоих газов-реагентов идентичны: наблюдается быстрый начальный захват и его последующее медленное уменьшение до практически нулевого значения. Ранее при исследовании захвата О3 на покрытии из метановой сажи была предложена модель захвата, которая описывала такую форму временнóй зависимости коэффициента захвата [28]. Согласно модели захват протекает по двухстадийному механизму реакции с адсорбированной частицей на поверхности [24, 31]. На первой стадии захвата образуются комплексы адсорбированной молекулы на активных поверхностных центрах с их последующим мономолекулярным распадом. В результате образуются новые, менее реакционно-способные центры, на которых происходит повторный захват по тому же механизму. Исходя из этого представления, времязависимый коэффициент захвата описывается формулой
(3)
$\gamma (t) = {{\gamma }_{r}}\exp ( - {{a}_{r}}t) + {{\gamma }_{s}}\exp ( - {{a}_{s}}t)[1 - \exp ( - {{a}_{r}}t)].$Рис. 1.
Предварительная обработка свежего сажевого покрытия реагентом NO2 при следующих условиях: [NO2] = = 4.4 ⋅ 1013 см–3, Т = 295 К, давление в реакторе p = 2 Торр, ΔL = 40 см, средняя скорость потока гелия u = 108 см ⋅ с–1, масса навески сажи на единичную поверхность стержня ρm = 116 мкг ⋅ см–2; ⚪ – измеряемая концентрация NO2 в отсутствие стержня с покрытием, ⚫ – концентрация NO2 при вставленном стержне в поток NO2.
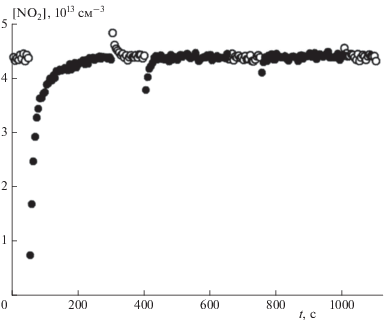
Рис. 2.
Захват газов-реагентов на свежем покрытии из метановой сажи: ⚪ – коэффициент захвата NO2 из данных рис. 1, ⚫ – коэффициент захвата О3 из данных рис. 3, сплошные кривые – аппроксимация по формуле (3) с параметрами из табл. 1.

Рис. 3.
Предварительная обработка свежего сажевого покрытия реагентом O3 при следующих условиях: [O3] = 1.6 ⋅ 1013 см–3, Т = 295 К, давление в реакторе p = 1.2 Торр, ΔL = 20 см, средняя скорость потока гелия u = 310 см ⋅ с–1, масса навески сажи на единичную поверхность стержня ρm = 95 мкг ⋅ см–2: ⚪ – измеряемая концентрация O3 в отсутствие стержня с покрытием, ⚫ – концентрация O3 при вставленном стержне в поток O3.

Таблица 1.
Параметры аппроксимации по формуле (3) коэффициента времязависимого захвата NO2 и О3 на свежем сажевом покрытии из рис. 2
| Газ-реагент | γr, 10−4 | ar, c−1 | γs, 10−5 | as, 10−2 c−1 |
|---|---|---|---|---|
| [NO2] = 4.4 ⋅ 1013 см−3 | 0.45 ± 0.1 | 0.15 ± 0.04 | 0.61 ± 0.1 | 1.7 ± 0.1 |
| [O3] = 1.6 ⋅ 1013 см−3 | 3.5 ± 0.1 | 0.16 ± 0.07 | 4 ± 0.2 | 1.3 ± 0.1 |
Параметры, определяющие эту зависимость, представляют собой комбинацию элементарных констант, описывающих процесс захвата:
(4)
${{\gamma }_{r}} = {{\gamma _{r}^{0}} \mathord{\left/ {\vphantom {{\gamma _{r}^{0}} {\left( {1 + {{K}_{L}}\left[ {{{{\text{O}}}_{3}}} \right]} \right)}}} \right. \kern-0em} {\left( {1 + {{K}_{L}}\left[ {{{{\text{O}}}_{3}}} \right]} \right)}},\,\,\,\,{{\gamma }_{s}} = {{\gamma _{s}^{0}} \mathord{\left/ {\vphantom {{\gamma _{s}^{0}} {\left( {1 + {{K}_{L}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right]} \right)}}} \right. \kern-0em} {\left( {1 + {{K}_{L}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right]} \right)}},$(6)
$\theta = {{{{K}_{L}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right]} \mathord{\left/ {\vphantom {{{{K}_{L}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right]} {\left( {1 + {{K}_{L}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right]} \right)}}} \right. \kern-0em} {\left( {1 + {{K}_{L}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right]} \right)}},$Для того чтобы убедиться в идентичности механизмов захвата О3 и NO2, был исследован захват NO2 на свежем сажевом покрытии и получена зависимость величины коэффициента захвата от времени экспозиции и концентрации NO2 в диапазоне 1 ⋅ 1012–4.4 ⋅ 1013 см–3. Экспериментальные зависимости, пример которых приведен на рис. 2, аппроксимировали по формуле (3). Полученная совокупность значений параметров γr и γs приведена на рис. 4, а значения параметров ar и as – на рис. 5. Результат аппроксимации зависимостей этих параметров в соответствии с предложенным механизмом захвата приведен в табл. 2. Здесь же приведены аналогичные параметры коэффициента захвата О3 на свежем покрытии из метановой сажи. Коэффициент Лэнгмюра KL и амплитудная величина коэффициента захвата $\gamma _{{r,s}}^{0}$ выражаются через элементарные параметры [28]:
Рис. 4.
Параметры γr и γs времязависимого захвата NO2 на свежем покрытии из метановой сажи от [NO2]: ⚪ – быстрая стадия захвата (масштаб 1 : 1); ⚫ – последующая, медленная стадия захвата (масштаб по вертикали 1 : 10). Сплошные прямые – аппроксимация по формуле (4) с параметрами $\gamma _{{r,s}}^{0}$ и KL из табл. 2.

Рис. 5.
Параметры ar и as времязависимого захвата NO2 на свежем покрытии из метановой сажи от [NO2]: ⚪ – быстрая стадия захвата (масштаб 1 : 1); ⚫ – последующая, медленная стадия захвата (масштаб по вертикали 10 : 1). Сплошные кривые – аппроксимация по формуле (5) с параметрами kr и KL из табл. 2.

Таблица 2.
Элементарные параметры, определяющие времязависимый коэффициент захвата в аналитическом представлении по формулам (3), (4)
| Адсорбат/адсорбент | $K_{L}^{r},$ 10−14 см3 | kr1, c−1 | ${{\gamma }_{r}},$ 10−4 |
|---|---|---|---|
| Первая, быстрая стадия | |||
| О3/сажа [28] | 7 ± 1 | 0.39 ± 0.05 | 6.6 ± 0.4 |
| NO2/сажа | 5.7 ± 0.7 | 0.22 ± 0.02 | 1.6 ± 0.2 |
| O3/сажа + NO2 | 3.5 ± 1 | 0.2 ± 0.06 | 1.5 ± 0.2 |
| Вторая, медленная стадия | |||
| О3/сажа [28] | 11 ± 2 | 2.8 ± 0.1 | 13 ± 2 |
| NO2/сажа | 6.3 ± 1.7 | 2.6 ± 0.3 | 2.1 ± 0.3 |
| O3/сажа + NO2 | 3.0 ± 0.8 | 2.0 ± 0.5 | 2.2 ± 0.5 |
При исследовании захвата NO2 (1.4 ⋅ 1013 см–3) на сажевом покрытии, предварительно обработанном потоком О3, установлено практически полное отсутствие захвата с остаточной величиной коэффициента захвата, равной (6 ± 2) ⋅ 10–7. Однако поверхность, предварительно обработанная потоком NO2, остается реакционно-способной к захвату О3. На рис. 6 приведены результаты вычисления коэффициента захвата О3 при его захвате на поверхности, полученной после обработки потоком NO2 в тех же условиях, что и в случае рис. 1. Захват исследовался при двух различных концентрациях O3 на двух одинаковых участках поверхности: на первых 20 см – при [O3] = 6.6 ⋅ ⋅ 1012 см–3 до полного прекращения захвата, затем на следующих 20 см – при [O3] = 4.3 ⋅ 1013 см–3.
Рис. 6.
Времязависимый захват О3 на сажевом покрытии, предварительно обработанном потоком NO2: точки – экспериментальные данные по коэффициенту захвата при исходной концентрации озона 6.6 ⋅ 1012 (⚪) и 4.3 ⋅ 1013 см–3 (⚫); жирные кривые – аппроксимация по формуле (3) с параметами из табл. 3, тонкие кривые – вклады из первичного и повторного захватов.

Вид зависимости на рис. 6 аналогичен зависимостям на рис. 2, поэтому в предположении того же механизма захвата проведена аппроксимация этих зависимостей по формуле (3) с параметрами из табл. 3. Для сравнения в этой же таблице приведены параметры, определяющие коэффициент захвата О3 на свежем покрытии. Из экспериментальных значений γr, γs, ar, as при двух концентрациях О3 из табл. 3 и их представлений через элементарные параметры KL, kr, $\gamma _{{r,s}}^{0}$ по формулам (4)–(6) мы получаем оценку этих параметров для захвата О3 на сажевом покрытии после его обработки потоком NO2. Их величины приведены в табл. 2.
Таблица 3.
Влияние предварительной обработки сажевого покрытия потоком газа-реагента NO2 на времязависимый захват О3
| Тип покрытия | γr, 10−4 | ar, c−1 | γs, 10−5 | as, 10−2 c−1 |
|---|---|---|---|---|
| [O3] = 6.6 · 1012 см−3 | ||||
| Свежее [28] | 4.5 ± 0.3 | 0.12 ± 0.02 | 7.5 ± 1.3 | 1 ± 0.2 |
| Обработанное | 1.2 ± 0.1 | 0.04 ± 0.01 | 1.9 ± 0.2 | 0.4 ± 0.1 |
| [O3] = 4.3 · 1013 см−3 | ||||
| Свежее [28] | 1.65 ± 0.2 | 0.29 ± 0.02 | 2.27 ± 0.48 | 2.1 ± 0.1 |
| Обработанное | 0.58 ± 0.07 | 0.11 ± 0.02 | 1.5 ± 0.1 | 1 ± 0.1 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
С учетом дополнительного расхода озона на твердых продуктах реакции NO2 его захват в условиях конкурентной адсорбции NO2 и О3 можно представить следующей схемой на основе общепринятой лэнгмюровской модели адсорбции:
(R1)
$\begin{gathered} {{{\text{O}}}_{{\text{3}}}}\left( {\text{г}} \right) + {{z}_{r}}\left( {{\text{тв}}} \right)\underset{{{{k}_{{d1}}}}}{\overset{{{{k}_{a}}}}{\longleftrightarrow}}{{{\text{O}}}_{3}} \ldots {{z}_{r}}\xrightarrow{{{{k}_{{r1}}}}} \\ \to {\text{О}} \ldots {{z}_{r}}\left( {{\text{тв}}} \right) + {{{\text{О}}}_{2}}\left( {\text{г}} \right), \\ \end{gathered} $(R2)
$\begin{gathered} {\text{N}}{{{\text{O}}}_{2}}\left( {\text{г}} \right) + {{z}_{r}}\left( {{\text{тв}}} \right)\underset{{{{k}_{{d2}}}}}{\overset{{{{k}_{a}}}}{\longleftrightarrow}}{\text{N}}{{{\text{O}}}_{2}} \ldots {{z}_{r}}\xrightarrow{{{{k}_{{r2}}}}} \\ \to {{z}_{{{\text{N}}{{{\text{O}}}_{2}}}}}\left( {{\text{тв}}} \right) + {\text{NО}}\left( {\text{г}} \right)\,\,{\text{и}}\,\,{\text{HONO}}\left( {\text{г}} \right), \\ \end{gathered} $(R3)
$\begin{gathered} {{{\text{O}}}_{{\text{3}}}}\left( {\text{г}} \right) + {{z}_{{{\text{N}}{{{\text{O}}}_{2}}}}}\left( {{\text{тв}}} \right)\underset{{{{k}_{{d3}}}}}{\overset{{{{k}_{a}}}}{\longleftrightarrow}}{{{\text{O}}}_{3}} \ldots {{z}_{{{\text{N}}{{{\text{O}}}_{2}}}}}\xrightarrow{{{{k}_{{r1}}}}} \\ \to {{z}_{{fin}}}\left( {{\text{тв}}} \right) + {{{\text{О}}}_{2}}\left( {\text{г}} \right). \\ \end{gathered} $Газофазные продукты реакций (R1) и (R2) обнаружены ранее в ряде работ [32–36]. Дополнительно в модель включена совокупность элементарных процессов (R3). Они включают обратимую адсорбцию на твердых продуктах реакции NO2, образование комплекса с адсорбированной молекулой и его последующий мономолекулярный распад.
В лэнгмюровском представлении конкурентной адсорбции плотность поверхностных центров [O3…zr], [NO2…zr] и [O3…${{{\text{z}}}_{{{\text{N}}{{{\text{O}}}_{{\text{2}}}}}}}$] определяется долей адсорбированных молекул на исходных центрах zr, зависящей от концентраций обоих адсорбатов в газовой фазе:
(7)
$\begin{gathered} {{\theta }_{{{\text{N}}{{{\text{O}}}_{2}}}}} = \\ = {{{{K}_{{L,{\text{N}}{{{\text{O}}}_{{\text{2}}}}}}}[{\text{N}}{{{\text{O}}}_{2}}]} \mathord{\left/ {\vphantom {{{{K}_{{L,{\text{N}}{{{\text{O}}}_{{\text{2}}}}}}}[{\text{N}}{{{\text{O}}}_{2}}]} {(1 + {{K}_{{L,{{{\text{O}}}_{{\text{3}}}}}}}[{{{\text{O}}}_{3}}] + {{K}_{{L,{\text{N}}{{{\text{O}}}_{2}}}}}[{\text{N}}{{{\text{O}}}_{2}}])}}} \right. \kern-0em} {(1 + {{K}_{{L,{{{\text{O}}}_{{\text{3}}}}}}}[{{{\text{O}}}_{3}}] + {{K}_{{L,{\text{N}}{{{\text{O}}}_{2}}}}}[{\text{N}}{{{\text{O}}}_{2}}])}}, \\ \end{gathered} $(8)
${{J}_{{{\text{R}}2}}}\left( t \right) = {{k}_{{r2}}}{{\theta }_{{{\text{N}}{{{\text{O}}}_{2}}}}}\left[ {{{{\text{z}}}_{r}}\left( t \right)} \right],$Из определения коэффициента захвата газа-реагента как отношения его реакционного потока к его суммарному потоку на единичную поверхность следует его выражение в виде
(9)
$\begin{gathered} {{\gamma }_{{{{{\text{O}}}_{3}}}}}\left( t \right) = {{4\left[ {{{J}_{{{\text{R1}}}}}\left( t \right) + {{J}_{{{\text{R}}3}}}\left( t \right)} \right]} \mathord{\left/ {\vphantom {{4\left[ {{{J}_{{{\text{R1}}}}}\left( t \right) + {{J}_{{{\text{R}}3}}}\left( t \right)} \right]} {{{c}_{{{{{\text{O}}}_{3}}}}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right]}}} \right. \kern-0em} {{{c}_{{{{{\text{O}}}_{3}}}}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right]}}, \\ {{\gamma }_{{{\text{N}}{{{\text{O}}}_{2}}}}}\left( t \right) = {{4{{J}_{{{\text{R}}2}}}\left( t \right)} \mathord{\left/ {\vphantom {{4{{J}_{{{\text{R}}2}}}\left( t \right)} {{{c}_{{{\text{N}}{{{\text{O}}}_{{\text{2}}}}}}}\left[ {{\text{N}}{{{\text{O}}}_{{\text{2}}}}} \right]}}} \right. \kern-0em} {{{c}_{{{\text{N}}{{{\text{O}}}_{{\text{2}}}}}}}\left[ {{\text{N}}{{{\text{O}}}_{{\text{2}}}}} \right]}}. \\ \end{gathered} $Реакционные потоки зависят от поверхностной плотности центров адсорбции, которая, в свою очередь, определяется системой уравнений
(10)
$ - \frac{d}{{dt}}[{{{\text{z}}}_{r}}] = ({{k}_{{r1}}}{{\theta }_{{{{{\text{O}}}_{3}}}}} + {{k}_{{r2}}}{{\theta }_{{{\text{N}}{{{\text{O}}}_{2}}}}})[{{{\text{z}}}_{r}}],$(11)
${{J}_{{{\text{R2}}}}}\left( t \right) = {{a}_{{{\text{N}}{{{\text{O}}}_{2}}}}}\left[ {{{{\text{z}}}_{0}}} \right]\exp \left( { - {{a}_{{tot}}}t} \right),$(12)
$\begin{gathered} \gamma _{{{{{\text{O}}}_{{\text{3}}}}}}^{{ampl}}\left( {t = 0} \right) = \\ = {{\gamma _{{{{{\text{O}}}_{{\text{3}}}}}}^{0}} \mathord{\left/ {\vphantom {{\gamma _{{{{{\text{O}}}_{{\text{3}}}}}}^{0}} {\left( {1 + {{K}_{{L,{{{\text{O}}}_{3}}}}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right] + {{K}_{{L,{\text{N}}{{{\text{O}}}_{{\text{2}}}}}}}\left[ {{\text{N}}{{{\text{O}}}_{{\text{2}}}}} \right]} \right)}}} \right. \kern-0em} {\left( {1 + {{K}_{{L,{{{\text{O}}}_{3}}}}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right] + {{K}_{{L,{\text{N}}{{{\text{O}}}_{{\text{2}}}}}}}\left[ {{\text{N}}{{{\text{O}}}_{{\text{2}}}}} \right]} \right)}}, \\ \gamma _{{{\text{N}}{{{\text{O}}}_{{\text{2}}}}}}^{{ampl}}\left( {t = 0} \right) = \\ = {{\gamma _{{{\text{N}}{{{\text{O}}}_{{\text{2}}}}}}^{0}} \mathord{\left/ {\vphantom {{\gamma _{{{\text{N}}{{{\text{O}}}_{{\text{2}}}}}}^{0}} {\left( {1 + {{K}_{{L,{{{\text{O}}}_{{\text{3}}}}}}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right] + {{K}_{{L,{\text{N}}{{{\text{O}}}_{{\text{2}}}}}}}\left[ {{\text{N}}{{{\text{O}}}_{{\text{2}}}}} \right]} \right)}}} \right. \kern-0em} {\left( {1 + {{K}_{{L,{{{\text{O}}}_{{\text{3}}}}}}}\left[ {{{{\text{O}}}_{{\text{3}}}}} \right] + {{K}_{{L,{\text{N}}{{{\text{O}}}_{{\text{2}}}}}}}\left[ {{\text{N}}{{{\text{O}}}_{{\text{2}}}}} \right]} \right)}} \\ \end{gathered} $Для одного из предельных случаев при 0.3 ppb О3 и 47 ppb NO2 в зимнее время на базе изложенной выше модели и значений элементарных параметров из табл. 2 оценка дает возрастание характерного времени переработки с 10 мин до 2.8 сут. Однако наличие конкурирующего реагента не влияет на величину амплитудных коэффициентов захвата О3 и NO2. Отметим, что оценка изменения характерного времени реакции проводилась для второй, медленной стадии захвата, поскольку именно она определяет максимальное время переработки сажи. При альтернативных условиях: 63 ppb О3 и 4 ppb NO2 (летом), характерное время обработки сажи остается малым и возрастает с 4 до 19 мин. Амплитудное же значение коэффициентов захвата обоих газов-реагентов вследствие их конкурентной адсорбции уменьшается в 1.2 раз. Таким образом, наличие дополнительного канала стока озона при его захвате на сажевом покрытии может существенно изменить представление о динамике его захвата.
ЗАКЛЮЧЕНИЕ
Захват NO2 на свежем сажевом покрытии протекает по механизму реакции на поверхности с адсорбированной молекулой и аналогичен механизму захвата O3 на таком же покрытии. Установлено, что сажа, обработанная реагентом NO2 до полного прекращения его захвата, остается реакционноспособной по отношению к О3. При этом механизм захвата О3 остается тем же, а захват NO2 на сажевом покрытии, экспонированном к потоку О3, пренебрежимо мал. На основе установленного механизма предложено аналитическое описание экспериментальных зависимостей коэффициента захвата от времени экспозиции и концентрации газа-реагента. В результате аппроксимации определены элементарные параметры, описывающие процесс захвата NO2 на свежем сажевом покрытии и захвата О3 на сажевом покрытии, обработанном потоком NO2. На базе лэнгмюровского представления о конкурентной адсорбции рассмотрена схема совместного захвата газов-реагентов NO2 и О3 на покрытии из сажи с учетом дополнительного канала захвата озона. Получена аналитическая зависимость коэффициентов захвата этих газов-реагентов от времени экспозиции и концентрации обоих адсорбатов. Сделана оценка влияния дополнительного канала захвата О3 на величину коэффициентов захвата и на характерное время обработки сажи в условиях типичных приземных концентраций NO2 и О3. Полученная оценка показывает ощутимое влияние дополнительного стока озона на динамику процесса его захвата в условиях конкурентной адсорбции.
Работа выполнена по программе фундаментальных исследований Российской академии наук (грант № АААА-А18-118112290069-6).
Список литературы
Laj P., J. Klausen J., Bilde M. et al. // Atmos. Environ. 2009. V. 43. P. 5351; https://doi.org/10.1016/j.atmosenv.2009.08.020
Folwer D., Steadman C.E., Stevenson D. et al. // Atmos. Chem. Phys. 2015. V. 15. P. 13849; https://doi.org/10.5194/acp-15-13849-2015
Vinken G.C.M., Boersma K.F., Maasakkers J.D., Adon M., Martin R.V. // Atmos. Chem. Phys. 2014. V. 14. P. 10363; https://doi.org/10.5194/acp-14-10363-2014
Knorr W., Dentener F., Lamarque J-F., Jiang L., Arneth A. // Atmos. Chem. Phys. 2017. V. 17. P. 9223; https://doi.org/10.5194/acp-17-9223-2017
DeCaria A.J., Pickering K.E., Stenchikov G.L., Ott L.E. // J. Geophys. Res. 2005. V. 110. D14303; https://doi.org/10.1029/2004JD005556
Shen L., Wang H., Kong X. et al. // Atmos. Environ. 2021. V. 246. P. 118152; https://doi.org/10.1016/j.atmosenv.2020.118152
Kholod N., Evans M., Kuklinski T. // Atmos. Chem. Phys. 2016. V. 16. P. 11267; https://doi.org/10.5194/acp-16-11267-2016
Diaz J., Ortiz C., Falcon I., Salvador C., Linares C. // Atmos. Environ. 2018. V. 187. P. 107; https://doi.org/10.1016/j.atmosenv.2018.05.059
Liu H., Liu S., Xue B. et al. // Atmos. Environ. 2018. V. 173. P. 223; https://doi.org/10.1016/j.atmosenv.2017.11.014
Karimi B., Shokrinezhad B. // Atmos. Environ. 2021. V. 246. P. 118161; https://doi.org/10.1016/j.atmosenv.2020.118161
Singh N., Mhawish A., Banerjee T. et al. // Atmos. Environ. 2021. V. 246. P. 118088; https://doi.org/10.1016/j.atmosenv.2020.118088
Ларин И.К. // Хим. физика. 2020. Т. 39. № 4. С. 44; https://doi.org/10.31857/S0207401X20040111
Евстафьева Е.В., Лапченко В.А., Макарова А.С. и др. // Хим. физика. 2019. Т. 38. № 11. С. 42; https://doi.org/10.1134/S0207401X19110037
Holder A.L., Carter B.J., Goth-Goldstein R., Lucas D., Koshland C.P. // Atmos. Pollut. Res. 2012. V. 3. P. 25; https://doi.org/10.5094/APR.2012.001
Зеленов В.В., Апарина Е.В., Козловский В.И. и др. // Хим. Физика. 2019. Т. 38. № 1. С. 86; https://doi.org/10.1134/S0207401X19010163
Lin J.-T., McElroy M.B. // Atmos. Environ. 2010. V. 44. P. 1726; https://doi.org/10.1016/j.atmosenv.2010.02.009
Martins D.K., Najjar R.G., Tzortziou M. et al. // J. Geophys. Res. Atmos. 2016. V. 121. P. 14175; https://doi.org/10.1002/2016JD024998
Ryan R.G., Rhodes S., Tully M. et al. // Atmos. Chem. Phys. 2018. V. 18. P. 13969; https://doi.org/10.5194/acp-18-13969-2018
Jurado X., Reiminger N., Vazquez J. et al. // Atmos. Environ. 2020. V. 221. P. 117087; https://doi.org/10.1016/j.atmosenv.2019.117087
Wang Y., Dörner S., Donner S. et al. // Atmos. Chem. Phys. 2019. V. 19. P. 5417; https://doi.org/10.5194/acp-19-5417-2019
Wang P., Wang T., Ying Q. // Atmos. Environ. 2020. V. 224. P. 117337; https://doi.org/10.1016/j.atmosenv.2020.117337
Roberts-Semple D., Song F., Gao Y. // Atmos. Pollut. Res. 2012. V. 3. P. 247; https://doi.org/10.5094/APR.2012.027
Oh I., Hwang M-K., Bang J-H. et al. // Atmos. Environ. 2021. V. 244. P. 117907; https://doi.org/10.1016/j.atmosenv.2020.117907
Pöschl U., Rudich Y., Ammann M. // Atmos. Chem. Phys. 2007. V. 7. P. 5989; www.atmos-chem-phys.net/7/5989/2007/
Shiraiwa M., Garland R.M., Poschl U. // Atmos. Chem. Phys. 2009. V. 9. P. 9571; https://doi.org/10.5194/acp-9-9571-2000
Burkholder J.B., Sander S.P., Abbatt J. et al. // Chemical Kinetics and Photochemical Data for Use in Atmospheric Studies. Evaluat № 18. Pasadena: JPL Publ., 2015; http://jpldataeval.jpl.nasa.gov
Kaiser J.C., Riemer N., Knopf D.A. // Atmos. Chem. Phys. Discuss. 2011. V. 11. P. 5127; https://doi.org/10.5194/acp-11-4505-2011
Зеленов В.В., Апарина Е.В. // Хим. физика 2021. Т. 40. № 5. С. 55; https://doi.org/10.31857/S0207401X21050149
Lelievre S., Bedjanian Yu., Pouvesle N. et al. // Phys. Chem. Chem. Phys. 2004. V. 6. P. 1181; https://doi.org/10.1039/b316895f
Karagulian F., Rossi M.J. // J. Phys. Chem. A. 2007. V. 111. P. 1914; https://doi.org/10.1021/jp0670891
Ammann M., Pöschl U., Rudich Y. // Phys. Chem. Chem. Phys. 2003. V. 5. P. 351; https://doi.org/10.1039/b208708a
Alcala-Jornod C., van den Bergh H., Rossi M.J. // Phys. Chem. Chem. Phys. 2000. V. 2. P. 5584; https://doi.org/10.1039/B0072350
Lelievre S., Bedjanian Yu., Laverdet G., Le Bras G. // J. Phys. Chem. A. 2004. V. 108. P. 10807; https://doi.org/10.1021/jp0469970
Aubin D.G., Abbatt J.P.D. // J. Phys. Chem. A. 2007. V. 111. P. 6263; https://doi.org/10.1021/jp068884h
McCabe J., Abbatt J.P.D. // J. Phys. Chem. C. 2009. V. 111. P. 2120; https://doi.org/10.1021/jp806771q
Liu Y., Liu C., Ma J., Ma Q., He H. // Phys. Chem. Chem. Phys. 2010. V. 12. P. 10896; https://doi.org/10.1039/c0cp00402b
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


