Химическая физика, 2021, T. 40, № 2, стр. 18-23
Новая водорастворимая форма BODIPY люминофоров на основе кремофора®: синтез, спектральные свойства и исследование in vitro
И. В. Клименко 1, *, А. А. Ксенофонтов 2, М. С. Клименко 3, Е. В. Антина 2, М. Б. Березин 2, А. В. Лобанов 1, 4
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Институт химии растворов им. Г.А. Крестова Российской академии наук
Иваново, Россия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
4 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
* E-mail: inna@deom.chph.ras.ru
Поступила в редакцию 02.07.2020
После доработки 02.07.2020
Принята к публикации 21.09.2020
Аннотация
Новая водорастворимая форма бор(III)дипиррометеновых люминофоров получена нами на примере 3,3′,5,5′-тетрафенил-ms-аза-2,2′-дипиррометената бора(III) (BODIPY) и кремофора® (полиэтиленгликоль, ПЭГ-40). Представлены результаты исследования спектрально-люминесцентных свойств изученных систем “BODIPY–кремофор®–водно-спиртовая среда”. Установлено, что кремофор® оказался единственным из серии исследованных вспомогательных веществ (ПЭГ-400, ПЭГ-1000, поливинилпирролидон, бычий сывороточный альбумин, натриевая соль карбоксиметилцеллюлозы), обеспечивающим солюбилизацию BODIPY в водной среде с сохранением интенсивных спектральных характеристик, в том числе флуоресценции, люминофора в красной области спектра. Проведено тестирование системы “BODIPY–кремофор®” на двух клеточных линиях мышей – метастазирующего рака молочной железы и неметастазирующего рака кожи. Установлено, что введение системы “BODIPY–кремофор®” в обе клеточные линии мышей приводит к отрыву клеточных культур от субстрата и подавлению развития раковых опухолей. Полученные результаты показали, что иммобилизация BODIPY в ПЭГ-40 в водно-спиртовой среде позволяет получать препараты c пролонгированным действием, которые возможно использовать в качестве фотосенсибилизаторов в фотодинамической терапии, а также для биовизуализации в клеточной биологии.
ВВЕДЕНИЕ
Фотодинамическая терапия (ФДТ) в настоящее время является одним из важнейших минимально инвазивных органосохраняющих методов лечения онкологических заболеваний. Данный метод основан на селективной деструкции целевых опухолевых тканей в результате фотохимических реакций, происходящих при облучении светом определенной длины волны накопленного в опухоли фотосенсибилизатора (ФС). Фотодинамический эффект достигается посредством генерации в процессе фотохимических реакций синглетного кислорода, а также других активных форм кислорода, обладающих цитотоксическим действием. При этом как в России, так и за рубежом в качестве фотосенсибилизаторов преимущественно используются красители порфиринового, хлоринового, пурпуринового, а также фталоцианинового и нафталоцианинового типа [1–3]. Одним из направлений развития метода ФДТ является поиск так называемого “идеального ФС” с высокой селективностью и ускоренной фармакодинамикой [3], который должен обладать и некоторыми специфическими фотофизическими свойствами, такими как поглощение в области “фототерапевтического окна” (600–850 нм) и энергией триплетного состояния более 0.98 эВ. Кроме того, наряду с отсутствием цитотоксичности ФС должен быть термодинамически стабилен, устойчив к окислительно-восстановительным процессам, которые могут быть вызваны клеточным окружением, и не склонен к агрегированию, приводящему к падению квантового выхода генерации синглетного кислорода.
Перспективными соединениями для использования в качестве ФС оказались представители достаточно “молодого” класса флуоресцентных красителей на основе бор(III)дипиррометенатов (BODIPY) [4]. Для люминофоров BODIPY характерны: поглощение и испускание в длинноволновой области видимого спектра, в которой биологические ткани наиболее оптически прозрачны; структурно регулируемые в широком диапазоне значений спектральные характеристики; высокие молярные коэффициенты экстинкции (~105 л ⋅ моль–1 ⋅ см–1) и квантовые выходы флуоресценции (до 99%), а также большие термическая и кинетическая стабильность [4, 5]. Однако большинство красителей BODIPY нерастворимы в воде, поэтому их использование в медицине и биохимии сопряжено с поиском путей получения тех или иных водорастворимых форм люминофоров без изменения их спектральных характеристик [6]. Одним из путей преодоления гидрофобности BODIPY является получение супрамолекулярных структур люминофоров с транспортными белками крови [5, 7–9], так как доказано, что транспорт ФС к клетке осуществляется за счет сывороточных белков – альбуминов, глобулинов и липопротеинов, при этом местами локализации ФС в клетке являются мембранные структуры [10–12].
Следует заметить, что поиск новых BODIPY для использования их в качестве ФС в фотодинамической терапии постоянно расширяется [13–23]. Наряду с этим разработка новых эффективных лекарственных форм BODIPY на основе различных супрамолекулярных структур и других многокомпонентных систем является наиболее актуальной задачей.
Нами получены новые водорастворимые формы BODIPY с использованием серии различных вспомогательных гидрофильных соединений: полиэтиленгликоли – ПЭГ-40 (кремофор®), ПЭГ-400, ПЭГ-1000, поливинилпирролидон (ПВП), бычий сывороточный альбумин (БСА), натриевая соль карбоксиметилцеллюлозы (Na-КМЦ) и изучены их фотофизические свойства. Эффективность лучшей с точки зрения фотофизических характеристик системы была протестирована на двух клеточных линиях: линия 4T1 – метастазирующий рак молочной железы и линия B16F0 – неметастазирующий рак кожи мышей. Первая линия клеток по своей морфологии подобна клеткам на 4-ой стадии рака молочной железы человека с аналогичным ростом и метастатическим распространением; она соответствует эпителиоцитам и растет в адгезионной культуре. Известно, что метастазы являются основной причиной смертности больных раком молочной железы, и исследования механизма возникновения метастазы и способов ее лечения являются центральными в исследовании раковых заболеваний. Вторая клеточная линия является слабоиммуногенной, что связано с низкой экспрессией МНС (главный комплекс гистосовместимости, играющий важную роль в иммунной системе и развитии иммунитета) I класса, по морфологии соответствует эпителиоцитам и растет в адгезионной культуре. Линия B16F0 была выведена от родительской линии B16F1 как клон со слабым метастатическим потенциалом, что дает возможность изучать первичный опухолевый рост [24].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе проанализированы спектральные характеристики систем на основе 3,3′,5,5′-тетрафенил-ms-аза-2,2′-дипирролилметена (BODIPY, рис. 1) и различных водорастворимых вспомогательных веществ. Исходный BODIPY синтезирован по авторской методике и охарактеризован [25] в Институте химии растворов им. Г.А. Крестова Российской академии наук.
Получение систем на основе BODIPY и водорастворимых вспомогательных веществ
Для приготовления растворов BODIPY с водорастворимыми соединениями использовали 0.1%-ный спиртовой раствор люминофора. В качестве растворителя применялся 96.6%-ный этанол (ОАО “СЭПТ”, спирт этиловый ректифицированный “Экстра”, ГОСТ Р51652-2000, C2H5OH). В качестве вспомогательных соединений использовали: 1%-ный (по массе) водный раствор ПВП (Sigma, (C6H9NO)n, 10 кДа); 0.5%-ный (по массе) водный раствор БСА (Sigma, USA); 0.1%-ный водный раствор Na-КМЦ (пищевая добавка Е466, [C6H7O2(OH)x(CH2COONa)y]n Acros, 250 кДа); 1%-ные (по массе) водные растворы полиэтиленгликолей (C2nH4n + 2On + 1): кремофора® (солюбилизатор гидрогенизированного касторового масла, ПЭГ-40), ПЭГ-400 (пищевая добавка E1521, ООО “ПраймКемикалсГрупп”) и ПЭГ-1000 (Merck). Все растворы хранили в темноте при температуре +4 °С. Выбор указанных водорастворимых вспомогательных веществ объясняется тем, что они являются распространенными биосовместимыми соединениями, входящими в состав фармакологических и косметических средств.
Электронные спектры поглощения (200–900 нм) регистрировали с помощью UV-vis спектрофотометра ТU-1901 фирмы “Beijing Purkinje General Instrument Co., Ltd”.
Электронные спектры испускания (480–800 нм) регистрировали с помощью спектрофлуориметра “Флюорат-02 Панорама” фирмы “Люмэкс”, λвозб = = 475 нм. Все измерения проводили при 293 K. Результаты измерений усреднены в серии из трех образцов для каждой структурной единицы.
Клеточные линии, использованные для тестирования и изучения действия наиболее эффективной с точки зрения фотофизических свойств системы:
1) клеточная линия 4T1 (ATCC № CRL 2539) – метастазирующий рак молочной железы мыши (Mus musculus, клетки молочной железы);
2) клеточная линия B16F0 (ATCC № CRL 6322) – неметастазирующий рак кожи мыши (Mus musculus, клетки кожи).
Культивирование клеток
Клетки рака молочной железы 4T1 и меланомы B16F0 размораживали, отмывали от среды для криоконсервации клеток базальной средой DMEM (НПП “ПанЭко”), не содержащей сыворотку, центрифугировали (10 мин, 1260 об/мин, 277 K), ресуспендировали в 1 мл раствора бычьего сывороточного альбумина в фосфатном буфере (ФБ–БСА, pH 7.4) и переносили на чашки Петри с питательной средой DMEM. Культивирование клеток проводили в соответствии с рекомендациями ATCC (American Type Culture Collection) с регулярными пассажами с интервалом 2–3 дня в полной среде DMEM (ЭТС – 10%, L-глютамин – 2 мM, заменимые аминокислоты, пируват натрия – 1 мM, пенициллин – 100 ЕД/мл, стрептомицин – 100 ЕД/мл). Клетки инкубировали при 310 К в атмосфере 5%-ного CO2. Для нового пассажа клетки наращивали до конфлюэнтности 80%. Чтобы снять адгезионные клетки (4T1), со дна чашки убирали питательную среду и добавляли 2 мл раствора трипсин– ЭДТА. Суспензию клеток собирали, разбавляли до 10 мл раствором ФБ–БСА. Для снятия суспензионной культуры клетки вместе со средой помещали в пробирки для дальнейшего осаждения. Клетки осаждали центрифугированием (10 мин, 1260 об/мин, 277 К). После определения концентрации клеток на проточном цитометре клетки ресуспендировали в 1 мл ФБ–БСА и переносили на чашки Петри с питательной средой по 200 тыс. на чашку.
Порядок проведения тестирования и изучения действия наиболее эффективной системы на клетках опухолей 4T1 и B16F0
На чашку Петри диаметром 60 мм с клеточной культурой в количестве 1 млн клеток вносили 3 мл среды DMEM и добавляли 1 мл синтезированной системы (состав системы: 100 мкг BODIPY на 3 мл водного раствора вспомогательного вещества). По прошествии 10, 30 и 60 мин проводили исследование клеток с помощью люминесцентного микроскопа “Альтами Люм 2” с тринокулярной насадкой для подключения фотоаппарата и галогенной лампой 6 В / 20 Вт. Фотографирование проводили в течение 1 мин, далее образец помещали в темный инкубатор до следующего фотографирования. Помимо фотографирования проводили подсчет клеток в 10 мкл на цитофлуориметре BD FACSAria II (BD Biosciences, USA) и параллельно – в камере Горяева. Полученные данные анализировали с использованием программных пакетов DIVA и Cytobank. Мертвые клетки отделяли от живых с помощью флуоресцентного красителя DAPI. Для дальнейшего анализа клетки отмывали 3 раза и собирали последний супернатант для контроля с помощью методов абсорбционной и флуоресцентной спектроскопии отсутствия в образцах супрамолекулярной системы. После сбора супернатанта к клеткам добавили 4 мл питательной среды и оставили в инкубаторе на 2 дня (Т = 310 К, 5%-ный CO2) для исследования жизнеспособности.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Электронный спектр поглощения 0.1%-ного спиртового раствора BODIPY, представленный на рис. 2 (кривая 1), характеризуется тремя полосами. Первая, наиболее интенсивная полоса с максимумом поглощения при 646 нм обусловлена S0–S1 электронным переходом, плечо на левом скате полосы вызвано 0–1 колебательным переходом [26]. Максимум второй, уширенной S0–S2- полосы, находится вблизи 476 нм. Третья полоса (S0–S3 электронный переход) с максимумом при 310 нм вызвана внутримолекулярным перераспределением электронной плотности с фенильных фрагментов на дипиррометеновое ядро BODIPY [27]. Сочетание фенильного и ms-аза-замещения позволяет достичь существенного смещения максимума S0–S1-полосы BODIPY в область “фототерапевтического окна” по сравнению со многими другими структурно-родственными дипиррометеновыми красителями [13, 28].
Рис. 2.
Электронные спектры поглощения: 0.1%-ного спиртового раствора BODIPY (1), 1%-ного водного раствора кремофора® (2), водно-спиртового раствора BODIPY (0.1%) (3) и системы “BODIPY (0.1%)–кремофор®” (4).
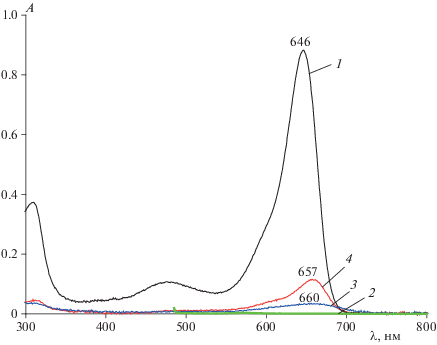
При исследовании спектральных свойств BODIPY в системах на основе серии изученных соединений (ПЭГ-40, ПЭГ-400, ПЭГ-1000, ПВП, БСА, Na-КМЦ) только кремофор® (ПЭГ-40) оказался единственным вспомогательным водорастворимым веществом, обеспечивающим солюбилизацию BODIPY в водной среде с сохранением поглощения и интенсивной флуоресценции люминофора в красной области спектра. ПЭГ-400 и ПЭГ-1000, как и другие выше перечисленные вспомогательные вещества, такой способности не обнаружили. Поэтому в дальнейшем обсуждение всех полученных экспериментальных данных будет связано только с системой BODIPY–кремофор® (ПЭГ-40).
В представленных для сравнения на рис. 2 электронных спектрах поглощения спиртового раствора BODIPY, водного раствора кремофора®, водно-спиртовых растворов BODIPY и системы “BODIPY–кремофор®” необходимо отметить отсутствие поглощения в видимой области спектра для водного раствора кремофора® и значительное (на 96%) снижение интенсивности полосы поглощения с красным сдвигом ее максимума на 14 нм в спектре BODIPY в водно-спиртовом растворе по сравнению с раствором в спирте. Причина наблюдаемого эффекта заключается в значительной агрегации гидрофобных молекул BODIPY вследствие низкой растворимости и плохой сольватируемости в водной среде.
В системе “BODIPY (0.1%)–кремофор®” красный сдвиг составляет 11 нм, а интенсивность полосы поглощения люминофора – более чем в два раза выше, чем в водно-спиртовом растворе. Отметим, что наблюдаемый красный сдвиг на величину 11–14 нм максимума спектра поглощения играет существенную роль для повышения эффективности ФДТ [1, 3, 29]. Анализ спектров испускания исследуемых систем (рис. 3) подтвердил отсутствие флуоресценции водного раствора кремофора® и показал, что в водно-спиртовом растворе флуоресценция BODIPY полностью потушена. Солюбилизация BODIPY кремофором® сопровождается незначительным (на 3 нм) батохромным сдвигом максимума полосы испускания BODIPY и разгоранием флуоресценции в ~1000 раз по сравнению с водно-спиртовым раствором люминофора. Наблюдаемые особенности электронных спектров поглощения и испускания системы “BODIPY–кремофор®” могут быть обусловлены дезагрегацией молекул BODIPY в менее полярном сольватном окружении кремофора® в отличие от плохо сольватирующей высокополярной водно-спиртовой среды. Необходимо отметить, что увеличение концентрации BODIPY в системе “BODIPY–кремофор®–водно-спиртовая среда” сопровождается увеличением интенсивности поглощения и испускания.
Рис. 3.
Спектры флуоресценции: 0.1%-ного спиртового раствора BODIPY (1), 1%-ного водного раствора кремофора® (2), водно-спиртового раствора BODIPY (0.1%) (3) и системы “BODIPY (0.1%)–кремофор®” (4).
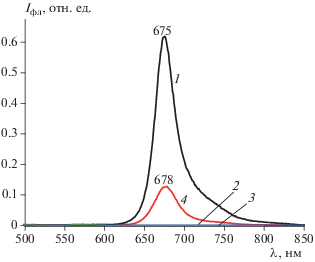
Известно, что изменением состава среды и концентрации люминофора можно влиять на спектральные характеристики систем [30] за счет варьирования вероятности интеркомбинационных переходов молекул красителей в триплетные состояния. Поэтому для апробирования полученной системы на клеточных линиях необходимо было подобрать наиболее оптимальную концентрацию водно-спиртового раствора “BODIPY–кремофор®”. По результатам серии спектральных исследований выбран следующий оптимальный состав системы: 100 мкл спиртового раствора BODIPY на 3 мл 1%-ного водного раствора кремофора®.
На рис. 4 представлены фотографии двух клеточных культур, сделанные до начала эксперимента и во время его проведения в течение 60 мин. Обе культуры обладают адгезионными свойствами (“липкостью” к субстрату), однако часть клеток культуры 4Т1 более “ошаренные” (круглые), чем клетки B16F0. При культивировании клеток, когда они не прикреплены к твердой поверхности или субстрату, на их способность к делению влияет их форма. Клетки, имеющие круглую форму, почти никогда не делятся. Исходное количество клеток до начала эксперимента составляло 1.33 млн/мл для 4T1 и 1.57 млн/мл для B16F0.
Рис. 4.
Фотографии клеточных культур 4Т1 (а) и B16F0 (б): 1 – до начала эксперимента; 2 – спустя 10 мин после начала эксперимента; 3 – спустя 30 мин после начала эксперимента; 4 – спустя 1 ч после начала эксперимента. Увеличение микроскопа – ×100.
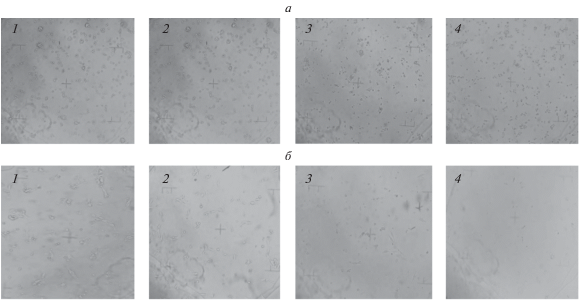
Через 10 мин после начала эксперимента в культуре 4Т1 наблюдается большое количество суспензионных (не прикрепленных к субстрату) клеток. Клетки, отделившиеся от субстрата, на котором они росли, уже, как правило, не способны к росту в суспензии и обычно деградируют. В культуре B16F0 также наблюдается “ошаривание” (округление) клеток и их отрыв от субстрата, что приводит к уменьшению количества видимых на фотографии клеток. Такой процесс может происходить за счет изменения энергии клеточной поверхности в результате включения в мембрану изнутри клетки веществ из раствора, а именно системы “BODIPY–кремофор®”. Это предположение также подтверждается данными спектрального анализа последнего супернатанта, на которых не были обнаружены даже следы исследуемой системы. Вероятно, в дальнейшем в процессе проведения тестирования действия системы на клетки опухолей практически все полученное нами вещество было включено в клетки.
Спустя 30–60 мин от начала эксперимента в культуре 4Т1 изменений не наблюдается. Клетки не прикреплены к субстрату (количество прикрепленных к субстрату клеток равно 0), но находятся около его поверхности. В культуре B16F0 все больше клеток теряют морфологические признаки и отрываются от субстрата, и через 60 мин почти все клетки переходят из адгезионного состояния в суспензионное и оказываются равномерно распределенными в растворе. Количество адгезионных клеток в данной культуре составило всего 20 тыс.
После окончания эксперимента проводили отмывание клеточных культур. Вместе с культуральной средой были смыты и все суспензионные клетки. Была поставлена проверка на жизнеспособность клеток: спустя два дня после инкубации (310 К, 5% CO2) ни одна из клеточных культур не выжила. Подсчет в камере Горяева подтвердил эти данные.
ЗАКЛЮЧЕНИЕ
Таким образом, проведенные спектральные исследования различных систем на основе BODIPY позволяют сделать вывод о перспективности дальнейших исследований для поиска новых сенсибилизаторов для фотодинамической терапии. Полученная новая водорастворимая форма BODIPY в составе системы с кремофором® при тестировании на клеточных линиях мышей показала обнадеживающие результаты. Cистема вызывает отрыв клеточных культур карциномы 4T1 и меланомы B16F0 от субстрата, и клетки теряют свои адгезионные свойства. Скорость перехода из адгезионного в суспензионное состояние выше для клеточных культур карциномы 4T1 мышей. Введение системы “BODIPY–кремофор®” в обе клеточные линии мышей приводит к подавлению развития раковых опухолей. Вероятно, данная водорастворимая система “BODIPY–кремофор®” обладает цитотоксическим действием и приводит к структурным повреждениям клетки и в дальнейшем к ее гибели. И хотя полученные в работе результаты требуют дальнейшего изучения, спектральные свойства системы “BODIPY–кремофор®”, а также данные цитологического мониторинга ясно демонстрируют перспективность подобных систем для биовизуализации клеток и ФДТ.
Авторы выражают благодарность д-ру биол. наук К.О. Муранову за помощь в планировании эксперимента и критическое обсуждение результатов.
Работа выполнена в рамках государственного задания ИБХФ РАН (№ гос. регистрации 01201253304) и государственного задания Министерства науки и высшего образования Российской Федерации (тема 0082-2018-0006, регистрационный номер АААА-А18-118020890097-1).
Список литературы
Клименко И.В., Лобанов А.В. // Хим. физика. 2018. Т. 37. № 1. С. 13.
Klimenko I.V., Lobanov A.V. // J. Biomed. Photonics Eng. (Samara). 2016. V. 2(4). P. 040310-1-5.
Klimenko I.V., Lobanov A.V. // Macroheterocycles. (Ivanovo). 2020. 13(2); https://doi.org/10.6060/mhc200390k
Kamkaew A., Lim S.H., Lee H.B. et al. // Chem. Soc. Rev. 2013. № 1(42). P. 77; https://doi.org/10.1039/c2cs35216h
Ksenofontov A.A., Bocharov P.S., Antina E.V. // J. Photochem. Photobiol., A. 2019. V. 368. P. 254.
Kue C.S., Ng S.Y., Voon S.H. et al. // Photochem. Photobiol. Sci. 2018. Issue 17. P. 1691; https://doi.org/10.1039/C8PP00113H
Jameson L.P., Smith N.W., Annunziata O. et al. // Phys. Chem. Chem. Phys. 2016. V. 18. P. 14182; https://doi.org/10.1039/c6cp00420b
Solomonov A.V., Rumyantsev E.V., Kochergin B.A. et al. // Biophysics. 2014. V. 59(1). P. 35; https://doi.org/10.1134/S0006350914010217
Chen Y., Liu J., Song M. et al. // Spectrochim. Acta A. 2018. V. 203. P. 158; https://doi.org/10.1016/j.saa.2018.05.103
Kessel D. // J. Photochem. Photobiol., B. 1998. V. 42. № 2. P. 89.
Плотникова О.А., Мельников А.Г., Мельников Г.В. и др. // Хим. физика. 2017. Т. 36. № 8. С. 48; https://doi.org/10.7868/S0207401X17080106
Власова И.М., Салецкий А.М. // Хим. физика. 2009. Т. 28. № 12. С. 66.
Kritskaya A.Yu., Berezin M.B., Antina E.V. et al. // J. Fluoresc. 2019. V. 29. P. 911; https://doi.org/10.1007/s10895-019-02403-2
Молчанов Е.Е., Марфин Ю.С., Румянцев Е.В. и др. // Изв. вузов. Химия и хим. технология. 2019. Т. 62. Вып. 12. С. 13; https://doi.org/10.6060/ivkkt.20196212.6017
Ksenofontov A.A., Stupikova S.A., Bocharov P.S. et al. // J. Photochem. Photobiol. 2019. V. 382. P. 111899; https://doi.org/10.1016/j.jphotochem.2019.111899
Tao J., Sun D., Sun L. et al. // Dyes Pigm. 2019. V. 168. P. 166; https://doi.org/10.1016/j.dyepig.2019.04.054
Antina L.A., Ksenofontov A.A., Kalyagin A.A. et al. // Spectrochim. Acta., A. 2019. V. 218. P. 308; https://doi.org/10.1016/j.saa.2019.03.117
Dong B., Zhong K., Lu Y. // Dyes Pigm. 2019. V. 164. P. 156; https://doi.org/10.1016/j.dyepig.2019.01.017
Sevinç G., Küçüköz B., Elmali A. et al. // J. Mol. Struct. 2020. V. 1206. P. 127691; https://doi.org/10.1016/j.molstruc.2020.127691
Mazzone G., Quartarolo A.D., Russo N. // Dyes Pigm. 2016. V. 130. P. 9; https://doi.org/10.1016/j.dyepig.2016.02.021
Kamkaew A., Lim S.H., Lee H.B. et al. // Chem. Soc. Rev. 2013. V. 42 P. 77.
Awuah S.G., You Y. // RSC Adv. 2012. V. 2. P. 11169.
Valdez-Calderón A., Farfán-Paredes M., Araujo-Padilla X. et al. // Polyhedron. 2020. V. 176. P. 114207; https://doi.org/10.1016/j.poly.2019.114207
Overwijk W.W., Restifo N.P. // Curr. Protoc. Immunol. 2000. V. 39(1). P. 20.1.1; https://doi.org/10.1002/0471142735.im2001s39
Kuznetsova R.T., Aksenov Iu.V., Prokopenko A.A. // J. Mol. Liq. 2019. V. 278. P. 5; https://doi.org/10.1016/j.molliq.2019.01.049,https://doi.org/10.1007/s10895-019-02403-2
Uppal T., Hu X., Fronczek F.R. et al. // Chem. Eur. J. 2012. V. 18. № 13. P. 3893; https://doi.org/10.1002/chem.201103002
Jiao L., Wu Ya., Ding Y. et al. // Chem. Asian J. 2014. V. 9. № 3. P. 805; https://doi.org/10.1002/asia.201301362
Антина Е.В., Березин М.Б., Дудина Н.А. и др. // Журн. неорган. химии. 2014. Т. 59. № 10. С. 1427.
Генина Э.А. Методы биофотоники: Фототерапия. Уч. пос. Саратов: Новый ветер, 2012.
Левшин Л.В., Салецкий А.М. Люминесценция и ее измерения. Молекулярная люминесценция. М.: Изд-во Моск. ун-та, 1989.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика