Химическая физика, 2021, T. 40, № 2, стр. 33-43
Физико-химические характеристики и противоопухолевые свойства липосомальной формы метилового эфира пирофеофорбида-а
М. А. Климович 1, Н. Н. Сажина 1, А. Ш. Радченко 1, Н. Ю. Герасимов 1, А. Е. Егоров 1, О. В. Неврова 1, А. В. Шибаева 1, А. О. Шкирдова 1, 3, А. А. Маркова 2, Е. С. Беляев 3, И. А. Замилацков 3, В. В. Спиридонов 4, В. А. Кузьмин 1, *, А. Б. Шевелёв 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
Москва, Россия
3 Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
Москва, Россия
4 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: vak@sky.chph.ras.ru
Поступила в редакцию 02.07.2020
После доработки 02.07.2020
Принята к публикации 21.09.2020
Аннотация
Для повышения биодоступности нерастворимого в воде метилового эфира пирофеофорбида-а (PPP-a) была приготовлена его липосомальная форма и изучены физико-химические и фотохимические свойства. Было установлено, что квантовый выход 1О2 имел колоколообразную зависимость от концентрации PPP-a в липидной фазе липосом с максимумом при ее значении 31.6 мкмоль/г липидов. С помощью ИК-спектроскопии показано фотоиндуцированное образование альдегидных групп в липидной фазе липосом. Методом конфокальной микроскопии подтверждено внутриклеточное накопление PPP-a.
ВВЕДЕНИЕ
Фотодинамическая терапия (ФДТ) является в настоящее время одним из перспективных методов лечения злокачественных опухолей. Этот метод отличается от традиционных методов лечения опухолей высокой избирательностью воздействия, отсутствием тяжелых системных осложнений при лечении, возможностью многократного повторения процедур [1]. Поглощение энергии света фотосенсибилизатором (ФС) приводит к фотохимическим реакциям с образованием активных форм кислорода (АФК): синглетного кислорода 1О2 и анион-радикала супероксида ${\text{О}}_{{\text{2}}}^{{ - \,\centerdot }},$ действие которых на опухолевые клетки ведет к их гибели.
Производные хлорофилла-а являются перспективными ФС для ФДТ. Метиловый эфир пирофеофорбида-а (PPP-a) является фотосенсибилизатором второго поколения на основе хлорофилла-а, имеет полосу поглощения в красной области спектра при 668 нм в дихлорметане c коэффициентом молярной экстинкции 45 000 см–1 ⋅ M–1 [2]. Последние 20 лет активно исследуются влияние данного ФС на внутриклеточные сигнальные системы [3] и эффективность использования его в терапии карциномы толстой кишки HCT 116 и других карцином [4–6]. Пирофеофорбид-a нерастворим в водной среде, а добавление к его раствору в этаноле воды до концентрации в 30% приводит к агрегации красителя и снижению квантового выхода 1О2 на два порядка по сравнению с мономерной формой, для которой квантовый выход 1О2 составляет 50–80% [7].
При добавлении неионного ПАВ к водному раствору феофорбида агрегированные формы PPP-a преимущественно переходят в мономерную форму [8]. Для повышения биодоступности, фотосенсибилизирующих свойств PPP-a и селективности к опухолевым клеткам используются различные наноконтейнеры [9–12]. Распространенным типом контейнеров для доставки лекарственных средств являются липосомы на основе природных лецитинов, которые хорошо растворимы в биологических жидкостях, имеют повышенное сродство к опухолевым клеткам, защищают ФС от разрушения и не вредны для организма [13–16]. Липосомы позволяют донести включенные в них фотосенсибилизаторы по кровеносному руслу до опухоли. Это расширяет возможности их применения в фотодинамической терапии, в основе которой лежат фотоиндуцированные окислительные процессы, приводящие к гибели опухолевых клеток по апоптотическому и некротическому путям.
Ключевой проблемой разработки противоопухолевых средств, обеспечивающих продление жизни больных, является обеспечение избирательности действия цитотоксических агентов в отношении раковых клеток при минимальной токсичности в отношении нормальных клеток организма [1]. В случае свободных фотосенсибилизаторов порфиринового ряда селективность достигается за счет того, что in vivo эти гидрофобные соединения практически полностью включаются в комплексы с альбумином, имеющим специальные карманы или полости, или с липопротеинами низкой плотности, за счет взаимодействия с их гидрофобными областями, для транспортировки водонерастворимых соединений (жирных кислот, стеролов, билирубина и других) по кровяному руслу.
Аномально высокая по сравнению с нормальными клетками катаболическая активность опухолевых клеток приводит к ускоренному поглощению ими транспортных белков крови, выполняющих в организме трофическую функцию, в результате чего происходит ускоренное накопление порфиринов в очагах опухолевого роста. При включении ФС в липосомы этот эффект полностью исключается [17], однако при использовании липидов определенного состава, в частности димиристоил-L-a-фосфатидилхолина, удается достигнуть эффективной передачи ФС из липосом в плазматическую мембрану опухолевой клетки без слияния и даже прямого контакта клеточной и липосомной мембран между собой [18].
Целью настоящей работы было изучение физико-химических основ, обеспечивающих бесконтактную передачу PPP-a из липосом в опухолевые клетки, в частности выбор концентрации ФС, обеспечивающей наибольшую стабильность липосомных наноконтейнеров при их хранении и циркуляции в кровяном русле. Выполнено исследование темновой и фотоиндуцированной цитотоксичности липосомальной формы PPP-a на культуре клеток карциномы толстой кишки человека НСТ 116.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление липосом
Для приготовления липосом использовали суспензию соевого лецитина в концентрации 1 мг/мл (1.29 мМ) марки L-α-фосфатидилхолин производства компании Sigma-Aldrich (USA) в фосфатном буфере (1 мM, рН 7.4). В состав лецитина данной марки входило два основных фосфолипида: фосфатидилхолин – 63% и фосфатидилэтаноламин – 32%. Содержание жирных кислот в % к общему их количеству составило: пальмитиновая – 17, стеариновая – 4, олеиновая – 9, линолевая – 60, линоленовая – 7.
Смесь перемешивали в течение 20 мин в шейкере, добавляя от 7 до 100 мкл раствора PPP-a с концентрацией 9.1 мМ в толуоле. Липосомы формировали c использованием ультразвукового гомогенизатора VCX-130 производства компании Sonics & Materials (USA) в течение 15 мин при мощности 70 Вт. Для предохранения липосом от окисления во время ультразвуковой обработки сосуд с суспензией помещали в смесь воды со льдом. Дисперсию липосом центрифугировали при Т = 4 °С в течение 20 мин при 13 000 об/мин. Для регистрации люминесценции синглетного кислорода суспензии липосом были приготовлены с применением тяжелой воды.
Спектральные измерения
Спектры поглощения и флуоресценции снимали в кварцевых кюветах размером 10 мм × 4 мм на спектрофотометрах Shimadzu UV-3101 PC (Япония), Perkin Elmer Lambda-25 (США) и на спектрофлуориметре Флюорат-02-Панорама (Россия) [19, 20]. Для инициирования окисления липосом использовали водорастворимый инициатор ААРН – 2.2′-азо-бис(амидинопропан)дигидрохлорид производства компании Acros Organics (USA). Кинетику образования продуктов перекисного окисления липидов (ПОЛ) – диеновых конъюгатов регистрировали на длине волны максимума их поглощения λ = 234 нм при физиологической температуре (37 °С) [20]. Диеновы коньюгаты являются начальными продуктами ПОЛ и образуются в результате миграции двойных связей при отрыве протона от метиленовой группы, окруженной двойными связями.
Времена жизни флуоресценции PPP-a, включенного в липосомы, измеряли при 678 нм на времяразрешенном спектрофлуориметре Fluotime 300 PicoQuant (Germany): фотовозбуждение от лазера Solea при 507 нм. Времена жизни люминесценции синглетного кислорода измеряли на этом же приборе при 1275 нм. Фотовозбуждение РРР-а проводили с помощью ксеноновой лампы при 543 нм. Образцы разводили до значений поглощения 0.065–0.07 на длине волны λ = 543 нм. Для расчета квантового выхода синглетного кислорода аналогичные измерения были сделаны и для раствора бенгальского розового в тяжелой воде.
Анизотропию флуоресценции свободного PPP-a в дихлорметане и в составе водной суспензии липосом измеряли также на Fluotime 300 PicoQuant: фотовозбуждение поляризованным светом от лазера LDH 405 при 398 нм, флуоресценция (поляризованный свет) при 680 нм.
Метод динамического светорассеяния
Для определения размеров липосом в суспензии использовался метод динамического светорассеяния. Измерения среднего диаметра липосом проводили на высокочувствительном приборе Zetasizer Nano ZS (Great Britain) по оценке корреляционной функции флуктуаций интенсивности рассеянного на липосомах под углом 173° лазерного излучения с λ = 633 нм. Концентрация лецитина в суспензии липосом составляла 0.5 мг/мл, температура – 25 °С, индекс полидисперсности варьировался в пределах 0.21–0.26. Для каждого размера выполняли регистрацию 5–10 распределений интенсивности по размерам частиц с 15 накоплениями в каждом измерении; усреднение проводили по размерам частиц с максимальной интенсивностью рассеяния. Для измерения ζ-потенциала (Z) липосом этот же прибор использовался в режиме регистрации электрофоретической подвижности частиц. Усреднение максимальных значений ζ-потенциала выполняли по результатам трех измерений, погрешность измерений не превышала 10%.
Определение вязкости компонентов в липосомах
Текучесть липидного бислоя мембран определяли методом электронного парамагнитного резонанса (ЭПР) спиновых зондов. В качестве зонда использовали стабильные нитроксильные радикалы 2,2,6,6-тетраметил-4-каприлоилоксилпиперидин-1-оксил, синтезированные в Институте химической физики им. Н.Н. Семёнова РАН. Глубина расположения нитроксильного радикала в липосомах составляла 0.2–0.4 нм. Из полученных спектров ЭПР рассчитывали время корреляции вращательной диффузии (τс), характеризующее микровязкость компонентов мембраны. Регистрацию спектров ЭПР проводили на радиоспектрометре ER 200D-SRC компании Bruker (Germany).
ИК-спектроскопия
Измерение методом ИК-спектроскопии проводили на приборе Specord (M80 Carl Zeiss, Germany). Спектры регистрировали в диапазоне волновых чисел от 1000 до 2000 см–1. Образцы наносили в виде водных суспензий на стекло марки КРС-5 (объем суспензии составлял 3 мкл) и прижимали вторым таким же стеклом. Условия облучения красным светом кювет с суспензиями липосом аналогичны условиям опытов, проведенных с клетками (светофильтр КС-11, 30 Дж/см2).
Культивирование клеток HCT 116
В работе использовали клеточную линию аденокарциномы кишки НСТ 116. Клетки культивировали в питательной среде DMEM производства компании ПанЭко (Россия). В культуральные среды добавляли 10% эмбриональной телячьей сыворотки (GE LifeSciences, USA), 2 мМ L-глутамина (ПанЭко, Россия), 100 ед/мл пенициллина (ПанЭко, Россия) и 100 мкг/мл стрептомицина (ПанЭко, Россия), инкубировали при 37 °С в увлажненной атмосфере c 5%-ным содержанием СО2. В экспериментах использовали культуры в логарифмической фазе роста.
Для проведения экспериментов на клетках карциномы толстой кишки НСТ 116 была приготовлена суспензия липосом с концентрациями лецитина и РРР-а в них соответсвенно 1 мг/мл и 31.7 мкM. Данная концентрация PPP-a была выбрана как наиболее эффективная по результатам спектральных исследований.
Конфокальная спектроскопия
Для определения локализации PPP-a и подтверждения генерации АФК использовался метод конфокальной микроскопии. Клетки НСТ 116 инкубировали с липосомами в конечной концентрации PPP-a, равной 3.5 мкМ, в течение 24 ч в СО2-инкубаторе. Далее их (клетки) промывали и инкубировали с флуоресцентными клеточными маркерами: Hoechst 33342 (концентрация – 0.01 мг/мл, λex = 405 нм/λem = 415–470 нм), LysoTracker™ Green DND-26 (0.05 мкМ, λex = = 488 нм/λem = 500–580 нм), ER-Tracker™ Green (1 мкМ, λex = 488 нм/λem = 510–570 нм), Dihydrorhodamine 123 (10 мкМ, λex = 488 нм/λem = 510–570 нм), пропидия иодид (0.1 мг/мл) согласно методике производителя (Thermo Fisher Scientific, USA). Регистрацию результатов осуществляли на конфокальном микроскопе Leica TCS SPE 5 (Leica Microsystems GmbH, Germany).
Проведение экспериментов in vitro
Клетки НСТ 116 инкубировали в суспензии липосом с конечными концентрациями 0.06–0.33 мг/мл в течение 24 ч в СО2-инкубаторе. Затем клетки освещали галогеновой лампой через красный светофильтр КС-11 (Оптические лазерные технологии, Россия) с пропусканием в области свыше 610 нм. Дозы освещения составили 0–60 Дж/см2. Для предотвращения нагревания использовали теплоотведение насыщенным раствором нитрата натрия. В темновом варианте эксперимента клетки не освещали, оставляя в инкубаторе. После освещения или темновой инкубации клетки инкубировали в СО2-инкубаторе в течение 24 ч для развития эффектов гибели и анализировали жизнеспособность клеток методом МТТ-теста. Показатели выживаемости рассчитывали в процентах как отношение оптической плотности растворов формазана в диметилсульфоксиде в экспериментальных лунках к среднему значению в контрольных лунках (клетки без препаратов). Каждую пробу анализировали в трех повторах, погрешность измерений не превышала 5%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химические свойства суспензий липосом с различной концентрацией в них метилового эфира пирофофорбида-а
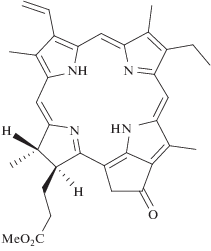
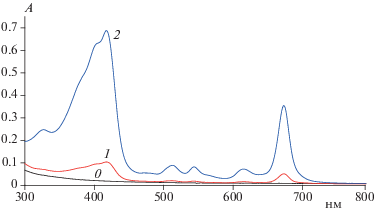
Метиловый эфир пирофеофорбида-а, обозначаемый в зарубежных источниках как PPME, является тетрапиррольным соединением, практически нерастворимым в воде (его структурная формула приведена на рис. 1). Для исследования фотохимических и физико-химических свойств липосомальной формы PPP-a были приготовлены шесть видов липосом: “чистые” липосомы (без PPP-a) и липосомы с концентрациями PPP-a в липидной фазе, составляющими 3.4, 9.1, 32.9, 48 и 75 мкмоль/г липидов; так как концентрация лецитина в водной суспензии составляла 1 мг/мл, то моляльные концентрации PPP-a в липидной фазе числено совпадают с молярными в водной суспензии. На спектрах PPP-a (рис. 2) видны две основные полосы поглощения: Сорэ с максимумом при λ = 417 нм и Q-полосы в красной области спектра с максимумом при λ = 673 нм; последняя используется для возбуждения ФС при выполнении ФДТ. Кроме этих полос, PPP-a имеет несколько менее выраженных максимумов поглощения при 512, 542 и 615 нм.
Рис. 2.
Спектры поглощения липосом: 0 – без PPP-a, 1 – с концентрацией PPP-a, равной 3.42 мкмоль/г липидов, 2 – 32.9 мкмоль/г липидов. Разбавление исходных липосом в 4 раза.
Кинетические кривые инициированного ААРН окисления липосом с приведенными в подписи к рис. 2 концентрациями PPP-a представлены на рис. 3. Видно, что PPP-a дозозависимо тормозит окисление, что свидетельствует о проявлении этим ФС антиокислительных свойств. Еще, по-видимому, PPP-a значительно структурирует бислой липосом, что способствует уменьшению проникновения кислорода в липосому и снижению скорости окисления (происходит ингибирование окисления липидов в липосоме). Аналогичные эффекты были ранее описаны в работах [20, 21]. Применяя хемилюминесцентные методы, можно получить более точную картину антиокислительного действия PPP-a. Особенности изучения ингибированного окисления подробно рассмотрены в работе [22]. Результаты по измерению вязкости бислоя липосом приведены на рис. 4.
Рис. 3.
Кинетические кривые образования диеновых конъюгатов при инициированном ААРН окислении липосом: 0 – без PPP-a, 1 – с концентрацией PPP-a, равной 3.42 мкмоль/г липидов, 2 – 32.9 мкмоль/г липидов; А – оптическая плотность ДК при λ = 234 нм, [лецитин] = 0.1 мг/мл, [AAPH] = 0.3 мМ.
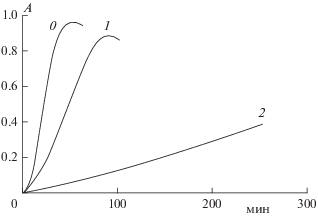
Рис. 4.
Зависимость времени корреляции вращательной диффузии (τc) зонда от концентрации PPP-a в липидной фазе липосом.
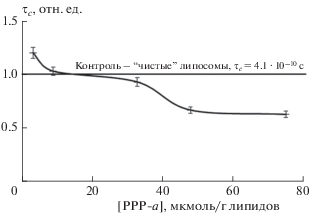
Пирофеофорбид-а, встроенный в липидную мембрану, сложным образом изменяет ее микровязкость. Порфирины в малых концентрациях координируют вокруг себя молекулы липидов, способствуя их более плотной упаковке в мембране. При концентрации PPP-a, равной 32.9 мкмоль/г липидов, наоборот, микровязкость снижается, а выход на плато происходит при концентрациях более 48 мкмоль/г липидов. Липидные фазы “чистых” липосом и липосом, содержащих 9.1 мкмоль/г липидов PPP-a, имели близкие значения микровязкости. Механизмы данных эффектов рассмотрены в работе [23], а локальная динамика и локальная организация мицеллярной фазы показаны в работе [24].
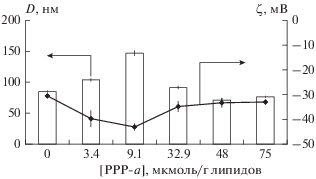
Влияние различного содержания PPP-a в липосомах видно и по изменению размеров липосом и их ζ-потенциала (рис. 5). При малых концентрациях PPP-a наблюдался рост среднего диаметра D липосом, однако уже при концентрации 32.9 мкмоль/г липидов значение D становится сопоставимым с диаметром “чистых” липосом и далее уменьшается с увеличением концентрации PPP-a. Наибольшее абсолютное значение отрицательного ζ-потенциала и максимальный размер липосом достигались при концентрации PPP-a, равной 9.1 мкмоль/г липидов, при которой, по-видимому, значительно структурируется бислой липосом. Увеличение их поверхностного заряда способствовало уменьшению агрегации частиц. Следует отметить, что значения ζ-потенциала липосом менее –30 мВ свидетельствуют о высокой стабильности суспензии.
Люминесцентные характеристики водной суспензии липосом с PPP-a
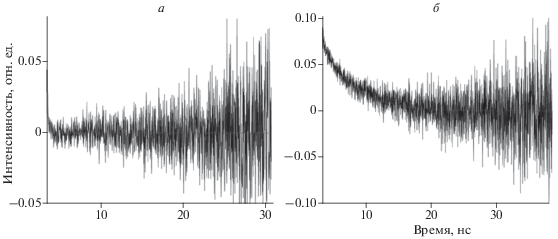
При формировании водной суспензии липосом PPP-a включался в липидную фазу мицелл, что доказывается данными анизотропии флуоресценции: для “свободного” PPP-a, растворенного в CH2Cl2, время вращательной корреляции τс = (0.09 ± 0.013) нс, а для PPP-a в составе водной суспензии липосом ввиду более высокой вязкости липидов τс = (4.7 ± 0.24) нс (рис. 6).
Рис. 6.
Анизотропия флуоресценции РРР-а в растворе CH2Cl2 (а) и в составе водной суспензии липосом (б).
Растворенный в CH2Cl2 PPP-a при возбуждении лазерным излучением с длиной волны λ = = 410 нм имел квантовый выход возбужденного синглетного состояния ϕf = 0.66, время жизни τ1f = 6.5 нс и ϕ (∆1O2) = 0.78. При включении PPP-a в состав бислоя липосом времена жизни τ1f снижались при увеличении его концентрации в липидной фазе (табл. 1).
Таблица 1.
Фотохимические характеристики липосом с различной концентрацией PPP-a
| [PPP-a], мкмоль/г липидов | τ1f, нс | χ2 |
|---|---|---|
| 3.42 | 7.90 ± 0.03 | 0.82 |
| 9.1 | 5.38 ± 0.03 | 1.19 |
| 32.9 | 4.20 ± 0.01 | 1.06 |
| 48 | 3.24 ± 0.04 | 1.33 |
| 75 | 2.07 ± 0.04 | 1.09 |
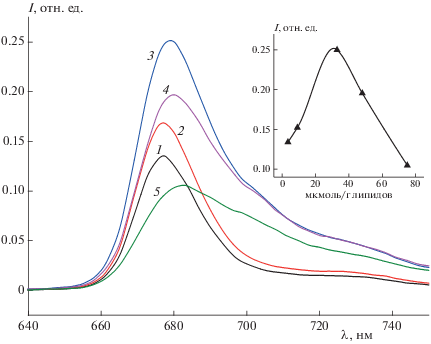
Были получены спектры флуоресценции липосом (рис. 7). Видно, что интенсивность флуоресценции PPP-a в составе липосом имеет колоколообразную зависимость от концентрации ФС с максимумом ее значения при 32.9 мкмоль/г липидов.
Рис. 7.
Спектры флуоресценции водной суспензии липосом с различной концентрацией PPP-a, мкмоль/г липидов: 1 – 3.4, 2 – 9.1, 3 – 32.9, 4 – 48, 5 – 75. На вставке – интенсивность флуоресценции (I) липосом при 678 нм (разведение суспензии в 10 раз).
Для определения квантового выхода ϕ(∆1O2) были приготовлены суспензии липосом в тяжелой воде с сопоставимыми концентрациями PPP-a. Время жизни 1O2 в тяжелой воде в среднем составляет 60–68 мкс, что на порядок больше, чем в водных растворах (3.9 мкс). Результаты, представленные на рис. 8, показывают, что наибольший квантовый выход 1O2 был в суспензии липосом с концентрацией PPP-a, равной 31.6 мкмоль/г липидов.
Рис. 8.
Квантовый выход 1O2 в суспензии липосом, приготовленных на тяжелой воде (D2O), в зависимости от концентрации PPP-a в липидной фазе.
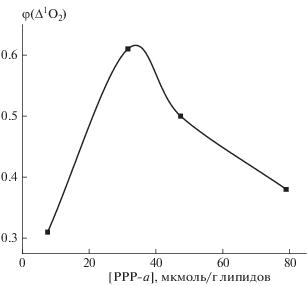
Образование димеров и агрегатов при высоких концентрациях PPP-a в липидной фазе приводило к уменьшению выхода триплетных состояний мономерного соединения PPP-a и, следовательно, к падению квантового выхода синглетного кислорода.
Фотосенсибилизаторы, инициирующие процессы перекисного окисления липидов
В основе фотохимических реакций II типа лежит генерация триплетным ФС синглетного кислорода, который окисляет ненасыщенные жирные кислоты фосфолипидов до их гидропероксидов. Продукты более глубокого окисления липидов являются результатом фотохимических реакций I типа, связанных с переносом электронов. Так, триплетный ФС образует из гидропероксидов жирных кислот высокореакционные пероксильные или алкоксильные радикалы, последние из которых превращаются в альдегиды [25]. Непосредственный отрыв протона от ненасыщенной жирной кислоты триплетным ФС приводит к образованию алкильного радикала и далее – пероксильного радикала, который участвует в разветвленных цепных реакциях ПОЛ. Наиболее цитотоксичными продуктами окисления липидов являются спирты, кетоны и особенно альдегиды, которые деформируют липидный бислой [26] Для определения вклада фотохимических реакций I типа в окислении липидов методом ИК-спектроскопии были проведены исследования образцов суспензий липосом с различными концентрациями PPP-a.
ИК-спектры поглощения суспензий липосом
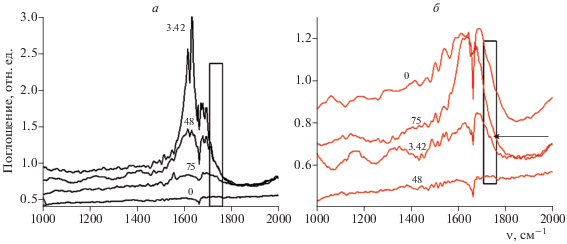
Окисление липидов контролировали по появлению характерной полосы (плеча) в ИК-спектре при 1740 см–1 (указана стрелкой на рис. 9). Эта полоса свидетельствует об образовании фрагмента, содержащего группу С=О в процессе окисления липидов. Обнаруженный результат свидетельствует, очевидно, о появлении альдегидной группы в составе окисленных липидов после фотоактивации суспензии липосом с концентрацией PPP-a, равной 3.42 мкмоль/г липидов.
Исследование темновой и фотоиндуцированной цитотоксичности липосомальной формы PPP-a на клетках карциномы толстой кишки человека НСТ 116
В настоящее время вопрос о распределении ФС ряда порфиринов среди клеточных компартментов не решен. Одни авторы [18, 27] обнаружили преимущественно митохондриальную локализацию порфиринов, тогда как другие [28, 29] указывали на их тропность к мембранам эндоплазматического ретикулума и аппарата Гольджи. В работе [18] было показано, что облучение клеток HCT 116, нагруженных PPP-a с использованием липосом, приводит к их гибели преимущественно по пути некроза, а не апоптоза, что ставит под сомнение факт преимущественного накопления этого ФС в митохондриях.
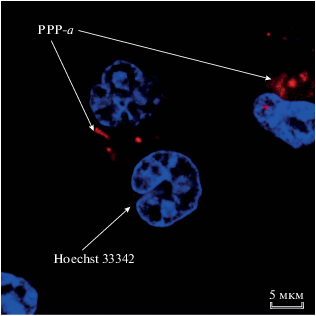
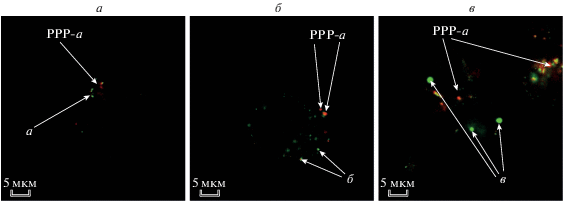
Полученные нами результаты показали, что краситель локализован главным образом в цитоплазме, в ядре сигнала практически не наблюдалось (рис 10). В результате наложения сигнала от PPP-a на сигналы от клеточных красителей DHR 123, ER-Tracker и Lysotracker (LT) не удалось установить точную локализацию PPP-a ввиду его высокой фотосенсибилизирующей активности, которая приводила к быстрому нарушению нормальной морфологии клетки при возбуждении лазером в ходе выполнения микроскопического исследования. Во всех случаях наблюдалось перекрывание сигналов (рис. 11).
Рис. 11.
Наложение флуоресцентного сигнала от PPP-a и клеточных маркеров: а – DHR 123, б – ER-Tracker, в – LT.
Краситель DHR 123 способен улавливать АФК в клетке, в результате чего он переходит в флуоресцирующую форму (родамин 123), а его катионная природа способствует накоплению этого красителя в митохондриях клеток. На рис. 12 для контрольного образца (а) и образца с “чистыми” липосомами (б) виден сигнал от митохондрий клеток. В образце с PPP-a наблюдалось “разгорание” сигнала, связанного с генерацией АФК.
Рис. 12.
Визуализация клеточных органелл красителями DHR 123 (митохондрии), ER-Tracker (эндоплазматический ретикулум) и LT (лизосомы) в контроле (а), после инкубации с “чистыми” липосомами (б) и с липосомами, содержащими PPP-a (в).
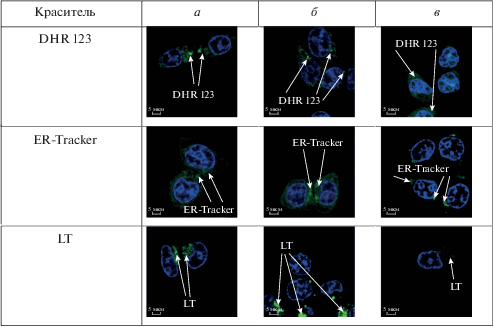
Облучение клеток красным светом в присутствии PPP-a приводило к образованию АФК, что вызывало окислительную деструкцию и деградацию мембранных систем клетки. Это отчетливо видно по остаткам эндоплазматического ретикулума, окрашенного красителем ER-tracker, и по слабому сигналу от лизосом, окрашенных красителем LT. В контрольных пробах и в пробах с липосомами сохранялась нормальная морфология клеток НСТ 116.
Главным подтверждением фотоиндуцированной гибели содержащих PPP-a клеток карциномы НСТ 116 после инкубации с липосомами является проникновение в ядра клеток йодида пропидия PI (рис. 13). Этот флуоресцентный краситель не способен проникать через мембрану живых клеток, и окрашивание ядра возможно только в результате перфорации клеточных мембран.
Рис. 13.
Визуализация (Hoe) клеточных ядер, накопление пропидия йодида (PI) в клеточном ядре и наложение обеих картинок (Hoe + PI) в контроле (а), после инкубации с “чистыми” липосомами (б) и с липосомами, содержащими PPP-a (в).

Используя питательную среду DMEM, готовили серию разведений суспензии липосом с концентрацией липидов в фосфатном буфере 0.06, 0.11, 0.2 и 0.33 мг/мл, которые соответствовали содержанию PPP-a в водных растворах 1.9, 3.5, 6.3 и 10.5 мкМ. Результаты, представленные в табл. 2, показывают, что липосомальная форма PPP-a в исследованных концентрациях не имела темновой цитотоксичности. Увеличение доз облучения с 30 до 60 Дж/см2 не приводило к ускорению фотоиндуцированной гибели клеток карциномы НСТ 116. Липосомы без фотосенсибилизатора при этом вызывали незначительный рост числа опухолевых клеток.
Таблица 2.
Процент (%) выживших клеток линии НСТ116 по результатам МТТ-теста
| [PPP-a], мкмоль/г липидов | Доза облучения, Дж/см2 | ||
|---|---|---|---|
| 0 | 30 | 60 | |
| 1.9 | 100.0 | 32.1 | 29.8 |
| 3.5 | 100.1 | 23.5 | 29.8 |
| 6.3 | 103.3 | 21.7 | 29.8 |
| 10.5 | 102.3 | 32.2 | 23.3 |
В работе [18] показано эффективное накопление PPP-a после двадцатичасовой инкубации клеток НСТ 116 с липосомальной формой PPP-a в концентрации 2 мкМ. В наших экспериментах мы также не видим существенного повышения клеточной гибели с ростом концентрации PPP-a выше 1.9 мкМ. Таким образом, липосомальная форма PPP-a обладала концентрационными ограничениями при ее использовании ФДТ, а низкая темновая цитотоксичность липосомальной формы PPP-a дает возможность многократного повторения процедур ФДТ. Необходимо отметить тот факт, что ФС, включенные в липидный бислой липосом, при действии света запускают процессы, ведущие к нарушению целостности липосом. В работе [30] рассматриваются молекулярные основы использования этого эффекта для оптимального выделения под действием света заключенных в липосомах лекарственных препаратов, что должно значительно повысить эффективность ФДТ. Применение PPP-a в этом качестве имеет, на наш взгляд, хорошие перспективы.
ЗАКЛЮЧЕНИЕ
Полученные результаты показали, что фотоиндуцированное образование альдегидных групп в липидной фазе липосом, содержащих PPP-a, оказалось слабовыраженным, что свидетельствует о малом вкладе фотохимических реакций I типа в окислительное повреждение липидов. В механизме фотосенсибилизации преобладающими были фотохимические реакции II типа, связанные с переносом энергии и генерацией синглетного кислорода. Квантовый выход последнего достигал максимального значения при концентрации PPP-a 31.6 мкмоль/г липидов. Результаты, полученные в экспериментах на клетках карциномы НСТ 116, показали, что липосомальная форма PPP-a нетоксична в рассматриваемых условиях и при этом обладает выраженной фототоксичностью. Максимальная фотохимическая эффективность липосомальной формы PPP-a проявляется при его концентрации в липидной фазе 31–33 мкмоль/г липидов.
Спектроскопические измерения проведены на базе ЦКП “Новые материалы и технологии” ИБХФ РАН.
Работа выполнена при финансовой поддержке Российским научным фондом по проекту № 18-13-00463 “Механизмы фотохимических процессов в комплексах полиметиновых красителей с двумя сопряженными хромофорами и белков”.
Список литературы
Yano S., Hirohara S., Obata M. et al. // J. Photochem. Photobiol. C. 2011. V. 12. № 1. P. 46.
Pandey R.K., Bellnier D.A., Smith K.M. et al. // Photochem. Photobiol. 1991. V. 53. P. 65.
Matroule J.Y., Bonizzi G., Morliere P. et al. // J. Biol. Chem. 1999. V. 274. P. 2988.
Sun X., Leung W.N. // Photochem. Photobiol. 2002. V. 75. P. 644.
Roder B., Hackbarth St., Korth O. et al. // Biochem. Biophys. Res. Commun. 2006. V. 348. P. 413.
Xu C.S., Leung A.W. // Med. Sci. Monit. 2006. V. 12. P. 257.
Wang K.-K., Li J., Kim B.-J. et al. // Intern. J. Photo-energy. 2014. P. 793.
Krasnovsky A.A., Jr., Neverov K.V., Egorov S.Y., Reder B. // Opt. Spectrosc. 1988. V. 64. № 4. P. 790.
Roeder B., Hackbarth St., Korth O. et al. // Photochemo-therapy: Photodynamic Therapy and Other Modalities. 1996. V. 179. P. 2625.
Ponomarev G.V., Solovieva M.N., Dugin N.O. et al. // Bioorg. Med. Chem. 2013. V. 21. P. 5420.
Buchholz J., Kaser-Hotz B., Khan T. et al. // Clin. Cancer Res. 2005. V. 11. № 20. P. 7538.
Yoon Il, Jia Zhu Li, Young Key Shim // Clin. Endosc. 2013. V. 46. P. 7.
Барышников А.Ю. // Вестн. РАМН. 2012. № 3. C. 23.
Röder B., Hanke T., Oelckers S. et al. // J. Porphyrins Phthalocyanines. 2000. V. 4. № 1. P. 37.
Tran M.A., Watts R.J., Robertson G.P. // Pigm. Cell Melanoma Res. 2009. V. 22. № 4. P. 388.
Ikeda A., Doi Y., Nishiguchi K. et al. // Org. Biomol. Chem. 2007. V. 5. № 8. P. 1158.
Düzgünes N., Piskorz J., Skupin-Mrugalska P. et al. // Ther. Deliv. 2018. V. 9. № 11. P. 823.
Guelluy P.-H., Fontaine-Aupart M.-P., Grammenos A. et al. // Photochem. Photobiol. Sci. 2010. V. 1258. № 9. P. 1252.
Кузьмин В.А., Волнухин В.А., Егоров А.Е. и др. // Хим. физика. 2019. Т. 38. № 12. С. 3.
Сажина Н.Н., Антипова А.С., Семенова М.Г. и др. // Биоорган. химия. 2019. Т. 45. № 2. С. 34.
Голощапов А.Н., Бурлакова Е.Б., Шаталова О.В. и др. // Хим. физика. 2013. Т. 32. № 5. С. 91.
Русина И.Ф., Карпухин О.Н., Касаикина О.Т. // Хим. физика. 2013. Т. 32. № 8. С. 49.
Герасимов Н.Ю., Голощапов А.Н., Бурлакова Е.Б. // Хим. физика. 2009. Т. 28. № 7. С. 82.
Вассерман А.М., Отдельнова М.В., Захарова Ю.А. и др. // Хим. физика. 2005. Т. 24. № 3. С. 29.
Bacellar I.O.L., Oliveira M.C., Dantas L.S. et al. // J. Amer. Chem. Soc. 2018. V. 140. № 30. P. 9606.
Bacellar I.O.L., Baptista M.S. // ACS Omega. 2019. V. 4. P. 21636.
Wei Y., Kong B., Song K. et al. // Photochem. Photobiol. 2007. V. 83. P. 1319.
Begum G., Dube A., Joshi P.G. et al. // J. Photochem. Photobiol. 2009. V. 95. P. 177.
Matroule J.Y., Carthy C.M., Granville D.J. et al. // Oncogene. 2001. V. 20. P. 4070.
Massiot J., Rosilio V., Makky A. // J. Mater. Chem. 2019. V. 7. № 11. P. 1805.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика