Химическая физика, 2021, T. 40, № 2, стр. 49-52
Трансформация антиоксидантных свойств смолы табачного дыма в метаболических процессах. Модельное хемилюминесцентное исследование
В. А. Меньшов 1, В. Д. Кънчева 2, О. И. Яблонская 1, А. В. Трофимов 1, 3, *
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Институт органической химии с центром фитохимии Болгарской академии наук
София, Болгария
3 Московский физико-технический институт (Национальный исследовательский университет)
Долгопрудный, Московская обл., Россия
* E-mail: avt_2003@mail.ru
Поступила в редакцию 02.07.2020
После доработки 28.07.2020
Принята к публикации 21.09.2020
Аннотация
Хемилюминесцентные процессы окисления люминола с участием пероксида водорода в присутствии пероксидазы хрена, глицина, добавок смолы табачного дыма и пирокатехина использованы для моделирования in vitro метаболической трансформации антиоксидантов дыма при их попадании в живой организм. Продемонстрирована важность учета трансформации свойств экзогенных антиоксидантов в организме для оценки суммарного биоантиоксидантного эффекта.
ВВЕДЕНИЕ
Табачный дым – аэрозоль, состоящий из газовой и твердой фаз, представляет собой сложнейшую композицию из нескольких тысяч химических соединений [1] и оказывает на организм как курящего человека, так и окружающих многогранное воздействие, являющееся фактором риска развития целого ряда заболеваний [2]. Среди разнообразных путей влияния дыма на человеческий организм следует обратить внимание на развитие в организме окислительного стресса под воздействием этого физиологически активного аэрозоля, поскольку окислительный стресс является универсальным генератором патологий [3]. В самом деле, в дыме образуются и содержатся большие количества активных форм кислорода и азота, прежде всего в свободнорадикальной форме [1]. Но кроме этих высокоактивных оксидантов дым содержит также и вещества, обладающие антиоксидантными свойствами, как показали исследования с нашим участием [4, 5]. Таким образом, суммарное воздействие дыма на окислительные процессы in vivo зависит одновременно от его оксидантных и антиоксидантных свойств. Необходимо отметить, однако, что в то время как оксидантам, образующимся в дыме, посвящено немалое количество исследований, антиоксидантным свойствам дыма до упомянутых работ [4, 5] совершенно не уделялось внимания. При исследовании антиоксидантных свойств табачного дыма необходимо иметь в виду, во-первых, то, что антиоксидантную активность проявляют как газовая фаза дыма [4], так и твердая фаза, называемая также смолой или TPM (“total particulate matter”) [4, 5]. А во-вторых, очень важным аспектом является возможная трансформация свойств экзогенных антиоксидантов, попавших в человеческий организм (прежде всего, со смолой), в метаболических процессах in vivo. Настоящая работа посвящена моделированию такой ситуации в условиях in vitro. Основу экспериментального подхода к исследованию антиоксидантной активности составили измерения хемилюминесценции в модельной системе, куда вводились пробы, проявляющие антиоксидантные свойства. Хемилюминесцентные подходы в анализе антиоксидантов наиболее удобны именно тогда, когда речь идет об исследовании активности таких реагентов [5–16].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ввиду участия пероксидаз (ферментов, неизбежно присутствующих в слизистых оболочках в местах попадания в организм человека компонентов табачного дыма) в метаболических процессах трансформации составляющих смолы́ в качестве хемилюминофора использовался люминол – 5-амино-2,3-дигидро-1,4-фталазиндион марки “Special Grade” производства компании Sigma-Aldrich (USA). Его хемилюминесценцию измеряли c помощью хемилюминометра Lum-5773 (МГУ) в присутствии перекиси водорода (Н2О2) и пероксидазы хрена производства компании AppliChem (Germany) [16] при добавлении в хемилюминесцирующий раствор глицина марки “Pharma Grade” (Sigma-Aldrich, USA) в качестве модельной аминокислоты, экстрактов смолы табачного дыма и проб типичного фенольного антиоксиданта – пирокатехина (катехола, 1,2-дигидроксибензола) марки “BioReagent Grade” (Sigma-Aldrich, USA), входящего в состав смолы табачного дыма [1].
Для автоматического прокуривания экспериментальных сигарет использовали курительную машину марки A14 производства фирмы Borgwaldt KC GmbH (Германия). Сбор смолы сигаретного дыма от четырех полностью выкуренных сигарет осуществлялся с помощью кембриджских фильт-ров [1, 4, 5] с ее последующим экстрагированием бензолом в течение 12 ч при 8 °C.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
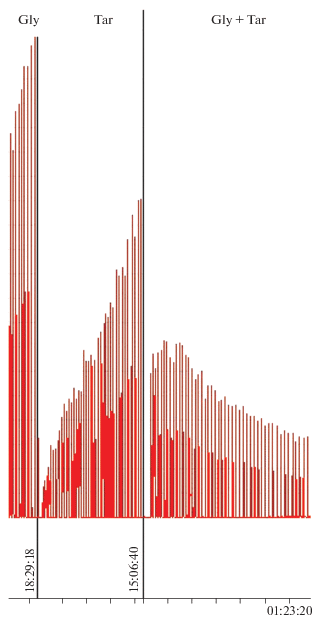
На рис. 1 показаны сигналы хемилюминесценции люминола в присутствии пероксидазы хрена и перекиси водорода (которую вводили маленькими порциями через каждые 1.5–2.0 мин) при добавлении глицина (слева), экстракта смолы (в центре) и смолы с глицином в одной пробе в тех же самых концентрациях (справа). Как видно из этого рисунка, ввод глицина вместе со смолой табачного дыма приводит к сильнейшему ингибированию окисления люминола, отражающемуся в тушении его хемилюминесценции.
Рис. 1.
Сигналы хемилюминесценции люминола (5 ⋅ 10–5 М) в присутствии пероксидазы хрена (10 ед./мл) в фосфатно-карбонатном буфере (рН 7.8) при добавлении глицина (Gly, 20 мг/мл) – слева, экстракта смолы (Tar, 20 мг/мл) – в центре и смолы с глицином в одной пробе в тех же концентрациях – справа. Перекись водорода вводилась в концентрациях 5.9 ⋅ 10–7 М с интервалами 1.5–2.0 мин.
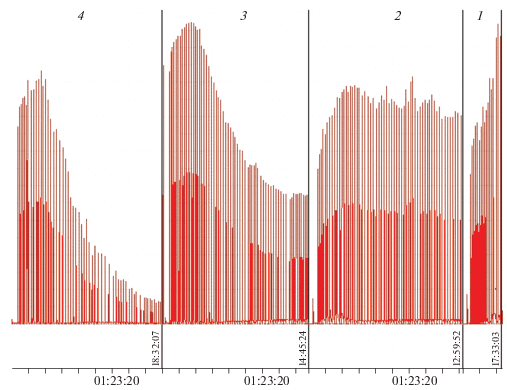
Замена смолы на пирокатехин приводит качественно к тем же результатам. Как видно из рис. 2, пирокатехин тушит хемилюминесценцию окисляющегося люминола, и степень ингибирования этого хемилюминесцентного процесса растет с увеличением концентрации пирокатехина. Но наиболее интересной оказалась зависимость интенсивности хемилюминесценции люминола от отношения концентраций глицина (Gly) и пирокатехина (Cat) (рис. 3). Как видно из этих данных, чем больше отношение [Gly]/[Cat], тем больше глубина тушения хемилюминесценции.
Рис. 2.
Сигналы хемилюминесценции люминола (5 ⋅ 10–5 М) в присутствии пероксидазы хрена (10 ед./мл) в фосфатно-карбонатном буфере (рН 7.8) в зависимости от добавок прирокатехина в следующих концентрациях: 0 (1), 4.54 ⋅ 10–6 (2), 9.10 ⋅ 10–6 (3), 1.36 ⋅ 10–5 (4) и 1.82 ⋅ 10–5 М (5). Перекись водорода вводилась в концентрациях 5.9 ⋅ 10–7 М с интервалами 1.5–2.0 мин.
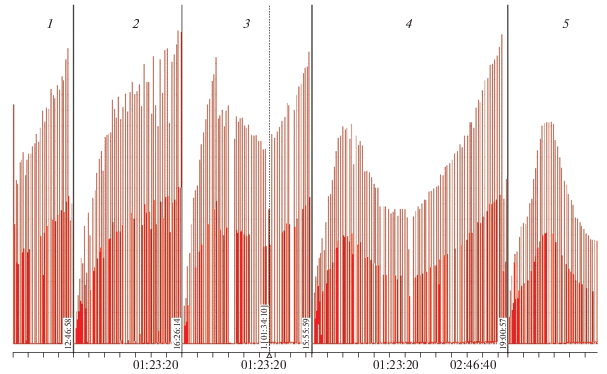
Рис. 3.
Сигналы хемилюминесценции люминола (5 ⋅ 10–5 М) в присутствии пероксидазы хрена (10 ед./мл) в фосфатно-карбонатном буфере (рН 7.8) в зависимости от отношения концентраций глицина и пирокатехина, lg([Gly]/[Cat]): 2.4 (1), 3.00 (2), 3.48 (3), 4.07 (4). Перекись водорода вводилась в концентрациях 5.9 ⋅ 10–7 М с интервалами 1.5–2.0 мин.
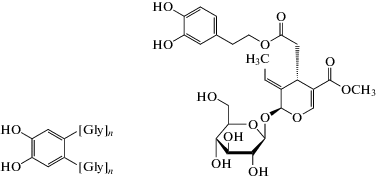
Как было показано относительно недавно [17], пирокатехин в присутствии глицина способен образовывать в ферментативном окислительном процессе пирокатехин-глициновые аддукты (рис. 4) [17], которые, возможно, проявляют бóльшую антирадикальную активность, чем сам пирокатехин. По всей видимости, именно это и происходит при введении пирокатехина в хемилюминесцентную систему, использованную в настоящей работе, и объясняет зависимость глубины тушения свечения от соотношения концентраций [Gly]/[Cat].
В этой связи следует упомянуть интересный случай взаимодействия глицина с катехольными (пирокатехиновыми) фрагментами в присутствии пероксидазы в in vivo. Такие процессы используются личинками бабочек Brahmaea Wallichii с целью преодолеть денатурирующее действие олеуропеина (используемого растениями для своей защиты от поедания) в своем пищеварительном тракте [18], имеющего в своей структуре катехольный фрагмент (рис. 4). Для нейтрализации воздействия олеуропеина личинки Brahmaea Wallichii синтезируют в своем пищеварительном тракте до 50 мМ глицина [18]. Этот пример показывает, что метаболические ферментативные процессы с участием глицина и полифенольных соединений действительно играют важную роль живой природе. Поэтому использованный в настоящей работе ферментативный хемилюминесцентный процесс является адекватной моделью таких взаимодействий in vitro.
ЗАКЛЮЧЕНИЕ
В настоящей работе показана важность учета трансформации свойств экзогенных антиоксидантов в метаболических процессах при их попадании в живой организм для оценки и прогнозирования суммарного биоантиоксидантного эффекта. Полифенольные соединения могут вступать в окислительные ферментативные процессы с участием аминокислот с образованием продуктов, обладающих большей антиоксидантной активностью, чем исходные вещества.
Работа выполнена при финансовой поддержке Российским фондом фундаментальных исследований (грант № 19-53-18019 Болг_а) и Национальным научным фондом Болгарии (грант № КП-06-Русия-28).
Список литературы
Davis D.L., Nielsen M.T. Tobacco: Production, Chemistry and Technology. Oxford: Blackwell Science, 1999.
Saha S.P., Bhalla D.K., Whayne T.F., Jr. et al. // Intern. J. Angiol. 2007. V. 16. № 3. P. 77.
Fedorova G.F., Kancheva V.D., Menshov V.A. et al. // Stud. Nat. Prod. Chem. 2016. V. 47. P. 357.
Palmina N.P., Maltseva E.L., Chasovskaya T.E. et al. // Aust. J. Chem. 2014. V. 67. № 6. Р. 858.
Fedorova G.F., Menshov V.A., Trofimov A.V. et al. // Photochem. Photobiol. 2017. V. 93. № 2. P. 579.
Fedorova G.F., Menshov V.A., Trofimov A.V. et al. // Analyst. 2009. V. 134. № 10. P. 2128.
Русина И.Ф., Карпухин О.Н., Касаикина О.Т. // Хим. физика. 2013. Т. 32. № 8. С. 49.
Беляков В.А., Васильев Р.Ф., Трофимов А.В. // Хим. физика. 1994. Т. 13. № 11. С. 74.
Жигачева И.В., Русина И.Ф., Генерозова и др. // Хим. физика. 2018. Т. 37. № 11. С. 68.
Васильев Р.Ф., Вепринцев Т.Л., Долматова Л.С. и др. // Кинетика и катализ. 2014. Т. 55. № 2. С. 157.
Slavova-Kazakova A.K., Angelova S.E., Denev P. et al. // Beilstein J. Org. Chem. 2015. V. 11. P. 1398.
Fedorova G.F., Menshov V.A., Naumov V.V. et al. // Photochem. Photobiol. 2019. V. 95. № 3. P. 780.
Fedorova G.F., Trofimov A.V., Vasil’ev R.F. et al. // ARKIVOC. 2007. № 8. P. 163.
Цаплев Ю.Б., Васильев Р.Ф., Кънчева В.Д. и др. // Хим. физика. 2020. Т. 39. № 6. С. 7.
Васильев Р.Ф., Кънчева В.Д., Наумов В.В и др. // Хим. физика. 2020. Т. 39. № 6. С. 36.
Whitehead T.P., Thorpe G.H.G., Maxwell S.R.J. // Anal. Chim. Acta. 1992. V. 266. № 2. P. 265.
Ali M.A.S.H.M., El-Gizawy A.M., El-Bassiouny R.E.I. // Food Chem. 2016. V. 192. P. 879.
Konno K., Yasui H., Hirayama C., Shinbo H. // J. Chem. Ecol. 1998. V. 24. P. 735.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика