Химическая физика, 2021, T. 40, № 2, стр. 3-10
Полиметиновые красители как зонды для обнаружения коронавируса SARS-CoV-2: исследование in silico методом молекулярного докинга
П. Г. Пронкин 1, *, А. С. Татиколов 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: pronkinp@gmail.com
Поступила в редакцию 02.07.2020
После доработки 02.07.2020
Принята к публикации 21.09.2020
Аннотация
С целью разработки эффективных зондов для обнаружения коронавируса SARS-CoV-2 методом моделирования in silico (молекулярный докинг) исследовано нековалентное взаимодействие полиметиновых красителей различных классов (всего 45 соединений) с одним из основных структурных компонентов вируса – спайк-протеином (S). Определены энергии взаимодействия и пространственные конфигурации комплексов молекул красителей с S. Показано, что катионные полиметиновые красители (а также нейтральные скварилиевые красители) не образуют устойчивых комплексов с S. Некоторые анионные красители, демонстрирующие отрицательные значения общей энергии Etot, могут быть рекомендованы для практических исследований.
ВВЕДЕНИЕ
Пандемия нового коронавируса SARS-CoV-2, начавшаяся в 2019 году и продолжающаяся в настоящее время, поставила перед исследователями всего мира актуальные задачи по поиску подходов к диагностике коронавирусной инфекции и лечению заболевших пациентов. С этой точки зрения важной является разработка эффективных экспресс-методов анализа на коронавирусную инфекцию. Одним из таких методов может служить метод спектрально-флуоресцентных зондов, а в качестве зондов можно использовать полиметиновые (цианиновые и скварилиевые) красители. Они обладают высокими коэффициентами экстинкции, поглощением и излучением в длинноволновой области спектра, охватывающей оптическое окно прозрачности биологических образцов и тканей, и их фотофизические и фотохимические свойства зависят от молекулярного окружения [1]. Цианиновые и скварилиевые красители могут взаимодействовать с биомолекулами, образуя нековалентные комплексы, сопровождаемые усилением флуоресценции, что также создает предпосылки для их использования в качестве зондов в системах, содержащих биомолекулы [2, 3]. Использование красителей (в том числе цианиновых) в качестве спектрально-флуоресцентных зондов при исследовании вирусов различных типов активно изучается [4]. На актуальность проблемы указывает, в частности, недавно появившаяся работа по изучению ассоциации некоторых цианиновых красителей с малым вирусом – бактериофагом MS2 с целью его обнаружения и охарактеризования; при этом, наряду с другими методами, применялся метод молекулярного докинга [5]. Разработка зондов для обнаружения коронавируса должна включать в себя изучение нековалентного взаимодействия красителей с его молекулярными компонентами. Разнообразие структур и свойств полиметиновых красителей (отличающихся длиной полиметиновой цепи, концевыми гетероциклами, заместителями в цепи и гетероциклах) потребовало использования моделирования in silico при отборе эффективных соединений – кандидатов для дальнейших исследований их взаимодействия с вирусом in vitro. Моделирование с помощью молекулярного докинга широко применяется при изучении взаимодействия различных терапевтических средств с белковыми компонентами SARS-CoV-2, что дает ценную информацию об энергии взаимодействия (или сродстве) молекулы субстрата с выбранными белковыми компонентами и центрах связывания субстрата с данными белками [6–8].
В настоящей работе методом молекулярного докинга in silico проведено исследование нековалентного взаимодействия различных классов полиметиновых и скварилиевых красителей (всего 45 соединений) с одним из важнейших структурных компонентов коронавируса SARS-CoV-2 – спайк-протеином (Spike protein, S), образующим “шипы” на поверхности вирусной частицы. Для выявления влияния заряда на это взаимодействие изучались как катионные, так и анионные красители.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты по молекулярному докингу проводились с использованием веб-сайта DockThor [9, 10] через веб-интерфейс. Структура белка-мишени S взята на сайте DockThor. Она также доступна на сайте Protein Data Bank (PDB ID 7BZ5) [11].
В PDB-файле структуры спайк-белка были добавлены атомы водорода и оптимизированы водородные связи (рН 7), антитела и небелковые молекулы удалены, остатки селенометионина (Se–Met) в структуре заменены на метиониновые остатки (Met) (DockThor). Предложенная структура белка-мишени использована как есть, дополнительная настройка протонирования остатков аминокислот не проводилась. Эксперименты выполняли в режиме “слепого” докинга (blind docking), размер решетки аппроксимации – 40 Å, центр x = –30.68, y = 30.43, z = 22.38, с шагом дискретизации, равным 0.42 Å. При анализе результатов брались в расчет шесть наилучших конфигураций.
Для создания PDB-структур красителей-лигандов и оптимизации их геометрии (силовое поле MMFF94) применяли молекулярный редактор Avogadro [12, 13]. Пакет UCSF Chimera ([14, 15] использовался для 3D-визуализации и анализа результатов докинга.
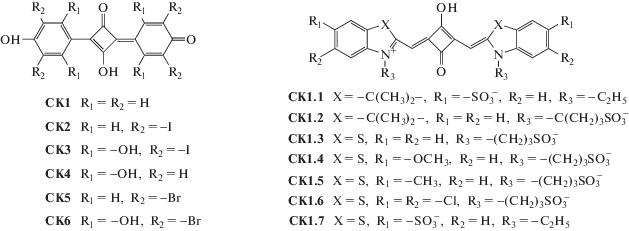
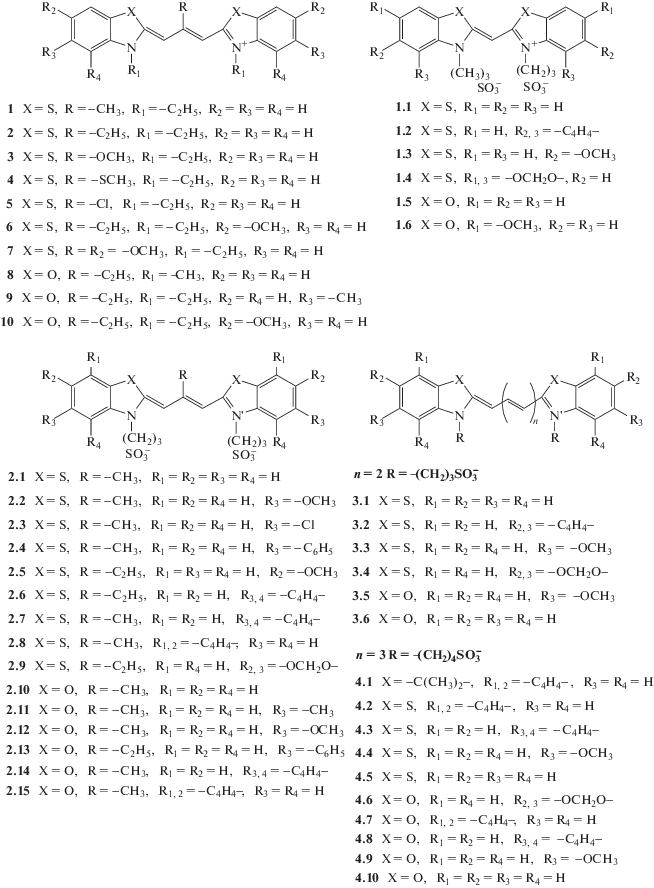
Исследовались симметричные монометин-, триметин-, пентаметин- и гептаменцианины (катионные и анионные) с различными гетероциклами (бензимидазолил, бензтиазолил, бензоксазолил) и заместителями в гетероциклах. Триметинцианины (карбоцианины) имели также различные заместители в мезо-положении полиметиновой цепи (CH3, C2H5, CH3O, CH3S, Cl), поскольку мезо-замещенные тиакарбоцианины ранее были охарактеризованы как эффективные зонды для биомакромолекул [16]. Структуры цианиновых красителей изображены на рис. 1. Исследовали также скварилиевые красители, в том числе скварилиевые индо- и тиацианины, имеющие анионные сульфогруппы (см. рис. 2).
Рис. 1.
Структурные формулы изученных катионных и анионных моно-, три-, пента- и гептаметинцианиновых красителей.
В качестве исходных конформаций в случаях моно-, пента- и гептаметинцианинов брали транс-изомеры красителей [17]. О стабильности возможных комплексов краситель–белок судили по знаку и величине общей энергии системы Etot, полученной в результате докинга: образование стабильных комплексов возможно при достаточно низких (т.е. больших по абсолютной величине) отрицательных значениях энергии.
РЕЗУЛЬТАТЫ
Докинг катионных цианиновых красителей
Исследовано взаимодействие с S десяти катионных тиа- и оксатриметинцианиновых красителей, отличающихся заместителями в мезо-положении полиметиновой цепи и концевых гетероциклов (структуры K1–K10, см. рис. 1). Исходные структуры мезо-замещенных триметинцианинов соответствовали их цис-конфигурации как наиболее устойчивой для этих красителей в водном растворе [18]. Исследование показало, что нековалентное взаимодействие с белком может приводить к изменению изомерной конфигурации молекул красителей. В частности, для тиакарбоцианинов K1–K4 оказываются характерными искаженные транс-конфигурации, а для оксакарбоцианина K8 – сильно скрученная цис-форма. Молекулы красителей располагаются на расстоянии 7–10 Å от остатков Leu184, Glu183, Phe131, Phe96.
Для всех красителей характерны положительные значения общей энергии Etot, которая в среднем составляет 31.24 ± 6.0 ккал ⋅ моль–1; наименьшее значение Etot получено для оксакарбоцианина K8 (22.85 ± 1.07 ккал ⋅ моль–1). Высокие положительные значения Etot говорят о нестабильности комплексов катионных полиметиновых красителей с S. Вследствие этого наше исследование в дальнейшем было сконцентрировано главным образом на анионных полиметиновых красителях.
Докинг анионных цианиновых красителей
Монометинцианины. Был проведен докинг с S ряда из шести анионных монометинцианинов, имеющих бензоксазольные и бензтиазольные концевые гетероциклы и отличающихся заместителями в гетероциклических остатках (рис. 1, структуры 1.1–1.6). Молекулы красителей имеют отрицательный заряд благодаря двум сульфопропильным группам в положениях 3 и 3'. Для большинства исследованных красителей (за исключением 1.4) получены отрицательные значения Etot (см. табл. 1), что указывает на способность этих красителей образовывать стабильные комплексы с S. Монометинцианины располагаются на расстоянии 6–8 Å от остатков As95, Phe131, Leu185; конфигурации тиацианиновых красителей соответствуют скрученным транс-изомерам, в случае оксацианинов – более плоским транс-конфигурациям. Пространственная иллюстрация докинга комплекса красителя 1.5 с S приведена на рис. 3а.
Таблица 1.
Результаты молекулярного докинга анионных моно- и триметинцианиновых красителей с S: общая энергия взаимодействия Etot, энергия ван-дер-ваальсовых взаимодействий EvdW и электростатическая энергия Eel
| Краситель | X | Etot, ккал/моль | EvdW, ккал/моль | Eel, ккал/моль |
|---|---|---|---|---|
| Монометинцианины | ||||
| 1.1 | S (тиа-) |
–41.5 ± 2.5 | –8.2 ± 2.3 | –38.6 ± 5.7 |
| 1.2 | –13.1 ± 0.7 | –11.8 ± 6.6 | –33.1 ± 6.2 | |
| 1.3 | –29.3 ± 0.9 | –10.0 ± 6.0 | 35.0 ± 5.3 | |
| 1.4 | 35.8 ± 1.4 | –12.5 ± 3.0 | –33.2 ± 3.1 | |
| 1.5 | O (окса-) |
–58.6 ± 3.2 | –11.7 ± 5.8 | –34.4 ± 7.6 |
| 1.6 | –52.3 ± 2.8 | –12.5 ± 5.7 | –35.5 ± 5.4 | |
| Триметинцианины | ||||
| 2.1 | S (тиа-) |
–13.7 ± 1.6 | –5.9 ± 4.8 | –38.6 ± 5.9 |
| 2.2 | –24.2 ± 0.95 | –18.5 ± 1.2 | –32.4 ± 1.5 | |
| 2.3 | –19.1 ± 1.6 | –5.2 ± 1.2 | –41.7 ± 4.1 | |
| 2.4 | 18.8 ± 0.47 | –14.9 ± 6.2 | –41.9 ± 9.1 | |
| 2.5 | 0.38 ± 1.02 | –6.89 ± 4.2 | –41.4 ± 5.0 | |
| 2.6 | 7.06 ± 2.8 | –16.5 ± 6.7 | –30.2 ± 8.0 | |
| 2.7 | 48.3 ± 1.3 | –12.7 ± 8.1 | –37.1 ± 5.0 | |
| 2.8 | 84.5 ± 1.0 | –18.0 ± 4.7 | –31.6 ± 5.0 | |
| 2.9 | –18.2 ± 0.97 | –10.2 ± 7.0 | –38.0 ± 6.2 | |
| 2.10 | O (окса-) |
–32.4 ± 0.46 | –10.4 ± 7.9 | –33.6 ± 8.7 |
| 2.11 | –30.0 ± 0.50 | –10.6 ± 6.3 | –37.3 ± 6.4 | |
| 2.12 | 63.5 ± 2.1 | –6.9 ± 5.1 | –40.6 ± 5.7 | |
| 2.13 | –1.05 ± 0.78 | –17.6 ± 2.7 | –34.9 ± 5.0 | |
| 2.14 | 51.9 ± 0.71 | –11.6 ± 3.7 | –35.4 ± 4.13 | |
| 2.15 | –9.5 ± 1.3 | –15.8 ± 4.8 | –32.3 ± 7.2 | |
Рис. 3.
Пространственные иллюстрации докинга красителей с S (структура PDB ID 7BZ5): а – окса-монометинцианина 1.5, б – тиакарбоцианина 2.1 и в – скварилиевого красителя CK1.3.
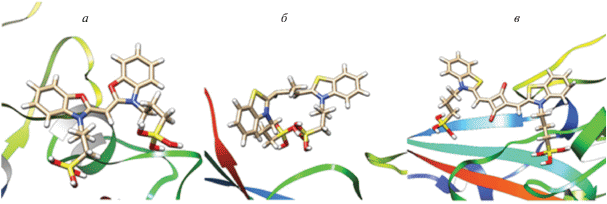
Триметинцианины. Изучено взаимодействие с S ряда из 15 мезо-замещенных анионных тиа- и оксатриметинцианиновых (карбоцианиновых) красителей, отрицательный заряд молекулам которых придает наличие двух сульфогрупп (см. рис. 1, структуры 2.1–2.15). Исходные структуры красителей соответствовали их цис-конфигурации как наиболее устойчивой для мезо-замещенных анионных карбоцианинов в водном растворе [19]. В эксперименте in silico получены результаты, указывающие на способность некоторых красителей ряда образовывать энергетически устойчивые комплексы с S. В частности, для соединений 2.1–2.3, 2.9–2.11, 2.13, 2.15 получены отрицательные значения общей энергии (Etot < 0, см. табл. 1), причем наименьшие значения Etot – для оксакарбоцианинов 2.10 и 2.11. Наличие объемистых фенильных заместителей, а также конденсированных бензольных циклов в концевых гетерогруппах красителей может приводить к повышению величины Etot до положительных значений (для красителей 2.4–2.8, 2.14). Высокие положительные значения Etot говорят о нестабильности комплексов красителей 2.4–2.8, 2.12, 2.14 с S. В связанном с S состоянии пространственные структуры оксакарбоцианиновых красителей соответствуют в основном скрученным цис- и перпланарным конфигурациям, для тиа-красителей могут быть также характерны перпланарные структуры и искаженные (неплоские) транс-изомеры. В связанных с S формах триметинцианины расположены на расстоянии 5–8 Å от Glu183 и на расстоянии 10–12 Å от остатков Phe96, Phe131. Пространственное изображение комплекса красителя 2.1 с S приведено на рис. 3б.
Пентаметинцианины. Молекулярный докинг ряда из шести тиа- и оксапентаметинцианиновых красителей (дикарбоцианинов; структуры 3.1–3.6 на рис. 1) показал, что такие соединения потенциально могут образовывать стабильные комплексы с S (см. табл. 2). Для пентаметинцианинов характерны отрицательные значения общей энергии (за исключением красителя 3.2), при этом, как и в случае триметинцианинов, наименьшие значения Etot получены для окса-красителей (3.6 и 3.5, см. табл. 2).
Таблица 2.
Результаты молекулярного докинга анионных пента-, гептаметинцианиновых и скварилиевых красителей с S: общая энергия взаимодействия Etot, энергия ван-дер-ваальсовых взаимодействий EvdW и электростатическая энергия Eel
| Краситель | X | Etot, ккал/моль | EvdW, ккал/моль | Eel, ккал/моль |
|---|---|---|---|---|
| Пентаметинцианины | ||||
| 3.1 | S (тиа-) |
–30.8 ± 2.0 | –10.5 ± 5.6 | –39.8 ± 7.0 |
| 3.2 | 58.3 ± 1.14 | –22.4 ± 3.4 | –33.5 ± 2.6 | |
| 3.3 | –34.6 ± 2.1 | –11.8 ± 3.4 | –40.5 ± 4.8 | |
| 3.4 | –11.4 ± 0.89 | –10.4 ± 5.3 | –45.3 ± 4.6 | |
| 3.5 | O (окса-) |
–39.2 ± 3.2 | –5.3 ± 7.6 | –47.9 ± 4.9 |
| 3.6 | –53.4 ± 1.42 | –13.3 ± 6.0 | –37.7 ± 6.4 | |
| Гептаметинцианины | ||||
| 4.1 | C(CH3)2 (индо-) | 15.9 ± 0.77 | –20.6 ± 5.9 | –35.7 ± 5.3 |
| 4.2 | S (тиа-) |
10.3 ± 1.24 | –16.3 ± 2.46 | –39.4 ± 4.3 |
| 4.3 | 60.7 ± 2.6 | –17.3 ± 6.7 | –41.0 ± 8.5 | |
| 4.4 | –45.0 ± 2.0 | –18.7 ± 3.8 | –30.1 ± 6.1 | |
| 4.5 | –21.7 ± 1.1 | –16.0 ± 5.8 | –36.3 ± 6.4 | |
| 4.6 | –20.0 ± 0.72 | –10.9 ± 9.0 | –45.2 ± 11.9 | |
| 4.7 | O (окса-) |
–12.7 ± 3.3 | –17.2 ± 3.7 | –35.4 ± 6.0 |
| 4.8 | 59.1 ± 0.95 | –15.6 ± 7.2 | –36.9 ± 7.9 | |
| 4.9 | –32.8 ± 1.04 | –13.0 ± 5.4 | –38.8 ± 4.3 | |
| 4.10 | –38.4 ± 1.65 | –8.3 ± 4.0 | –45.1 ± 6.3 | |
| Скварилиевые красители | ||||
| CK1.1 | C(CH3)2 | 19.6 ± 1.89 | –12.9 ± 3.5 | –33.4 ± 4.6 |
| CK1.2 | 22.7 ± 0.86 | –2.83 ± 3.8 | –49.1 ± 5.6 | |
| CK1.3 | S | –63.0 ± 3.7 | –7.84 ± 5.1 | –50.5 ± 7.9 |
| CK1.4 | 39.2 ± 6.7 | –2.18 ± 2.1 | –54.8 ± 4.9 | |
| CK1.5 | 39.2 ± 2.6 | –0.91 ± 5.6 | –57.9 ± 4.8 | |
| CK1.6 | 3.31 ± 1.73 | –13.87 ± 5.8 | –45.1 ± 9.0 | |
| CK1.7 | –60.7 ± 2.2 | –7.1 ± 1.30 | –46.0 ± 2.4 | |
В связанном с белком состоянии конфигурации тиа-красителей (структуры 3.1–3.4) соответствуют искаженным транс-изомерам и скрученным перпланарным конфигурациям. Для окса-красителей 3.5 и 3.6 моделирование дает более плоские транс-конфигурации.
Гептаметинцианины. Докинг с S ряда анионных тиа- 4.2–4.6 и оксагептаметинцианинов 4.7–4.10 (трикарбоцианинов) показал для красителей без заместителей в концевых гетероциклических ядрах молекул 4.5 и 4.10 отрицательные значения Etot (см. табл. 2). Введение метокси-заместителей в концевые группы (красители 4.4, 4.9) еще снижает значение Etot для тиацианина и мало влияет на Etot окса-красителя. В то же время введение дополнительных конденсированных бензольных циклов в гетероциклические ядра молекул резко повышает величину Etot и делает ее положительной для красителей 4.2, 4.3 и 4.8. Аналогично для индоцианина 4.1 с конденсированными бензольными циклами (индоцианинового зеленого) получено положительное значение Etot (см. табл. 2). Молекулы гептаметинцианинов в комплексе с S располагаются на расстоянии 6–13 Å от остатков Pro93, AS94, Phe131, Glu183; конфигурации молекул красителей соответствуют в основном транс-изомерам.
Докинг скварилиевых красителей
Наряду с классическими полиметиновыми красителями было исследовано взаимодействие с S их родственных соединений – скварилиевых красителей. Проведен молекулярный докинг с S 13 скварилиевых красителей, имеющих различную структуру и заряды молекул (нейтральные CK1–CK6 и анионные CK1.1–CK1.7 с сульфогруппами, см. рис. 2). Исходными структурами красителей CK1.1–CK1.7 служили цис-изомеры. Для всех нейтральных соединений (CK1–CK6) получены положительные значения Etot. Так, для CK3, имеющего OH-группы в концевых циклах, Etot = 45.7 ± 1.69 ккал ⋅ моль–1, тогда как докинг не имеющего таких заместителей красителя CK1 дал значение Etot почти в 11 раз меньше (Etot = 4.1 ± ± 0.36 ккал ⋅ моль–1). Довольно высокие положительные значения Etot говорят о нестабильности комплексов таких красителей с S.
В результате докинга с S скварилиевых красителей, имеющих индольные и бензтиазольные гетерогруппы (рис. 2, CK1.1–CK1.7) и обладающих отрицательным зарядом за счет наличия двух сульфогрупп, для тиа-красителей CK1.3 и CK1.7 получены близкие, довольно низкие значения Etot (табл. 2). В комплексе структура красителя CK1.3 соответствует плоской конформации, краситель CK1.7 скручен и концевые гетерогруппы депланированы. Молекулы красителей CK1.3 и CK1.7 располагаются на расстоянии 5–10 Å от остатков Pro130, Pro93, Glu132, Glu183. Для остальных скварилиевых красителей получены положительные значения Etot. Пространственное строение комплекса красителя CK1.3 с S, полученное в результате докинга, изображено на рис. 3в.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты показывают, что основное влияние на стабильность нековалентных комплексов краситель–S оказывает общий заряд молекулы красителя. Для катионных (или нейтральных в случае скварилиевых красителей) молекул красителя величина Etot положительна, что указывает на неустойчивость комплексов с S. В то же время отрицательные значения Etot, указывающие на возможную устойчивость соответствующих комплексов, получены только для анионных красителей. Все это свидетельствует о существенной роли кулоновских взаимодействий при связывании красителя с S. К тому же, для всех изученных анионных красителей величина Eel, характеризующая кулоновские взаимодействия, отрицательна и по абсолютной величине превышает величину EvdW, характеризующую ван-дер-ваальсовы взаимодействия в комплексе (табл. 1 и 2), что также указывает на ведущую роль кулоновских сил при образовании комплекса.
Наряду с зарядом большое влияние на устойчивость комплексов с S оказывают структурные различия. В частности, большую роль играет наличие или отсутствие дополнительных конденсированных бензольных или диоксиметиленовых циклов в концевых гетероядрах молекулы. Как можно видеть, многие красители, не имеющие таких циклов (красители 1.1, 1.5, 2.1, 2.10, 3.1, 3.6, 4.5, 4.10, СK1.3), демонстрируют отрицательные величины Etot, что указывает на устойчивость соответствующих комплексов. В то же время введение конденсированных циклов или объемистых заместителей (например, –C6H5) часто приводит к нестабильности комплексов, что выражается в положительных значениях Etot (красители 1.4, 2.4, 2.7, 2.8, 2.14, 3.2, 4.1–4.3, 4.8). Это, возможно, обусловлено меньшей компактностью последних и большими стерическими препятствиями для образования комплекса, чем в случае красителей без дополнительных циклов. Кроме того, во многих случаях можно отметить более отрицательные значения Etot для окса-красителей по сравнению с соответствующими тиа- (и индо-) аналогами (ср. пары красителей 1.5–1.1, 2.10–2.1, 2.15–2.8, 3.6–3.1, 3.5–3.3, 4.10–4.5, 4.7–4.2 и 4.1, хотя из этого правила есть и исключения – пары 2.12–2.2 и 4.9–4.4). Возможно, это также связано с более компактной структурой окса-красителей по сравнению с тиа- и индо-аналогами.
По критерию устойчивости комплексов с S – существенно отрицательной величине Etot – можно отобрать в качестве возможных зондов следующие красители: монометинцианины 1.1–1.3, 1.5, 1.6; триметинцианины 2.1–2.3, 2.9–2.11, 2.15; пентаметинцианины 3.1, 3.3–3.6; гептаметинцианины 4.4–4.7, 4.9, 4.10; скварилиевые красители CK1.3 и CK1.7.
Если красители используются в качестве спектрально-флуоресцентных зондов, тогда наряду с устойчивостью комплексов большую роль играет то, насколько резко изменяются спектрально-флуоресцентные свойства красителей при комплексообразовании. При нековалентном связывании с биомакромолекулами для полиметиновых красителей характерны спектральные сдвиги и усиление флуоресценции [2]. Особенно резкий рост интенсивности флуоресценции наблюдается для мезо-замещенных карбоцианинов (триметинцианинов) вследствие сдвига подвижного цис-транс-равновесия, что позволяет обнаруживать очень малые концентрации биомолекул при их использовании в качестве флуоресцентных зондов [20]. С этой точки зрения весьма перспективными для дальнейших практических исследований могут быть тиакарбоцианины 2.2, 2.3 и 2.9 и оксакарбоцианины 2.10 и 2.11.
Для использования в биологических объектах важно, чтобы красители поглощали и флуоресцировали в “окне прозрачности” биологических тканей (в области длин волн >600–650 нм [21, 22]). Этим условиям удовлетворяют красители с более длинной полиметиновой цепочкой – пента-, гептаметинцианины, скварилиевые красители. К перспективным здесь можно отнести почти все исследованные нами пентаметинцианины (кроме 3.2), а также гептаметинцианины 4.4–4.7, 4.9, 4.10 и скварилиевые красители CK1.3 и CK1.7.
Наряду со спектрально-флуоресцентными свойствами при связывании с биомолекулами могут изменяться и фотохимические свойства полиметиновых красителей. В частности, для триметинцианинов наблюдается рост квантового выхода в триплетное состояние [23, 24]. Это свойство в перспективе может быть использовано для фотодинамической терапии – повреждения под действием света биомолекулы-мишени, например компонента вируса, с которым связывается краситель, и, таким образом, инактивации самого вируса. В настоящее время для фотохимической инактивации коронавирусов MERS-CoV и SARS-CoV-2 в сыворотке крови используется рибофлавин в сочетании с облучением УФ-светом [25, 26]. Настоящая работа открывает перспективу применения для этой же цели триметинцианинов, образующих комплексы с биокомпонентами вирусов; при этом можно было бы использовать видимый свет, глубже проникающий в биоткани, чем ультрафиолетовое излучение. Триметинцианины в триплетном состоянии могли бы инициировать повреждение биомолекулы в таком комплексе.
ЗАКЛЮЧЕНИЕ
Путем моделирования с помощью метода молекулярного докинга предпринято исследование нековалентного взаимодействия различных классов полиметиновых (цианиновых и скварилиевых) красителей с одним из структурных белков коронавируса SARS-CoV-2 – спайк-протеином (S). Показано, что катионные или нейтральные красители не образуют устойчивых комплексов с данным белком, но обнаружен ряд анионных красителей, которые потенциально могли бы образовывать такие комплексы. Это позволило провести отбор красителей для дальнейших практических исследований с целью разработки спектрально-флуоресцентных зондов для обнаружения SARS-CoV-2. Показана также перспектива использования триметинцианиновых красителей для фотодинамической терапии – инактивации коронавируса.
Работа выполнена в рамках госзадания № 001201253314 (ИБХФ РАН).
Список литературы
Shindy H.A. // Dyes Pigm. 2017. V. 145. P. 505; https://doi.org/10.1016/j.dyepig.2017.06.029
Tatikolov A.S. // J. Photochem. Photobiol. C: Photochem. Rev. 2012. V. 13. № 1. P. 55; https://doi.org/10.1016/j.jphotochemrev.2011.11.001
Татиколов А.С., Пронкин П.Г., Шведова Л.А., Панова И.Г. // Хим. физика. 2019. Т. 38. № 12. С. 11; https://doi.org/10.1134/S0207401X19120185
Sivaraman D., Biswas P., Cella L.N., Yates M.V., Chen W. // Trends Biotechnol. 2011. V. 29. № 7. P. 307; https://doi.org/10.1016/j.tibtech.2011.02.006
Vus K., Tarabara U., Balklava Z. et al. // J. Mol. Liq. 2020. V. 302. P. 112569; https://doi.org/10.1016/j.molliq.2020.112569
Beg M.A., Athar F. // Pharm. Pharmacol. Intern. J. 2020. V. 8. № 3. P. 163; https://doi.org/10.15406/ppij.2020.08.00292
Tazikeh-Lemeski E., Moradi S., Raoufi R. et al. // J. Biomol. Struct. Dyn. 2020. P. 0739; https://doi.org/10.15406/ppij.2020.08.00292
Al-Masoudi N.A., Elias R.S., Saeed B. // Biointerface Res. Appl. Chem. 2020. V. 10. № 5. P. 6444; https://doi.org/10.33263/BRIAC105.64446459
De Magalhães C.S., Barbosa H.J.C., Dardenne L.E. Genetic and Evolutionary Computation (GECCO 2004). Lecture Notes in Computer Science. V. 3102. Berlin–Heidelberg: Springer, 2004; https://doi.org/10.1007/978-3-540-24854-5_382004
De Magalhães C.S., Almeida D.M., Barbosa H.J.C., Dardenne L.E. // Inf. Sci. 2014. V. 289. P. 206; https://doi.org/0.1016/j.ins.2014.08.002
Wu Y., Wang F., Shen C. et al. // Science. 2020. V. 368. № 6496. P. 1274; https://doi.org/10.1126/science.abc2241
Hanwell M.D., Curtis D.E., Lonie D.C. et al. // J. Cheminformatics. 2012. V. 4. P. 17; https://doi.org/10.1186/1758-2946-4-17
Avogadro: инструмент для построения молекул и визуализации с открытым исходным кодом. Версия 1.2.0; http://avogadro.cc (дата обращения: 11.08.2020).
Yang Z., Lasker K., Schneidman-Duhovny D. et al. // J. Struct. Biol. 2012. V. 179. P. 269; https://doi.org/10.1016/j.jsb.2011.09.006
UCSF Chimera: система визуализации для поисковых исследований и анализа. Версия 1.13.1; http://www.rbvi.ucsf.edu/chimera (дата обращения: 11.08.2020).
Татиколов А.С., Акимкин Т.М., Кашин А.С., Панова И.Г. // Химия высоких энергий. 2010. Т. 44. № 3. С. 252.
Колесников А.М., Михайленко Ф.А. // Успехи химии. 1987. Т. 56. С. 466.
Акимкин Т.М., Татиколов А.С., Ярмолюк С.М. // Химия высоких энергий. 2011. Т. 45. № 3. С. 252.
Khimenko V., Chibisov A.K., Görner H. // J. Phys. Chem. A. 1997. V. 101. P. 7304; https://doi.org/10.1021/jp971472b
Pronkin P.G., Shvedova L.A., Tatikolov A.S. // Biophys. Chem. 2020. V. 261. P. 106378; https://doi.org/10.1016/j.bpc.2020.106378
Красников И.В., Привалов В.Е., Сетейкин А.Ю., Фотиади А.Э. // Вестн. СПбГУ. 2013. Сер. 11. Вып. 4. С. 202.
Patterson M.S., Wilson B.C., Wyman D.R. // Lasers Med. Sci. 1991. V. 6. P. 379; https://doi.org/10.1007/bf02042460
Пронкин П.Г., Татиколов А.С., Скляренко В.И., Кузьмин В.А. // Химия высоких энергий. 2006. Т. 40. № 4. С. 295.
Пронкин П.Г., Татиколов А.С., Скляренко В.И., Кузьмин В.А. // Там же. № 6. С. 451.
Keil S.D., Bowen R., Marschner S. // Transfusion. 2016. V. 56. P. 2948; https://doi.org/10.1111/trf.13860
Keil S.D., Ragan I., Yonemura S. et al. // Vox Sang. 2020. V. 115. P. 495; https://doi.org/10.1111/vox.12937
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика