Химическая физика, 2021, T. 40, № 3, стр. 80-85
Влияние сульфатного аэрозоля в нижней стратосфере на время жизни нечетного кислорода
И. К. Ларин 1, *, А. Е. Алоян 2, А. Н. Ермаков 1
1 Институт энергетических проблем химической физики им. В.Л. Тальрозе
Российской академии наук
Москва, Россия
2 Институт вычислительной математики Российской академии наук
Москва, Россия
* E-mail: iklarin@narod.ru
Поступила в редакцию 11.07.2019
После доработки 25.08.2019
Принята к публикации 20.09.2019
Аннотация
В работе приводятся результаты расчетов времени жизни нечетного кислорода и концентраций ряда малых составляющих в нижней стратосфере с учетом химических реакций в переохлажденных жидких частицах сульфатного аэрозоля (background aerosol). Найдено, что захватываемые аэрозолем из воздуха газовые молекулы N2O5 и другие подвергаются реакциям гидролиза. Их быстрый сток на высотах менее 15 км удлиняет время жизни нечетного кислорода (Ox), что вызвано снижением концентраций компонентов семейства NOx и подавлением их реакций с компонентами семейства Ox. На бóльших высотах: 16–22 км, время жизни нечетного кислорода, напротив, сокращается; сказывается ускорение реакций Ox с компонентами семейств HOx и ClOx, концентрации которых возрастают при снижении содержания в воздухе компонентов семейства NOx. Полученные результаты указывают на то, что это влияние сульфатного аэрозоля необходимо учитывать в расчетах динамики разрушения озона в нижней стратосфере в каталитических HOx-, NOx-, ClOx- и Ох-циклах.
ВВЕДЕНИЕ
В работах [1, 2] при исследовании процессов образования и разрушения стратосферного озона нами рассматривался вопрос о методологии корректных расчетов атмосферного времени жизни так называемого семейства нечетного кислорода Ox ([Ox] = [O3] + [O(3P)] + [O(1D)]). При этом указывалось на коренное отличие этого семейства от семейств HOx, NOx и других, также рассматриваемых в литературе (см., например, [3–5]). Действительно, если содержание компонентов последних определяется исключительно процессами внутри этих семейств, то в семействе Ox их концентрации определяются не только процессами внутри самого семейства, но и взаимодействием с компонентами других семейств, осуществляющимся в каталитических циклах HOx, NOx, ClOx, в которых разрушается нечетный кислород.
В нижней стратосфере наряду с газовыми реакциями следует считаться и с гетерогенными химическими реакциями (ГХР) [6–8], в том числе с участием частиц сульфатного аэрозоля (частицы слоя Юнге) [9]. Переохлажденные капли этого слоя, основными компонентами которых являются вода и серная кислота, располагаются между высотами ≈10–12 и ≤25 км, глобально обволакивая при этом планету (по данным [10] – от ≈70° с.ш. до ≈50° ю.ш.). В работе [11] в этой связи указывалось, что отрицательная тенденция изменения концентрации в нижней стратосфере одного из компонентов семейства Ox – озона – в период озонового кризиса (конец XX-го столетия) обусловлена именно протеканием ГХР с участием частиц слоя Юнге. Свидетельства влияния ГХР на содержание малых примесей в атмосфере в средних широтах находим и в данных натурных экспериментов, например в кампании самолетных экспериментов SPADE (Stratospheric Photochemistry Aerosols and Dynamics Expedition) [12]. Цели данной работы – проведение численных расчетов, позволяющих учитывать влияние сульфатного аэрозоля на время жизни нечетного кислорода, и определение концентраций малых составляющих в нижней стратосфере.
МОДЕЛЬ ChemWG
В настоящей работе, как и в [11], о влиянии ГХР с участием частиц слоя Юнге на концентрации малых составляющих в нижней стратосфере судили с использованием ранее построенной 0‑мерной модели (ChemWG). Подобным образом в работе [13] рассматривалось и локальное разрушение озона в нижней стратосфере в высоких широтах (68 ± 10)° с.ш. с участием “больших” частиц (размером 5 мкм и более) частиц тригидрата азотной кислоты (NAT rocks). Как отмечалось в работе [11], обоснованием выбора такого подхода служит инверсное распределение температуры в стратосфере, препятствующее развитию конвективных потоков.
Подробное описание модели ChemWG, включающей такой же блок химических реакций в газовой фазе, как и в модели SOCRATES, а также блоки процессов массообмена на границе “газ–капля” и жидкофазных реакций в каплях, дается в работе [11]. Численные расчеты выполнялись для единичного объема газа с равномерно распределенными по его объему каплями радиусом 0.1 мкм на высотах от 10 до 25 км. Время счета: ≤ 3 ⋅ 106 с (≈30 сут). При этом, как и в модели SOCRATES, содержание малых примесей рассчитывалось с учетом их суточных изменений. В расчетах принимали во внимание и диффузионные ограничения жидкофазных реакций в объеме частиц аэрозоля. Ключевую роль при этом играет соотношение “реакционной длины” l [см] = (D(p-p)/K)1/2, т.е. расстояния от поверхности, на котором завершается реакция в объеме капли с захватываемым из газа компонентом (X(p-p)), и радиуса r частиц аэрозоля: l/r. Здесь D(p-p) – коэффициент диффузии реагента в жидкой фазе, см2/с; а K = k[X(p-p)], с–1 – глобальная константа скорости, численное значение которой характеризует время протекания данной реакции. По результатам этого рассмотрения было найдено, что основную роль в рассматриваемых условиях играют процессы гидролиза захватываемых из воздуха молекул N2O5 и в гораздо меньшей степени – гидролиза ClONO2:
Оба эти процесса протекают в приповерхностном слое, а их скорости пропорциональны площади удельной поверхности частиц сульфатного аэрозоля в газе: 3L/r. Здесь L – объемное содержание капельной влаги в газе (безразмерное).
Необходимые для вычислений динамики этих ГХР значения удельных объема и поверхности частиц сульфатного аэрозоля в нижней стратосфере заимствовались из данных натурных экспериментов по измерению содержания серной кислоты в нижней стратосфере [14]. При этом физико-химические свойства переохлажденных капель (содержание серной кислоты и других компонентов, плотность, активность воды и свободных протонов) рассчитывались с привлечением термодинамической модели Atmospheric Inorganic Model (AIM) [15]. В расчетах использовались данные по растворимости “резервуарных” хлорсодержащих газов (HCl, ClNO3) и N2O5, которые были получены в экспериментах (wetted wall flow tube technique) [16] по изучению динамики захвата газовых молекул переохлажденными растворами серной кислоты, а также данные по их вязкости и кинетике низкотемпературных жидкофазных химических реакций [17]. Высотные профили концентраций индивидуальных компонентов в газовой фазе (xi, см–3), а также температуры и относительной влажности (RH) в заданной географической точке рассчитывали с использованием двумерной интерактивной модели SOCRATES [18]. Результаты расчетов, проведенные для средних широт (50° с.ш.) и летнего времени (июнь 1995 года) приведены ниже.
РЕЗУЛЬТАТЫ РАСЧЕТОВ И ИХ ОБСУЖДЕНИЕ
По результатам расчетов было найдено, что вопреки невысокой растворимости высотные профили большинства малых составляющих в атмосфере обнаруживают существенные изменения при учете захвата аэрозолем газовых молекул N2O5 и СlONO2. При этом главную роль, как отмечалось, играет захват молекул N2O5. На рис. 1 в качестве примера приводятся рассчитанные высотные профили относительных концентраций компонент ([Xi(г)]г + ГХР/[Xi(г)]г) рассматривавшихся выше семейств HOx, NOx и ClOx, участвующих в разрушении озона при учете ГХР. Подстрочные индексы “г” и “г + ГХР” отвечают концентрациям OH, СlO и NO2 соответственно при учете химических и фотохимических реакций в газовой фазе и в условиях одновременного протекания в нижней стратосфере газовых реакций и ГХР.
Рис. 1.
Рассчитанные высотные профили относительных концентраций [Xi(г)]г+ГХР/[Xi(г)]г компонентов семейств HOx (OH), NOx (NO2) и ClOx (ClO) с учетом гетерогенных химических реакций с участием аэрозольного слоя Юнге в нижней стратосфере для условий июня 1995 года на широте 50° с.ш. (см. текст).
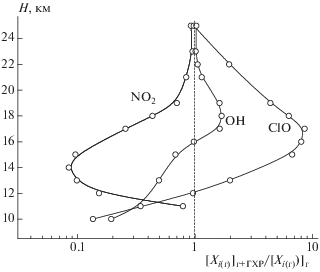
Видно, что при одновременном осуществлении этих химических процессов концентрации NO2 – одного из компонентов семейства NOx – на высотах ≤16 км оказываются гораздо более низкими в сравнении с рассчитанными в отсутствие рассматриваемых ГХР. При этом по мере подъема над подстилающей поверхностью наблюдается снижение [NO2(г)]г + ГХР/[NO2(г)]. Подобная, хотя и менее выраженная картина прослеживается и для других компонент этого семейства (NO и NO3; на рис. 1 не показано). В то же время концентрации радикалов ОН и ClO, т.е. компонент семейств НОх и ClOх, на рассматриваемых высотах при учете ГХР, напротив, растут по мере подъема над подстилающей поверхностью (см. рис. 1). Похожий рост с увеличением высоты обнаруживается и для и концентрации атомов О(3Р) – компонентов семейства Ox (на рис. 1 не показано).
Из данных рис. 1 следует, что на бóльших высотах (>16–18 км) концентрации компонентов всех рассматриваемых семейств приближаются к найденным в расчетах в отсутствие рассматриваемых нами ГХР. С чем же связано ослабление их влияния на больших высотах? Причина заключается в нарастании температуры и снижении относительной влажности воздуха с ростом высоты над подстилающей поверхностью. Как следствие, содержание серной кислоты в сульфатных частицах нарастает, что сопровождается подавлением диссоциации H2SO4 и переходом ее молекул в газовую фазу, завершающимся в конечном итоге полным испарением частиц сульфатного аэрозоля. С этими процессами связано и происхождение верхней границы слоя Юнге [9, 19].
Свидетельства изменений концентраций малых составляющих, вызванных аэрозолем, находим, рассматривая данные цитировавшихся выше натурных экспериментов SPADE [12]. Так, на высоте ∼19 км (∼50° с.ш., P ≈ 67 мБар, Т ≈ 216 К) в середине мая 1993 г. содержание NO2 по этим данным снижалось почти втрое, концентрации OH и НО2 возрастали примерно на 30–50%, а содержание ClO возрастает приблизительно вчетверо. При этом в качестве базового уровня их содержания (т.е. в отсутствие частиц слоя Юнге) рассматривались концентрации этих компонентов, рассчитанные в приближении отсутствия ГХР с частицами.
На малых высотах (≤16 км) картина высотного распределения компонент рассматриваемых нами семейств определяется в основном захватом из воздуха молекул N2O5. Имеющиеся лабораторные данные показывают, что эффективность захвата этих молекул сульфатным аэрозолем не слишком чувствительна к колебаниям температуры и [H2SO4] [17]. При этом рассматривались два параллельных канала гидролиза: N2O5(p-p) + H2O и N2O5(p-p) + H2O + ${\text{H}}_{{{\text{p - p}}}}^{ + }.$ С учетом значений констант скорости этих реакций [17] и рассчитанного отношения l/r $ \ll $ 1 для коэффициента захвата молекул N2O5 парами вод, γ, имеем значение, равное 0.1. Для характерного времени захвата N2O5 при максимальном массовом содержании сульфатного аэрозоля отсюда находим: τ ≈ ${r \mathord{\left/ {\vphantom {r {\gamma {{\omega }_{{{{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}}L}}} \right. \kern-0em} {\gamma {{\omega }_{{{{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}}L}}$ ≈ 104 c. Полученное значение τ близко ко времени установления равновесия термической диссоциации N2O5 на NO2 и NO3 и времени фотодиссоциации N2O5, что говорит о значимости учета их захвата частицами сульфатного аэрозоля. Здесь ${{\omega }_{{{{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}}$ – средняя скорость газовых молекул N2O5. В результате их захвата аэрозольными частицами равновесие N2O5 ⇆ NO2 + NO3 смещается влево, а концентрации NO2 и NO3 в газовой фазе снижаются. Их спад сопровождается подавлением реакций ОН/HO2+ NO(NO2), а также ClO + NO/NO2, что и влечет за собой рост концентраций компонентов семейств НОх и ClOx при учете ГХР с участием захватываемых сульфатным аэрозолем газовых молекул N2O5 (см. рис. 1).
Подытоживая, можно утверждать, что приводимые высотные профили относительных концентраций компонентов семейств NOx, НОх и ClOx повторяют высотный профиль распределения массовой концентрации частиц слоя Юнге в нижней стратосфере. При этом, однако, максимумы концентраций ОН и ClO приходятся на несколько большие высоты (на 1–3 км), чем минимум концентрации NO2. В случае ОН причина смещения максимума их концентрации вверх – рост содержания озона, а в случае ClO – растущее с увеличением высоты над подстилающей поверхностью содержание резервуарных хлорсодержащих газов (HCl, ClONO2) – предшественников ClO, так как основные источники HCl и ClONO2 – хлорфторуглероды располагаются на бóльших высотах.
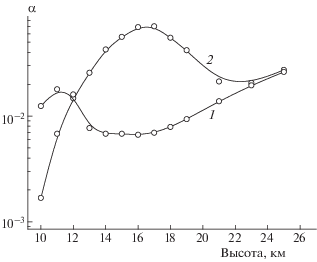
Из данных рис. 1 следует, что захват из воздуха молекул N2O5 и отчасти ClONO2 наиболее существенно сказывается на концентрациях компонентов семейства ClOx, играющих ключевую роль в разрушении стратосферного озона, в высоких широтах и в условиях местной зимы (галогенная активация). Максимальная концентрация активной формы хлора (ClO) при учете химического влияния частиц слоя Юнге даже в летнее время возрастает почти на порядок величины (см. рис. 1). Сравнение относительных концентраций активных в отношении разрушения Ох хлорсодержащих соединений (ClO, Cl2O2): α = ([ClO] + + 2[Cl2O2])/([HCl] + [ClONO2]), при учете ГХР и в их отсутствие представлено на рис. 2. Видно, что на высотах, где протекают ГХР с участием резервуарных газов, т.е. в условиях максимально высоких массовых концентраций сульфатного аэрозоля, скорость трансформации резервуарных хлорных компонент в активные хлорные соединения заметно возрастает. На этих высотах величина α ≥ 7%, тогда как в отсутствие учета влияния частиц аэрозоля значение α ≈ 1%. Таким образом, даже в невозмущенной вулканизмом атмосфере и в летнее время, т.е. в условиях низких массовых концентраций частиц сульфатного аэрозоля, их присутствие существенным образом сказывается на газовом составе в нижней стратосфере.
Рис. 2.
Высотные профили глубин трансформации резервуарных хлорных компонентов в активные соединения, участвующих в ClOx-цикле разрушения озона в нижней стратосфере для условий июня 1995 года на широте 50° с.ш. Кривая 1 – газофазные реакции, кривая 2 – газофазные + гетерогенные химические реакции с участием частиц сульфатного аэрозоля.
На рис. 3 приводится картина сравнения высотных профилей времен жизни нечетного кислорода (τi), вычисленных с учетом ГХР $({{\tau }_{{{{{\text{O}}}_{x}}{\text{,ГХР}}}}})$ и в их отсутствие $\left( {{{\tau }_{{{{{\text{O}}}_{x}}}}}} \right).$ Расчеты τi проводились с использованием приводимого в работе [1] выражения:
Рис. 3.
Высотные профили времени жизни нечетного кислорода, рассчитанные при учете газофазных (светлые точки) и суммы газофазных и гетерогенных химических реакций (темные точки) для условий июня 1995 г. на широте 50° с.ш.
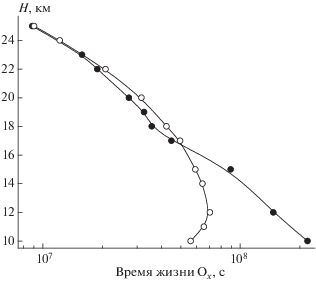
где v(Ox-des), v(HOx-des), v(NOx-des) и v(ClOx-des) – скорости разрушения озона в этих циклах, абсолютные значения которых также вычислялись с использованием развитой в [1] методологии. При этом концентрации компонент этих семейств вычислялись как с учетом ГХР, так и в их отсутствие. Можно видеть, во-первых, что ${{\tau }_{{{{{\text{O}}}_{x}}{\text{,ГХР}}}}}$ на высотах 10–15 км существенно отличается от ${{\tau }_{{{{{\text{O}}}_{x}}}}};$ величины ${{\tau }_{{{{{\text{O}}}_{x}}{\text{,ГХР}}}}}$ значительно превосходят ${{\tau }_{{{{{\text{O}}}_{x}}}}}.$ Это значит, что учет ГХР с частицами сульфатного аэрозоля, в нашем случае – в основном гидролиза захватываемых из воздуха молекул N2O5, приводит к росту времени жизни нечетного кислорода, т.е. к уменьшению скорости разрушения стратосферного озона – основного компонента семейства Ox. Причина – замедление реакций NOx-цикла, вызванное захватом молекул N2O5, и снижение концентраций NO, NO2 и NO3. Это значит также, что характеристическое время переноса τd = = ${{{{H}^{2}}} \mathord{\left/ {\vphantom {{{{H}^{2}}} {{{k}_{{zz}}}}}} \right. \kern-0em} {{{k}_{{zz}}}}}$ в атмосфере на этих высотах оказывается меньше ${{\tau }_{{{{{\text{O}}}_{x}}{\text{,ГХР}}}}},$ что препятствует использованию “метода семейств” [1]. Напомним в этой связи, что использование этого метода позволяет существенно увеличить шаг счета по времени, поскольку уравнения переноса в этом случае записываются не для короткоживущих компонент, а для их долгоживущей совокупности, что позволяет существенно сократить время счета. При этом метод семейств “работает”, когда атмосферное время жизни семейства во всем диапазоне рабочих высот остается меньше τd. В приведенном выше для τd выражении H – высота однородной атмосферы, равная ${{RT} \mathord{\left/ {\vphantom {{RT} {mg}}} \right. \kern-0em} {mg}}$ (R – универсальная газовая постоянная, T – абсолютная температура, m – средний молекулярный вес воздуха, g – ускорение свободного падения), а kzz – коэффициент турбулентной диффузии.
На высотах от 17 до ≈23 км рассчитанные значения ${{\tau }_{{{{{\text{O}}}_{x}}{\text{ - ГХР}}}}}$ оказываются несколько меньшими (≈10–15%) в сравнении с ${{\tau }_{{{{{\text{O}}}_{x}}}}}.$ Это значит, что на этих высотах присутствие в нижней стратосфере частиц аэрозоля способствует ускорению процесса разрушения озона. При этом активация процесса его разрушения обеспечивается в основном за счет роста скорости реакций HOx-цикла вследствие сохраняющегося на этих высотах подавления процессов ОН/HO2 + NO(NO2), хотя определенную роль играют также реакции ClOx-цикла (хлорная активация). На динамике разрушения озона сказывается и рост скорости разрушения озона в NOx-цикле по мере подъема, что маскирует активацию этого процесса в HOx- и ClOx-циклах. Как отмечалось, увеличение скорости разрушения озона в NOx-цикле обусловлено нарастанием концентраций NO, NO2 и NO3 по мере подъема вследствие снижения скорости захвата молекул N2O5 из-за уменьшения концентрации частиц аэрозоля (см. рис. 1). На этих высотах величины ${{\tau }_{{{{{\text{O}}}_{x}}{\text{,ГХР}}}}}$ оказываются меньшими τd, что позволяет пользоваться методом семейств, заметно экономящим время численных расчетов. Наконец, на высотах, превышающих 20 км, влияние частиц слоя Юнге на время жизни нечетного кислорода постепенно уменьшается. Это обусловлено снижением массовой концентрации частиц аэрозоля на этих высотах и в конечном итоге их полным испарением.
ЗАКЛЮЧЕНИЕ
В работе приводятся результаты расчетов атмосферного времени жизни нечетного кислорода и малых составляющих в нижней стратосфере с учетом гетерогенных химических реакций с участием частиц сульфатного аэрозоля. Расчеты указывают на существенное влияние захвата из воздуха молекул N2O5 на концентрации большей части малых составляющих в нижней стратосфере (OH, ClO, NO2 и др.). Это влияние обусловлено главным образом снижением концентраций компонентов NOx-семейства и подавлением их реакций с компонентами HOx- и ClOx-семейств, и его необходимо учитывать даже в летнее время в расчетах динамики разрушения озона в каталитических HOx-, NOx- и ClOx- и Ох-циклах в нижней стратосфере.
Работа выполнена при поддержке Российским фондом фундаментальных исследований (проекты № 18-05-00289 и № 19-05-00080), а также в рамках госзадания ИНЭП ХФ РАН им. В.Л. Тальрозе (регистрационный номер AAAA-0047-2018-0012).
Список литературы
Ларин И.К. // Хим. физика. 2017. Т. 36. № 3. С. 87.
Ларин И.К. // Хим. физика. 2017. Т. 36 № 1. С. 90.
Brasseur G., Solomon S. Aeronomy of the Middle Atmosphere: Chemistry and Physics of the Stratosphere and Mesosphere. Third revised and enlarged edition. Montreal, Canada: Springer, 2005.
Jacob D.J. Introduction to Atmospheric Chemistry. Princeton: University Press, 1999.
Shimazaki T. Minor constituents in the middle atmosphere. Tokyo, Japan: Terra Sci. Publ. Company, 1985.
Кумпаненко И.В., Рощин А.В., Иванова Н.А., Зеленина Е.И., Волченко Т.С., Панин Е.О. // Хим. физика. 2018. Т. 37. № 2. С. 25.
Зеленов В.В., Апарина Е.В., Козловский В.И., Сулименков И.В., Носырев А.Е. // Хим. физика. 2018. Т. 37. № 3. С. 72.
Алоян А.Е., Ермаков А.Н., Арутюнян В.О. // Хим. физика. 2019. Т. 38. № 1. С. 81.
Junge C.E., Chagnon C.W. Manson J.E. // J. Meteorol. 1961. V. 18. P. 81.
Turco R.P., Whitten R.C., Toon O.B. // Rev. Geophys. 1982. V. 20. P. 233.
Ларин И.К., Алоян А.Е., Ермаков А.Н. // Хим. физика. 2016. Т. 35. № 9. С. 76.
Salawitch R.J., Wofsy S.C., Wennberg P.O. et al. // Geophys. Res. Lett. 1994. V. 21. P. 2547.
Voigt C., Schlager H., Luo B.P. et al. // Atmos. Chem. Phys. 2005. V. 5. P. 1371.
Myhre G., Berglen T.F., Myhre C.L.E. et al. // Tellus. 2004. V. 56B. P. 294.
http://www.aim.env.uea.ac.uk/aim/aim.php
Hanson D.R. // J. Phys. Chem. A. 1998. V. 102. P. 4794.
Shi Q., Jayne J.T., Kolb C.E. et al. // J. Geophys. Res. 2001. V. 106. P. 24259.
http://cdp.ucar.edu/browse/browse.htm?uri=http:// dataportal.ucar.edu/metadata/acd/software/Socrates/ Socrates.thredds.xml
Carslaw K.S., Peter T., Clegg S.L. // Rev. Geophys. 1997. V. 35. P. 125.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


