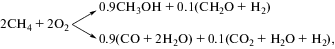Химическая физика, 2021, T. 40, № 5, стр. 46-54
Новые некаталитические методы переработки углеводородных газов
С. М. Алдошин 1, 2, В. С. Арутюнов 1, 2, 3, В. И. Савченко 1, И. В. Седов 1, 2, *, А. В. Никитин 1, 3, И. Г. Фокин 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
* E-mail: isedov@icp.ac.ru
Поступила в редакцию 29.10.2020
После доработки 13.11.2020
Принята к публикации 20.11.2020
Аннотация
Теория разветвленно-цепных процессов, созданная основателем российской школы химической физики Николаем Николаевичем Семёновым, стала фундаментом современных представлений о механизме газофазных процессов конверсии углеводородов и основой глубокого понимания явлений, протекающих во многих смежных областях. Однако на протяжении всего XX века химическая переработка углеводородных газов оставалась второстепенным направлением нефтегазохимии, поскольку основным углеводородным сырьем были жидкие углеводороды нефти. Кардинальное изменение ситуации после начала промышленной разработки огромных нетрадиционных ресурсов природного газа сделало необходимым создание экономически эффективных технологий переработки в базовые нефтехимические продукты более дешевых и доступных газообразных углеводородов. В статье рассмотрены новые некаталитические методы переработки углеводородных газов, разработанные в ИПХФ РАН и ФИЦ ХФ РАН, и перспективные направления их применения.
ВВЕДЕНИЕ
Теория разветвленно-цепных реакций, созданная Н.Н. Семёновым [1], основывается на высокой реакционной способности атомов и радикалов, образующихся в реакциях зарождения цепей, и в их последующем взаимодействии с исходными молекулами, ведущем к продолжению и разветвлению цепей. Она позволила объяснить процессы окисления и воспламенения газов (классические работы – по воспламенению гремучей смеси и окислению CO), определить условия и кинетические закономерности протекания этих реакций, включая существование концентрационных пределов воспламенения, установить механизм влияния внешних факторов и различных примесей на протекание реакций.
Представления, развитые Н.Н. Семёновым при разработке теории разветвленно-цепных процессов, нашли практическое применение во многих областях науки и техники, в том числе не связанных непосредственно с химической технологией. Что касается газохимии, то поскольку в ХХ веке основным углеводородным сырьем были жидкие углеводороды нефти, глубокая переработка углеводородных газов на основе радикально-цепных процессов не получила широкого распространения.
Благодаря огромным, прежде всего нетрадиционным ресурсам газа, выявленным в последнее время, и новым технологиям их добычи, сделавшим газ более дешевым и потому более привлекательным сырьем не только для энергетики, но и для производства химических продуктов, все больший интерес привлекает глубокая переработка углеводородных газов. Для этого, помимо рентабельных технологий их добычи и транспортировки, необходимы эффективные технологии как малотоннажные [2–4], так и крупнотоннажные [5], их переработки в химические продукты. Таким образом, реальная структура мировых углеводородных ресурсов ставит перед современной газохимией в качестве основной цели получение на базе основного компонента природного газа – метана – органических продуктов, традиционно получаемых переработкой нефти.
Однако высокая термодинамическая стабильность легких углеводородов, в первую очередь метана, требует больших затрат энергии на реализацию газохимических процессов. Поскольку наиболее доступный и дешевый источник энергии для таких процессов – окисление (горение) самого метана, являющееся сильно экзотермической реакцией, сочетание экзотермического окисления с эндотермическими процессами образования термодинамически менее стабильных продуктов делает перспективным направлением газохимии автотермические процессы и технологии. Выделение энергии непосредственно в реакционном объеме за счет глубокого окисления части исходного сырья позволяет избежать использования дорогостоящего и малоэффективного для газовых сред теплообменного оборудования, а также неизбежных при этом теплопотерь.
Одним из важнейших продуктов химической конверсии метана является синтез-газ, в который метан может быть превращен практически со 100%-ной селективностью, правда, при температурах, близких к 1000 °С. Уже освоенные крупнотоннажные промышленные процессы синтеза из него метанола и синтетических углеводородов (процесс Фишера–Тропша) открывают пути получения многих продуктов, традиционно производимых из нефти. Однако высокие температуры и большие энергозатраты делают рентабельную и эффективную конверсию метана в синтез-газ сложной технологической задачей. На стадию конверсии метана в синтез-газ приходится до 70% всех затрат на получение целевых продуктов, что делает современные крупнотоннажные процессы на основе предварительной конверсии метана в синтез-газ сложными, энерго- и капиталоемкими технологиями. Сложность и высокая энергоемкость существующих газохимических процессов является основным фактором, сдерживающим развитие газохимии.
Ведущее место в производстве химических и нефтехимических продуктов из углеводородного сырья занимают окислительные процессы, на долю которых приходится значительная часть производства базовых химических продуктов. Естественно, что в период бурного развития нефтехимии большое внимание исследователей привлекали процессы жидкофазного окисления углеводородов. Исследования газофазных процессов окисления углеводородов носили в основном академический характер. В настоящее время в связи с увеличением доли природного газа в общемировом объеме запасов ископаемых углеводородов, газофазные процессы его окисления приобретают все большее практическое значение.
Главная особенность окисления метана – нелинейный характер практически всех основных стадий и быстро нарастающая в ходе окисления сложность системы, особенно если окисление метана протекает при температурах заметно ниже температуры его горения. В этом случае оно сопровождается появлением большого числа разнообразных вторичных, третичных и так далее продуктов вплоть до образования твердых продуктов различного строения. Разнообразие нелинейных процессов, сопровождающих окисление метана, иллюстрируют такие явления, как холодные пламена, многостадийное воспламенение, появление области отрицательного температурного коэффициента (ОТК) скорости реакции и температурного гистерезиса скорости реакции, колебательные режимы окисления и другие [6]. Такое многообразие типов поведения и образующихся при этом продуктов открывает большие возможности для создания новых технологических процессов.
Основные направления в разработке новых процессов конверсии метана в химические продукты можно разделить на две большие группы: процессы на основе прямого превращения метана в целевые продукты и процессы на основе его предварительной конверсии в синтез-газ. В настоящей работе представлен обзор разрабатываемых в ИПХФ РАН и ИХФ РАН новых некаталитических методов конверсии метана в ценные химические продукты, отличающихся от традиционных каталитических методов его переработки, и дана оценка возможностей их практического применения, в первую очередь для малотоннажного получения ценных химических продуктов и энергоносителей.
МАТРИЧНАЯ КОНВЕРСИЯ УГЛЕВОДОРОДОВ В СИНТЕЗ-ГАЗ
Предложен и испытан принципиально новый метод конверсии углеводородных газов в синтез-газ – метод матричной конверсии [6–10]. Суть метода заключается в том, что стабильная конверсия метана при соотношениях О2/СН4, близких к стехиометрии реакции образования синтез-газа
(1)
$\begin{gathered} {\text{С}}{{{\text{Н}}}_{{\text{4}}}} + 0.{\text{5}}{{{\text{О}}}_{{\text{2}}}} \to {\text{СО}} + {\text{2}}{{{\text{Н}}}_{{\text{2}}}} \\ \Delta H_{{298}}^{^\circ } = --{\text{36}}\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}, \\ \end{gathered} $т.е. при четырехкратном или близком к этому недостатке кислорода по сравнению с необходимым для его полного окисления в Н2О и СО2, достигается компенсацией низкого теплового эффекта этой реакции за счет предварительного повышения температуры реагентов. Наиболее целесообразно использовать для этого тепло продуктов окислительной конверсии метана. Но передача тепла с использованием внешних теплообменников неэффективна, поскольку газофазные продукты и реагенты обладают низкой теплопроводностью. Более эффективный перенос тепла может быть реализован непосредственно в ходе самой конверсии. При конверсии газа внутри замкнутой полости с проницаемой для газовой смеси стенкой в режиме поверхностного (беспламенного) горения фронт пламени стабилизируется на расстоянии 1.5–2 мм от поверхности за счет интенсивного теплообмена с ней (рис. 1а). Интенсивная конвективная и радиационная рекуперация тепла продуктов конверсии при беспламенном горении вблизи внутренней поверхности проницаемой матрицы и запирание ИК-излучения фронта пламени в полости матрицы позволяют значительно расширить пределы горения в область очень богатых метан-воздушных смесей с соотношением метан/кислород, близким к стехиометрии уравнения (1) (рис. 1б).
Рис. 1.
а – Принцип работы конвертора на основе поверхностного горения внутри замкнутого матричного блока; 1 – корпус матричного блока, 2 – газопроницаемая матрица, 3 – камера сгорания; б – зависимость температуры горения метан-воздушной смеси от коэффициента избытка воздуха на поверхности матрицы и в объеме; точки – эксперимент по матричному горению, верхняя кривая – расчет температуры при горении в объеме.
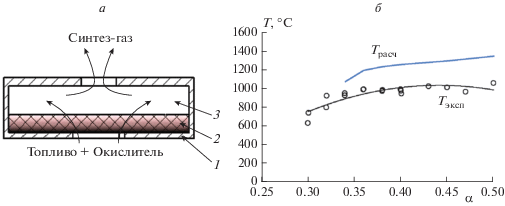
На рис. 2 представлены экспериментальная установка для конверсии углеводородных газов различного состава производительностью до 3 м3/ч и схема ее внутреннего устройства. Основными преимуществами такой организации процесса (матричной конверсии) по сравнению с другими методами превращения природного газа в синтез-газ являются: автотермический характер процесса, не требующего дополнительных источников тепла или энергии; возможность превращать в синтез-газ углеводородные газы практически любого состава и происхождения; большой диапазон возможной производительности – от малотоннажных установок до крупных агрегатов; компактность и высокая удельная объемная производительность, минимум в 10 раз превышающая удельную производительность традиционных технологий, что обеспечивает соответствующее снижение габаритов и капитальных затрат. Простота конструкции определяет низкую стоимость оборудования и низкие затраты на его обслуживание, а отсутствие катализатора обеспечивает низкие операционные затраты и низкие требования к предварительной подготовке газа.
Рис. 2.
а – Экспериментальная установка матричной конверсии углеводородных газов; б – схема внутреннего устройства и работы конвертора.
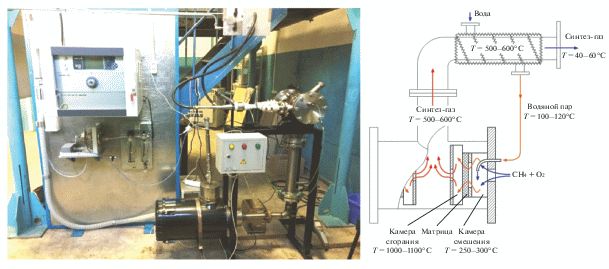
При использовании в качестве окислителя атмосферного воздуха процесс позволяет стабильно работать при коэффициенте избытка окислителя α = [O2]/2[CH4] = 0.32–0.40, обеспечивая при практически полной конверсии реагентов концентрацию компонентов синтез-газа до 40% (рис. 3). Полученный методом матричной конверсии природного газа воздухом дешевый азотсодержащий синтез-газ может быть использован для создания рентабельных и безопасных для реализации непосредственно в промысловых условиях малотоннажных технологий конверсии природных и попутных газов в жидкие продукты (метанол или СЖУ) [11].
Рис. 3.
Зависимость концентрации основных продуктов матричной конверсии и соотношения Н2/СО от коэффициента избытка окислителя α при окислении атмосферным воздухом.
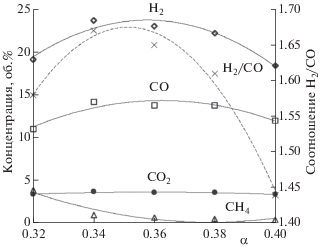
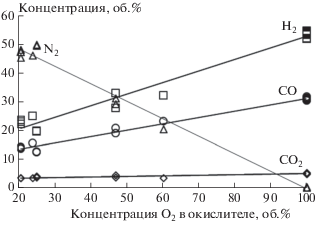
При использовании в качестве окислителя обогащенного воздуха и кислорода матричной конверсией может быть получен синтез-газ с любым содержанием азота вплоть до его полного отсутствия (рис. 4). Задачей проводимых в настоящее время исследований в области матричной конверсии является оптимизация состава реагентов и температурного режима работы матрицы, а также повышение соотношения Н2/СО сверх достигнутых значений 1.7–1.8 и разработка методов получения синтез-газа с заданным соотношением Н2/СО, в том числе путем совмещения с процессами парового риформинга продуктов конверсии.
Рис. 4.
Зависимость концентрации основных компонентов синтез-газа от концентрации кислорода при α = 0.34–0.36.
Так как условия матричной конверсии углеводородных газов близки к условиям парциального окисления метана при получении ацетилена [12, 13], в образующихся продуктах, помимо СО и Н2, содержатся продукты термического пиролиза метана – преимущественно ацетилен, а также этилен, сажа и непрореагировавший метан. Наличие этих примесей снижает выход Н2, соотношение Н2/СО и требует дополнительных технологических операций по очистке газа. На основе детального кинетического моделирования парциального окисления метана в настоящее время исследуется влияние на конверсию метана, выход водорода и остаточное содержание ацетилена высокотемпературных процессов пиролиза и паровой конверсии в послепламенной зоне основных компонентов газовой смеси: СН4, СО, С2Н4 и С2Н2. Эти исследования показали, что в бескислородных условиях послепламенной зоны матричного конвертора определяющими процессами являются пиролиз метана с образованием ацетилена и последующая паровая конверсия ацетилена, которые в данных условиях протекают быстрее, чем непосредственно паровая конверсия самого метана. В результате этой последовательности реакций существенно снижается содержание метана и ацетилена в продуктовом газе при одновременном повышении выхода водорода и СО. Простота конструкции реактора, отсутствие катализатора и отсутствие жестких требований к составу и подготовке сырьевого газа в сочетании со значительно более высокой объемной производительностью по сравнению с традиционными процессами делают матричную конверсию привлекательной перспективой для конверсии природного газа в синтез-газ [12].
Указанные выше достоинства матричного риформинга делают его потенциально привлекательным, в первую очередь, для малотоннажных процессов переработки углеводородных газов из нетрадиционных источников, например, попутного нефтяного газа (ПНГ) или биогаза. Матричный риформинг открывает также возможность переработки природного газа непосредственно в промысловых условиях и получения водорода непосредственно в местах его потребления.
ПРЯМЫЕ МЕТОДЫ КОНВЕРСИИ ПРИРОДНОГО ГАЗА В НЕФТЕХИМИЧЕСКИЕ ПРОДУКТЫ
Важным направлением в газохимии является поиск альтернативных путей превращения природного газа в химические продукты. Это возможно при функционализации метана путем разрыва в нем С–H связи с последующим присоединением к атому углерода более электроотрицательной группы, т.е. в окислительных процессах.
Реальные перспективы промышленного применения в области малотоннажных технологических процессов для промысловых условий имеет прямое окисление метана в метанол (ПОММ), которое протекает в среднетемпературной области примерно от 400 до 600 °С, т.е. при температурах, значительно ниже характерных температур газофазного горения углеводородов. Различие между их парциальным окислением и горением носит принципиальный характер, заключающийся в различии механизмов этих процессов. Одна из наиболее важных особенностей механизма парциального окисления алканов – большая роль пероксидных соединений и радикалов. При окислении метана в низкотемпературной области определяющую роль играют метилпероксидные радикалы СН3ОО• и молекулы метилпероксида СН3ООН, а при более высоких температурах – пероксидные радикалы НОО• и молекулы пероксида водорода НООН. В то же время роль таких частиц, как О, СН, СН2, а также возбужденных молекул и радикалов, активно участвующих в процессах горения, при парциальном окислении незначительна [6, 14].
Образующийся при окислении метана в результате гетерогенного или гомогенного зарождения метильный радикал ${\text{СH}}_{3}^{\centerdot }{\text{:}}$
(2)
${\text{С}}{{{\text{H}}}_{{\text{4}}}} + {{{\text{O}}}_{{\text{2}}}} \to {\text{СH}}_{3}^{\centerdot } + {\text{HO}}_{2}^{\centerdot },$при умеренных температурах легко вступает в обратимую реакцию с молекулой кислорода с образованием пероксидного радикала СH3OO•
(3)
${\text{СH}}_{3}^{\centerdot } + {{{\text{O}}}_{{\text{2}}}} \leftrightarrow {\text{С}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{O}}}^{\centerdot }}.$При повышенных давлениях и температурах ниже 600 °С равновесие в этой реакции сдвинуто вправо, и радикал СH3OO• становится ведущим активным центром процесса. При его взаимодействии с метаном и другими водородсодержащими молекулами образуется метилпероксид СH3OOH, термический распад которого приводит к вырожденному разветвлению цепей
(4)
${\text{С}}{{{\text{H}}}_{{\text{3}}}}{\text{OOH}} \to {\text{С}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{\centerdot }} + {\text{O}}{{{\text{H}}}^{\centerdot }}.$В последующих реакциях образующихся при этом алкоксильных радикалов СH3O•:
(5)
${\text{С}}{{{\text{Н}}}_{{\text{3}}}}{{{\text{О}}}^{\centerdot }} + {\text{С}}{{{\text{Н}}}_{{\text{4}}}} \to {\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{ОН}} + {\text{СН}}_{3}^{\centerdot },$(6)
${\text{С}}{{{\text{Н}}}_{{\text{3}}}}{{{\text{О}}}^{\centerdot }} + {{{\text{О}}}_{{\text{2}}}} \to {\text{С}}{{{\text{Н}}}_{{\text{2}}}}{\text{О}} + {\text{НО}}_{2}^{\centerdot },$появляются относительно стабильные при недостатке кислорода продукты – метанол и формальдегид, т.е. это – область эффективного образования оксигенатов. Их образование может быть представлено следующей обобщенной схемой:
которая не является стехиометрическим выражением процесса, поскольку все коэффициенты в ней могут изменяться в зависимости от условий его проведения (температуры, давления, соотношения реагентов). Температура процесса должна быть не ниже 400–450 °C, чтобы обеспечить время реакции на уровне ~1 с, но она не должна превышать 600 °С, чтобы предотвратить разложение оксигенатов и образование сажи. При Т > 600 °С равновесие в реакции (3) сдвигается влево, скорость образования метилпероксидных радикалов резко падает и процесс перестает быть разветвленно-цепным, а образование метанола и формальдегида по реакциям (5) и (6) практически прекращается. Как показывает кинетический анализ, максимальный выход метанола достигается при изотермических условиях в диапазоне 500–550 °C [6, 14]. Отметим, что из-за высокого теплового эффекта ПОММ каждый процент кислорода в начальной реакционной смеси повышает конечную температуру продуктов на ~40 °С. Поэтому начальная концентрация кислорода должна быть менее 4%. Максимальный выход метанола (до 20 г/м3 газа за проход через реактор) достигается при концентрации кислорода около 3% и давлении 60–80 атм.
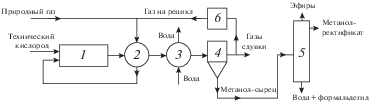
Общая блок-схема технологического процесса ПОММ представлена на рис. 5. Процесс включает компримирование газа (в случае необходимости) и окислителя, рекуперативный нагрев газа отходящими продуктами парциального окисления, стадию окисления, рекуперацию тепла реакции, дальнейшее охлаждение продуктов с утилизацией их тепла, сепарацию жидких и газообразных продуктов и ректификацию жидких продуктов с получением метанола и других жидких продуктов. Помимо простого проточного способа, процесс может быть реализован с рециркуляцией отработанного газа; в этом случае схема комплектуется циркуляционным компрессором.
Рис. 5.
Блок-схема процесса прямого окисления метана в метанол (ПОММ): 1 – проточный реактор, 2 – теплообменник рекуперативный, 3 – теплообменник водяной, 4 – сепаратор, 5 – блок ректификации, 6 – циркуляционный компрессор.
Учитывая невысокую степень конверсии подаваемого в процесс природного газа и его большой расход на единицу производимого метанола, важнейшими критериями при выборе вариантов организации процесса ПОММ являются количество и энергетические параметры отработанного газа (сдувки). При этом должна учитываться возможность получения отработанного газа с топливными характеристиками, позволяющими использовать его либо в качестве топлива для газопоршневых двигателей (ГПД), либо в виде горючего газа промышленного и коммунально-бытового назначения. В первом случае, в соответствии с требованиями к качеству топливного газа для ГПД, содержание метана в отработанном газе должно быть более 70%, низшая теплотворная способность (LHV) – 30–36 МДж/м3. В соответствии с требованиями к газам коммунально-бытового назначения [15] LHV должна быть не менее 31.8 МДж/м3, молярная доля СО2 – менее 2.5%. Для компримированного газа, используемого в качестве топлива для двигателей внутреннего сгорания (ГОСТ 27577-2000) [16], LHV также должна быть не менее 31.8 МДж/м3, молярная доля негорючих компонентов – менее 7.0%.
Был выполнен кинетический анализ различных вариантов организации технологического процесса ПОММ с учетом таких критериев, как выход метанола на подаваемый природный газ (удельный расход природного газа), энергетические и капитальные затраты на организацию рециркуляции, затраты на получение кислорода, характеристики сбрасываемого газа [17]. Анализ показал, что наиболее простой в технологическом отношении проточный процесс, использующий в качестве окислителя атмосферный воздух, позволяет получать метанол с удельным выходом до 16 кг/1000 м3 природного газа и отходящий газ с характеристиками, соответствующими ГОСТам, предъявляемым к топливу для ГПД [15, 16]. Такой процесс требует переработки больших объемов природного газа (более 60 000 Нм3/т метанола). Поэтому его реализация целесообразна на установках, обеспечивающих собственные потребности газодобывающих предприятий в метаноле-ингибиторе гидратообразования с последующим сбросом отработанного газа в общий поток добываемого газа, либо в составе энергохимических комплексов, сочетающих получение метанола с производством электроэнергии из отходящего газа.
Рециркуляция газа позволяет увеличить выработку метанола до 120–130 кг/1000 м3 подаваемого природного газа, при этом определяющее значение для выбора кратности циркуляции имеет начальная концентрация кислорода в газовой смеси. Если она составляет 3.3%, то возможная кратность циркуляции с получением сдувки с LHV ≥ 30 МДж/м3 (т.е. газа для ГПД) составляет около 8, тогда как при начальной концентрации кислорода 2.3, 2.0 и 1.7% – соответственно 12, 13 и 15 (рис. 6а).
Рис. 6.
а – Выход метанола и кратность циркуляции при различной начальной концентрации кислорода в газовой смеси; б – удельный расход природного газа и кислорода при различной кратности циркуляции отработанной газовой смеси.
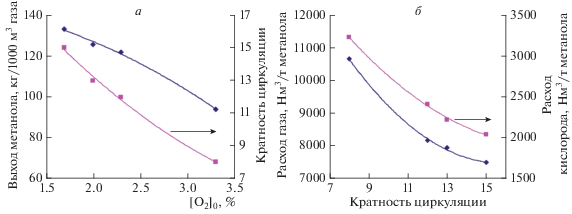
По сравнению с проточным процессом окисления воздухом циркуляционный процесс окисления техническим кислородом с начальной концентрацией 2% и кратностью циркуляции 13 : 1 позволяет в 9 раз снизить удельный расход природного газа и более чем в 10 раз снизить объем сдувочного газа. Но это требует производства более 2200 м3/т кислорода, дополнительных капитальных и энергетических затрат на рециркуляцию процессного газа (рис. 6б). Выбор того или иного варианта реализации процесса ПОММ зависит от конкретных практических приложений и определяется экономическим анализом.
ТЕХНОЛОГИИ НА ОСНОВЕ СЕЛЕКТИВНОГО ОКСИКРЕКИНГА И СОПРЯЖЕННОГО ОКИСЛЕНИЯ ГОМОЛОГОВ МЕТАНА
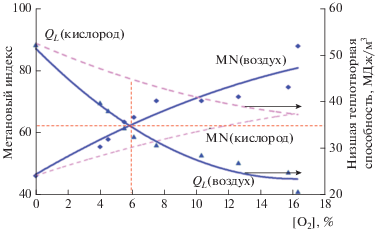
Интересные перспективы открывает возможность селективной конверсии гомологов метана без их предварительного выделения из природного или попутного газа. Такая возможность основана на большом отличии их реакционной способности от реакционной способности самого метана. В частности, предложен процесс селективного оксикрекинга тяжелых компонентов С2–С7 попутных нефтяных газов с получением газомоторного топлива с высоким метановым индексом (MN) и требуемой теплотой сгорания [18–20]. Предварительный окислительный крекинг природных и попутных нефтяных газов позволяет селективно окислять “тяжелые” низкооктановые компоненты сложных углеводородных смесей и получать для энергоустановок топливный газ с высоким метановым индексом и требуемой низшей теплотворной способностью (рис. 7). Метод характеризуется технологической простотой, большой гибкостью в отношении сырья и возможностью реализации на модульных автоматизированных установках в условиях удаленных месторождений.
Рис. 7.
Изменение низшей теплотворной способности QL и метанового индекса MN при различной концентрации вводимого на стадии селективного оксикрекинга (в составе воздуха) О2; состав исходной смеси: СН4 – 71.9%, С2Н6 – 2.5%, С3Н8 – 22.5%, С4Н10 – 3.1%; Р ~ 30 бар, Т = 450 °С.
Селективный оксикрекинг тяжелых гомологов метана эффективно протекает в достаточно мягких условиях при температурах до 750 °С, давлениях 1–3 атм и временах ~1 с. Основными продуктами помимо самого метана являются этилен, СО и водород.
На базе прямых процессов парциального окисления метана в метанол (ПОММ) и селективного оксикрекинга тяжелых гомологов метана может быть реализовано прямое получение ценных нефтехимических продуктов за счет селективных каталитических реакций [21, 22]. Поскольку в процессе ПОММ в близких концентрациях образуются метанол и СО, а в селективном оксикрекинге – этилен и СО, соотношение между которыми можно регулировать, с использованием различных селективных катализаторов возможно получение ряда высокоценных продуктов, включая уксусную кислоту, метилацетат, метилпропаноат, диметилкарбонат, диэтилкетон и другие (рис. 8).
Рис. 8.
Возможные пути конверсии природных и попутных газов в ценные химические продукты без стадии их предварительного превращения в синтез-газ.
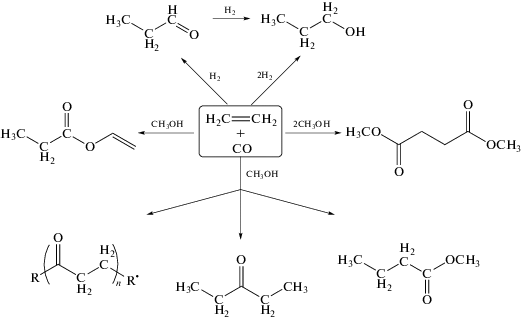
Большим преимуществом такой концепции является то, что большинство предлагаемых процессов карбонилирования или олигомеризации уже хорошо отработаны и освоены промышленностью. Как правило, в них применяются катализаторы на основе металлов платиновой группы, удельная активность которых на 2–3 порядка превышает удельную активность катализаторов синтеза Фишера–Тропша. Это позволяет использовать реакторы относительно небольшого размера, что снижает удельные капитальные затраты получения жидких продуктов [21, 22].
Еще одно перспективное и пока малоисследованное направление в разработке некаталитических процессов конверсии природного газа – совместное (сопряженное) окисление предельных и непредельных углеводородов [23, 24]. Например, при сопряженном окислении этилена и метана с увеличением концентрации метана в смеси быстро увеличивается выход пропилена. По-видимому, это происходит в результате присоединения метильного радикала к этилену с образованием пропильного радикала и его последующего распада с образованием пропилена. Это открывает перспективу получения пропилена из легкого углеводородного сырья, особенно интересную в том случае, если на промышленном уровне будет освоен процесс окислительной конденсации метана в этилен, так как появится возможность получать непосредственно из метана не только этилен, но и пропилен.
Установлено также, что выход пропилена может быть значительно повышен при сопряженном окислении пропана и этилена. При этом могут быть подобраны такие условия, что концентрация этилена, являющегося не только исходным реагентом, но и продуктом окисления пропана, на входе и на выходе процесса практически одинакова, т.е. при окислительном пиролизе пропана присутствие этилена, играющего в данном случае роль гомогенного катализатора, может значительно повысить выход пропилена.
ЗАКЛЮЧЕНИЕ
Создание эффективных технологий конверсии природного и попутного газа в химические продукты является ключевым условием освоения громадных ресурсов газообразных углеводородов земной коры. В настоящее время сформировались два основных направления в разработке газохимических технологий: повышение эффективности конверсии природного газа в синтез-газ и последующие синтезы на его основе и разработка прямых методов конверсии природного газа в химические продукты. В обоих случаях хорошие перспективы имеют процессы на основе некаталитического газофазного окисления углеводородов, позволяющие рационально использовать высокий энергетический потенциал окислительных процессов и особенности разветвленно-цепного механизма окисления легких углеводородов, открытого и детально разработанного школой Н.Н. Семёнова.
Работа выполнена в рамках Программы фундаментальных научных исследований государственных академий наук: тема ИПХФ РАН 0089-2019-0018 (регистрационный номер АААА-А19-119022690098-3); тема ФИЦ ХФ РАН 0082-2019-0014 (регистрационный номер АААА-А20-120020590084-9).
Список литературы
Семенов Н.Н. Избранные труды: в 4 т. Т. 1. Кн. 1. М.: Наука, 2004.
Arutyunov V.S. // J. Phys.: Conf. Ser. 2011. V. 291. P. 012001.
Arutyunov V.S., Savchenko V.I., Sedov I.V., Fokin I.G., Nikitin A.V., Strekova L.N. // Chem. Eng. J. 2015. V. 282. P. 206.
Арутюнов В.С., Савченко В.И., Седов И.В., Макарян И.А., Шмелев В.М., Алдошин С. М. // НефтеГазоХимия. 2014. № 4. С. 19.
Савченко В.И., Макарян И.А., Арутюнов В.С. // Мир нефтепродуктов. Вестник нефтяных компаний. 2013. № 11. С. 3.
Arutyunov V.S. Direct Methane to Methanol: Foundations and Prospects of the Process. Amsterdam: Elsevier B.V., 2014.
Arutyunov V.S., Shmelev V.M., Sinev M.Yu., Shapovalova O.V. // Chem. Eng. J. 2011. V. 176–177. P. 291.
Shapovalova O.V., Young N.C., Mun S.L., Arutyunov V.S., Shmelev V.M. // Intern. J. Hydrogen Energy. 2012. V. 37. P. 14040.
Arutyunov V.S., Shmelev V.M., Rakhmetov A.N., Shapovalova O.V. // Ind. Eng. Chem. Res. 2014. V. 53. P. 1754.
Арутюнов В.С., Савченко В.И., Седов И.В. и др. // Журн. прикл. химии. 2016. Т. 89. № 11. С. 1816.
Арутюнов В.С., Стрекова Л.Н., Савченко В.И., Седов И.В., Никитин А.В. и др. // Нефтехимия. 2019. Т. 59. № 3. С. 246.
Nikitin A., Ozersky A, Savchenko V., Sedov I., Shmelev V., Arutyunov V. // Chem. Eng. J. 2019. V. 377; https://doi.org/10.1016/j.cej.2019.01.162
Liu Y., Wang T., Li Q., Wang D. // Chin. J. Chem. Eng. 2011. V. 19. P. 424.
Арутюнов В.С. Окислительная конверсия природного газа. М.: Красанд, 2011.
ГОСТ 5542-2014 “Газы горючие природные промышленного и коммунально-бытового назначения”.
ГОСТ 27577-2000 “Газ природный топливный компримированный для двигателей внутреннего сгорания”.
Савченко В.И., Озёрский А.В., Фокин И.Г., Никитин А.В., Арутюнов В.С., Седов И.В. // Журн. прикл. химии. 2021. Т. 94. Вып. 4. С. 516.
Никитин А.В., Трошин К.Я., Беляев А.А., Арутюнов А.В., Кирюшин А.А., Арутюнов В.С. // НефтеГазоХимия. 2018. № 3. С. 23.
Савченко В.И., Арутюнов В.С., Фокин И.Г. и др. // Нефтехимия. 2017. Т. 57. № 2. С. 177.
Никитин А.В., Трошин К.Я., Беляев А.А. и др. // Горение и взрыв. 2019. Т. 12. № 1. С. 20.
Алдошин С.М., Арутюнов В.С., Савченко В.И., Седов И.В. // НефтеГазоХимия. 2015. № 3. С. 60.
Алдошин С.М., Арутюнов В.С., Савченко В.И. // Вестн. РАН. 2016. Т. 86. № 8. С. 719.
Погосян Н.М., Погосян М.Д., Шаповалова О.В. и др. // НефтеГазоХимия. 2016. № 2. С. 38.
Arutyunov V., Poghosyan N., Poghosyan M., Tavadyan L., Shapovalova O., Strekova L. // Chem. Eng. J. 2017. V. 329. P.231.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика