Химическая физика, 2021, T. 40, № 5, стр. 68-74
Изомеризация и распад интермедиата Криге CH3CHOO в верхней атмосфере Земли
Ю. А. Дьяков 1, 2, *, С. О. Адамсон 1, П. К. Ванг 2, Г. В. Голубков 1, 3, О. А. Ольхов 1, В. Д. Песков 1, И. Д. Родионов 1, И. П. Родионова 1, А. И. Родионов 2, В. Л. Шаповалов 1, Д. В. Шестаков 1, М. Г. Голубков 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Исследовательский центр экологических изменений, Академия Синика
Тайбэй, Тайвань
3 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: yuri_dyakov@mail.ru
Поступила в редакцию 07.10.2020
После доработки 15.11.2020
Принята к публикации 21.12.2020
Аннотация
Интермедиаты Криге, или карбонилоксиды, образуются при озонолизе алкенов, являющихся типичными антропогенными загрязнителями атмосферы. Они играют важную роль во множестве химических реакций, протекающих как в приповерхностном слое, так и в верхних слоях атмосферы Земли. В нижней тропосфере интермедиаты Криге успевают потерять свою внутреннюю колебательную энергию вследствие столкновений с молекулами азота и в результате взаимодействуют с другими компонентами атмосферы в своей исходной форме. Продуктами таких реакций являются, например, серная и азотная кислоты. В стратосфере и мезосфере интермедиаты Криге распадаются на химически активные фрагменты, которые участвуют в разнообразных вторичных реакциях. В настоящей работе рассмотрены процессы распада изомера метилкарбонилоксида anti-CH3CHOO в верхних слоях атмосферы. Показано, что основными продуктами распада являются атомарный кислород, метан, CO, CO2 и радикалы OH. Возможно образование и более сложных химически активных фрагментов.
1. ВВЕДЕНИЕ
Карбонилоксиды, известные также как интермедиаты Криге (Criegee Intermediates), активно
образуются в загрязненной антропогенными выбросами атмосфере при взаимодействии озона
с ненасыщенными углеводородами. Впервые на их роль в химии атмосферы Земли обратил
внимание Рудольф Криге [1] в начале 1950-х годов. Карбонилоксиды являются химически чрезвычайно активными соединениями
благодаря наличию группы 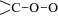 , обладающей бирадикальными свойствами. В частности, они активно реагируют с молекулами
SO2 и NO2, способствуя образованию соответственно серной и азотной кислот [2, 3], а также с большим числом органических соединений [4–14]. Образование интермедиатов Криге сопровождается выделением значительного количества
энергии (обычно 40–50 ккал/моль в зависимости от типа реагентов) [15], основная часть которой переходит во внутреннюю колебательную энергию продуктов
реакции.
, обладающей бирадикальными свойствами. В частности, они активно реагируют с молекулами
SO2 и NO2, способствуя образованию соответственно серной и азотной кислот [2, 3], а также с большим числом органических соединений [4–14]. Образование интермедиатов Криге сопровождается выделением значительного количества
энергии (обычно 40–50 ккал/моль в зависимости от типа реагентов) [15], основная часть которой переходит во внутреннюю колебательную энергию продуктов
реакции.
В плотных слоях атмосферы эта энергия рассеивается вследствие столкновений с молекулами азота. Такие столкновения сравнительно редки, поэтому карбонилоксиды быстро распадаются, образуя в том числе и OH-радикалы [16–21], которые являются основными “очистителями” атмосферы от антропогенных загрязнителей [22–25]. Это связано с тем, что OH-радикалы инициируют множество вторичных реакций в атмосфере, например приводят к образованию озона и NO2 из NO.
В экспериментах интермедиаты Криге зарегистрировать напрямую практически невозможно. Поэтому для их исследования применяются косвенные методы измерений, где важную роль играет компьютерное моделирование химических реакций. Сравнение теоретических расчетов с экспериментально наблюдаемым выходом продуктов реакций при тех или иных условиях дает основание делать выводы о реальном ходе процессов.
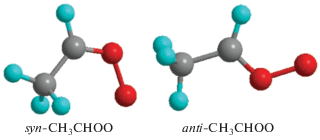
В работах [10–13] было показано, что реакция интермедиатов Криге с мономером и особенно димером воды приводит к их быстрому распаду. В большинстве публикаций внимание уделяется процессам в нижней тропосфере, где концентрация молекул воды велика, поэтому преимущественно рассматриваются интермедиаты, слабо реагирующие с водой. Так, например, наиболее распространенный интермедиат Криге CH3CHOO может существовать в виде двух возможных изомеров (см. рис. 1). Однако по оценкам, сделанным в [11], изомер syn-CH3CHOO реагирует с водой на два-три порядка медленнее, чем изомер anti-CH3CHOO, поэтому последний в теоретических и экспериментальных работах практически не упоминался.
В настоящей работе подробно рассмотрены химические процессы, протекающие в разреженном воздухе верхних слоев атмосферы (стратосферы и мезосферы), где влияние межмолекулярных столкновений мало. В качестве объекта исследования выбран изомер anti-CH3CHOO, распад которого приводит к образованию химически активных радикалов. Он может протекать как под действием собственной внутренней энергии, полученной при синтезе, так и при дополнительном возбуждении фотонами различных энергий, которые в избытке присутствуют на больших высотах. Так, например, поглощение УФ-фотонов приводит либо к ионизации молекулы, либо к ее переходу в электронно-возбужденное состояние с последующим неадиабатическим переходом системы в состояние с более низким электронным возбуждением. При этом такой переход происходит через коническое пересечение термов с одновременным возбуждением внутримолекулярных колебаний, что подробно описано в работах [26–28]. Принимая во внимание специфическую бирадикальную структуру электронной оболочки карбонилоксидов, после ионизации УФ-излучением следует ожидать сильного изменения электронного строения и химических свойств данных соединений, как это имеет место в ранее исследованных молекулах пенталена и бензоциклобутадиена [29, 30]. Однако это является предметом отдельного рассмотрения, выходящего за рамки данной работы.
2. МЕТОДИКА РАСЧЕТОВ
Во всех исследуемых ниже реакциях молекулы anti-CH3CHOO, их интермедиаты и переходные состояния (ПС) находились в синглетном электронном состоянии, соответствующем минимуму потенциальной энергии. Оптимизация геометрии поверхностей потенциальной энергии (ППЭ) молекул и образующихся фрагментов была осуществлена методом функционала плотности UB3LYP/aug-cc-pVTZ. Ввиду того, что многие интермедиаты и переходные состояния имеют открытые электронные оболочки, вычисления начинались с получения волновой функции триплетного состояния, позволяющей затем использовать ее как стартовую в расчетах с открытой электронной оболочкой. Энергии в точках минимумов и максимумов пересчитывались с помощью более точного квантовохимического метода UCCSD(T)/aug-cc-pVTZ. Константы скоростей реакций и конечный выход продуктов были рассчитаны в рамках статистического метода Райса–Рамспегера–Касселя–Маркуса (РРКМ) [31, 32]. Ввиду того, что некоторые каналы реакции не имели выраженного максимума, константы скоростей реакций в этих случаях рассчитывались микроканоническим методом вариационного переходного состояния (ВПС) [33]. Практическое применение методов РРКМ и ВПС для каскадной диссоциации молекул подробно описано в работах [34–39]. Квантовохимические расчеты выполнены с использованием пакета программ GAUSSIAN 09 [40].
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 2 схематично изображена поверхность потенциальной энергии молекулы anti-CH3CHOO вдоль основных каналов диссоциации. Из этого рисунка видно, что реакция протекает по четырем основным направлениям хода: 1) изомеризация в syn-изомер в две стадии (через ПС1, ПС5 и промежуточный интермедиат метилдиоксиран); 2) перенос атома водорода от ближайшего к OO-группе атома углерода на атом кислорода с последующим отрывом OH-группы (через ПС2); 3) безбарьерный отрыв атома кислорода от OO-группы; 4) прямая изомеризация исходной молекулы в syn-изомер путем поворота OO-группы вокруг оси C–O (через ПС4). Следует отметить, что реакция переноса атома водорода от CH3-группы на группу OO с образованием винилгидропероксида, как это имеет место в случае syn-CH3CHOO [16–21], для данного изомера невыгодна ввиду высокого потенциального барьера ПС6 (см. рис. 2). В результате реакция отрыва группы OH от молекулы anti-CH3CHOO (около 32 ккал/моль [12–14]) имеет намного больший энергетический барьер, чем в случае syn-изомера (16.5 ккал/моль [19]), и поэтому обычно не рассматривается в литературе.
Рис. 2.
Поверхность потенциальной энергии изомера anti-CH3CHOO вдоль основных каналов диссоциации. Энергии в минимумах и максимумах даны в ккал/моль.
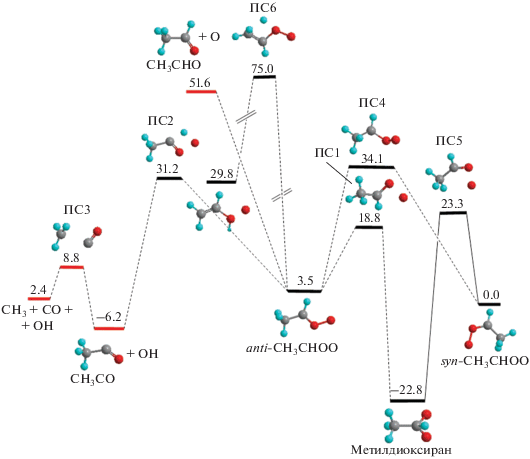
Действительно, если принять, что процесс образования данного соединения происходит в приповерхностном слое Земли и молекула теряет свою внутреннюю энергию через столкновения до диссоциации, то этот канал в самом деле можно не учитывать. Однако в данной работе нас интересуют процессы, протекающие в верхних слоях атмосферы, где столкновения молекул редки, а уровень УФ-излучения высок. Поэтому предполагается, что молекула anti-CH3CHOO не только сохраняет внутреннюю энергию, приобретенную в ходе синтеза (что составляет около 50 ккал/моль), но может также дополнительно возбудиться за счет поглощения УФ-фотона. Поэтому в рассмотрение включены и реакция образования OH-радикала, и требующая существенных затрат энергии (51.6 ккал/моль) реакция отрыва атома кислорода O(1D). Расчет последнего процесса требует отдельного рассмотрения.
Отрыв атомарного кислорода происходит без барьера, поэтому для вычисления констант скоростей реакции отрыва атома кислорода O(1D) при различных значениях внутренней энергии молекулы требуется использовать метод ВПС [33]. При этом необходимо построить профиль ППЭ вдоль пути реакции с достаточно малым шагом сканирования. В результате образуется атомарный кислород в синглетном 1D-состоянии, поэтому для точного расчета его энергии требуется учет корреляций порядков выше третьего. Однако в используемом нами методе UCCSD(T) учитываются только корреляции второго порядка и существенно занижается энергия данного канала, поэтому с его помощью невозможно правильно рассчитать константу скорости реакции отрыва O(1D) при больших значениях расстояний O–O и энергию образующихся фрагментов. “Срыв” кривой потенциальной энергии, полученной методом UCCSD(T), согласно оценке параметра T1, происходит при расстоянии O–O, большем 2 Å. При этом кривая потенциальной энергии, полученная методом функционала плотности UB3LYP, используемого для расчета геометрических параметров молекулы и колебательных частот, имеет классический монотонный рост и асимптотически, на расстоянии около 3.5–4 Å, выходит на рассчитанные энергии отдельных фрагментов CH3CHO + O(1D). Метод UB3LYP традиционно дает заниженные значения энергии для систем с открытой электронной оболочкой, поэтому при расчете кинетики реакций эти значения следует уточнять методами UCCSD(T), G3 и G4 (см., например, [41–43]).
В нашем случае эти методы неприменимы, поскольку в них не учитываются корреляции высших порядков. Поэтому сначала методом UCCSD(T) была рассчитана энергия фрагментов CH3CHO + + O(3P). Она оказалась равной 6.3 ккал/моль, что хорошо совпадает с экспериментальной оценкой в 10.5 ккал/моль, приведенной в работе [44]. Затем к полученному значению 6.3 ккал/моль была добавлена известная из спектроскопических измерений [45] разница энергий между состояниями 1D и 3P атомарного кислорода. В итоге была получена величина, равная 51.6 ккал/моль. Это значение также согласуется с экспериментальной оценкой [44] энергии отрыва атома O(1D) от CH3CHOO (<55.9 ккал/моль). После определения энергии фрагментов CH3CHO + O(1D) кривая потенциальной энергии, полученная методом UCCSD(T), была аппроксимирована от точки “срыва” до точки выхода на асимптотику с предполагаемым значением в 51.6 ккал/моль. Колебательные частоты, необходимые для определения констант скоростей реакции в точках вдоль кривой, были рассчитаны методом UB3LYP. Следует отметить, что при расчете константы скорости данной реакции используется только начальный участок кривой потенциальной энергии (с расстоянием O–O, меньшим 2.5 Å), где она вычисляется либо без коррекции, либо предполагаемая точность ее аппроксимации лежит в пределах точности самого квантовохимического метода. Поэтому данный подход полностью применим к расчету выхода продуктов распада данной молекулы, и использованные приближения лежат в пределах традиционной точности метода РРКМ.
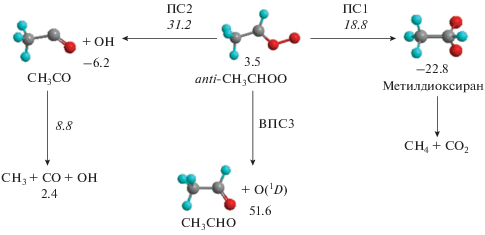
Рассмотрим теперь влияние anti–syn-изомеризации, которая позволяет продолжить цепочку химических реакций, начинающихся уже с syn-изомера, рассмотренных во многих работах, упомянутых выше. Прямая трансформация через ПС4 маловероятна из-за большой высоты барьера. Как правило, в качестве основного канала изомеризации рассматривается двухстадийная реакция через барьеры ПС1, ПС5 и промежуточный продукт метилдиоксиран. Действительно, высоты этих барьеров почти в два раза ниже высоты барьера ПС2 отрыва OH-группы. Однако в работе [19] было показано, что данный изомер легко (через несколько метастабильных состояний) распадается на фрагменты CH4 и CO2. Поэтому в наших расчетах переход через барьер ПС1 рассматривался не как изомеризация, а как диссоциация с образованием метана и углекислого газа. Следует отметить, что фрагмент CH3CO, образующийся при отрыве группы OH, нестабилен и достаточно легко распадается на CO и радикал CH3 через барьер в (8.8 + 6.2) = 15.0 ккал/моль. С учетом значительной высоты обратного барьера при переходе через ПС2 (31.2 + 6.2 = 37.4 ккал/моль) запасенной при этом переходе внутренней энергии оказывается достаточно для вторичной диссоциации фрагмента CH3CO. Поэтому на принципиальной схеме диссоциации изомера anti-CH3CHOO (см. рис. 3) конечными продуктами данного канала реакции указаны CH3 + OH + CO.
Рис. 3.
Упрощенная принципиальная схема реакции диссоциации изомера anti-CH3CHOO. Энергии даны в ккал/моль. Курсивными числами указаны высоты барьеров, обычным шрифтом – энергии минимумов ППЭ.
Результаты расчетов конечного выхода продуктов реакции, полученных по указанной на рис. 3 схеме, приведены на рис. 4. Видно, что при низких значениях внутренней энергии молекулы единственным продуктом распада является метилдиоксиран, который далее распадается на CH4 + CO2. Интенсивность этого канала падает с ростом колебательной энергии молекулы и выходит на значение около 20% на правом участке кривой. При энергии 40 ккал/моль начинают появляться фрагменты, образующиеся при отрыве группы OH. Относительный выход продуктов реакции этого канала медленно увеличивается с ростом внутренней энергии молекулы. Он достигает 25% при значении энергии 125 ккал/моль, после чего практически не изменяется. Атомарный кислород начинает образовываться при значениях колебательной энергии молекулы выше 60 ккал/моль. Его выход быстро увеличивается с ростом последней, пересекая кривую, соответствующую образованию OH, при 100 ккал/моль. Максимальный выход в 56% достигается при значении энергии 200 ккал/моль.
Рис. 4.
Относительный выход продуктов реакции диссоциации изомера anti-CH3CHOO, полученных согласно схеме, представленной на рис. 3. Значения энергий по оси абсцисс приведены относительно основного состояния молекулы anti-CH3CHOO.
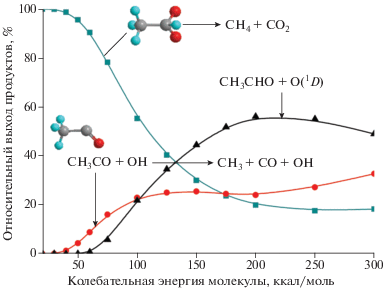
Следует отметить, что в плотных слоях атмосферы (где вероятность столкновения с другими молекулами высока, а вкладом энергии в виде излучения можно пренебречь) изомер anti-CH3CHOO либо теряет внутреннюю энергию и остается стабильным (до тех пор, пока не прореагирует с другими веществами), либо переходит в форму метилдиоксирана, который распадется на стабильные фрагменты. В верхней атмосфере, особенно при поглощении дополнительного кванта энергии, при распаде данного интермедиата образуется не только большое количество радикалов OH (до 25%), но и атомарный кислород в активном синглетном 1D-состоянии. При столкновении с молекулярным кислородом он превращается в озон, восполняя тем самым его потерю при образовании интермедиатов Криге. Альтернативой является взаимодействие атомарного кислорода с водой, когда образуются OH-радикалы и запускается целый каскад вторичных реакций, включая образование атомарного водорода, NO2, перекиси водорода и других продуктов [22].
4. ЗАКЛЮЧЕНИЕ
В настоящей работе исследованы возможные пути диссоциации интермедиата Криге для случая, когда исходным изомером является anti-CH3CHOO. Кроме традиционного канала диссоциации с образованием OH-радикала, впервые рассмотрен канал распада с образованием атомарного кислорода в электронном состоянии 1D. Показано, что в условиях верхней атмосферы при дополнительном возбуждении изомера УФ-фотонами доминирующим становится канал с образованием синглетного атома O(1D). Относительный выход достигает 56%. При этом канал с образованием радикала OH также остается существенным. Относительный выход здесь практически не изменяется в широком интервале изменения внутренней энергии молекулы и составляет около 25%.
В последние годы теоретически было предсказано и экспериментально подтверждено, что в D- и E-слоях ионосферы (на высотах 60–110 км от поверхности Земли) происходят задержка, ослабление и усиление сигналов глобальных навигационных спутниковых систем (ГНСС) вследствие процесса l-перемешивания [46] и в результате многократного резонансного рассеяния на ридберговских комплексах [47, 48].
Ослабление сигналов ГНСС происходит преимущественно в нижних слоях атмосферы, где наибольший эффект достигается за счет взаимодействия с заряженными аэрозольными слоями. Поскольку спектр излучения и поглощения радикалов ОН на вращательных переходах включает СВЧ-диапазон [49, 50], то эти радикалы тоже принимают участие в ослаблении радиосигналов.
В работе [51] было показано, что возбужденные состояния атомов кислорода O(1D) играют важную роль в Е-слое ионосферы Земли (на высоте 90–105 км), поскольку они активно задействованы в реакциях обмена и ассоциативной ионизации [52]. Кроме того, атомарный кислород O(1D) инициирует химические реакции, приводящие к синтезу озона, и вносит заметный вклад в свечение атмосферы [53]. При полярном сиянии отчетливо наблюдаются зеленая линия излучения с длиной волны 555.7 нм вследствие перехода ${\text{O}}{\kern 1pt} ({}^{1}D) \leftarrow {\text{O}}{\kern 1pt} ({}^{1}S)$ и красный дублет с длинами волн 630.0 и 636.4 нм, соответствующими переходам ${\text{O}}{\kern 1pt} ({}^{3}{{P}_{J}}) \leftarrow {\text{O}}{\kern 1pt} ({}^{1}D).$
Таким образом, синтез и последующий распад интермедиатов Криге влияют на формирование состава верхних слоев атмосферы. А от этого зависят состояние озонового слоя Земли, проницаемость атмосферы для космических лучей, количество парниковых газов, а также устойчивая работа ГНСС и систем дистанционного зондирования поверхности Земли [54, 55].
Работа выполнена в рамках госзадания Министерства науки и высшего образования Российской Федерации (регистрационный номер АААА-А19-119010990034-5), а также при финансовой поддержке Министерством науки и технологии Тайваня (грант MOST 109‑2111‑M‑001‑001) и Академией наук Тайваня (грант AS‑TP‑107‑M10).
Список литературы
Criegee R., Wenner G. // Just. Lieb. Ann. Chem. 1949. V. 564. № 1. P. 9.
Kanakidou M., Seinfeld J.H., Pandis S.N. et al. // Atmos. Chem. Phys. 2005. V. 5. № 4. P. 1053.
Hallquist M., Wenger J.C., Baltensperger U. et al. // Atmos. Chem. Phys. 2009. V. 9. № 14. P. 5155.
Welz O., Eskola A.J., Sheps L. et al. // Ang. Chem. Intern. Ed. 2014. V. 53. № 18. P. 4547.
Foreman E.S., Kapnas K.M., Murray C. // Ang. Chem. Intern. Ed. 2016. V. 55. № 35. P. 10419.
Chhantyal-Pun R., McGillen M.R., Beames J.M. et al. // Ang. Chem. Intern. Ed. 2017. V. 56. № 31. P. 9044.
Taatjes C.A., Khan M.A.H., Eskola A.J. et al. // Env. Sci. Techn. 2019. V. 53. № 3. P. 1245.
Taatjes C.A., Shallcross D.E., Percival C.J. // Phys. Chem. Chem. Phys. 2014. V. 16. № 5. P. 1704.
Khan M., Percival C., Caravan R. et al. // Env. Sci. Proc. Imp. 2018. V. 20. №3. P. 437.
Chao W., Hsieh J.T., Chang C.H. et al. // Science. 2015. V. 347. № 6223. P. 751.
Long B., Bao J.L., Truhlar D.G. // J. Amer. Chem. Soc. 2016. V. 138. № 43. P. 14409.
Taatjes C.A., Welz O., Eskola A.J. et al. // Science. 2013. V. 340. № 6129. P. 177.
Sheps L., Scully A.M., Au K. // Phys. Chem. Chem. Phys. 2014. V. 16. № 48. P. 26701.
Yin C., Takahashi K. // Phys. Chem. Chem. Phys. 2017. V. 19. № 19. P. 12075.
Herron J.T., Martinez R.I., Huie R.E. // Intern. J. Chem. Kinet. 1982. V. 14. № 3. P. 201.
Zhou X.H., Liu Y.Q., Dong W.R. et al. // J. Phys. Chem. Lett. 2019. V. 10. № 17. P. 4817.
Wang X.H., Bowman J.M. // J. Phys. Chem. Lett. 2016. V. 7. № 17. P. 3359.
Kidwell N.M., Li H.W., Wang X.H. et al. // Nature Chem. 2016. V. 8. № 5. P. 509.
Wang Z., Dyakov Y.A., Bu Y. // J. Phys. Chem. A. 2019. V. 123. № 5. P. 1085.
Fang Y., Liu F., Barber V.P. et al. // J. Chem. Phys. 2016. V. 144. № 6. 061102.
Nguyen T.L., McCaslin L., McCarthy M.C. et al. // J. Chem. Phys. 2016. V. 145. № 13. 131102.
Levy H. // Science. 1971. V. 173. № 3992. P. 141.
Lelieveld J., Dentener F., Peters W. et al. // Atm. Chem. Phys. 2004. V. 4. № 9–10. P. 2337.
Mauldin R.L., Berndt T., Sipila M. et al. // Nature. 2012. V. 488. № 7410. P. 193.
Vereecken L., Harder H., Novelli A. // Phys. Chem. Chem. Phys. 2012. V. 14. № 42. P. 14682.
Lin M.F., Tseng C.M., Dyakov Y.A. et al. // J. Chem. Phys. 2007. V. 126. № 24. 241104.
Dyakov Y.A., Ho Y.C., Hsu W.H. et al. // Chem. Phys. 2018. V. 515. P. 543.
Dyakov Y.A., Toliautas S., Trakhtenberg L.I. et al. // Chem. Phys. 2018. V. 515. P. 672.
Дьяков Ю.А., Пузанков А.А., Адамсон С.О. и др. // Хим. физика. 2020. Т. 39. № 10. С. 3.
Dyakov Y.A., Adamson S.O., Golubkov G.V. et al. // Proc. SPIE Intern. Soc. Opt. Eng. 2019. V. 11322. 113221Q.
Eyring H., Lin S.H., Lin S.M. Basic Chemical Kinetics. N.Y.: John Wiley & Sons, 1980.
Robinson P.J., Holbrook K.A. Unimolecular Reactions. N.Y.: Wiley, 1972.
Steinfeld J.I., Francisco J.S., Hase W.L. Chemical kinetics and dynamics. Upper Saddle River: Prentice Hall, 1999.
Zyubina T.S., Dyakov Y.A., Lin S.H. et al. // J. Chem. Phys. 2005. V. 123. № 13. 134320.
Mebel A.M., Zyubina T.S., Dyakov Y.A. et al. // Intern. J. Quant. Chem. 2005. V. 102. № 5. P. 506.
Sharifi M., Kong F., Chin S.L. et al. // J. Phys. Chem. A. 2007. V. 111. № 38. P. 9405.
Wang Q.Q., Wu D., Jin M.X. et al. // J. Chem. Phys. 2008. V. 129. № 20. 204302.
Wang Q.Q., Wu D., Jin M.X. et al. // J. Phys. Chem. C. 2009. V. 113. № 27. P. 11805.
Wang Q.Q., Dyakov Y.A., Wu D. et al. // Chem. Phys. Lett. 2013. V. 586. P. 21.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Scalmani G., Barone V., Petersson G.A., Nakatsuji H., Li X., Caricato M., Marenich A.V., Bloino J., Janesko B.G., Gomperts R., Mennucci B., Hratchian H.P., Ortiz J.V., Izmaylov A.F., Sonnenberg J.L., Williams-Young D., Ding F., Lipparini F., Egidi F., Goings J., Peng B., Petrone A., Henderson T., Ranasinghe D., Zakrzewski V.G., Gao J., Rega N., Zheng G., Liang W., Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T., Throssell K., Montgomery J.A., Jr., Peralta J.E., Ogliaro F., Bearpark M.J., Heyd J.J., Brothers E.N., Kudin K.N., Staroverov V.N., Keith T.A., Kobayashi R., Normand J., Raghavachari K., Rendell A.P., Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Millam J.M., Klene M., Adamo C., Cammi R., Ochterski J.W., Martin R.L., Morokuma K., Farkas O., Foresman J.B., Fox D.J. Gaussian 09. Rev. A.02. Wallingford CT: Gaussian, Inc., 2009.
Dyakov Y.A., Ni C.K., Lin S.H. et al. // J. Phys. Chem. A. 2005. V. 109. № 39. P. 8774.
Dyakov Y.A., Ni C.K., Lin S.H. et al. // Phys. Chem. Chem. Phys. 2006. V. 8. № 12. P. 1404.
Dyakov Y.A., Mebel A.M., Lin S.H. et al. // J. Phys. Chem. A. 2007. V. 111. № 38. P. 9591.
Li H., Fang Y., Kidwell N.M. et al. // J. Phys. Chem. A. 2015. V. 119. № 30. P. 8328.
Moore C.E. Tables of spectra of hydrogen, carbon, nitrogen, and oxygen atoms and ions / Eds. Gallagher J.W., Moore C.E. Boca Raton: CRC Press, 1993.
Голубков Г.В., Иванов Г.К., Балашов Е.М. и др. // ЖЭТФ. 1998. Т. 114. Вып. 1. С. 100.
Голубков Г.В., Манжелий М.И., Берлин А.А. и др. // Хим. физика. 2016. Т. 35. № 1. С. 5.
Kuverova V.V., Adamson S.O., Berlin A.A. et al. // Adv. Space Res. 2019. V. 64. № 10. P. 1876.
Голубков Г.В., Манжелий М.И., Лушников А.А. // Хим. физика. 2014. Т. 33. № 7. С. 101.
Адамсон С.О., Харлампиди Д.Д., Голубков Г.В. и др. // Хим. физика. 2018. Т. 37. № 12. С. 20.
Голубков Г.В., Маслов Т.А., Бычков В.Л. и др. // Хим. физика. 2020. Т. 39. № 10. С. 47.
Golubkov M.G., Ozerov G.K., Adamson S.O. et al. // Chem. Phys. 2015. V. 462. P. 28.
Адамсон С.О., Бюнкер Р.Дж., Голубков Г.В. и др. // Хим. физика. 2009. Т. 28. № 4. С. 26.
Голубков Г.В., Манжелий М.И., Берлин А.А. и др. // Хим. физика. 2018. Т. 37. № 7. С. 33.
Golubkov G.V., Manzhelii M.I., Berlin A.A. et al. // Atmosphere. 2020. V. 11. № 6. 650.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика